Peptik Ülserli ve Ülser Olmayan Dispepsili Hastaların
Mide Doku Örneklerinde
Helicobacter pylori vacA ve cagA Genlerinin Moleküler Yöntemlerle
Belirlenmesi
Molecular
Detection of Helicobacter pylori vacA and cagA Genes in Gastric
Tissue Specimens of
Patients with Peptic Ulcer Disease and Non-Ulcer Dyspepsia
Meral KARAMAN1, Hakan ABACIOĞLU2, Ömer S. TOPALAK3, İlkay ŞİMŞEK3
1 Dokuz Eylül Üniversitesi Tıp Fakültesi, Multidisipliner Laboratuvarları, İzmir.
1 Dokuz Eylul University Faculty of Medicine, Multidisiplinary Laboratories Izmir, Turkey.
2 Dokuz Eylül Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
2 Dokuz Eylul University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
3 Dokuz Eylül Üniversitesi Tıp Fakültesi, Gastroenteroloji Anabilim Dalı, İzmir.
3 Dokuz Eylul University Faculty of Medicine, Department of Gastroenterology, Izmir, Turkey.
ÖZET
Helicobacter pylori, mide mukozası içinde kolonize olabilen bir mikroorganizma olup, kronik aktif gastrit, peptik ülser, gastrik adenokarsinom ve primer gastrik lenfoma gibi hastalıklar için risk faktörü olarak bildirilmektedir. Bakterinin virülans faktörleri arasında, vakuolleri aktive edici sitotoksin (vacA) ve sitotoksin ile ilişkili gen (cagA) önemli rol oynamaktadır. Bu çalışmada, klinik olarak peptik ülser hastalığı (PÜH) ve ülser olmayan dispepsi (ÜOD) tanısı almış hastaların mide doku örneklerinde, H.pylori vacA s ve m genotiplerinin belirlenmesi; vacA genotiplerinin cagA ile birlikteliğinin araştırılması ve bunların klinik tanı ile ilişkisinin değerlendirilmesi amaçlanmıştır. Çalışmaya, 19 (%65.5)'u kadın olmak üzere, birbirleriyle ailesel bağlantıları olmayan 29 hasta (yaş aralığı 18-74 yıl; yaş ortalaması: 47.8 ± 13.6) dahil edilmiştir. Klinik olarak olguların 13 (%44.8)'ü PÜH, 16 (%55.2)'sı ÜOD olarak tanımlanmış olup, tümünün endoskopi ile alınan mide doku örneğinde üreaz testleri olumlu bulunmuştur. Mide doku örneklerinden H.pylori DNA'sı proteinaz-K, fenol-kloroform-izoamilalkol yöntemi ile elde edilmiş; vacA geni s, m1, m2 ve cagA bölgeleri polimeraz zincir reaksiyonu (PCR) ile dört ayrı primer seti kullanılarak belirlenmiştir. Tüm hasta örneklerinde ayrıca, H.pylori vacA m bölgesi içinde korunmuş 785 baz çifti uzunluğundaki bölgeye DNA dizi analizi yapılmış, elde edilen diziler Gen-Bank dizileri ile birlikte hizalanmış ve filogenetik ağaç oluşturulmuştur. Çalışmamızda, H.pylori pozitif 29 hastada vacA genotip dağılımı; s1m1 (n= 16), s1m2 (n= 6) ve s2m2 (n= 7) olarak bulunmuş; olguların 19'unda ise cagA pozitifliği tespit edilmiştir. Genotipi s1m1 olarak saptanan 16 olgunun tümünde cagA'nın pozitif olduğu görülmüş ve bu olgulardan 13'ünün klinik olarak PÜH tanısı alan hastalar olduğu izlenmiştir (p= 0.008). vacA m bölgesinde nükleotid dizilerinin filogenetik analizi ile elde edilen genotiplendirme sonuçları, PCR sonucu elde edilen m genotipleri ile uyumlu bulunmuştur. Sonuç olarak bu çalışmada, PÜH ile vacA s1m1, cagA pozitif suşlar arasında anlamlı bir birliktelik olduğu tespit edilmiş; H.pylori vacA m genotiplerinin saptanmasında, nükleotid dizi analizi yerine daha ucuz ve basit bir yöntem olan PCR yönteminin güvenle kullanılabileceği düşünülmüştür.
Anahtar sözcükler: Helicobacter pylori; vacA; cagA; polimeraz zincir reaksiyonu; dizi analizi.
ABSTRACT
Helicobacter pylori can colonize the gastric mucosa and is considered as a risk factor for chronic active gastritis, peptic ulcer, gastric adenocarcinoma and primary gastric lymphoma. Among its various virulence factors, vacuolating cytotoxin encoded by vacA and cytotoxin-associated toxin encoded by cagA gene play an important role. The aims of this study were the detection of H.pylori vacA s and m genotypes, investigation of the association between vacA genotypes and cagA gene presence, and evaluation of the correlation between those factors and the clinical diagnosis. Gastric tissue specimens of patients who were clinically diagnosed as peptic ulcer disease (PUD) and non-ulcer dyspepsia (NUD) were included in the study. A total of 29 patients (age range: 18-74 years, mean age: 47.8 ± 13.6 years; 19 were female) without any familial relationship were evaluated. Thirteen (44.8%) of the patients were diagnosed clinically as PUD, while 16 (55.2%) as NUD. All of the patients' gastric tissue samples obtained by endoscopy were urease positive. H.pylori DNA was extracted from the tissue specimens by proteinase-K, phenol-chloroform-isoamyl alcohol method and vacA s, m1, m2 and cagA regions were identified by polymerase chain reaction (PCR) using four different primer sets. In addition, DNA sequencing was performed for the protected 785 base-pairs region of vacA m gene in all of the samples, and the sequences were aligned with Gene-Bank sequences, creating a phylogenetic tree. The distribution of vacA genotypes between 29 H.pylori positive patients were found as; s1m1 (n= 16), s1m2 (n= 6) and s2m2 (n= 7), while 19 patients yielded positive results for cagA gene. CagA positivity was detected in all of the 16 patients harboring s1m1 genotype, and 13 of those were the patients diagnosed as PUD (p= 0.008). Genotyping data achieved by phylogenetic analysis of the vacA m region were compatible with m genotypes identified by PCR. In conclusion, we detected a significant relationship between PUD and vacA s1m1 and cagA positivity. It was also determined that PCR would be a reliable, simpler and cheaper alternative to nucleotide sequencing for the identification of H.pylori vacA m genotypes.
Key words: Helicobacter pylori; vacA; cagA; polymerase chain reaction; sequencing.
Geliş Tarihi (Received): 21.07.2010 • Kabul Ediliş Tarihi (Accepted): 24.11.2010
GİRİŞ
Helicobacter pylori, gastrik mukozada kolonize olan gram-negatif, sarmal şekilli, mikroaerofilik bir bakteridir1. Enfekte kişilerin tümünde gastroduodenal hastalık gelişmeyip, semptomsuz olgular olmakla birlikte, temelde kronik aktif gastritin en önemli etyolojik ajanıdır. H.pylori'nin peptik ülser, gastrik adenokarsinom ve primer gastrik lenfoma için risk faktörü olduğu bilinmektedir2,3. Dünyanın farklı coğrafi bölgelerinde H.pylori enfeksiyonu oranlarına bakıldığında; gelişmiş ülkelerde düşük, gelişmekte olan ülkelerde yüksek seroprevalans oranları dikkati çekmektedir4. H.pylori enfeksiyonunun temel bulaş yolu olarak, dışkı-ağız ve ağız-ağız bulaşı bildirilmektedir5. Enfeksiyonun aile içinde kümelendiği, enfekte annenin aile içi bulaşta anahtar rol oynadığı, ayrıca sosyal ve etnik farklılıkların enfeksiyonun kazanılmasında önemli bir faktör olduğu ifade edilmektedir6,7. Aile içinde özellikle anneden çocuğa dikey aktarımın yanı sıra, kardeşler arasında yatay aktarımın önemi de vurgulanmaktadır8.
H.pylori'nin virülans faktörleri arasında üreaz, flajel proteinleri, süperoksit dismutaz ve vakuolleri aktive edici sitotoksin (vacuolating cytotoxin; vacA) gibi proteinler yer almaktadır3. Kolonizasyon için gerekli flajel proteini ve üreazın aksine, vacA geni her zaman eksprese edilmemektedir. Kökenlerin sadece %50-65'inde 87 kDa'luk bir protein olan VacA üretilmekte ve bu sitotoksini yapan suşlar ile karşılaşan primer mide epitel hücrelerinde vakuolizasyon indüklenmektedir9. vacA geninin, amino ucu sinyal bölgesi (s) ve orta (middle-m) bölgesinin nükleotid dizilerine göre farklı allelik varyantları tanımlanmıştır. Genin s bölgesi s1a, s1b, s1c veya s2 allellerinden, m bölgesi ise m1, m2a veya m2b allellerinden birini içerir. Farklı s ve m allelleri rekombinasyonla bir araya gelerek s1/m1, s1/m2, s2/m2 ve varlığı tartışmalı olan s2/m1 genotiplerini oluşturmaktadır10,11,12,13. Bu farklı genotiplerin sitotoksik aktivite ve klinik tablolar ile yakından ilişkili olduğu bildirilmektedir10,11. Bakterinin bir diğer virülans faktörü, sitotoksin ile ilişkili gen (cytotoxin-associated gen; cagA) ürünüdür. Bu protein, tek başına bir sitotoksin olarak değil, sitotoksine yardımcı toksin olarak nitelendirilmekte ve cag patojenite adası (cag PAI) için bir belirleyici olarak kullanılmaktadır14,15.
Ülkemizde H.pylori'nin seroprevalansı ile ilgili çalışmalar olmasına karşın, genotipleri ve bunların hastalık patogenezi ile ilişkisi konusunda bilgilerimiz sınırlıdır. Bu çalışmada; klinik olarak peptik ülser hastalığı ve ülser olmayan dispepsi tanısı almış hastaların mide doku örneklerinde, H.pylori vacA s ve m genotiplerinin belirlenmesi, vacA genotiplerinin cagA ile birlikteliğinin araştırılması ve bunların klinik tanı ile ilişkisinin değerlendirilmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, Dokuz Eylül Üniversitesi Tıp Fakültesi Hastanesi, Gastroenteroloji Bilim Dalında peptik ülser hastalığı (PÜH) ve ülser olmayan dispepsi (ÜOD) tanısı almış hastalardan, endoskopi ile alınan mide doku örneğinde üreaz testi olumlu bulunan 29 hasta dahil edildi. Örneklerde H.pylori vacA s ve m genotipleri ve cagA varlığı polimeraz zincir reaksiyonu (PCR) ile araştırıldı.
Mide doku örnekleri, gastroenteroloji uzmanları tarafından, uygun şekilde dezenfeksiyonu yapılmış forseps ve endoskop yardımı ile pilordan 3-5 cm uzaklıktaki antrum bölgesinden ve en az iki farklı alandan alındı. Doku örnekleri 100 µl steril distile su içeren ependorf tüplere alınarak DNA izolasyonu basamağına kadar -70°C'de saklandı.
Mide doku örneğinden H.pylori DNA'sının eldesi için proteinaz-K, fenol-kloroform-izoamilalkol yöntemi kullanıldı. Her bir örnek için vacA s, m1, m2 ve cagA bölgelerine özgül dört ayrı primer seti ile (Tablo I), Perkin Elmer GenAmp 9600 cihazında (Roche, Almanya) 94°Cde 1 dakika ön denatürasyon; 94°Cde 1 dakika, 55°C'de 1 dakika, 72°Cde 2 dakika (5 döngü); 94°Cde 1 dakika, 53°C'de 1 dakika, 72°Cde 2 dakika (5 döngü); 94°Cde 1 dakika, 50°C'de 1 dakika, 72°Cde 2 dakika (20 döngü) ve 72°Cde 10 dakika son uzatma ile PCR gerçekleştirildi10. Kontrol olarak vacA s1m1 ve cagA pozitif NCTC 11637 suşu kullanıldı.
H.pylori vacA m bölgesinin nükleotid dizilimini saptamak için, bu bölgenin 785 baz çiftlik (bç) kısmı VA6-F ve VA6-R primerleri kullanılarak amplifiye edildi16 (Tablo I). Amplifiye edilen ürünler agaroz jel elektroforezi ile görüntülenerek 785 bç'lik ürün uzunluğu ile uyumlu bant büyüklükleri olumlu olarak değerlendirildi. Bu örnekler etanol ile saflaştırıldı. Dizileme reaksiyonları, Sequitherm Excel II DNA Sequencing Kits-LC (Epicentre Biotechnologies, SE9202LC, ABD) kullanılarak LI-COR "DNA sequencer" aygıtında gerçekleştirildi. İşlemler üreticilerin önerileri doğrultusunda uygulandı.
Elde edilen H.pylori dizileri Gen-Bank'tan alınan 35 referans dizi ile birlikte (AF049631 nt: 1925-2595) Clustal X versiyon 1.81 programı kullanılarak hizalandı17. Hizalanmış dizilerden MEGA versiyon 2.1 yazılımında "Neighbour-Joining" yöntemi ve "Kimura-2 parametre" düzeltmesi kullanılarak filogenetik ağaç oluşturuldu18. Ağacın güvenilirliği "bootstrap" analizi ile (1000 set) test edildi.
Hastalara ait klinik ve tanımlayıcı bilgiler, deneyler sonucunda elde edilen verilerle birlikte SPSS 8.0 programına aktarıldı. İstatistiksel değerlendirmede "Fisher's exact test" kullanıldı ve dağılımların p değeri için 0.05 düzeyinde farklı olup olmadıkları araştırıldı.
BULGULAR
Çalışmada, mide doku örnekleri alınan 29 hastanın 19 (%65.5)'u kadın, 10 (%34.5)'u erkek olup, yaşları 18-74 (ortalama 47.8 ± 13.6) yıl arasında değişmektedir. Klinik olarak, olguların 13 (%44.8)'ü PÜH, 16 (%55.2)'sı ÜOD tanısı almıştır. Hastaların birbirleriyle ailesel bağlantıları yoktur.
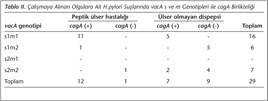
Peptik ülserli olguların 12'sinde s1, birinde s2 genotipi saptanırken; dispepsili olguların 10'u s1, altısı ise s2 genotipi olarak bulunmuştur. PÜH olan olguların 11'i m1, ikisi m2; ÜOD'li olguların ise beşi m1, 11'i m2 genotipinde tespit edilmiştir.
Yirmi dokuz olgunun 19'u cagA pozitif, 10'u cagA negatif olarak saptanmıştır. Genotipi s1 olan 17 olguda cagA pozitif bulunurken, genotipi s2 olan iki olguda pozitif olması, istatistiksel olarak anlamlı bulunmuştur (p= 0.002). Benzer olarak, m1 genotipli olguların tümü cagA pozitif olarak değerlendirilirken, m2 genotipli üç olgunun pozitif olması istatistiksel olarak anlamlıdır (p= 0.000). PÜH olan 13 olgudan 12'si cagA pozitif, biri cagA negatif (p= 0.008) ve ÜOD'li 16 olgudan yedisi cagA pozitif, dokuzu cagA negatif olarak saptanmıştır (Tablo II).
Tüm hasta (n= 29) örneklerine nükleotid dizi analizi uygulanmış; bu analiz sırasında H.pylori vacA m bölge dizisi içinde korunmuş 785 bç uzunluğundaki DNA dizilerinden, teknik şartlar nedeniyle 670 nükleotidlik diziler elde edilmiştir. Bu dizilerin hizalanması ve daha sonra filogenetik ağacın oluşturulması basamağında güvenilir veriler elde edebilmek amacıyla, Atherton ve arkadaşlarının19 önerdiği şekilde 670 nükleotidlik dizinin 3' ucundaki açıklıklardan zengin 113 nükleotidlik bölge analiz dışı bırakılmıştır. Gen-Bank'tan sağlanan genotipleri belirli H.pylori dizileri ve bu çalışmada elde edilen hizalanmış diziler ile oluşturulan filogenetik ağaç incelendiğinde, 29 örneğin 16'sının vacA m1, 13'ünün vacA m2 genotipi olarak yer aldığı izlenmiştir (Şekil 1). Dizileme sonucunda elde edilen genotipleme verileri ile PCR sonucu elde edilen genotiplemenin uyumlu olduğu görülmüştür.
TARTIŞMA
Gelişmekte olan ülkelerde H.pylori enfeksiyonları genç yaşlarda ve sıklıkla da çocukluk döneminde kazanılmaktadır20. Ülkemiz de, enfeksiyonun dağılımı açısından gelişmekte olan ülkeler arasında yer almaktadır21,22. Bu çalışmada, üç aydan uzun süreli dispeptik yakınmaları olan, klinik olarak PÜH ve ÜOD tanısı konulan ve mide doku örneklerinde üreaz testi pozitif bulunan seçilmiş bir grup hastada, H.pylori virülans faktörlerinden vacA genotipleri ve cagA'nın varlığı araştırılmıştır. H.pylori enfeksiyonlarının tanısında invazif olan (kültür, histopatoloji, hızlı üreaz testi, PCR) ve olmayan (serolojik testler, üre solunum testi) yöntemler kullanılmakta, bu yöntemlerin çeşitli avantajları ve dezavantajları bulunmaktadır23. Biyopsi örneklerinden kültür sonrası PCR ve genotiplendirme yapılabilmekle birlikte, bakterinin zor üretilmesi ve kültür için özel koşullara gereksinim duyulması sorun oluşturmaktadır. Çalışmamızda kültür yapılmaksızın, doğrudan mide doku örneklerinden DNA elde edilmiş, ardından PCR ve nükleotid dizi analizi yapılmıştır.
Son yıllarda H.pylori ile enfekte bireylerin bazılarında kronik atrofik gastritin yanı sıra gastrik adenokarsinom ve MALT lenfoma gelişirken bazılarında gelişmemesi, bu bakteriye özgü virülans faktörlerini gündeme getirmiştir. Bu faktörlerden biri olan vacA geninin s (s1a, s1b, s1c, s2) ve m (m1, m2a, m2b) bölgeleri için farklı allelik varyantları tanımlanmıştır11. H.pylori'nin vacA genotipinin saptanmasının, suşun ülserojenik özelliğinin belirlenmesinde, in vitro sitotoksin üretiminin gösterilmesinden daha önemli olduğu vurgulanmaktadır10. Ülkemizde, bakterinin virülans faktörleri ile ilgili serolojik ve moleküler yöntemler kullanılarak çeşitli çalışmalar yapılmış ve bu faktörlerin klinik seyir üzerindeki etkileri ile ilgili araştırmalara gereksinim olduğu vurgulanmıştır24,25,26,27. Kantarçeken ve arkadaşları24, histolojik olarak doudenal ülser, gastrik ülser ve ÜOD tanısı almış 107 olguda vacA ve cagA'nın varlığını tipe özgül primerler ile araştırmışlardır. Bu araştırıcılar, cagA pozitifliği ile duodenal ve gastrik ülser arasında istatistiksel olarak anlamlı bir birliktelik saptarken, bu gruplarda ÜOD grubuna göre daha yüksek oranda vacA pozitifliği bildirmişlerdir24. Çalışmamızda ise PÜH olan 13 olgunun 12'si s1, biri s2 genotipi; ÜOD'li 16 olgunun 10'u s1, altısı s2 genotipi olarak tanımlanmıştır. Suşların vacA s genotipleri ile birlikte m genotiplerinin de saptanması, genotiplerin klinik tanı ile birlikteliğinin incelenmesi ve PCR sonuçları ile nükleotid dizi analizi sonuçlarının karşılaştırılması, çalışmamızı farklı kılmıştır. Eldeki veriler ülkemizde vacA s1 genotipin baskın olduğunu ve PÜH ile ilişkili olduğunu göstermekle birlikte, gerek coğrafik, gerekse ekonomik ve sosyokültürel açıdan karışık bir toplum olmamız nedeniyle H.pylori genotiplerinin dağılımı açısından bölgeler arasında farklılıklar olabilir. Bu nedenle daha fazla veriye gerek vardır.
H.pylori'de rekombinasyonun ilk kanıtları vacA'da mozaik yapının saptanmasıyla ortaya konmuştur10. Bu mozaik yapı nedeniyle vacA s ve m genotiplerinin s1m1, s1m2 ve s2m2 olmak üzere farklı kombinasyonları bulunmuştur. Çalışmamızda, H.pylori pozitif 29 olgudan 16'sı s1m1, altısı s1m2 ve yedisi s2m2 olarak saptanmıştır (Tablo II). Genotipi s1m1 olan 16 olgunun tamamında cagA pozitifliği gözlenmiş ve bu olguların 11'inin klinik olarak PÜH tanısı aldığı izlenmiştir. Erzin ve arkadaşları28, H.pylori genotipleri ile klinik bulguların ilişkisini araştırdıkları çalışmalarında, H.pylori pozitif 91 olgudan 37'sinde vacA s1m1, 44'ünde s1m2 ve dokuzunda s2m2 genotipi saptamışlar; vacA s1a, cagA ve cagE pozitif suşların duodenal ülser ve gastrik kanser ile, vacA s2m2 genotipinin ise ÜOD ile birlikteliğini anlamlı bulmuşlardır. Ülkemizde yapılan bazı genotiplendirme çalışmalarında29 olduğu gibi çalışmamızda da s2m1 genotipi saptanmazken; Erzin ve arkadaşları28 gastrik kanserli bir olguda s2m1 genotipinin varlığını bildirmişlerdir. Bazı uluslararası çalışmalarda da vacA s2m1 genotipinin varlığına ilişkin veriler bildirilmiştir12,13. Bu genotipin etnik ya da coğrafik bir dağılım eğiliminde olabileceği düşünülmekle birlikte henüz bu konuda yeterli veri yoktur. Daha önceki veriler11 ve çalışmamızın sonuçları, vacA s1m1/cagA pozitif H.pylori suşlarının PÜH ile yakından ilişkili olduğu yönündedir.
CagA, H.pylori için tek başına bir virülans faktörü olarak değil, daha ziyade sitotoksine yardımcı bir toksin olarak fonksiyon görmekte ve cag patojenite adası (cagPAI) için bir belirleyici olarak kullanılmaktadır14,15. CagA varlığının, yüksek virülans, PÜH ve gastrik kanser ile yakından ilişkili olduğu vurgulanmaktadır30. Yapılan araştırmalarda, PÜH olan hastaların hemen hemen tamamının vacA pozitif H.pylori suşları ile enfekte olduğu, bunların da %90-95'inin cagA pozitif olduğu belirtilmektedir31. Yine vacA'nın farklı genotiplerine bakıldığında, vacA s1m1 genotipinin cagA pozitif suşlar ile birlikteliği bildirilmektedir11. Son yıllarda cagA'daki allelik varyasyonlar konusu da yoğun olarak araştırılmış ve tıpkı vacA'da olduğu gibi cagA'nın da coğrafi farklılıkları tanımlanmıştır32. Ayrıca, cag genotiplerindeki heterojenitenin H.pylori ile ilişkili klinik hastalık tipini etkileyebileceği belirtilmiştir30. Çalışmamızda, cagA bölgesi varlığının araştırılması amacıyla kullandığımız primerlerin nitelikleri nedeniyle cagA genotip farklılıklarının saptanması mümkün olamamıştır. Bulgularımız, olguların 19 (%65.5)'unda cagA geni varlığını göstermiş ve bu oran, Sarıbaş ve arkadaşlarının27 çocuk ve yetişkin hastaların endoskopik biyopsi örneklerinden izole edilen H.pylori suşlarında PCR ile saptadıkları cagA pozitiflik oranı (116/198; %58.6) ile uyumlu bulunmuştur. PÜH olan hastalar incelendiğinde, 13 hastanın 12'sinde cagA pozitifliğinin olduğu görülmüştür. CagA negatif bulunan bir PÜH olgusunun ise, klinik olarak endoskopi sırasında formu bozulmuş bulbus ve eritematöz gastrit bulguları gösteren bir hasta olduğu, fizik tedavi ve rehabilitasyon anabilim dalında gonartroz tanısı ile izlendiği ve yoğun nonsteroid antiinflamatuvar (NSAI) ilaç tedavisi aldığı belirlenmiştir. Dolayısıyla söz konusu olguda peptik ülserin ortaya çıkmasında, kullanılan NSAI ilaçların da rolü olabilir.
Çalışmamızda, üreaz testi ile H.pylori pozitif saptanan olguların tümüne vacA m bölge analizleri uygulanmış; bu amaçla hem bu bölgeye özgül primerler kullanılarak PCR yöntemi, hem de nükleotid dizi analizi yöntemi gerçekleştirilmiştir. Filogenetik analiz sonucunda, çalışmaya alınan 29 olgunun 16'sı vacA m1, 13'ü m2 olarak saptanmış ve bu sonuçlar PCR verileri ile uyumlu bulunmuştur. Genotiplendirmelerde nükleotid dizilerinin filogenetik analizi altın standart bir yöntem olmasına karşın, uygulaması oldukça zor, zaman alıcı ve pahalıdır. Tipe özgül primerler kullanarak PCR ile elde ettiğimiz verilerin dizi analizi sonuçları ile uyumlu oluşu, H.pylori vacA m bölgesine ait genotiplendirmenin uygun primerler ile yapılabileceği kanısını uyandırmaktadır.
KAYNAKLAR
- Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet 1984; 1(8390): 1311-5. [Özet]
- Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol 2000; 6(1): 20-31. [Tam Metin] [PDF]
- Correa P, Piazuelo MB. Natural history of Helicobacter pylori infection. Dig Liver Dis 2008; 40(7): 490-6. [Özet]
- Bruce MG, Maaros HI. Epidemiology of Helicobacter pylori infection. Helicobacter 2008; 13(Suppl 1): 1-6. [Özet]
- Thomas JE, Gibson GR, Darboe MK, Dale A, Weaver LT. Isolation of Helicobacter pylori from human faeces. Lancet 1992; 340(8829): 1194-5. [Özet]
- Owen RJ, Xerry J. Tracing clonality of Helicobacter pylori infecting family members from analysis of DNA sequences of three housekeeping genes (ureI, atpA and ahpC), deduced amino acid sequences, and pathogenicity-associated markers (cagA and vacA). J Med Microbiol 2003; 52(6): 515-24. [Özet] [Tam Metin] [PDF]
- Fujimoto Y, Furusyo N, Toyoda K, Takeoka H, Sawayama Y, Hayashi J. Intrafamilial transmission of Helicobacter pylori among the population of endemic areas in Japan. Helicobacter 2007; 12(2): 170-6. [Özet]
- Brenner H, Rothenbacher D, Bode G, Adler G. Parental history of gastric or duodenal ulcer and prevalence of Helicobacter pylori infection in preschool children: population based study. BMJ 1998; 316(7132): 665. [Tam Metin] [PDF]
- Leunk RD, Jonson PT, David BC, Kraft WGİ, Morgan DR. Cytotoxic activity in broth-culture filtrates of Camphylobacter pylori. J Med Microbiol 1988; 26(2): 93-9. [Özet] [PDF]
- Atherton JC, Cao P, Peek RM, Tummuru MKR, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. J Biol Chem 1995; 270(30): 17771-7. [Özet] [Tam Metin] [PDF]
- Doorn LJ, Figueiredo C, Sanna R, et al. Expanding allelic diversity of Helicobacter pylori vacA. J Clin Microbiol 1998; 36(9): 2597-603. [Özet] [Tam Metin] [PDF]
- Martinez A, Gonzales C, Kawaguchi F, et al. Helicobacter pylori: cagA analysis and vacA genotyping in Chile. Detection of a s2/m1 strain. Rev Med Chil 2001; 129(10): 1147-53. [Özet]
- Letley DP, Lastovica A, Louw JA, Hawkey CJ, Atherton JC. Allelic diversity of the Helicobacter pylori vacuolating cytotoxin gene in South Africa: rarity of the vacA s1a genotype and natural occurrence of an s2/m1 allele. J Clin Microbiol 1999; 37(4): 1203-5. [Özet] [Tam Metin] [PDF]
- Censini S, Lange C, Xiang Z, et al. Cag, a pathogenity island of Helicobacter pylori, encodes type I-specific and disease-associated virulence factors. Proc Natl Acad Sci USA 1996; 93(25): 14648-53. [Özet] [Tam Metin] [PDF]
- Slater E, Owen RJ, Willams M, Pounder R. Conservation of the cag pathogenity island of Helicobacter pylori: associations with vacuolating cytotoxin allele and IS605 diversity. Gastroenterology 1999; 117(6): 1308-15. [Özet] [Tam Metin] [PDF]
- Strobel S, Bereswill S, Balig P, Allgaier P, Sonntag HG, Kist M. Identification and analysis of a new vacA genotype variant of Helicobacter pylori in different patient groups in Germany. J Clin Microbiol 1998; 36(5): 1285-9. [Özet] [Tam Metin] [PDF]
- Thompson JD, Gibson TJ, Plewniak F, Jeanmougin F, Higgins DG. The CLUSTAL X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res 1997; 25(24): 4876-82. [Özet] [PDF]
- Kumar S, Tamura K, Jacobsen I, Nei M. MEGA 2: molecular evolutionary genetics analysis software. Bioinformatics 2001; 17(12): 1244-5. [Özet] [PDF]
- Atherton JC, Sharp PM, Cover TL, et al. Vacuolating cytotoxin (vacA) alleles of Helicobacter pylori comprise two geographically widespread types m1 and m2 and have evolved through limited recombination. Curr Microbiol 1999; 39(4): 211-8. [Özet] [Tam Metin] [PDF]
- Bardhan PK. Epidemiological features of Helicobacter pylori infection in developing countries. Clin Infect Dis 1997; 25(5): 973-8. [Özet] [PDF]
- Us D, Hascelik G. Seroprevalence of Helicobacter pylori infection in an asymptomatic Turkish population. J Infect 1998; 37(2):148-50. [Özet]
- Seyda T, Derya C, Fusun A, Meliha K. The relationship of Helicobacter pylori positivity with age, sex, and ABO/Rhesus blood groups in patients with gastrointestinal complaints in Turkey. Helicobacter 2007; 12(3): 244-50. [Özet]
- Yılmaz YA. Helicobacter pylori. Mikrobiyolojik tanı yöntemleri. Hacettepe Tıp Derg 2004; 35(4): 182-6. [PDF]
- Kantarceken B, Aladag M, Atik E, et al. Association of CagA and VacA presence with ulcer and non-ulcer dyspepsia in a Turkish population. World J Gastroenterol 2003; 9(7): 1580-3. [Özet] [Tam Metin] [PDF]
- Erzin Y, Altun S, Dobrucali A, et al. Analysis of serum antibody profile against H.pylori VacA and CagA antigens in Turkish patients with duodenal ulcer. World J Gastroenterol 2006; 12(42): 6869-73. [Özet] [Tam Metin] [PDF]
- Guducuoglu H, Berktaş M, Bozkurt H, et al. Evaluation of western blot method for the detection of antibodies to Helicobacter pylori antigens in patients with gastric carcinoma and cases with epigastric complaints. Mikrobiyol Bul 2010; 44(1): 21-8. [Özet]
- Saribas Z, Demir H, Saltik Temizel IN, Simsek H, Ozen H, Akyon Y. Detection of cagA prevalence in clinical isolates of Helicobacter pylori. Mikrobiyol Bul 2010; 44(3): 461-5. [Özet]
- Erzin Y, Koksal V, Altun S, et al. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA, babA2 genotypes and correlation with clinical outcome in Turkish patients with dyspepsia. Helicobacter 2006; 11(6): 574-80. [Özet]
- Saribasak H, Salih BA, Yamaoka Y, Sander E. Analysis of Helicobacter pylori genotypes and correlation with clinical outcome in Turkey. J Clin Microbiol 2004; 42(4): 1648-51. [Özet] [Tam Metin] [PDF]
- Tomasini ML, Zanussi S, Sozzi M, Tedeschi R, Basaglia G, De Paoli P. Heterogeneity of cag genotypes in Helicobacter pylori isolates from human biopsy specimens. J Clin Microbiol 2003; 41(3): 976-80. [Özet] [Tam Metin] [PDF]
- Salih BA. The role of the putative virulence markers (cagA and vacA) of Helicobacter pylori in peptic ulcer disease. Saudi Med J 2004; 25(7): 830-6. [Özet] [PDF]
- Valmaseda Pérez T, Gisbert JP, Pajares García JM. Geographic differences and the role of cagA gene in gastroduodenal diseases associated with Helicobacter pylori infection. Rev Esp Enferm Dig 2001; 93(7): 471-80. [Özet]
İletişim (Correspondence):
Dr. Meral Karaman,
Dokuz Eylül Üniversitesi Tıp Fakültesi,
Multidisipliner Laboratuvarları, İzmir, Türkiye.
Tel (Phone): +90 232 412 46 53,
E-posta (E-mail): meral.karaman@deu.edu.tr