Trichophyton rubrum Klinik İzolatlarının
Hemolitik Aktivitesi ve
Antifungal İlaçlara İn Vitro Duyarlılığının Saptanması*
Determination
of Hemolytic Activity and In Vitro Antifungal Susceptibility of
Trichophyton rubrum Clinical Strains
Gülkan SOLGUN, Duygu FINDIK, Hatice TÜRK DAĞI, Uğur ARSLAN
Selçuk Üniversitesi Meram Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Konya.
Selcuk University Meram Faculty of Medicine, Department of Medical Microbiology, Konya, Turkey.
* Bu çalışma Selçuk Üniversitesi Bilimsel Araştırma Proje Koordinatörlüğü tarafından desteklenen (BAP Proje No: 06102040) proje kapsamında gerçekleştirilmiş ve "XII. International Congress of Mycology, 5-9 Ağustos 2008, İstanbul" Kongresinde poster olarak sunulmuştur.
ÖZET
Yüksek morbiditeye sahip dermatofitoz etkenleri arasında yer alan Trichophyton türleri, immün sistem hücreleri üzerine toksik etki gösteren hemolizinler de dahil olmak üzere virülans faktörü olarak kabul edilen çok sayıda enzim salgılamaktadır. Relaps ve kronikleşme oranının yüksek olduğu dermatofitozların tedavisi ise, uygun olmayan antifungal seçimi ve çapraz direncin giderek artması nedeniyle oldukça zorlaşmaktadır. Bu çalışmada, dermatofitoz ön tanılı hastalardan izole edilen Trichophyton rubrum suşlarının hemolitik aktivitesinin araştırılması ve ketokonazol, itrakonazol, sulkonazol, ekonazol ve terbinafine karşı in vitro duyarlılıklarının belirlenmesi amaçlanmıştır. Hastalardan alınan saç, deri ve tırnak örnekleri, potasyum hidroksit ile direkt mikroskobik olarak incelenmiş ve mikolojik kültürleri (mikobiyotik agar ve Sabouraud dekstroz agar besiyerlerinde, 25°C ve 37°C'de, üç hafta inkübasyon) yapılmıştır. İzolatların hemolitik aktiviteleri, %5 koyun kanlı Columbia agar kullanılarak 25°C'de 7-14 gün inkübasyon sonucu değerlendirilmiştir. Hemoliz saptanan besiyerleri hemolitik aktivitenin artması için 37°C'de 1-5 gün daha inkübe edilmiştir. Antifungal duyarlılık testi "Clinical and Laboratory Standards Institute (CLSI)" M38-A standartlarına uygun olarak sıvı mikrodilüsyon yöntemi ile çalışılmıştır. Çalışmada, üreaz aktivitesi ve kıl delme testi negatif, patates dekstroz agarda pigmentasyon yapan 79 T.rubrum suşu değerlendirilmiş; suşların 71 (%89.9)'inde hemolitik aktivite saptanmıştır. Elli suş tam olmayan (alfa) hemoliz, 21 suş tam (beta) hemoliz oluştururken, sekiz tanesinde hemoliz görülmemiştir. Büyük kolonilerin daha geniş, küçük kolonilerin ise daha küçük hemoliz zonu oluşturdukları görülmüş; ancak koloninin büyümesi alfa-hemolizi beta-hemolize dönüştürmemiştir. Antifungal duyarlılık testi sonuçlarına göre minimum inhibitör konsantrasyonu (MİK) aralığı, MİK50 ve MİK90 değerleri sırasıyla; ketokonazol için 0.0125-4 µg/ml, 0.5 ve 2 µg/ml; itrakonazol için 0.0625-2 µg/ml, 0.5 ve 1 µg/ml; sulkonazol için 0.0313-4 µg/ml, 0.25 ve 1 µg/ml; ekonazol için 0.0313-0.125 µg/ml, 0.0313 ve 0.0625 µg/ml ve terbinafin için 0.0313-0.0313 µg/ml, 0.0313 ve 0.0313 µg/ml olarak bulunmuştur. Hemoliz oluşturan ve oluşturmayan izolatların MİK değerleri karşılaştırıldığında, hemolitik aktivite ile MİK değerleri arasında bir ilişki olmadığı görülmüştür. Sonuç olarak çalışmamızda, klinik T.rubrum suşlarına karşı en etkili antifungal ilacın terbinafin olduğu izlenmiş; sıklıkla kullanılan itrakonazolün MİK değerlerinin beklenenden daha yüksek, ekonazolün ise daha düşük olduğu saptanmıştır.
Anahtar sözcükler: Trichophyton rubrum; antifungal duyarlılık; minimum inhibitör konsantrasyonu; hemolitik aktivite.
ABSTRACT
Trichophyton spp. which are among the agents of dermatophytosis with high morbidity, produce many virulence factors including hemolysins that exhibit toxic activity on immune system cells. Since relapses and chronicity are common problems related to dermatophytosis, prompt and appropriate treatment is of crucial importance. However, treatment is getting difficult due to the choice of inappropriate antifungals and increasing rates of cross-resistance among antifungal agents. The aims of this study were to investigate the hemolytic activities of Trichophyton rubrum strains isolated from patients with dermatophytosis and to detect the in vitro susceptibilities of those strains to ketoconazole, itraconazole, sulconazole, econazole and terbinaphine. Hair, skin and nail samples of patients were examined with direct microscopy using potassium hydroxide and cultivated on mycobiotic agar and Sabouraud dextrose agar. To determine hemolytic activities of T.rubrum strains, they were subcultured in Columbia Agar with 5% sheep blood and incubated for 7-14 days at 25°C in aerobic conditions. Media which displayed hemolysis were further incubated for 1-5 days at 37°C to increase hemolytic activity. Antifungal susceptibility testing was done with broth microdilution method guided by Clinical and Laboratory Standards Institute (CLSI) M38-A document. A total of 79 T.rubrum strains which exhibited negative urease and hair perforation tests, yielded pigmentation in potato-dextrose agar, were evaluated in the study. Hemolytic activity was detected in 71 strains (89.9%). Fifty strains showed incomplete (alpha) hemolysis and 21 strains showed complete (beta) hemolysis, whereas hemolysis was absent in eight of the isolates. Larger colonies created a larger zone of hemolysis and the smaller ones created a smaller zone. However, alpha-hemolysis did not turn to beta-hemolysis following further enlargement of the colony. According to antifungal susceptibility testing, the minimum inhibitory concentration (MIC) ranges, MIC50 and MIC90 values were found 0.0125-4 µg/ml, 0.5 and 2 µg/ml for ketoconazole; 0.0625-2 µg/ml, 0.5 and 1 µg/ml for itraconazole; 0.0313-4 µg/ml, 0.25 and 1 µg/ml for sulconazole; 0.0313-0.125 µg/ml, 0.0313 and 0.0625 µg/ml for econazole; 0.0313-0.0313 µg/ml, 0.0313 and 0.0313 µg/ml for terbinaphine, respectively. When the MIC values of hemolytic and non-hemolytic T.rubrum strains were compared, it was detected that hemolytic activity had no effect on MIC values. Our data have indicated that terbinaphine was the most effective antifungal agent against T.rubrum, while MIC values for itraconazole which is in common clinical use, were higher than expected and MIC values for econazole were lower than expected.
Key words: Trichophyton rubrum; antifungal sensitivity; minimum inhibitory concentration; hemolytic activity.
Geliş Tarihi (Received): 14.05.2010 • Kabul Ediliş Tarihi (Accepted): 06.08.2010
GİRİŞ
Yüzeyel mikozların majör etkeni olan dermatofitler, aerop funguslar olup keratini besin maddesi olarak kullandıkları için keratinofilik funguslar olarak adlandırılır. Dermatofitlerin neden olduğu enfeksiyon ya da kolonizasyona "dermatofitoz" adı verilmektedir1. Epidermophyton, Microsporum ve Trichophyton olmak üzere üç anamorfik (aseksüel ya da imperfect) türde sınıflandırılan dermatofitler, canlı hücreye girişi sağlayan keratinofilik proteazlar yaparak hifleri ile deri ve tırnağın stratum korneum tabakasına penetre olurlar1,2. İnsan enfeksiyonlarından izole edilen dermatofit türleri çoğunlukla Trichophyton cinsi içinde yer alır. Trichophyton türleri saç, deri ve tırnağı enfekte eder. Antropofilik olan Trichophyton rubrum, tinea pedis, tinea korporis, tinea manum ve tinea unguium olgularında en önemli etkendir3.
Dermatofitlerin laboratuvar tanısında moleküler yöntemler, gerek alt yapı gereksinimi gerekse yüksek maliyeti nedeniyle sık kullanılmamaktadır. Rutin olarak laboratuvarlarda dermatofitlerin tanımlanmasında anamorf formları temel alınmaktadır. Tanımlamada kullanılan primer kriterler, mikroskobik görünüm, konidyum ve pigment oluşumu, Sabouraud dekstroz agar (SDA)'daki özellikleri; sekonder kriterler ise beslenme gereksinimi, ısıya tolerans, üre hidrolizi, saç perforasyonu gibi fizyolojik özelliklerdir3.
Dermatomikozlar, bildirimi zorunlu hastalıklardan olmadıkları için gerçek insidansları bilinmemektedir. Buna rağmen toplumun yaklaşık %20'sinde kronik dermatomikoz görülmektedir. Erişkin erkeklerin ortalama %90'ında yaşamları boyunca en az bir kez dermatomikoz görüldüğü bilinmektedir1,2. Dermatomikozların tedavisinde sistemik ve topikal etkili antifungal ilaçlar kullanılır; ancak bu enfeksiyonların tedavisi relapslar, reenfeksiyonlar ve tedavinin uzun sürmesinden dolayı zordur4. Yeni antifungal ilaçların kullanıma girmesi ve ilaçlara dirençlerin görülmeye başlanması ile antifungal ilaçlara in vitro duyarlılık testlerinin önemi giderek artmaktadır. Mantarların antifungal ilaçlara duyarlılıkları makro ve mikrodilüsyon, agar dilüsyon ya da disk difüzyon yöntemleri ile belirlenebilmektedir4.
Hemolizin, ökaryotik hücreler üzerinde por oluşturucu ve lizis etkisi yaptığı gibi eritrositler ve fagositik hücreler üzerine de sitotoksik etki göstermektedir. T.rubrum, Trichophyton equinum, Trichophyton mentagrophytes ve Trichophyton verrucosum gibi bazı türlerin koyun, at ve sığır kanlı agar besiyerlerinde hemoliz özellikleri araştırılmış, T.rubrum ve T.equinum'un hem tam hem de tam olmayan hemoliz meydana getirdiği belirlenmiştir5.
Bu çalışmada, dermatofitoz ön tanılı hastaların saç, deri ve tırnak örneklerinden izole edilen T.rubrum suşlarının hemolitik aktivitesinin ve ketokonazol, itrakonazol, sulkonazol, ekonazol ve terbinafin duyarlılıklarının araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, Selçuk Üniversitesi Meram Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Merkez Mikrobiyoloji (Mikoloji) Laboratuvarına 01.11.2005- 01.01.2007 tarihleri arasında, dermatoloji kliniğinden dermatofitoz ön tanısı ile gönderilen hastalardan alınan klinik örneklerden izole edilen T.rubrum suşları dahil edildi. Dermatofit enfeksiyonu düşünülen lezyon alanı %70'lik alkol ile silinerek örnek alındı. Direkt mikroskopi için lam üzerine alınan örneğe %10-15 potasyum hidroksit (KOH) ilave edildi ve epidermal doku kolayca yayılabilir hale gelinceye kadar oda ısısında bekletildi. Daha sonra ışık mikroskobunda tomurcuklanan ve tomurcuklanmayan mantar sporları ve artrospor yapan ya da yapmayan hifler arandı.
Kültür için alınan örnekler, mikobiyotik agar (Oxoid) ve SDA'ya (Oxoid) her besiyerinde 4-5 inokülasyon olacak şekilde besiyerine yarı yarıya gömülerek ekildi. Besiyerleri 25°C ve 37°C de üç hafta süreyle inkübe edildi ve üreme saptananlar ayrıldı. Primer izolasyon besiyerinde oluşan koloninin üreme hızı, yüzey yapısı (çıplak, mumsu, pudramsı, granüler, süet benzeri, kadifemsi ve tüysü), yüzey topografisi (düz, kabarık ve dağınık koloni şekli), koloninin büklüm tipi (ışınsal, beyin ya da krater görünümlü), yüzey boyası, koloni tabanında pigment oluşumu, iyi ürediği ısı derecesi (25oC ve 37oC'de üreyebilme) ve çözünebilir pigmentin varlığı incelendi. Mikobiyotik agarda 25oC'de üreyen küf kolonileri laktofenol pamuk mavisi (LPM) boyası ile boyanarak preparatlarda hiflerin yapısı, makro ve mikrokonidyum varlığı araştırıldı. Birbirlerine benzer konidyum üreten Trichophyton spp. izolatlarının tür düzeyinde tanımlanması üreaz testi, in vitro kıl delme testi ve patates dekstroz agar (PDA)'da (Oxoid) kırmızı pigment oluşumu değerlendirilerek yapıldı3,6.
Üre hidroliz testinde Christensen's üre agar (Oxoid) ve Christensen's üre buyyon (Merck) kullanıldı ve agarda 14 gün içinde, buyyonda dört gün içinde pembe rengin oluşması üreaz enzimi pozitif olarak kabul edildi6.
Kıl delme testi için küçük çocuklardan alınan 1 cm boyundaki açık renkli saçlar 100 mm'lik petri kutularında otoklavda 120°C'de 20 dakika steril edildi. Petri kutuları soğuduktan sonra 8-10 saç teli içeren petri kutusuna 25 ml steril distile su ve süzerek steril edilmiş %10'luk maya özütünden (Oxoid) 100 µl dağıtıldı. Üzerine üremiş olan küften miçel parçacıkları ekildi ve 25°C'de yaklaşık dört hafta bekletildi. Yedi, 14 ve 28. günlerde birkaç saç teli çıkarılıp LPM ile boyanarak incelendi. Yirmi sekiz gün içinde saçı dikey ya da koni biçiminde delen mantar elemanları tespit edilince test pozitif olarak kabul edildi1,3,6.
Üreyen koloninin pigment oluşumunu daha iyi gözleyebilmek ve saf kültürünü elde edebilmek için PDA'ya pasajı yapıldı ve 25°C'de inkübe edildi. Yirmi sekiz gün içinde besiyerinin arka yüzünde şarap kırmızısı pigment gelişmesi pozitif reaksiyon olarak kaydedildi6. T.rubrum suşlarının hemolitik aktivitelerini saptamak için %5 koyun kanlı Columbia agara pasajları yapıldı5. 25°C'de, aerop koşullarda 7-14 gün inkübe edildi. Hemoliz görülen besiyerleri hemolitik aktivitenin artması için 37°C'de 1-5 gün daha inkübe edildi. Hemolitik aktivite tam (beta) ve tam olmayan (alfa) hemoliz olarak kaydedildi. Hemolitik aktivitesi olan ya da olmayan koloniler serum fizyolojik ile direkt preparat hazırlanarak, hifler ve mikrokonidyumlar yapı ve saflık bakımından incelendi7.
Antifungal duyarlılık testi "Clinical and Laboratory Standards Institute (CLSI)" M38-A standartlarına uygun olarak mikrodilüsyon yöntemi ile çalışıldı8. 165 M MOPS (Merck) ile oda ısısında pH 7.0'ye tamponlanan sentetik RPMI 1640 buyyonu (L-glutaminli, sodyum bikarbonatsız, pH indikatörü olarak fenol red bulunan) (Biological Industries) kullanıldı. Antifungal olarak ketokonazol (Sigma), itrakonazol (Sigma), terbinafin (Santa-farma), ekonazol (Sigma) ve sulkonazol (Sigma) toz halinde kullanıldı. 4.8 mg toz antifungal 3 ml DMSO'da (Merck) sulandırılarak 1600 µg/ml konsantrasyonda stok solüsyon elde edildi. Antifungal (final) test konsantrasyonları 0.0313-16 µg/ml olarak ayarlandı8. Mikrodilüsyon plaklarının (96 kuyucuklu) 1-10 kuyucuklarına dilüsyon sırasına uyularak 100 µl dağıtıldı. Üzeri steril olarak kapatıldı ve kullanılıncaya kadar -70°C'de saklandı.
İnokülum hazırlamak için +4°C'de saklanan T.rubrum suşları PDA'ya pasaj yapılarak 35°C'de yedi gün inkübe edildi. Kolonilerin üzerine 10 ml %0.85 NaCI eklendi ve halka öze ile dokunularak konidyum ve hiflerin ayrılması sağlandı. Bu süspansiyon steril bir tüpe transfer edildi. Üç-beş dakika oda ısısında ağır partiküllerin çökmesi için bekletildikten sonra üstteki homojen kısım alınıp, kapaklı steril tüpte 15 saniye vortekslendi. Bu karışımın bulanıklığı spektrofotometre (Analytic Jena, Spekol 1300) ile 530 nm'de optik dansite 0.15-0.17 (%68-70 transmittans) olacak şekilde ayarlandı. 0.2 ml süspansiyon 9.8 ml RPMI 1640 ile 1/50 dilüe edildi. 100 µl dilüe ilaç süspansiyonu bulunan mikropleytin 1-10 kuyucuğuna 100 µl dilüe inokülum süspansiyonu eklendi. Her mikroplak için iki sıra ilaçsız kontrol [bir sterilite kontrolü (yalnız besiyeri), bir üreme kontrolü (100 µl inokülum süspansiyonu ve 100 µl besiyeri)] kullanıldı. 28°C'de yedi gün inkübe edildi ve görsel olarak değerlendirildi. İnkübasyon sonrası her bir kuyucuktaki üreme, kontrol kuyucuğuyla karşılaştırıldı. Üremenin durduğu en düşük antifungal konsantrasyonu minimum inhibitör konsantrasyonu (MİK) değeri olarak kabul edildi8. Kontrol suşu olarak Candida krusei ATCC 6258 ve Candida parapsilosis ATCC 22019 kullanıldı. Referans suşlar her antifungal ilaç için test edildi.
BULGULAR
Çalışmamızda, dermatofitoz ön tanılı hastalardan alınan örneklerin kültürlerinden, üreaz aktivitesi ve kıl delme testi negatif, PDA'da pigmentasyon yapan 79 adet T.rubrum suşu üretilmiştir. Suşların 71 (%89.9)'inde hemolitik aktivite saptanmış; 50 suş alfa-hemoliz ve 21 suş beta-hemoliz oluştururken, sekiz tanesinde hemoliz görülmemiştir. Büyük kolonilerin daha geniş hemoliz zonu oluşturdukları, küçük kolonilerin ise daha küçük zon oluşturdukları gözlenmiş; ancak koloninin daha da büyümesi, alfa-hemolizi beta-hemolize dönüştürmemiştir.
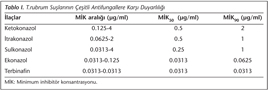
Antifungal duyarlılık testi sonucu izolatların ketokonazol, itrakonazol, sulkonazol, ekonazol ve terbinafin için saptanan MİK değerleri Tablo I'de gösterilmiştir. T.rubruma en etkili antifungalin terbinafin olduğu tespit edilmiş; sıklıkla kullanılan itrakonazol MİK değerlerinin beklenenden daha yüksek, ekonazolün ise düşük olduğu belirlenmiştir.
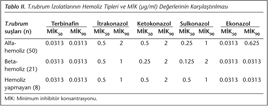
Hemoliz yapan ve yapmayan T.rubrum suşlarının MİK değerleri karşılaştırılmış ve hemolitik aktivitenin MİK değerleri üzerine etkisinin olmadığı izlenmiştir (Tablo II).
TARTIŞMA
Dermatofitozlar sırasında ortaya çıkan patolojik reaksiyonlar, büyük ölçüde mantar tarafından üretilen proteaz, keratinaz, üreaz, elastaz, deoksiribonükleaz, kollajenaz, lipaz, fosfolipaz ve glukosidaz gibi enzimlerle ilişkilidir2. Bu enzimler arasında keratinaz, konak dokunun mantar tarafından invazyonuna yardımcı olduğu için en önemli virülans faktörü kabul edilmektedir. Trichophyton türleri tarafından oluşturulan hemolizinler de, bakteriyel hemolizinler gibi konağın immün yanıt hücreleri üzerine toksik etki göstermekte ve mantarın immün yanıttan kaçışını kolaylaştırmaktadır5. Çalışmamızda, dermatofitozlu hastalardan izole edilen 79 T.rubrum suşunun hemolitik aktivitesi değerlendirilmiş ve 21 (%26.6)'inin beta, 50 (%63.3)'sinin ise alfa-hemoliz olmak üzere 71 (%89.9) suşun hemoliz oluşturduğu saptanmıştır.
Son yıllarda mantar enfeksiyonlarının tedavisi için geliştirilen yeni antifungal ilaçlar ile ilgili duyarlılık çalışmaları devam etmektedir4,9. Ancak filamentöz mantarların in vitro antifungal duyarlılık testlerinde; suşların yapısal farklılıkları, inokülum miktarı, kullanılan besiyeri, inkübasyon koşulları (ısı ve süre) ve sonuçların yorumlanması gibi faktörler nedeniyle standardizasyon zor olmaktadır9,10. Karşılaşılan önemli sorunlardan birisi de antifungal ilaçların duyarlılık ya da direnç sınırlarının (break point) tam olarak belirlenememiş olmasıdır11. Çalışmamızda, T.rubrum klinik izolatlarının terbinafin, ketokonazol, itrakonazol, sulkonazol ve ekonazole karşı duyarlılığı CLSI önerilerine göre mikrodilüsyon yöntemiyle araştırılmış ve MİK değerleri belirlenmiştir8.
Terbinafin, allilamin sınıfından hem topikal hem de sistemik kullanılabilen geniş spektrumlu bir antifungal olup, mantar hücresinde skualen epoksidaz enzimini inhibe ederek ergosterol sentezini engeller. Dermatofitlere karşı fungusid etki gösteren terbinafin, lipofilik ve keratinofilik bir ilaçtır12. Favre ve arkadaşlarının13 çalışmasında, dermatofitlere karşı terbinafinin MİK aralığı, MİK50 ve MİK90 değerleri sırasıyla; 0.002-0.004 µg/ml, 0.004 µg/ml ve 0.016 µg/ml olarak bulunmuş ve dermatofitler için en potent ilaç olduğu belirtilmiştir. Literatür incelendiğinde; dermatofitler için terbinafin MİK aralığının çok düşük bildirildiği çalışmaların yanında [(< 0.031 µg/ml)14,15, (0.001-≥ 0.5 µg/ml)16, (< 0.007-0.031 µg/ml)17, (0.007-0.015 µg/ml)18], daha yüksek değerlerin saptandığı çalışmalar [(0.03-4 µg/ml)19, (0.01-0.6 µg/ml)20] ve oldukça geniş MİK aralıklarının rapor edildiği çalışmaların [(0.003-16 µg/ml)21] mevcut olduğu görülmektedir. Bizim çalışmamızda terbinafin MİK aralığı 0.0313-0.0313 µg/ml, MİK50 ve MİK90 değerleri 0.0313 µg/ml olarak saptanmıştır. Dolayısıyla bizim çalışmamız ve diğer çalışmaların sonuçları, terbinafinin düşük MİK değerleri ile dermatofitlere karşı en etkili antifungal olma özelliğini koruduğunu vurgulamaktadır.
Azoller sitokrom p-450 enzim sisteminde yer alan ve lanosterolün ergosterole dönüşümünü sağlayan 14-α-demetilaz enzimini inhibe ederler. İtrakonazol, sistemik etkili sentetik bir triazol türevidir. Keratine yüksek afinitesi ve geniş spektrumlu aktivitesi ile tırnakta flukonazol ve terbinafinden daha uzun süre etkinliğini sürdürürür22. Yapılan çalışmalarda dermatofitler için itrakonazol MİK aralığı; 0.25-2 µg/ml23, 0.001-0.5 µg/ml16 ve 40-80 µg/ml24 gibi çok farklı değerlerde bildirilmiştir. T.rubrum suşları için itrakonazol MİK aralığı ise, çok merkezli bir çalışmada 0.06-2 µg/ml20, Çetinkaya ve arkadaşlarının19 çalışmasında 0.06-8 µg/ml olarak rapor edilmektedir. Bizim çalışmamızda T.rubrum izolatları için itrakonazol MİK aralığı 0.0625-2 µg/ml olarak saptanmış olup, bu sonucun diğer çalışmaların19,20,25,26 bulgularıyla uyumlu olduğu izlenmiştir.
Sulkonazol dermatofitlere karşı aktivitesi olan geniş spektrumlu bir sentetik imidazol türevidir27. Karaca ve Koç28 çalışmalarında, 50'si T.rubrum olan 56 dermatofit suşunun sulkonazole duyarlılıklarını mikrodilüsyon yöntemiyle araştırmışlar ve MİK aralığını < 0.008-4 µg/ml olarak bulmuşlardır. Bu sonuçlarla uyumlu olarak bizim çalışmamızda sulkonazol MİK aralığı < 0.0313-4 µg/ml olarak tespit edilmiştir.
Geniş spektrumlu bir mikonazol türevi olan ekonazolün topikal uygulamada stratum korneumdaki konsantrasyonu, dermatofitler için MİK değerinin çok üzerine çıkmakta ve dermisin orta bölgelerine kadar ulaşmaktadır27. Favre ve arkadaşları13 mikrodilüsyon yöntemi ile T.rubrum için ekonazol MİK aralığını 0.016-0.031 µg/ml, MİK50 ve MİK90 değerlerini ise sırasıyla 0.016 µg/ml ve 0.063 µg/ml olarak bildirmişlerdir. Bizim çalışmamızda ekonazol MİK aralığı 0.0313-0.125 µg/ml, MİK50 ve MİK90 değerleri sırasıyla 0.0313 µg/ml, 0.0625 µg/ml olarak tespit edilmiş ve terbinafinden sonra en etkin antifungal olduğu izlenmiştir.
Ketokonazol, lokal ve sistemik kullanılabilen bir imidazol türevidir. Ergosterol biyosentezini inhibe eder ve hücre membran geçirgenliğini artırır12,27. Pujol ve arkadaşları29 mikrodilüsyon yöntemi ile 49 dermatofitin antifungal ilaçlara duyarlılığını araştırmışlar, sekiz T.rubrum suşunda ketokonazol için MİK aralığını 0.5-2 µg/ml olarak tespit etmişlerdir. Ketakonazolün MİK aralığını 0.5-2 µg/ml olarak bulan Korting ve arkadaşları30 ise bu değerlerin dermatofitlerin eradikasyonu için yeterli olduğunu bildirmişlerdir. Macura'nın31 80 dermatofit suşunu içeren çalışmasında, ketokonazolün MİK aralığı 0.1-100 µg/ml gibi geniş bir değerde tespit edilmiştir. Bazı çalışmalarda ketokonazol için çok düşük MİK aralıkları da [(0.1-1 µg/ml)32, (0.03-1 µg/ml)33] elde edilmiştir. Bizim çalışmamızda ketokonazol MİK aralığı 0.0125-4 µg/ml, MİK50 ve MİK90 değerleri sırasıyla 0.5 ve 2 µg/ml olarak saptanmıştır.
Çalışmamızda, hemoliz yapan ve yapmayan T.rubrum izolatlarının MİK değerleri arasında önemli bir farkın olmaması, hemolitik aktivite ile MİK değerleri arasında bir ilişki olmadığını düşündürmekle birlikte, bu durumun ileri çalışmalarla doğrulanması gerektiği açıktır.
Son yıllarda antifungal duyarlılık testlerindeki gelişmeler ve standardizasyon çalışmaları, ilaçların in vitro aktivitesi, etki spektrumu ve direncin araştırılabilmesi açısından mikoloji alanı için önemli bir adımdır. Zira uygun olmayan antifungal seçimi ve çapraz direncin giderek artması, kronikleşme eğilimindeki dermatomikozların tedavi başarısını ortadan kaldırmaktadır. Sonuç olarak çalışmamızda, T.rubrum klinik izolatlarına karşı en etkili antifungalin terbinafin olduğu, sıklıkla kullanılan itrakonazolün MİK değerlerinin beklenenden daha yüksek, ekonazolün ise daha düşük olduğu saptanmıştır. Dolayısıyla bölgesel antifungal duyarlılık çalışmalarının yapılması, ampirik tedavi açısından klinisyene yardımcı olacaktır. Buna karşın yüzeyel mikoz etkenleri için in vitro ve in vivo uyumunun araştırıldığı daha ileri çalışmalara gereksinim vardır.
KAYNAKLAR
- Macura AB. Dermatophyte infections. Int J Dermatol 1993; 32(5): 313-23.
- Rippon JW. Cutaneous infections: dermatophytosis and dermatomycosis, pp: 169-275. In: Medical Mycology. The Pathogenic Fungi and the Pathogenic Actinomycetes. 1988, 3rd ed. WB Saunders, Philadelphia.
- Tümbay E. Dermatofitler, s: 1785-97. Topçu AW, Söyletir G, Doğanay M (ed), İnfeksiyon Hastalıkları ve Mikrobiyolojisi. 2002. Nobel Tıp Kitabevleri, Ankara.
- McGinnis MR, Rinaldi MG. Antifungal drugs: mechanism of action, drug resistance, susceptibility testing, and assays of activity in biologic fluids, pp: 176-211. In: Lorian V (ed), Antibiotics in Laboratory Medicine. 1996, 4th ed. Williams & Wilkins, Baltimore.
- Schaufuss P, Steller U. Haemolytic activities of Trichophyton species. Med Mycol 2003; 41(6): 511-6. [Özet]
- Sinski JT, Van Avermaete D, Kelley LM. Analysis of tests used to differentiate Trichophyton rubrum from Trichophyton mentagrophytes. J Clin Microbiol 1981; 13(1): 62-5. [Özet] [PDF]
- Schaufuss P, Brasch J, Steller U. Dermatophytes can trigger cooperative (CAMP-like) haemolytic reactions. Br J Dermatol 2005; 153(3): 584-90. [Özet]
- National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi. Approved Standard M38-A. 2002. NCCLS/CLSI, Wayne, Pa.
- Pfaller MA, Rex JH, Rinaldi MG. Antifungal susceptibility testing: technical advances and potential clinical applications. Clin Infect Dis 1997; 24(5): 776-84. [Özet] [PDF]
- Ghannoum MA, Rex JH, Galgiani JN. Susceptibility testing of fungi: current status of correlation of in vitro data with clinical outcome. J Clin Microbiol 1996; 34(3): 489-95. [Özet] [PDF]
- Ener B. İn vitro antifungal duyarlılık testleri: Standardizasyon ve klinik önemi. Mikrobiyol Bul 1996; 30(4): 419-5. [PDF]
- Kayaalp O. Antifungal antibiyotikler ve diğer antifungal ilaçlar, s: 291-300. Rasyonel Tedavi Yönünden Tıbbi Farmakoloji. 2000. Hacettepe Taş Kitapçılık, Ankara.
- Favre B, Hofbauer B, Hildering KS, Ryder NS. Comparison of in vitro activities of 17 antifungal drugs against a panel of 20 dermatophytes by using a microdilution assay. J Clin Microbiol 2003; 41(10): 4817-9. [Özet] [Tam Metin] [PDF]
- Santos DA, Hamdan JS. Evaluation of broth microdilution antifungal susceptibility testing conditions for Trichophyton rubrum. J Clin Microbiol 2005; 43(4): 1917-20. [Özet] [Tam Metin] [PDF]
- Santos DA, Barros ME, Hamdan JS. Establishing a method of inoculum preparation for susceptibility testing of Trichophyton rubrum and Trichophyton mentagrophytes. J Clin Microbiol 2006; 44(1): 98-101. [Özet] [Tam Metin] [PDF]
- Ghannoum MA, Chaturvedi V, Espinel-Ingroff A, et al. Intra- and interlaboratory study of a method for testing the antifungal susceptibilities of dermatophytes. J Clin Microbiol 2004; 42(7): 2977-9. [Özet] [Tam Metin] [PDF]
- Barros ME, Santos Dde A, Hamdan JS. In vitro methods for antifungal susceptibility testing of Trichophyton spp. Mycol Res 2006; 110(Pt 11): 1355-60. [Özet]
- Soares MM, Cury AE. In vitro activity of antifungal and antiseptic agents against dermatophyte isolates from patients with tinea pedis. Braz J Microbiol 2001; 32(2): 130-4.
- Cetinkaya Z, Kiraz N, Karaca S, et al. Antifungal susceptibilities of dermatophytic agents isolated from clinical specimens. Eur J Dermatol 2005; 15(4): 258-61. [Özet]
- Fernández-Torres B, Cabanes FJ, Carrillo-Munoz AJ, et al. Collaborative evaluation of optimal antifungal susceptibility testing conditions for dermatophytes. J Clin Microbiol 2002; 40(11): 3999-4003. [Özet] [Tam Metin] [PDF]
- Fernández-Torres B, Carrillo AJ, Martin E, et al. In vitro activities of 10 antifungal drugs against 508 dermatophyte strains. Antimicrob Agents Chemother 2001; 45(9): 2524-8. [Özet] [Tam Metin] [PDF]
- Elewski BE. Onychomycoses: pathogenesis, diagnosis, and management. Clin Microbiol Rev 1998; 11(3): 415-29. [Özet] [Tam Metin] [PDF]
- Esteban A, Abarca ML, Cabanes FJ. Comparison of disk diffusion method and broth microdilution method for antifungal susceptibility testing of dermatophytes. Med Mycol 2005; 43(1): 61-6. [Özet]
- Mock M, Monod M, Baudraz-Rosselet F, Panizzon RG. Tinea capitis dermatophytes: susceptibility to antifungal drugs tested in vitro and in vivo. Dermatology 1998; 197(4): 361-7. [Özet]
- Fernández-Torres B, Carrillo-Munoz A, Ortoneda M, Pujol I, Pastor FJ, Guarro J. Interlaboratory evaluation of the Etest for antifungal susceptibility testing of dermatophytes. Med Mycol 2003; 41(2): 125-30. [Özet]
- Santos DA, Hamdan JS. In vitro activities of four antifungal drugs against Tricophyton rubrum isolates exhibiting resistance to fluconazole. Mycoses 2007; 50(4): 286-9. [Özet]
- Gupta AK, Einarson TR, Summerbell RC, Shear NH. An overview of topical antifungal therapy in dermatomycoses. A North American perspective. Drugs 1998; 55(5): 645-74. [Özet]
- Karaca N, Koc AN. In vitro susceptibility testing of dermatophytes: comparison of disk diffusion and reference broth dilution methods. Diagn Microbiol Infect Dis 2004; 48(4): 259-64. [Özet]
- Pujol I, Capilla J, Fernandez-Torres B, Ortoneda M, Guarro J. Use to sensititre colorimetric microdilution panel for antifungal susceptibility testing of dermatophytes. J Clin Microbiol 2002; 40(7): 2618-21. [Özet] [Tam Metin] [PDF]
- Korting HC, Ollert M, Abeck D. Results of German multicenter study of antimicrobial susceptibilities of Tricophyton rubrum and Tricophyton mentagrophytes strains causing tinea unguium. German Collaborative Dermatophyte Drug Susceptibility Study Group. Antimicrob Agents Chemother 1995; 39(5): 1206-8. [Özet] [PDF]
- Macura AB. In vitro susceptibility of dermatophytes to antifungal drugs: a comparison of two methods. Int J Dermatol 1993; 32(7): 533-6. [Özet]
- Korting HC, Rosenkranz S. In vitro susceptibility of dermatophytes from Munich to griseofulvin, miconazole and ketokonazole. Mycoses 1990; 33(3): 136-9. [Özet]
- Ozkutuk A, Ergon C, Yulug N. Species distribution and antifungal susceptibilities of dermatophytes during a one year period at a university hospital in Turkey. Mycoses 2007; 50(2): 125-9. [Özet]
İletişim (Correspondence):
Prof. Dr. Duygu Fındık,
Selçuk Üniversitesi Selçuklu Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Konya, Türkiye.
Tel (Phone): +90 332 251 5000/40953-5047,
E-posta (E-mail): duygufin@yahoo.com