Deneysel Pulmoner Aspergilloz Modelinde İnterlökin-10,
Tümör Nekroz Faktörü-alfa ve
İnterferon-gama İfadelenmesinin Araştırılması*
Investigation
of Interleukin-10, Tumor Necrosis Factor-alpha and Interferon-gamma
Expression in Experimental Model of Pulmonary Aspergillosis
Kayhan
ÇAĞLAR1, Ayşe KALKANCI1, Işıl FİDAN1, Sibel
AYDOĞAN2, Kenan HIZEL3, Murat DİZBAY3,
Aylar POYRAZ4, Semra KUŞTİMUR1
1 Gazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gazi University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 Hacettepe Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
2 Hacettepe University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
3 Gazi Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Ankara.
3 Gazi University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Ankara, Turkey.
4 Gazi Üniversitesi Tıp Fakültesi, Tıbbi Patoloji Anabilim Dalı, Ankara.
4 Gazi University Faculty of Medicine, Department of Medical Pathology, Ankara, Turkey.
* Bu çalışmanın bir bölümü, Gazi Üniversitesi Bilimsel Araştırma Projeleri tarafından desteklenmiştir (No: 01/2005-37).
ÖZET
Pulmoner aspergilloz, özellikle nötropenik hastalarda görülen önemli bir fırsatçı enfeksiyon olup, en sık Aspergillus fumigatus tarafından oluşturulmaktadır. Enfeksiyonun patogenezi tam olarak açıklık kazanmamış olmakla birlikte, temel mekanizmanın hücresel bağışıklık ve sitokin yanıtı olduğu belirtilmektedir. Bu çalışmada, deneysel olarak pulmoner aspergilloz oluşturulan sıçanların akciğer dokularında bölgesel sitokin üretiminin ters transkriptaz-polimeraz zincir reaksiyonu (RT-PCR) ile araştırılması amaçlanmıştır. Deney Hayvanları Etik Kurulu onayı ile gerçekleştirilen çalışmada, Wistar albino cinsi 33 adet dişi sıçan kullanılmış; deneklerden 25i intratrakeal yolla A.fumigatus ile enfekte edilirken, sekizi kontrol olarak ayrılmıştır. Enfekte sıçanların akciğer dokularında A.fumigatus varlığı, kantitatif kültür ve histolojik boyama ile doğrulanmıştır. Hasta ve kontrol grubundaki deneklerin akciğer doku örneklerinden RNA izolasyonu ticari bir kit ile (Qiagen, Almanya) yapılmıştır. Genomik RNAdan komplementer DNA eldesi gerçekleştirildikten sonra interlökin-10 (IL-10), tümör nekroz faktörü-alfa (TNF-α) ve interferon gama (IFN-γ) sitokinlerine özgül primerler (Tıb Molbiol, Almanya) kullanılarak, in-house kalitatif ve kantitatif (gerçek zamanlı) PCR yöntemleri uygulanmış ve hedef bölgeler çoğaltılmıştır. Gerçek zamanlı PCR ile IL-10, TNF-α ve IFN-γ için elde edilen ortalama mRNA düzeyleri aspergillozlu grupta sırasıyla; 6.5 x 106 kopya/ml, 7.9 x 105 kopya/ml ve 2.2 x 103 kopya/ml olarak bulunurken, bu değerler kontrol grubunda sırasıyla; 4.3 x 102 kopya/ml, 5.6 x 103 kopya/ml ve 1.3 x 102 kopya/ml olarak hesaplanmıştır. Çalışmamızda, aspergilloz sıçan modelinde IL-10 ve TNF-α mRNA ifadelenmesinin kontrol grubuna göre anlamlı düzeyde farklı olduğu (p< 0.05), IFN-γ mRNA ifadelenmesinin ise gruplar arasında farklılık göstermediği (p= 0.53) saptanmıştır. Bu verilere göre, proinflamatuvar sitokinlerin yapımı ile fagositer hücrelerin bu bölgeye göçü arasında ilişki olabileceği düşünülmüştür. Akciğer dokusunda TNF-α ve IL-10 sitokin yapımının yüksek düzeyde olması, bölgesel doku yıkımının sınırlandırılmasında etkili olsa da, enfeksiyonun ortadan kaldırılmasında genellikle yetersiz kalındığını da işaret etmektedir.
Anahtar sözcükler: Pulmoner aspergilloz; hayvan modeli; ters transkripsiyon polimeraz zincir reaksiyonu; mRNA ifadelenmesi; IL-10; TNF-α; IFN-γ.
ABSTRACT
Pulmonary aspergillosis which is an important opportunistic infection in neutropenic patients, is usually caused by Aspergillus fumigatus. Since the pathogenesis of disease is not well understood, the main proposed mechanism is thought to be cell-mediated immunity and cytokine response. The aim of this study was to investigate the local production of cytokines in the lung tissues of rats with experimentally developed aspergillosis, by reverse transcriptase-polymerase chain reaction (RT-PCR). A total of 33 Wistar albino type rats were included in the study with the consent of Experimental Animal Ethics Committee. Twenty-five of the rats were infected with A.fumigatus by intratracheal way, while 8 animals were used as controls. The presence of A.fumigatus in the lung tissues of infected rats was confirmed with the use of quantitative culture and histologic staining methods. RNA isolation from the lung tissue samples of both groups were performed by a commercial kit (Qiagen, Germany). After obtaining complementary DNAs from the genomic RNAs, in-house qualitative and quantitative (real-time) PCR methods were used to amplify the target regions for interleukin-10 (IL-10), tumor necrosis factor-alpha (TNF-α) and interferon-gamma (IFN-γ) by using specific primers (Tıb Molbiol, Germany). Mean mRNA levels achieved by real-time PCR for IL-10, TNF-α and IFN-γ in aspergillosis group were 6.5 x 106 copies/ml, 7.9 x 105 copies/ml and 2.2 x 103 copies/ml, respectively, while those values in control group were 4.3 x 102 copies/ml, 5.6 x 103 copies/ml and 1.3 x 102 copies/ml, respectively. Our data indicated that rat model of aspergillosis was associated with significantly increased expression of mRNA encoding IL-10 and TNF-α than controls (p< 0.05), however there was no statistically significant difference between the groups with respect to IFN-γ expression (p= 0.53). In conclusion, the production of proinflammatory cytokines which mediate the influx of phagocytic cells might account for the localization of Aspergillus infection to the upper respiratory tract. The up-regulation of the expression of the immunomodulatory cytokine TNF-α and IL-10 in lung tissue from infected rats might be important to limit the extent of local tissue destruction, but might also account for the fact that infected rats are generally unable to clear the infection spontaneously.
Key words: Pulmonary aspergillosis; animal model; reverse transcriptase polymerase chain reaction; mRNA expression; IL-10; TNF-α; IFN-γ.
Geliş Tarihi (Received): 12.12.2010 • Kabul Ediliş Tarihi (Accepted): 21.01.2011
GİRİŞ
Aspergillus fumigatus tarafından oluşturulan enfeksiyonlara karşı konağın immün yanıtı, etkenin eliminasyonunda büyük öneme sahiptir. Enfeksiyonun ortadan kaldırılmasında etkili olan sistemik sitokin yanıtı ve diğer konak faktörlerinin gösterilmesi amacıyla çeşitli çalışmalar yapılmıştır1,2,3,4. Bu çalışmalarda, fare modellerinde hastalığın iyileşmesi, interlökin-6 (IL-6), IL-12, tümör nekroz faktörü-alfa (TNF-α) ve interferon-gama (IFN-γ) salınımı ile ilişkili bulunmuştur3,5. Yardımcı T hücreleri (T helper; Th) tarafından uyarılan IFN-γ, IL-6, IL-12, TNF-α ve IL-1 sitokinlerine Th1 tipi sitokinler adı verilmektedir. Bu sitokinler nötrofil ve makrofajları aktive ederek aspergillozun ortadan kaldırılmasına yardımcı olur. Buna karşılık IL-4 ve IL-10 gibi Th2 tipi sitokinler, IL-12 ve TNF-α düzeyinin baskılanmasına ve prognozun kötüye gitmesine yol açar. Bu iki yönlü fonksiyon, bağışıklık sisteminin temel mekanizmalarından biridir6.
Bu çalışmada, deneysel olarak pulmoner aspergilloz oluşturulan sıçanların akciğer doku örneklerinde TNF-α, IFN-γ ve IL-10 sitokinlerinin bölgesel ifadelenmesinin revers transkriptaz-polimeraz zincir reaksiyonu (RT-PCR) ile gösterilmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
Deney Hayvanları
Çalışmada kullanılan dört haftalık, 200 ± 15 g ağırlığındaki Wistar albino cinsi 33 adet dişi sıçan, Gazi Üniversitesi Laboratuvar Hayvanları Yetiştirme ve Deneysel Araştırmalar Merkezinden sağlandı. Deneklerden 25i A.fumigatus ile enfekte edilirken, sekizi kontrol olarak ayrıldı. Çalışma, Gazi Üniversitesi Deney Hayvanları Etik Kurulu onayı ile gerçekleştirildi. Denekler 20-25°C sıcaklıkta 12/12 saat karanlık/aydınlık uygulanan kafeslerde 4-5 sıçan olacak şekilde tutuldu. Tüm hayvanlarda, periton içine 10 mg/kg olmak üzere 5-fluorourasil enjekte edilerek immünsüpresyon oluşturuldu7.
Aspergilloz Modeli
Sabouraud dekstroz agar (SDA) plağında iki gün inkübe edilmiş A.fumigatus klinik suşu, %0.1 Tween 20 içeren fosfat ile tamponlanmış tuzlu su (PBS) içinde süspanse edildi ve karışım içinde 106 konidya/ml içerecek şekilde sulandırıldı7. Nötropenik deneklerin 25ine ketamin ve ksilazin anestezisi altında intratrakeal kanül takılarak konidya karışımı bu yoldan akciğerlere verildi. Nötropenik sıçanları bakteri enfeksiyonlarından korumak için aspergilloz oluşturulmasından önceki üç gün boyunca 30 mg/kg teikoplanin (Targocid®, Aventis Pharma BV) kas içine enjekte edildi. Aspergilloz oluşturulduğu gün ve takip eden iki gün boyunca ise 15 mg/kg teikoplanin uygulandı. Ayrıca deneklerin içme sularına deney süresince 660 mg/L siprofloksasin eklendi. Aspergilloz oluşturulmasından altı gün sonra bütün denekler ketamin (100 mg/kg) anestezisi altında feda edildi. Tam kan ve akciğer doku örnekleri ayrılarak doku örrnekleri sıvı azot içinde donduruldu ve deney gününe kadar -80°Cde saklandı. Kontrol grubu olarak ayrılan sekiz deneğe de antibakteriyel profilaksi uygulandı, farklı olarak A.fumigatus içermeyen Tween 20-PBS karışımı intratrakeal yoldan verildi.
Akciğer Dokusunda A.fumigatusun Gösterilmesi
Enfekte sıçanların akciğer dokularından kantitatif kültür yapılarak A.fumigatus enfeksiyonu varlığı doğrulandı. Otopside ayrılan dokular 10 ml steril tuzlu suda homojenize edildi, her akciğer için bu karışımdan 50şer µl SDA ve kanlı agar plaklarına ekildi. Örnekler en az 72 saat inkübe edildikten sonra koloni sayımı gerçekleştirildi. Akciğer doku örnekleri ayrıca %10 formol ve PBS içinde en az 24 saat bekletildi; alkol ile dehidrate edildi ve parafin içine yerleştirildi. Parafin bloklar ksilen banyosunda 15 dakika tutularak deparafinize edildi, %100 etanolde 15 dakika, %95 ve %75lik etanolde 10ar dakika, PBS içinde beş dakika bekletildikten sonra hematoksilen eozin (HE) ile boyandı.
Aspergillusa Özgül PCR
Akciğer doku örneklerinde Aspergillus varlığının PCR ile gösterilmesi için fungal DNA izole edildi ve gerçek zamanlı PCR yöntemi uygulandı. Pozitif kontrol olarak koloni süspansiyonu kullanıldı. Pozitif kontrol ve doku örneklerinden DNA eldesi proteinaz K içeren parçalama tamponu ile, DNA saflaştırması ise fenol-kloroform-izoamil alkol yöntemi ile yapıldı8. Elde edilen DNAnın çoğaltılması için LightCycler cihazında (Roche Diagnostics, ABD) hibridizasyon probları kullanılan bir protokol uygulandı. A.fumigatusa özgül primerler 18S rRNA gen (GenBank kabul no; AB008401) bölgesinden seçildi ve bu primer çiftine biri LC Red 640 ile diğeri floresan ile işaretli iki ayrı prob eklendi9 (Tablo I). Amplifikasyon karışımına denatürasyon sonrası, 45 döngü olmak üzere 30 saniye 95°Cde, 20 saniye 55°Cde, 20 saniye 72°Cde PCR işlemi uygulandı. Sonuçlar için absolute quantification analizi yapıldı.
Sitokin İfadelenmesi için RNA Eldesi ve RT-PCR
DNA bulaşını engellemek için bütün örnekler ribonuclease-free deoxyribonuclease içinde 15 dakika bekletildi. Dokulardan RNA izolasyonu için ticari bir sistem (Qiagen, Almanya) kullanıldı. Elde edilen genomik RNA miktarı spektrofotometrede (Nanodrop, ABD) ölçüldü. RNAdan komplementer DNA (cDNA) elde etmek için rastgele primerler ve enzim içeren karışım (Fermentas, Kanada) 95°Cde bir dakika, 50°Cde bir saat, 4°Cde beş dakika bekletildi. Elde edilen cDNA -20°Cde saklandı.
Sitokin İfadelenmesi İçin Kalitatif ve Kantitatif PCR
Sitokin ifadelenmesi, özgül primerler (Tıb Molbiol, Almanya) kullanılarak gösterildi (Tablo I). Hedeflenen IL-10, TNF-α ve IFN-γ PCR için en az 10 ng cDNA kullanıldı ve kalitatif PCR ısı döngü cihazında gerçekleştirildi. Kalitatif PCR karışımı (25 µl) cDNA, 10x tamponu, Taq DNA polimeraz enzimi, MgCl ve her bir primerden 100 pmol içerecek şekilde hazırlandı. Primerlerin bağlanma dereceleri IL-10 ve TNF-α için 58°C, IFN-γ için 50°C olarak belirlendi ve 35 döngü uygulandı. Kalitatif PCR sonucu agaroz jel elektroforezi ile değerlendirildi. Gerçek zamanlı kantitatif PCR karışımı (10 µl) cDNA, SYBR Green I karışımı ve her bir primerden 20 pmol içerecek şekilde hazırlandı. Primerlerin bağlanma dereceleri kalitatif PCR ile aynı idi. Kantitatif analiz için 50 ile 5 pg arasında cDNA içeren seri standartlar hazırlandı. Amplifikasyon sonrasında 55-90°C arasında erime eğrisi analizi yapıldı. Standartların DNA kopya sayıları kullanılarak elde edilen eğri üzerinden bütün örneklerin kopya sayıları hesaplandı. Sıçan doku örneklerinde housekeeping gen olarak beta (b)-aktin geni kullanıldı. Bu genin çoğaltılması için 57°C bağlanma derecesi kullanıldı.
İstatistiksel Analiz
Bağımsız grupların karşılaştırılması için ki-kare ve Yates düzeltmeli ki-kare testi, bağımlı grupların karşılaştırılması için Mc Nemar testi kullanıldı ve p< 0.05 değeri istatistiksel olarak anlamlı kabul edildi.
BULGULAR
A.fumigatus ile enfekte edilen 25 sıçanın 13 (%52)ü aspergilloz oluşturulmasını takip eden 2-5 gün içinde kaybedilmiş; kalan 12 (%48) denek deneyin altıncı gününde feda edilmiştir. Çalışmanın sonuçları bu 12 denekten elde edilen verilerdir. Nötropenik kontrol grubundan ise 2 (%25) denek kaybedilmiş, 6 (%75) denek altıncı güne kadar sağ kalmıştır.
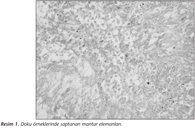
Akciğer doku örneklerinde aspergilloz varlığı histopatolojik, mikrobiyolojik ve moleküler yöntemlerle doğrulanmıştır. Deneyin sonunda canlı kalan 12 deneğin akciğer örneklerinde hifler görülmüş (Resim 1), 10unun akciğer doku kültürlerinde A.fumigatus üremesi saptanmıştır. Kantitatif kültürlerde saptanan ortalama koloni sayısı 103 cfu/mldir. Aspergilloz oluşturulan deneklerin tümünde A.fumigatus DNAsı gösterilmiştir (Tablo II). Kontrol grubunda ise aspergillozun olmadığı histopatolojik, mikrobiyolojik ve moleküler yöntemlerle doğrulanmıştır (Tablo II).
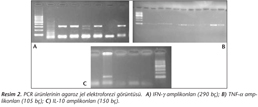
Kalitatif PCR sonucu agaroz jel elektroforezinde IL-10 için 150 baz çiftlik (bç) ürün, IFN-γ için 290 bç ürün, TNF-α için 105 bç ürün gözlenmiştir (Resim 2). Gerçek zamanlı kantitatif PCR sonucunda deney hayvanlarının akciğer doku örneklerinden elde edilen sitokin ifadelenmesine ait mRNA değerleri ortalama kopya sayısı olarak hesaplanmıştır. Her örnek beş kez çalışılmış ve sonuçlar ortalama olarak verilmiştir (Tablo II). Çalışmamızda, aspergilloz oluşturulan sıçanların akciğer doku örneklerinde kontrol grubuna göre istatistiksel olarak anlamlı düzeyde yüksek IL-10 ve TNF-α mRNA ifadelenmesi gösterilmiş (p< 0.05); IFN-γ ifadelenmesi açısından ise iki grup arasında fark bulunmamıştır (p> 0.05).
TARTIŞMA
A.fumigatus, immün sistemi baskılanmış konaklarda hayatı tehdit eden enfeksiyonlara neden olan fırsatçı bir küf mantarıdır. İnvazif aspergilloz patogenezinde temel mekanizmanın hücresel bağışıklık ve sitokin yanıtı olduğunun belirtilmesine rağmen, henüz tam olarak açıklık kazanmayan konular mevcuttur10,11. Aspergillus enfeksiyonlarının patogenezinde özellikle Th1/Th2 dengesinin aydınlatılması, kemoterapi ve aşı çalışmalarının geleceği açısından önem taşımaktadır12. Bilindiği gibi Th1 grubu sitokinler (IL-12, TNF-α, IL-1, IFN-γ, IL-6, IL-18, IL-2) antifungal etkili hücreler olan makrofajları uyarırken, Th2 grubu sitokinler (IL-4, IL-10) bu hücrelerin etkisini baskılamaktadır. Bu nedenle Th2 tipi sitokinlerin artışı, hastalığın ilerlemesiyle ilişkili kabul edilmektedir13. Bu çalışmada akciğer aspergillozu oluşturulmuş sıçanlarda, akciğer dokusundaki bölgesel sitokin yanıtının incelenmesi amaçlanmış; nötropenik sıçanlara A.fumigatus konidyalarının verilmesinin ardından Th1/Th2 sitokin dengesinin hangi yönde değişeceği ve hangi sitokin grubunun üretiminde artış olacağı incelenmiştir. Çalışmamızda akciğer dokusunda ifadelenen sitokinlerin gösterilmesi için hem klasik kalitatif PCR hem de kantitatif gerçek zamanlı PCR yöntemi uygulanmıştır. Sonuçlarımız, aspergillozlu hayvanların akciğer dokusunda TNF-α ve IL-10 ifadesinin arttığını, buna karşılık IFN-γ ifadesinin değişmediğini göstermiştir.
IL-10 antienflamatuvar bir sitokin olup proeinflamatuvar sitokinlerin salgılanmasını baskılayarak antifungal etkili hücreleri durdurur14. Deneysel modellerde, IL-10 üretiminin baskılanması ile Th1 tipi sitokinlerin artışına bağlı olarak farelerin A.fumigatus enfeksiyonuna daha dirençli oldukları gösterilmiştir15. IL-10 düzeyleri, aspergillozlu hastaların serum örneklerinde sağlıklılara göre daha yüksek düzeyde saptanmakta; A.fumigatus ile kolonize bireylerin serumlarında da daha yüksek IL-10 düzeyleri tespit edilmektedir16. Daha önce yapılan çalışmalara benzer şekilde, oluşturduğumuz deneysel aspergilloz modelinde de akciğer dokusunda yüksek düzeyde IL-10 mRNA ifadelenmesi gösterilmiştir. Literatürdeki diğer çalışmalarda periferik kandaki IL-10 düzeyleri ELISA yöntemiyle ölçülmüştür. Bizim çalışmamızda ise duyarlılığı çok yüksek olan gerçek zamanlı PCR yöntemi ile dokudaki ifadelenme değerlendirildiğinden, sonuçlarımızın daha anlamlı olduğu düşünülmektedir.
Proenflamatuvar bir sitokin olan ve enfeksiyonun erken döneminde salgılanan TNF-α da, mantarlara karşı immün yanıtın oluşturulmasında temel sitokinlerdendir17. İn vitro çalışmalarda TNF-αnın fagositik aktiviteyi özgül olarak artırdığı belirlenmiş; bu sitokinin erken dönemde makrofajlar, ilerleyen dönemlerde ise nötrofiller üzerinden etki gösterdiği saptanmıştır18. Peeters ve arkadaşları19, köpek modelinde oluşturdukları nazal aspergillozda yüksek düzeyde TNF-α ifadelenmesi olduğunu bildirmişlerdir. Bizim deneysel modelimizde altıncı günde TNF-α mRNA ifadelenmesinin gösterilmesi ve düzeyinin kontrollere göre yüksek bulunması, bu sitokinin hem erken hem de geç dönemde salgılandığını göstermektedir.
Aspergilloz modellerinde yapılan klinik çalışmalar, yüksek IFN-γ ve düşük IL-10 düzeylerinin hayatta kalma ile ilişkili olduğunu göstermiş; tedaviye yanıt veren olgularda IFN-γ/IL-10 oranının yüksek olduğu bildirilmiştir19,20. Sambatakou ve arkadaşları20, farelerin intratrakeal olarak A.fumigatus konidyaları ile enfekte edilmeleri sonrasında herhangi bir IFN-γ yanıtı oluşmadığını rapor etmişlerdir20. Bizim çalışmamızda da, kontrol grubu ile aspergilloz grubu arasında IFN-γ mRNA ifadelenmesi açısından bir fark bulunmadığı görülmüştür. Elde edilen bu sonuç, Peeters ve arkadaşlarının19 çalışması ile benzerlik göstermekte ve IFN-γnın ölümcül aspergilloz patogenezinde etkin bir sitokin olmadığını düşündürmektedir.
Bu çalışma akciğer aspergilloz modelinde bölgesel sitokin yanıtının gösterilmesi için düzenlenmiştir. Geliştirilen bu yöntemin diğer enfeksiyon modelleri veya diğer sitokinler için kullanılması mümkündür. Sonuç olarak, aspergillozlu dokuda sitokin yanıtının belirgin olarak arttığı anlaşılmaktadır. Enfeksiyon bölgesinde IL-10, TNF-α ve IFN-γ gen ifadelenmesini uyaran diğer faktörlerin tanımlanması, akciğer aspergillozunda yeni tanı yöntemlerinin ve yeni tedavi seçeneklerinin geliştirilmesi için yararlı olacaktır.
KAYNAKLAR
- Capilla J, Clemons KV, Stevens DA. Animal models: an important tool in mycology. Med Mycol 2007; 45(8): 657-84. [Özet]
- Kurup VP, Grunig G. Animal models of allergic bronchopulmonary aspergillosis. Mycopathologia 2002; 153(4): 165-77. [Özet]
- Balloy V, Huerre M, Latge JP, Chignard M. Differences in patterns of infection and inflammation for corticosteroid treatment and chemotherapy in experimental invasive pulmonary aspergillosis. Infect Immun 2005; 73(1): 494-503. [Özet] [Tam Metin] [PDF]
- van Vianen W, de Marie S, ten Kate MT, Mathot RA, Bakker-Woudenberg IA. Caspofungin: antifungal activity in vitro, pharmacokinetics, and effects on fungal load and animal survival in neutropenic rats with invasive pulmonary aspergillosis. J Antimicrob Chemother 2006; 57(4): 732-40. [Özet] [Tam Metin] [PDF]
- Roilides E, Dimitriadou A, Kadiltsoglou I, et al. IL-10 exerts suppressive and enhancing effects on antifungal activity of mononuclear phagocytes against Aspergillus fumigatus. J Immunol 1997; 158(1): 322-9. [Özet]
- ODwyer MJ, Mankan AK, Stordeur P, et al. The occurrence of severe sepsis and septic shock are related to distinct patterns of cytokine gene expression. Shock 2006; 26(6): 544-50. [Özet]
- Steinbach WJ, Benjamin DK, Jr Trasi SA, et al. Value of an inhalational model of invasive aspergillosis. Med Mycol 2004; 42(5): 417-25. [Özet]
- Loeffler J, Henke N, Hebart H, et al. Quantification of fungal DNA by using fluorescence resonance energy transfer and the Light Cycler system. J Clin Microbiol 2000; 38(2): 586-90. [Özet] [Tam Metin] [PDF]
- Hummel M, Spiess B, Kentouche K, et al. Detection of Aspergillus DNA in cerebrospinal fluid from patients with cerebral aspergillosis by a nested PCR assay. J Clin Microbiol 2006; 44(11): 3989-93. [Özet] [Tam Metin] [PDF]
- Richardson MD. Changing patterns and trends in systemic fungal infections. J Antimicrob Chemother 2005; 56(Suppl 1): i5-i11. [Özet] [PDF]
- Montagnoli C, Bozza S, Gaziano R, et al. Immunity and tolerance to Aspergillus fumigatus. Novartis Found Symp 2006; 279: 66-77. [Özet]
- Brummer E, Choi JH, Stevens DA. Interaction between conidia, lung macrophages, immunosuppressants, proinflammatory cytokines and transcriptional regulation. Med Mycol 2005; 43 (Suppl 1): S177-9. [Özet]
- Weber RW. Aspergillus fumigatus. Ann Allergy Asthma Immunol 2010; 104(5): A3.
- Sainz J, Hassan L, Perez E, et al. Interleukin-10 promoter polymorphism as risk factor to develop invasive pulmonary aspergillosis. Immunol Lett 2007; 109(1): 76-82. [Özet]
- Clemons KV, Grunig G, Sobel RA, Mirels LF, Rennick D, Stevens DA. Role of IL-10 in invasive aspergillosis: increased resistance of IL-10 gene knockout mice to lethal systemic aspergillosis. Clin Exper Immunol 2000; 122(2): 186-91. [Özet] [Tam Metin] [PDF]
- Brouard J, Knauer N, Boelle PY, et al. Influence of interleukin-10 on Aspergillus fumigatus infection in patients with cystic fibrosis. J Infect Dis 2005; 191(11): 1988-91. [Özet] [Tam Metin] [PDF]
- Mehrad B, Strieter RM, Standiford TJ. Role of TNF-alpha in pulmonary host defence in murine invasive aspergillosis. J Immunol 1999; 162(3): 1633-40. [Özet] [Tam Metin] [PDF]
- Kaur S, Gupta VK, Thiel S, Sarma PU, Madan T. Protective role of mannan-binding lectin in a murine model of invasive pulmonary aspergillosis. Clin Exp Immunol 2007; 148(2): 382-9. [Özet] [Tam Metin] [PDF]
- Peeters D, Peters IR, Clercx C, Day MJ. Quantification of mRNA encoding cytokines and chemokines in nasal biopsies from dogs with sino-nasal aspergillosis. Vet Microbiol 2006; 114(3-4): 318-26. [Özet]
- Sambatakou H, Pravica V, Hutchinson IV, Denning DW. Cytokine profiling of pulmonary aspergillosis. Int J Immunogenet 2006; 33(4): 297-302. [Özet]
İletişim (Correspondence):
Doç. Dr. Ayşe Kalkancı,
Gazi Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Beşevler, Ankara,
Türkiye. Tel (Phone): +90 312 202 4629,
E-posta (E-mail): aysekalkanci@email.com