Boğmacanın
Moleküler Tanısı İçin Laboratuvar Yapımı Bir PCR Yönteminin
Geliştirilmesi ve Optimizasyonu
Development and Optimization of an In-House PCR Method for Molecular Diagnosis of Pertussis
Dilek GÜLDEMİR1, Efsun AKBAŞ1, Selin NAR ÖTGÜN1, Alicem TEKİN2, Berrin ESEN1
1Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Salgın Hastalıklar Araştırma Müdürlüğü, Ankara.
1Refik Saydam National Public Health Agency, Department of Communicable Diseases Research, Ankara, Turkey.
2Dicle Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Diyarbakır.
2Dicle University Faculty of Medicine, Department of Medical Microbiology, Diyarbakir, Turkey.
ÖZET
Bordetella pertussisin etken olduğu boğmaca, her yaştan duyarlı bireyi, özellikle de çocukları etkileyen, akut, bulaşıcı bir solunum sistemi enfeksiyonu olup, ağır bir klinik tablo ile karakterizedir. Tanıda kullanılan geleneksel kültür yönteminin özgüllüğü yüksek olmasına rağmen, duyarlılığı düşüktür. Bu nedenle boğmaca tanısında duyarlı, özgül ve hızlı bir tanı yöntemine gereksinim vardır. Polimeraz zincir reaksiyonu (PCR), boğmaca tanısında son yıllarda kullanılmaya başlanan yeni bir yaklaşımdır ve kültür yönteminden daha duyarlı olduğu gösterilmiştir. Çeşitli çalışmalarda PCR için seçilen hedef gen bölgeleri arasında; pertusis toksin geni (ptxA-Pr), insersiyon sekans genleri (IS481 ve IS1001), adenilat siklaz geni, yapısal genlerden porin ve flajellin geni yer almaktadır. Bu araştırmada, ptxA-Pr ve IS481 gen bölgelerine özgül primerlerin kullanıldığı bir in-house PCR tanı yönteminin geliştirilmesi ve optimizasyonu amaçlanmıştır. Çalışmada, ptxA-Pr genine özgül PTp1/PTp2 primerleri ve IS481 genine özgül PIp1/PIp2 primerleri ve çeşitli standart bakteri suşlarının DNAları kullanılarak bir in-house PCR yöntemi geliştirilmiştir. Sağlıklı 45 bireyden alınan boğaz sürüntüsü ile azalan konsantrasyonlarda B.pertussis standart bakteri suşu karıştırılmak suretiyle oluşturulan temsili nitelikte klinik örnekler ile yöntemin duyarlılığı ve özgüllüğü test edilmiş ve optimizasyon yapılmıştır. PTp1/PTp2 primerlerinin kullanıldığı in-house PCR yönteminin özgüllüğünün yüksek, duyarlılığının ise düşük [34.4 cfu/Rm (koloni oluşturan ünite/reaksiyon karışımı)] olduğu görülmüştür. PIp1/PIp2 primerlerinin kullanıldığı in-house PCR yönteminin ise B.pertussis ile B.bronchiseptica arasında çapraz reaksiyon vermesi nedeniyle özgüllüğünün düşük olmasına rağmen, yüksek duyarlılık (1.12 cfu/Rm) gösterdiği tespit edilmiştir. Temsili nitelikteki klinik örnekler ile yapılan in-house PCR denemelerinden de benzer sonuçlar elde edilmiştir. Ayrıca yaptığımız eş zamanlı kültür çalışmasında, yöntemin B.pertussis saptama duyarlılığı 2 x 103 cfu/ml olarak saptanmıştır. Çalışmamızda, IS481 genini hedef alan PCRnin duyarlılığı yüksek bulunurken, ptxA-Pr genini hedef alan PCRnin özgüllüğü yüksek bulunmuş; bu nedenle boğmacanın moleküler tanısında, IS481i hedef alan PCR ile ön tanı konulması, ptxA-Pryi hedef alan PCRnin de konfirmasyon amaçlı kullanılmasının uygun olacağı kanısına varılmıştır.
Anahtar sözcükler: Bordetella pertussis; boğmaca; moleküler tanı; in-house PCR; IS481; ptxA-Pr.
ABSTRACT
Pertussis (whooping cough), caused by Bordetella pertussis is a severe, acute contagious disease of the respiratory system and it affects mostly children and also susceptible individuals of all ages. Although the conventional culture method used for diagnosis is highly specific, it has a lower sensitivity. Therefore, there is a need for a sensitive, specific and rapid method for diagnosis of pertussis. Polymerase chain reaction (PCR), introduced recently as a new approach for diagnosis of pertussis, has been shown to be more sensitive than culture method. Pertussis toxin gene (ptxA-Pr), insertion sequence genes (IS481 and IS1001), adenylate cyclase genes and structural porin and flagellin genes were chosen as targets for PCR, in different studies. This study aimed to develop and optimize a diagnostic in-house PCR method by using primers specific for ptxA-Pr and IS481 gene regions. An in-house PCR method was developed by using primer pairs of PTp1/PTp2 specific for ptxA-Pr gene and PIp1/PIp2 specific for IS481 gene and DNAs of various bacterial reference strains. Throat samples obtained from 45 healthy individuals and B.pertussis reference strain with decreasing concentrations were mixed to constitute a group of representative clinical samples and used to test and optimize sensitivity and specificity of the method. The in-house PCR with PTp1/PTp2 primers showed a very high specificity but a low sensitivity with a value of 34.4 cfu/Rm (colony forming unit/reaction mixture). Whereas, the in-house PCR with PIp1/PIp2 primers exhibited a low specificity due to cross-reactivity with B. pertussis and B.bronchiseptica but much higher sensitivity with a value of 1.12 cfu/Rm. The experiments performed with the representative clinical samples yielded similar results. Simultaneously applied cultivation studies indicated the detection limit of the PCR method as 2 x 103 cfu/ml. Based on our results, the PCR targeting IS481 gene had high sensitivity while the PCR targeting ptxA-Pr gene had high specificity. It was concluded that, PCR method targeting the IS481 gene might be used for pre-diagnosis and then PCR for ptxA-Pr gene might be applied for the confirmation of B.pertussis in the molecular diagnosis of pertussis.
Key words: Bordetella pertussis; whooping cough; molecular diagnosis; in-house PCR; IS481; ptxA-Pr.
Geliş Tarihi (Received): 08.11.2010 Kabul Ediliş Tarihi (Accepted): 14.07.2011
GİRİŞ
Her yaştaki duyarlı bireyi etkileyebilen ve özellikle çocukluk çağında ağır klinik tablo ile seyreden boğmaca, Bordetella pertussis tarafından oluşturulan akut bir solunum sistemi enfeksiyonudur. Dünyada her yıl 20-40 milyon boğmaca olgusunun gözlendiği, 300.000den fazla ölüme neden olduğu ve 50.000 hastada da uzun dönemli nörolojik sekel bıraktığı bilinmektedir1-3. Boğmaca tanısının erken dönemde konulması, tedavi ve bulaşın önlenmesinde son derece önemlidir. Bu amaçla kullanılan kültür yöntemi özgül olmakla birlikte yeterince duyarlı değildir. Ayrıca, kültür yöntemi ile izolasyon ve doğrulama için ortalama 7-10 günlük bir süre gerekmektedir. Bu nedenle boğmaca tanısında hızlı, özgül ve duyarlı bir tanı yöntemine gereksinim vardır4-6.
Polimeraz zincir reaksiyonu (PCR), boğmaca tanısında son yıllarda uygulanmaya başlanan yeni bir yaklaşımdır. PCRnin kültürden çok daha duyarlı olduğu, çeşitli araştırmalarla gösterilmiştir7,8. B.pertussisin PCR ile tespit edilmesine yönelik ilk çalışma 1989 yılında Houard ve arkadaşları9 tarafından yapılmıştır. Seçilen hedef gen bölgeleri arasında; pertusis toksin geni (ptxA-Pr), insersiyon sekans [IS] genleri (IS481 ve IS1001), adenilat siklaz geni, yapısal genlerden porin ve flajellin geni yer almaktadır10-11. B.pertussis tanısında IS481 gen bölgesini hedef alan PCR yöntemi oldukça duyarlıdır; ancak B.holmesii ile çapraz reaksiyonlara sık rastlanmaktadır. ptxA-Pr gen bölgesi hedeflendiğinde ise PCRnin özgüllüğü oldukça yüksektir, ancak duyarlılık IS481 PCRden daha düşük bulunmaktadır. Bu nedenle çalışmamızda B.pertussisin ptxA-Pr ve IS481 gen bölgelerine yönelik primerler kullanılarak, in-house PCRnin hem bir tanı yöntemi olarak geliştirilmesi ve optimize edilmesi hem de duyarlılığının ve özgüllüğünün artırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Bu çalışma, Kasım 2007-Nisan 2008 tarihleri arasında Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Salgın Hastalıklar Araştırma Müdürlüğü bünyesindeki Ulusal Boğmaca Referans Laboratuvarında yürütüldü. Çalışmada, ptxA-Pr ve IS481 gen bölgelerini hedef alan primerler kullanılarak in-house PCR yönteminin; (i) özgüllüğünün araştırılarak optimize edilmesi, (ii) duyarlılığının araştırılarak optimize edilmesi, (iii) temsili nitelikteki klinik örneklerde duyarlılığının araştırılması şeklinde üç ayrı etap izlendi.
Test Bakterileri ve Bakteri Süspansiyonları
PCR yönteminin özgüllüğü için, pozitif kontrol olarak B.pertussis Tohama phase I (B. pertussis Tp-I), B.pertussis ATCC 9797, B.pertussis klinik izolatı; negatif kontrol olarak B.parapertussis ATCC 15311, B.bronchiseptica ATCC 4617, H.influenzae ATCC 49247, N. meningitidis RSKK 645, S.aureus ATCC 95106, S.epidermidis ATCC 12228, C.diphtheriae varyant belfanti NCTC 10356, L.pneumophila serogrup 1 ATCC 43111, E.coli ATCC 25922, S.pyogenes ATCC 18615 suşları ile S.pneumoniae ve M.catarrhalis izolatları kullanıldı. B.pertussis Tp-I suşu ayrıca, PCR yönteminin özellikle temsili nitelikteki klinik örneklerdeki duyarlılığını araştırmak için kullanıldı.
Kullanılan suş ve izolatların taze pasajlarından birkaç koloni seçilip %0.85lik NaCl, temsili nitelikteki klinik örneklerden ise pH: 7.2 PBS (phosphate buffer saline) içerisinde McFarland-1 yoğunluğunda bakteri süspansiyonları ile bakteri süspansiyonlarının 1/3lük dilüsyonları ve ayrıca tüm süspansiyonların logaritmik dilüsyonları hazırlandı.
Bakteri Konsantrasyonlarının Tespiti
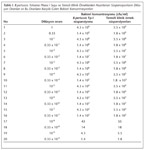
Duyarlılığı araştırmak için kullanılan hem B.pertussis Tp-I suşu hem de temsili nitelikteki klinik örneklerden hazırlanan süspansiyonların 1.0-0.33 x 10-9 oranlarında dilüsyonları hazırlandı ve bu dilüsyon oranlarına karşılık gelen bakteri konsantrasyonları belirlendi (Tablo 1)
Bu amaçla spektrofotometre (Bacharach, Coleman Model 35) ile 650 nm dalga boyunda optik dansiteleri (OD) ölçüldü ve Sato17 tarafından geliştirilmiş olan B.pertussis üreme grafiğinde ODye karşılık gelen bakteri konsantrasyonu [cfu (koloni oluşturan ünite)/ml] olarak tespit edildi.
Bakteri Süspansiyonlarından Kalıp DNA Hazırlanması
Özgüllük çalışmasında kullanılmak üzere izolatların taze pasajlarından hazırlanan bakteri süspansiyonları ile duyarlılık çalışmasında kullanılmak üzere hazırlanan B.pertussis Tp-I süspansiyonları (4.3 x 109-1.4 cfu/ml arası), ekstraksiyon yapılmaksızın test gününe kadar -20°Cde saklandı ve kalıp DNA olarak kullanıldı.
Temsili Klinik Örneklerden Kalıp DNA Hazırlanması
Duyarlılığının araştırılmasında B.pertussis Tp-I ile yapılan duyarlılık çalışmasının sonuçları esas alınarak, test edilecek konsantrasyon aralığı 5.5 x 106-5.5 x 102 cfu/ml olarak belirlendi. B.pertussis içermeyen klinik örnekler elde etmek amacıyla, sağlıklı bireylerden rayon uçlu eküvyon ile 45 adet boğaz sürüntüsü örneği alındı ve belirlenen konsantrasyon aralığında dokuz ayrı bakteri dilüsyonunun her biri beş farklı klinik örnekle test edildi. Hazırlanan bakteri dilüsyonlarının her birinden beş ayrı, 1.5 mllik mikrosantrifüj tüpüne 50 µl konularak bunların içine birer adet klinik örnek eküvyonu batırıldı ve bakteri süspansiyonunu absorbe etmesi sağlandı. Eküvyonların absorbe ettiği bakteri süspansiyonları kalıp DNA olarak kullanıldı. Ekstraksiyon işlemi QIAamp DNA Mini Kit (QIAGEN, ABD) ile üretici firmanın önerileri doğrultusunda uygulandı.
Kontrol Ekimi Yapılması
Temsili nitelikteki klinik örneklerle ekstraksiyona devam etmeden önce her bir süspansiyondan 50 µl alınarak BG (Bordet-Gengou) agar besiyerine ekim yapıldı ve uygun şartlarda inkübe edilerek inkübasyonun üçüncü ve yedinci günlerinde değerlendirildi. Üçüncü günde plaklarda üreyen koloniler içerisinden B.pertussis şüpheli olanlar seçilerek BG agara pasaj yapıldı ve uygun şartlarda inkübasyona kaldırılarak üç gün sonra değerlendirildi. Buna göre 1 ile 30 arasında örnek numarasına sahip temsili klinik örneklerden yapılan ekimlerden bazılarında B.pertussis izole edilebildi. BG agar besiyerinde B.pertussisin tespit edildiği en düşük bakteri konsantrasyonuna sahip olan plağa 30 nolu örnekten ekim yapıldı. 30 nolu örneğe karşılık gelen bakteri konsantrasyonu 2 x 103 cfu/ml olarak hesaplandı. Tablo 2 Temsili klinik örneklerle yapılan ekimlerin yedinci gün değerlendirmesinde, üçüncü gün yapılan değerlendirmeye eklenebilecek başka şüpheli kolonilere rastlanmadı.
Hedef Gen Bölgeleri ve Reaksiyon Karışımı
B.pertussis ptxA-Pr gen bölgesinin (191 bp) amplifikasyonu için PTp1 (F; 5-CCA ACG CGC ATG CGT GCA GAT TCG TC-3) ve PTp2 (R; 5-CCC TCT GCG TTT TGA TGG TGC CTA TTT TA-3) primer çifti ile IS481 gen bölgesinin (121 bp) amplifikasyonu için PIp1 (F; 5-CCC ATA AGC ATG CCC GAT TGA C-3) ve PIp2 (R; 5-CGC ACA GTC GGC GCG GTG AC-3) primer çifti kullanıldı. Hazırlanan kalıp DNAlar her bir primer çifti ile ayrı ayrı test edildi.
Her bir test için; 10X PCR tamponu [750 mM Tris HCI, pH: 8.8, 200 mM (NH4)2SO4, %0.1 Tween 20; MBI Fermentas], 25 mM MgCl2, 10 mM dNTP ve 50 pmol/µl primer ve Taq DNA polimeraz (5 U/µl, MBI Fermentas) reaktifleri kullanılarak reaksiyon karışımı hazırlandı. Bu reaktiflerin reaksiyon karışımı içerisindeki konsantrasyonları tekrarlayan denemelerle optimize edildi.
Bakteri DNAlarının Çoğaltılması ve Amplifikasyon Ürünlerinin Gösterilmesi
Reaksiyon karışımlarının üzerine kalıp DNAlar (tekrarlayan denemelerde 1, 2 ve 4 µllik hacimler halinde) eklendi ve termal döngü cihazında (Touchgene Techne, İngiltere), 95°Cde 5 dakika ilk denatürasyonu takiben, denatürasyon, primer bağlanma, uzama basamaklarından sonra son uzama için 72°Cde 10 dakika bekletilerek amplifikasyon tamamlandı. Uygulanacak amplifikasyon döngüleri tekrarlayan denemelerle standardize edildi.
Amplifikasyon ürünleri 0.5 µg/ml etidyum bromür eklenmiş %2.5lik agaroz jel (3:1 Nusieve agarose; FMC BioProducts, ABD; BioRad, İtalya) kullanılarak görüntülendi.
BULGULAR
Bu çalışmada in-house PCR yöntemi, ptxA-Pr ve IS481 genlerini hedef alan özgül PTp1/PTp2 ve PIp1/PIp2 primer çiftleri kullanılarak üç ayrı aşamada standardize edilmiştir.
1. Özgüllüğün Standardize Edilmesi
a. PTp1/PTp2 primerleri ile yapılan özgüllük çalışması: PTp1/PTp2 primer çifti ile yapılan PCRnin özgüllüğünü artırmak amacıyla; reaksiyon karışımı ve bakteri DNAsının çoğaltılması basamakları ile ilgili değişkenler test edilmiştir. Elde edilen verilere göre; (i) Her test için reaksiyon karışımının toplam hacminin 50 µl olmasına ve DNA kalıp olarak 4 µl bakteri süspansiyonu kullanılmasına, (ii) Bu amaçla her bir reaksiyon tüpünde 5 µl 10X PCR tamponu [750 mM Tris HCI, pH: 8.8, 200 mM (NH4)2SO4, %0.1 Tween 20; MBI Fermentas], 2 mM MgCl2, 0.2 mM dNTP, 0.5 pmol/µl primer ve 1.3 U Taq DNA polimeraz (5 U/µl, MBI Fermantas) bulunacak şekilde reaksiyon karışımı hazırlanmasına, (iii) Bakteri DNAsının çoğaltılması için termal döngü (Touchgene Techne) cihazında, 95°Cde 5 dakika ilk denatürasyonu takiben 94°Cde 45 saniye denatürasyon, 57°Cde 45 saniye primer bağlanma ve 72°Cde 45 saniye uzama basamaklarından oluşan 35 döngü tamamlandıktan sonra, son uzama için 72°Cde 10 dakika bekletilerek amplifikasyonun tamamlanmasına karar verilmiş ve reaktiflerin optimal konsantrasyonları ve amplifikasyon döngüleri bu şekilde optimize edilmiştir. Bu denemelerde üç pozitif (B.pertussis Tohama phase I, B.pertussis ATCC 9797 ve B.pertussis klinik izolat) ve altı negatif (B.parapertussis ATCC 15311, B.bronchiseptica ATCC 4617, H.influenzae ATCC 49247, N.meningitidis RSKK 645, S.aureus ATCC 95106 ve E.coli ATCC 25922) kontrol suşu kullanılarak yöntemin özgül olduğu gösterilmiştir.
Yukarıda bahsi geçen üç pozitif kontrol suşu arasında herhangi bir farklılık görülmediği için pozitif kontrol olarak çalışmaya B.pertussis Tohama phase I (Tp-I) ile devam edilmiştir. Bu aşamada özgüllük çalışmamıza negatif kontrol olarak S.epidermidis ATCC 12228, C.diphtheriae varyant belfanti NCTC 10356, L.pneumophila serogrup 1 ATCC 43111, S.pyogenes ATCC 18615 suşları ile S.pneumoniae ve M.catarrhalis de ilave edilmiş ve bunlarda da hiçbir çapraz bant pozitifliğine rastlanmamıştır. Böylece bu primer çifti ile yapılan özgüllük çalışmaları tamamlanmıştır.
b. PIp1/PIp2 primerleri ile yapılan özgüllük çalışması: PIp1/PIp2 primer çifti ile yapılan PCR deneylerinde; özgüllüğün artırılmasına odaklanarak, reaksiyon karışımı hazırlanması ve bakteri DNAsının çoğaltılması basamakları ile ilgili değişkenler test edilmiştir. Öncelikle PTp1/PTp2 primer çifti ile yapılan özgüllük çalışmaları ile elde edilen reaksiyon karışımı hazırlanması ve bakteri DNAsının çoğaltılması basamakları bu primer çifti ile yapılan deneylerde de uygulanmış ve sonuç olarak pozitif kontrol suşları pozitif olarak saptanırken; negatif kontrol suşlarından biri olan B.bronchiseptica ATCC 4617 ile çapraz bant pozitifliği gözlenmiştir. Daha sonra negatif kontrol olarak S.epidermidis ATCC 12228, C.diphtheriae varyant belfanti NCTC 10356, L.pneumophila serogrup 1 ATCC 43111, S.pyogenes ATCC 18615 suşları ile S.pneumoniae ve M.catarrhalisin de ilave edildiği özgüllük çalışmaları yapılmış ve bu çalışmada da B.bronchiseptica ATCC 4617 ile çapraz bant pozitifliği gözlenmiştir.
Bu çalışmada, özgül ürünler elde etmeyi hedefleyerek çalışmalar en fazla bu primer çifti kullanılarak yapılan PCRnin özgüllüğünün artırılması konusuna yoğunlaştırılmıştır. Ancak negatif kontrol suşu olan B.bronchiseptica ATCC 4617 ile oluşan çapraz bant pozitifliği engellenememiştir.
2. Duyarlılığın Standardize Edilmesi
In-house PCRnin duyarlılığı, B.pertussis Tp-I suşu ile araştırılmıştır. %0.85lik NaClde McFarland-1 yoğunluğunda hazırlanan bakteri süspansiyonunun 650 nm dalga boyunda ODsi 0.123 olarak ölçülmüş ve Yuji Satonun geliştirmiş olduğu B.pertussis üreme grafiğinde bu ODye karşılık gelen bakteri konsantrasyonu 4.3 x 109 cfu/ml olarak tespit edilmiştir. Bakteri süspansiyonlarının ve 1/3 sulandırımlarının logaritmik dilüsyonları ile bu dilüsyon oranlarına karşılık gelen bakteri konsantrasyonları hesaplanmıştır. PCRnin duyarlılığının saptanmasında, özgüllük çalışmaları ile optimize edilen PCR tekniği kullanılmıştır.
a. PTp1/PTp2 primerleri ile yapılan duyarlılık çalışması: Bu çalışmalarda
1.-9. bantlar arasında sırayla azalan parlaklıkta pozitiflik saptanmıştır. Resim 1
Dokuzuncu bant için dilüsyon oranı 10-4, buna karşılık
gelen ve DNA kalıp olarak kullanılan bakteri konsantrasyonu 4.3 x 105
cfu/ml olup; bu da 34.4 cfu/Rm [colony forming unit (koloni oluşturan
ünite)/reaction mixture (reaksiyon karışımı)] olarak hesaplanabilir (9.-10.
bantlar: 34.4-11.2 cfu/Rm olup; yapılan çalışmalarda ortalama olarak 9. bant).
b. PIp1/PIp2 primerleri ile yapılan duyarlılık çalışması: Bu çalışmalarda
1.-12. bantlarda pozitiflik saptanmıştır. Resim 2
On ikinci bant için
dilüsyon oranı 0.33 x 10-5, buna karşılık gelen ve kalıp DNA olarak
kullanılan bakteri konsantrasyonu 1.4 x 104 cfu/ml olup; bu da 1.12
cfu/Rm olarak hesaplanabilir (11.-12. bantlar: 3.44 - 1.12 cfu/Rm olup; yapılan
çalışmalarda ortalama olarak 12. bant).
3. Temsili Klinik Örneklerde Duyarlılığın Araştırılması
Temsili nitelikteki klinik örneklerde in-house PCRnin duyarlılığının araştırılmasında B.pertussis Tp-I ile yapılan duyarlılık çalışmasının sonuçları esas alınarak, test edilecek dilüsyon aralığı 10-3-10-7 olarak belirlenmiştir. Tablo 2 B.pertussis Tp-I suşu ile pH: 7.2 PBS içerisinde McFarland-1 yoğunluğunda hazırlanan bakteri süspansiyonunun 650 nm dalga boyunda ODsi 0.145 olarak ölçülmüş ve Yuji Satonun geliştirdiği B.pertussis üreme grafiğinde bu ODye karşılık gelen bakteri konsantrasyonu 5.5 x 109 cfu/ml olarak tespit edilmiştir. Buna göre test edilecek dilüsyon oranları; 1-5 arası örnekler için 10-3, 6-10 arası örnekler için 0.33 x 10-3, 11-15 arası örnekler için 10-4, 16-20 arası örnekler için 0.33 x 10-4, 21-25 arası örnekler için 10-5, 29-30 arası örnekler için 0.33 x 10-5, 31-35 arası örnekler için 10-6, 36-40 arası örnekler için 0.33 x 10-6 ve 41-45 arası örnekler için 10-7 olup, bunlara karşılık gelen bakteri konsantrasyonları sırasıyla 5.5 x 106, 1.8 x 106, 5.5 x 105, 1.8 x 105, 5.5 x 104, 1.8 x 104, 5.5 x 103, 1.8 x 103 ve 5.5 x 102 cfu/mldir. Tablo 2
Bu
çalışmada eş zamanlı olarak, B.pertussis içermeyen klinik örnekler elde
etmek amacıyla sağlıklı bireylerden alınan 45 adet boğaz sürüntüsü örneği,
seçilen 10-3 ile 10-7 dilüsyon oranlarına karşılık gelen
5.5 x 106 ile 5.5 x 102 cfu/ml arası bakteri
konsantrasyonlarında herbiri beş ayrı klinik örnekle test edilmiştir. Bu
şekilde içinde normal flora üyeleri, sekresyonlar ve bilinen konsantrasyonlarda
B.pertussis Tp-I suşu bulunan gerçek hasta örnekleri simüle edilmiştir.
Test ettiğimiz aralıktaki her bakteri dilüsyonu ile hazırlanan temsili
nitelikteki klinik örnekler, ekstraksiyonun başlangıcında bir kez daha 1/9
oranında dilüe edilmiştir. Buradan ekstraksiyona devam etmeden önce her bir
süspansiyondan 50 µl alınarak BGA besiyerine ekim yapılmış ve ardından
ekstraksiyon işlemine devam edilerek kalıp DNA hazırlanmıştır. Ekstraksiyon
sonrasında yaklaşık 150 µl kalıp DNA elde edilmiş olup; bu kalıp DNAlar için
gerekli bakteri konsantrasyonları da hesaplanmıştır. Tablo 2
.
a. Temsili nitelikte klinik örneklerde PTp1/PTp2 primerleri ile
duyarlılık çalışması: Bu çalışmaların sonunda 1.-10. bantlarda pozitiflik
saptanmıştır. 6.-10. bantlara karşılık gelen ve DNA kalıp olarak kullanılan
bakteri konsantrasyonu 3.1 x 105 cfu/ml olup; bu da 28.4 cfu/Rm
olarak hesaplanabilir. Tablo 2 Bu sonuçlara göre bu primer çifti ile B.pertussis
Tp-I kullanılarak yapılan duyarlılık çalışmalarının sonuçları ile temsili
nitelikteki klinik örneklerde B.pertussis Tp-Ii saptama duyarlılığı
yaklaşık olarak birbirine eşit bulunmuştur.
b. Temsili nitelikte klinik örneklerde PIp1/PIp2 primerleri ile
duyarlılık çalışması: Bu çalışmaların sonunda 1.-28. bantlarda pozitiflik
saptanmıştır. 26.-30. bantlara karşılık gelen ve DNA kalıp olarak kullanılan
bakteri konsantrasyonu 3.1 x 103 cfu/ml olup; bu da 0.25 cfu/Rm
olarak hesaplanabilir. Tablo 2
Bu sonuçlara göre, bu primer çifti ile B.pertussis
Tp-I kullanılarak yapılan duyarlılık çalışmalarının sonuçları ve temsili
nitelikteki klinik örneklerde B.pertussis Tp-Ii saptama duyarlılığı
birbirine yakın bulunmuştur.
TARTIŞMA
Boğmaca enfeksiyonunun morbiditesi, 1940lı yıllardan itibaren ülkemiz de dahil olmak üzere dünyanın birçok ülkesinde uygulanan standart aşılama programlarıyla belirgin azalma sağlamıştır. Ancak boğmaca, çocukluk çağı hastalıkları arasında halen önemini korumaktadır1-3. Erken dönemde tanı konulması, tedavi başarısı ve bulaşın önlenmesinde son derece önemlidir6. DSÖ tarafından boğmacanın konfirmasyonu için altın standart olarak değerlendirilen kültür yönteminin özgüllüğü %100 olmakla birlikte, duyarlılığı hastalığın evresi, hastanın yaşı, uygulanan tedavinin etkinliği, örneğin alınması, taşınması ve kültür şartlarına göre %30-80 (ortalama %50) arasında değişmektedir5,11. Kültür ile ancak, klinik örnekler öksürüğün başlamasından sonraki ilk 2-3 hafta içinde alınırsa başarı sağlanabilmekte ve en yüksek izolasyon oranı bebekler ve aşılı olmayan çocuklarda elde edilmektedir. Özellikle nükleik asit amplifikasyon testleri (NAT)nin geliştirilmesiyle birlikte boğmaca tanısında tanısal ve analitik duyarlılık büyük ölçüde artmıştır. Grimprel ve arkadaşları11, kültür ve PCRnin duyarlılığını bebek/çocuklarda sırasıyla %54.1 ve %95.8, yetişkinlerde ise sırasıyla %15.4 ve %61.5 olarak bildirmişlerdir. Ayrıca kültür ile izolasyon ve konfirmasyon için uzun süre (3-12 gün) gerekmesi, boğmaca tanısında hızlı, özgül ve duyarlı tanı yöntemlerini gerekli kılmaktadır4. Bu amaçla PCR, güncel bir yaklaşım olmakla birlikte henüz yeterli özgüllük ve duyarlılığa ulaşılamamış ve standardize edilememiştir. Ancak uygulamalardaki hızlı ilerlemeler PCRın gelecekte boğmaca tanısında daha yaygın ve hızlı bir yöntem olarak kullanılabileceğini düşündürmektedir4,18. Bununla beraber PCRnin duyarlılığı, örneğin kalitesi, hastalığın dönemi ve antimikrobiyal tedaviden etkilenmekte; nükleik asit ekstraksiyon yöntemine, amplifiye edilen örneğin miktarına, amplifikasyon koşulları ve etkinliğine, hedef bölgeye ve DNA saptama formatına bağlı olarak değişiklik göstermektedir. PCR, örnekte az sayıda bulunan bakteriyi ve canlı olmayan organizmaları da tespit edebildiğinden kültüre göre daha yüksek duyarlılığa sahiptir. Ek olarak hastalık süresince kültürden daha uzun süre pozitif olarak saptanabilir ve antibiyotik tedavisini takiben pozitif kalma olasılığı daha fazladır.
B.pertussisin PCR ile tespitine yönelik 1989 yılında Houard ve arkadaşları9 tarafından yapılan çalışmada, ptxA-Pr genini hedef alan PTp1/PTp2 ve IS481 genini hedef alan PIp1/PIp2 primer çiftleri kullanılmış; daha sonra 1993 yılında Grimprel ve arkadaşlarının11 PTp1/PTp2 primer çifti ile yaptıkları çalışmada da destekleyici veriler elde edilmiştir. Her iki çalışmada da in-house PCR testinin yeterince özgül ve duyarlılığının 102 cfu/ml olduğu tespit edilmiştir. B.pertussis tanısında IS481 gen bölgesini hedef alan PCR yöntemi oldukça duyarlıdır; ancak bu dizi B.bronchiseptica, B.holmesii ve B.pettrii gibi diğer Bordetella türleri ile yüksek homoloji gösterdiği için çapraz reaksiyonlarla sık karşılaşılmaktadır6,11,19-21. ptxA-Pr gen bölgesi hedeflendiğinde ise özgüllük oldukça yüksek olmakla birlikte; duyarlılık, IS481i hedef alan PCR yönteminden daha düşüktür4,6,10,11. Bu nedenle tanı, genellikle IS481i hedef alan PCR ile konulmakta ve ptxA-Pryi hedef alan PCR ile konfirmasyon yapılmaktadır22.
Çalışmamızda da, ptxA-Pr ve IS481e yönelik primerler kullanılarak, in-house PCR, tanı yöntemi olarak standardize edilmiştir. Araştırmada, özgüllüğün standardizasyonu amacıyla PTp1/PTp2 primer çifti ile yapılan çalışmalarda, tüm pozitif kontrol suşları pozitif, negatif kontrol suşları negatif olarak saptanmış; reaksiyonun özgül olduğu belirlenmiş ve reaktiflerin optimal konsantrasyonları ile amplifikasyon döngüleri buna göre standardize edilmiştir. PTp1/PTp2 primer çifti ile özgüllük çalışmalarında elde ettiğimiz veriler, daha önceden yapılan çalışmaları destekler niteliktedir. Sonraki etapta, PIp1/PIp2 primer çifti ile yapılan PCRnin özgüllüğünün artırılmasına odaklanılarak; reaksiyon karışımı hazırlanması ve bakteri DNAsının çoğaltılması ile ilgili değişkenler test edilmiştir. Reaksiyonun özgüllüğünü artırmak amacıyla yapılan çalışmalar sonucunda, negatif kontrol suşlarından biri olan B.bronchiseptica ATCC 4617 ile oluşan çapraz bant pozitifliği engellenememiştir. Bu veriler doğrultusunda ve bu konuda yapılan araştırmalar temel alınarak, PIp1/PIp2 primer çifti ile yapılan PCR testlerinde yeterli düzeyde özgüllük sağlanamayacağı sonucuna varılmış ve PTp1/PTp2 primer çifti için optimize ettiğimiz oranlardaki reaksiyon karışımı bileşenleri ve amplifikasyon döngülerinin PIp1/PIp2 primer çifti ile yapılan PCR testlerinde de kullanılmasına karar verilmiştir. Bu çalışmadan elde ettiğimiz veriler, bu konuda yapılan diğer çalışmaları destekler niteliktedir4.
B.pertussis IS481 ve IS1001 bölgelerini hedef alan in-house PCR çalışmalarında yöntemin analitik duyarlılığı 1 cfu/Rm (bakteri konsantrasyonu/reaksiyon karışımı) olarak saptanmış; IS481i hedef alan PCRnin özgüllüğü ise bu konuda yapılan diğer çalışmalardan farklı olarak %100 oranında belirlenerek bu yüksek özgüllüğün kullanılan yönteme bağlı olduğu ifade edilmiştir10,19. Van der Zee ve arkadaşları14 da, IS481 ve IS1001 genlerini hedef alan primerler kullanmışlar ve amplikonların dot blot hibridizasyon ile tespit edildiği bu in-house PCR yönteminin analitik duyarlılığını B.pertussis için 1 cfu/Rm olarak saptamışlardır. Özellikle son 10 yılda ortaya çıkan ilerlemeler sonucu kullanılan ekstraksiyon, amplifikasyon, hibridizasyon ve tespit yöntemlerinde önemli gelişmeler olmuştur. Gerçek zamanlı [Real-time (Rt)]-PCR gibi yeni kuşak sistemler ile birlikte kontaminasyon olasılığı azalmış, prob ve primerlerin birarada kullanılması ve özgül floresan boyaların uygulamaya girmesi ile özgüllük ve duyarlılığın artışı sağlanmıştır4,18. Real-time multiplex LightCycler PCR (LC-PCR) teknolojisinin kullanıldığı bir çalışmada, IS481 ve IS1001i hedef alan yöntemin (LC-PCR-IS) analitik duyarlılığı 0.75 cfu/Rm; ptxA-Prı hedef alan yöntemin (LC-PCR-PTG) analitik duyarlılığı ise < 10 cfu/Rm olarak bulunmuştur23.
Çalışmamızın sonraki aşamasında, in-house PCR yönteminin duyarlılığı araştırılmış ve bu amaçla, özgüllük çalışmaları ile standardize edilen PCR prosedürü kullanılmıştır. ptxA-Pr bölgesini hedef alan PTp1/PTp2 primerleri ile yaptığımız analitik duyarlılık çalışmalarında, yöntemin özgüllüğünün yüksek, duyarlılığının ise düşük (34.4 cfu/Rm) olduğu görülmüştür. Elde edilen değer 6.9 x 102 cfu/ml olarak hesaplanabilir. Bu bölgeyi hedef alan çeşitli PCR çalışmalarında da reaksiyonun duyarlılığı düşük ve 102-3 x 102 cfu/ml değerleri arasında tespit edilmiştir4,11. IS481 bölgesini hedef alan PIp1/PIp2 primerleri ile yaptığımız analitik duyarlılık çalışmalarında ise, reaksiyonun duyarlılığı 1.12 cfu/Rm olarak saptanmış; konu ile ilgili diğer çalışmalarda bu değerin 0.75-1 cfu/Rm aralığında bulunduğu görülmüştür10,14,19,23. Elde ettiğimiz değerlerin, diğer çalışmalardan elde edilen sonuçlara yakın olmakla beraber biraz daha düşük bulunması, diğer çalışmalarda kullanılan LC-PCR-IS gibi tekniklerin daha duyarlı olmasından kaynaklanmış olabilir.
Çalışmamızın son basamağında, elde edilen verilerin klinik örnekler için geçerli olup olmadığı, temsili nitelikte klinik örneklerin kullanıldığı bir araştırma ile desteklenmiştir. Bu amaçla temsili klinik örneklere, ptxA-Pr ve IS481 genlerini hedef alan primerler kullanılarak in-house PCR uygulanmış ve elde edilen duyarlılık sonuçları, önceki duyarlılık çalışmamızın sonuçlarını destekler nitelikte bulunmuştur. Ayrıca yaptığımız eş zamanlı kültür çalışmasında; yöntemin B. pertussis saptama duyarlılığı 2 x 103 cfu/ml olarak saptanmıştır. Bu sonuç aynı zamanda PCR yönteminin duyarlılığının kültürden daha yüksek olduğunu gösteren pek çok araştırmayı destekler niteliktedir7,8,10,11,13,24,25. Dolayısıyla birçok laboratuvarda PCR, kültürün yerini almaya başlamıştır. Bu durum, B.pertussisin moleküler tanısında standardizasyonun sağlanması gereğini ortaya koymuş ve yapılan bir araştırmada EQA (External Quality Control) programına katılan Avrupa laboratuvarlarının performansları karşılaştırılmıştır4. Değerlendirmeye katılan toplam 11 laboratuvarın verilerine göre; en duyarlı (3 x 101-3 x 102 cfu/ml) ve yüksek özgüllükteki (%100) sonuçların gerçek zamanlı (Rt)-PCR ile alındığı, bunu in-house nested PCR ve in-house single PCR yöntemlerinin izlediği görülmektedir4,26.
Boğmacanın tanısında, mükemmel bir standart yöntem olarak düşünebileceğimiz tek bir laboratuvar testi yoktur. Kültüre göre duyarlılığı daha yüksek olan NATın en önemli sınırlamaları; potansiyel kontaminasyona bağlı yanlış pozitif sonuç alınması, ölçümler arasında standardizasyonun olmaması ve kültür ile bakterinin saptanamadığı durumlarda pozitif sonuçların yorumlanmasındaki zorluktur. Bu nedenle B.pertussis tanısında tek başına PCR pozitifliğinin, klinik ve epidemiyolojik verilerle bir arada değerlendirilmesi gerekmektedir. Nitekim CDC (Centers for Disease Control and Prevention), PCRnin kültür ile birlikte ve hızlı bir şekilde ön tanıya gidilebilmesi amacıyla kullanılmasını önermektedir27.
Günümüzde boğmaca hastalığı açısından en riskli grup, üç doz aşısı tamamlanmamış olan < 6 ay bebekler ve aşılanmış okul öncesi dönemdeki çocuklardır. Bu yaş gruplarında PCRnin oldukça duyarlı olduğu dikkate alındığında, tanı amacıyla kullanılması yararlı olacaktır. PCR ayrıca, hastalığın genellikle atipik seyrettiği antibiyotik tedavisi alanların tanısı ve erişkinlerde epidemiyolojik çalışmalar açısından da önem taşımaktadır. Çalışmamızda, konu ile ilgili diğer çalışmaların sonuçlarına paralel olarak, IS481 gen bölgesini hedef alan primerler ile yapılan PCR testinin duyarlılığı yüksek bulunmuş ancak, B.bronchiseptica ATCC 4617 ile çapraz reaksiyonlara rastlanmıştır. ptxA-Pr gen bölgesi hedeflendiğinde ise, yine diğer çalışmalarda belirtildiği gibi yeterli özgüllük sağlanmış, ancak duyarlılık IS481i hedef alan PCR yönteminden daha düşük bulunmuştur. Bu nedenle boğmacanın moleküler tanısında, genellikle IS481i hedef alan PCR ile ön tanı konulması ve ptxA-Pryi hedef alan PCR ile konfirmasyon yapılması önerilmektedir18,22. Çalışmamızda elde edilen deneyimler sonucunda, biz de bu düşünceyi paylaşmaktayız. Sonuç olarak verilerimiz, B. pertussis enfeksiyonlarının tanısında PCRnin hızlı ve duyarlı bir yöntem olarak kullanılabileceğini düşündürmektedir.
TEŞEKKÜR
Metnin İngilizce özet kısmını düzenleyen Dr. Bio. Fatma Filiz Arıya teşekkür ederiz.
KAYNAKLAR
- World Health Organization. Pertussis surveillance: A global meeting. 16-18 October 2000, Geneva. 2001, WHO, Geneva. Available from: www.who.int/vaccines-documents/DocsPDF01/www605.pdf
- World Health Organization. WHO Recommended Surveillance Standards. WHO/CDS/CSR/ISR/99.2, A37.0 Pertussis (Whooping Cough). WHO, Geneva.
- World Health Organization. WHO vaccine-preventable disease: monitoring system. 2006 Global Summary. WHO, Geneva.
- Muyldermans G, Soetens O, Antoine M, et al. External quality assessment for molecular detection of Bordetella pertussis in European laboratories. J Clin Microbiol 2005; 43(1): 30-5. [Özet] [Tam Metin] [PDF]
- Reizenstein E, Lindberg L, Möllby R, Hallander HO. Validation of nested Bordetella PCR in pertussis vaccine trial. J Clin Microbiol 1996; 34(4): 810-5. [Özet] [PDF]
- Knorr L, Fox JD, Tilley PA, Ahmed-Bentley J. Evaluation of real-time PCR for diagnosis of Bordetella pertussis infection. BMC Infect Dis 2006; 6: 62. [Özet] [Tam Metin] [PDF]
- Ewanowich CA, Chui LW, Paranchych MG, Peppler MS, Marusyk RG, Albritton WL. Major outbreak of pertussis in northern Alberta, Canada: analysis of discrepant direct fluorescent-antibody and culture results by using polymerase chain reaction methodology. J Clin Microbiol 1993; 31(7):1715-25. [Özet] [PDF]
- Dragsted DM, Dohn B, Madsen J, Jensen JS. Comparison of culture and PCR for detection of Bordetella pertussis and Bordetella parapertussis under routine laboratory conditions. J Med Microbiol 2004; 53(Pt 8): 749-54. [Özet] [Tam Metin] [PDF]
- Houard S, Hackel C, Herzog A, Bollen A. Specific identification of Bordetella pertussis by the polymerase chain reaction. Res Microbiol 1989; 140(7): 477-87. [Özet]
- Farrell DJ, McKeon M, Daggard G, Loeffelholz MJ, Thompson CJ, Mukkur TK. Rapid-cycle PCR method to detect Bordetella pertussis that fulfills all consensus recommendations for use of PCR in diagnosis of pertussis. J Clin Microbiol 2000; 38(12): 4499-502. [Özet] [Tam Metin] [PDF]
- Grimprel E, Bégué P, Anjak I, Betsou F, Guiso N. Comparison of polymerase chain reaction, culture, and western immunoblot serology for diagnosis of Bordetella pertussis infection. J Clin Microbiol 1993; 31(10): 2745-50. [Özet] [PDF]
- Glare EM, Paton JC, Premier RR, Lawrence AJ, Nisbet IT. Analysis of a repetitive DNA sequence from Bordetella pertussis and its application to the diagnosis of pertussis using the polymerase chain reaction. J Clin Microbiol 1990; 28(9): 1982-7. [Özet] [PDF]
- He Q, Mertsola J, Soini H, Skurnik M, Ruuskanen O, Viljanen MK. Comparison of polymerase chain reaction with culture and enzyme immunoassay for diagnosis of pertussis. J Clin Microbiol 1993; 31(3): 642-5. [Özet] [PDF]
- Van der Zee A, Agterberg C, Peeters M, Schellekens J, Mooi FR. Polymerase chain reaction assay for pertussis: simultaneous detection and discrimination of Bordetella pertussis and Bordetella parapertussis. J Clin Microbiol 1993; 31(8): 2134-40. [Özet] [PDF]
- Douglas E, Coote JG, Parton R, McPheat W. Identification of Bordetella pertussis in nasopharyngeal swabs by PCR amplification of a region of the adenylate cyclase gene. J Med Microbiol 1993; 38(2): 140-4. [Özet] [PDF]
- Hozbor D, Fouque F, Guiso N. Detection of Bordetella bronchiseptica by the polymerase chain reaction. Res Microbiol 1999; 150(5): 333-41. [Özet]
- Imaizumi A, Suzuki Y, Ono S, Sato H, Sato Y. Effect of heptakis (2,6-O-dimethyl) beta-cyclodextrin on the production of pertussis toxin by Bordetella pertussis. Infect Immun 1983; 41(3):1138-43. [Özet] [PDF]
- Riffelmann M, Wirsing von König CH, Caro V, Guiso N; Pertussis PCR Consesus Group. Nucleic acid amplification tests for diagnosis of Bordetella infections. J Clin Microbiol. 2005; 43(10): 4925-9. [Tam Metin] [PDF]
- Farrell DJ, Daggard G, Mukkur TK. Nested duplex PCR to detect Bordetella pertussis and Bordetella parapertussis and its application in diagnosis of pertussis in nonmetropolitan southeast Queensland, Australia. J Clin Microbiol 1999; 37(3): 606-10. [Özet] [Tam Metin] [PDF]
- Reischl U, Lehn N, Sanden GN, Loeffelholz MJ. Real-time PCR assay targeting IS481 of Bordetella pertussis and molecular basis for detecting Bordetella holmesii. J Clin Microbiol 2001; 39(5): 1963-6. [Özet] [Tam Metin] [PDF]
- Lingappa JR, Lawrence W, West-Keefe S, Gautom R, Cookson BT. Diagnosis of community-acquired pertussis infection: comparison of both culture and fluorescent-antibody assays with PCR detection using electrophoresis or dot blot hybridization. J Clin Microbiol 2002; 40(8): 2908-12. [Özet] [Tam Metin] [PDF]
- Herwegh S, Carnoy C, Wallet F, Loïez C, Courcol RJ. Development and use of an internal positive control for detection of Bordetella pertussis by PCR. J Clin Microbiol 2005; 43(5): 2462-4. [Özet] [Tam Metin] [PDF]
- Sloan LM, Hopkins MK, Mitchell PS, et al. Multiplex LightCycler PCR assay for detection and differentiation of Bordetella pertussis and Bordetella parapertussis in nasopharyngeal specimens. J Clin Microbiol 2002; 40(1): 96-100. [Özet] [Tam Metin] [PDF]
- Loeffelholz MJ, Thompson CJ, Long KS, Gilchrist MJ. Comparison of PCR, culture, and direct fluorescent-antibody testing for detection of Bordetella pertussis. J Clin Microbiol 1999; 37(9): 2872-6. [Özet] [Tam Metin] [PDF]
- Heininger U, Schmidt-Schläpfer G, Cherry JD, Stehr K. Clinical validation of a polymerase chain reaction assay for the diagnosis of pertussis by comparison with serology, culture, and symptoms during a large pertussis vaccine efficacy trial. Pediatrics 2000; 105(3): E31. [Özet] [Tam Metin] [PDF]
- Muyldermans G, Soetens O, Lauwers S. Second External Quality Assessment for the molecular detection of Bordetella pertussis, p: 7-14. In: Second External Quality Assessment in Belgian Laboratories Performing Molecular Microbiology. Organised by the Working Group of Molecular Microbiology of the National Committee for Molecular Diagnostics, 2004. Available from: http://webhost.ua.ac.be/cmd/files/ 2nd%20EQA%20Microbiology%2002062004.doc
- Centers for Disease Control and Prevention. Guidelines for the Control of Pertussis Outbreaks. 2000, CDC, Atlanta. Available from: http://www.cdc.gov/vaccines/pubs/pertussis-guide/guide.htm
İletişim (Correspondence):
Mik. Uzm. Dilek Güldemir
Refik Saydam Hıfzıssıhha Merkezi Başkanlığı
Salgın Hastalıklar Araştırma Müdürlüğü
Moleküler Mikrobiyoloji Araştırma ve Uygulama Laboratuvarı
Sıhhiye, Ankara, Türkiye.
Tel: +90 312 458 2483,
E-posta: dilekg06@yahoo.com.tr