Kan İzolatı E.coli ve K.pneumoniae
Suşlarında Genişlemiş Spektrumlu Beta-Laktamaz,
KPC-Tip Karbapenemaz ve Plazmid Aracılı AmpC Beta-Laktamaz Varlığının
Araştırılması*
Investigation
of the Presence of Extended Spectrum Beta-Lactamase, KPC-Type Carbapenemase and
Plasmid-Mediated AmpC Beta-Lactamase in E.coli and K.pneumoniae
Strains Isolated from Blood Cultures
Atakan BAYKAL1, Nilay ÇÖPLÜ2, Hüsniye ŞİMŞEK2, Berrin ESEN2, Deniz GÜR3
1 Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Viroloji Laboratuvarı, Ankara.
1 Refik Saydam National Public Health Agency, Virology Laboratory, Ankara, Turkey.
2 Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Salgın Hastalıklar Araştırma Müdürlüğü, Ankara.
2 Refik Saydam National Public Health Agency, Department of Communicable Diseases Research, Ankara, Turkey.
3 Hacettepe Üniversitesi Tıp Fakültesi, İhsan Doğramacı Çocuk Hastalıkları Hastanesi, Mikrobiyoloji Laboratuvarı, Ankara.
3 Hacettepe University Faculty of Medicine, Ihsan Dogramaci Children's Hospital, Microbiology Laboratory, Ankara, Turkey.
* Bu çalışma GATA Mikrobiyoloji Günleri, Antimikrobiyal Direnç Toplantısında (20-22 Nisan 2010, İstanbul) poster olarak sunulmuştur.
ÖZET
Bu çalışma; ciddi enfeksiyonlara neden olan kan izolatı Escherichia coli ve Klebsiella pneumoniae'da görülen genişlemiş spektrumlu beta-laktamazlar (GSBL) ile son yıllarda artış gösteren plazmid kaynaklı AmpC (pAmpC) beta-laktamazlar ve KPC-tip karbapenemazın varlıklarını araştırmak amacıyla yapılmıştır. Ocak 2001-Mart 2009 tarihleri arasında Hacettepe Üniversitesi Tıp Fakültesi İhsan Doğramacı Çocuk Hastalıkları Hastanesine başvuran hastaların kan örneklerinden izole edilen 99 E.coli ve 114 K.pneumoniae suşu çalışmaya alınmıştır. GSBL, pAmpC beta-laktamaz ve KPC-tip karbapenemaz enzimleri için tarama testleri aynı plakta uygulanmıştır. "Clinical and Laboratory Standards Institute (CLSI)" önerileri doğrultusunda doğrulama testi olarak GSBL için kombine disk yöntemi, KPC-tip karbapenemaz için modifiye Hodge testi, ayrıca KPC-tip karbapenemaz, pAmpC beta-laktamaz için boronik asitli inhibisyon test yöntemi ve pAmpC beta-laktamazlar için modifiye Hodge testi uygulanmıştır. Her üç tip direncin birarada bulunabilmesi durumunda ortaya çıkacak direnç fenotipinin belirlenmesinde boronik asitli inhibisyon test yöntemi uygulanmıştır. E.coli ve K.pneumoniae suşlarında beta-laktamaz oranları sırasıyla GSBL için %26.2 (26/99) ve %61.4 (70/114); pAmpC için %1 (1/99) ve %0.9 (1/114); GSBL + pAmpC için %6 (6/99) ve %3.5 (4/114) olarak tespit edilmiştir. Bir suşta GSBL'nin maskelenmiş olduğu saptanmıştır. KPC-tip karbapenemaz için ertapeneme dirençli üç izolat (iki E.coli, bir K.pneumoniae), boronik asitli inhibisyon testi ile pozitif saptanmalarına karşın, modifiye Hodge testi ile negatif olarak bulunmuştur. CLSI önerileri doğrultusunda modifiye Hodge testi sonuçları geçerli kabul edilmiştir. Bu üç suşun GSBL ve pAmpC için de pozitif olmaları ve modifiye Hodge testi ile negatiflik göstermeleri, ertapenem direncinin başka bir mekanizmadan kaynaklanmış olduğunu düşündürmüştür. Laboratuvar açısından, pAmpC beta-laktamazların ve KPC-tip karbapenemazların rutin testlerle tanımlanabilmeleri için uygun duyarlılık test yöntemlerinin kullanılması gerekmektedir. Bu amaçla pAmpC beta-laktamaz için boronik asitli inhibisyon testi, uygulama ve yorumlanması kolay, pratik bir yöntemdir. KPC-tip karbapenemaz için ise CLSI tarafından standardize edilen modifiye Hodge testi uygun bir yöntemdir. Bu çalışmanın bulguları GSBL oranlarının alarm verecek kadar yüksek olduğunu ve pAmpC sıklığının da henüz düşük olmakla birlikte GSBL ile beraber sıklığının artmakta olduğunu göstermektedir. Bu bulgular, bu konuda acil önlem alınması gerektiğini düşündürmektedir.
Anahtar sözcükler: Escherichia coli; Klebsiella pneumoniae; genişlemiş spektrumlu beta-laktamaz; GSBL; pAmpC beta-laktamaz; KPC-tip karbapenemaz.
ABSTRACT
The aim of this study was to investigate the presence of extended spectrum beta-lactamase (ESBL), KPC-type carbapenemase and plasmid-mediated AmpC beta-lactamase (pAmpC) which have increased in incidence in recent years in Escherichia coli and Klebsiella pneumoniae strains isolated from the blood samples causing serious infections. Ninety nine E.coli and 114 K.pneumoniae strains which were isolated from the blood samples of patients admitted to Hacettepe University Medical Faculty, Ihsan Dogramaci Children's Hospital between January 2001 and March 2009 were investigated. The screening tests for ESBL, pAmpC beta-lactamase and KPC-type carbapenemase were performed on the same plate. Combined disk test was performed for ESBL and modified Hodge test was done for KPC-type carbapenemase confirmation according to Clinical and Laboratory Standards Institute (CLSI) guidelines. In addition the inhibitory-based test with boronic acid for KPC-type carbapenemase, pAmpC beta-lactamase and the modified Hodge test for pAmpC beta-lactamase were performed. Boronic acid inhibition test was performed to detect the co-presence of the three types of resistance. The frequency of the beta-lactamases in E.coli and K.pneumoniae isolates were as follows respectively: ESBL 26.2% and 61.4%; pAmpC 1% and 0.9% and ESBL + pAmpC 6% and 3.5%. ESBL was masked by pAmpC in an isolate. Ertapenem resistance was shown in three isolates and KPC-type carbapenemases were detected positive by the inhibitory-based test with boronic acid but found to be negative by the modified Hodge test. The results of modified Hodge test was considered valid according to CLSI comments. Since both ESBL and pAmpC were positive but modified Hodge test was negative in these three strains, ertapenem resistance was attributed to another mechanism. For the determination of ESBL and pAmpC beta-lactamases in the routine laboratory, reliable and sensitive susceptibility tests should be performed. The inhibitory-based test with boronic acid is easy for interpretation, and a practical method for the detremination of pAmpC beta lactamases. For KPC-type carbapenemases modified Hodge test which has been standardized by CLSI, is a reliable method. The results of this study showed that ESBL positivity rates are alarming and although the frequency of pAmpC is currently low, it is increasing together with ESBL. These data indicated the need for the establishment of urgent measures to control the increase in plasmid-mediated antibiotic resistance in gram-negative enteric bacteria.
Key words: Escherichia coli; Klebsiella pneumoniae; extended spectrum beta-lactamase; ESBL; pAmpC beta-lactamase; KPC-type carbapenemase.
Geliş Tarihi (Received): 20.09.2011 • Kabul Ediliş Tarihi (Accepted): 06.01.2012
GİRİŞ
Escherichia coli ve Klebsiella pneumoniae, özellikle üriner sistem enfeksiyonları, septisemi, pnömoni ve nozokomiyal enfeksiyonlardan sorumludur1. Bu etkenlere bağlı enfeksiyonların tedavisinde ilk seçenek beta-laktam grubu antibiyotiklerdir. Beta-laktam antibiyotiklere karşı direnç gelişiminden sorumlu mekanizmalar içinde en önemlisi gram-negatif bakterilerin ürettiği beta-laktamaz enzimleridir2. Genişlemiş spektrumlu beta-laktamazlar (GSBL) klinik olarak önemli enzimlerdir; değişik antibiyotik direnç genlerini içeren büyük plazmidler aracılığıyla taşındıkları için çoklu ilaç direncine neden olurlar ve suşlar arasında kolayca yayılabilirler2. "Clinical and Laboratory Standards Institute (CLSI)", GSBL tanısı için sefpodoksim, sefotaksim, seftriakson, seftazidim veya aztreonama azalmış duyarlılık şeklindeki tarama testi ve tek başına ve klavulanik asitli sefotaksim ve seftazidim disklerinin karşılaştırıldığı kombine disk yöntemiyle doğrulama önermiştir3.
AmpC beta-laktamazlar, GSBL'lerden daha geniş bir spektrumda ilaç direncinden sorumlu olmaları nedeniyle klinik olarak önemli bir gruptur. Ayrıca, klavulanik asit gibi beta-laktamaz inhibitörlerinden etkilenmez. Plazmid-kaynaklı AmpC (pAmpC) beta-laktamazlar antibiyotik direnç genlerini suşlar arasında kolayca yayarak çoklu ilaç direncine neden olabilir ve GSBL enzimleriyle birarada bulunabilir2. Fenotipik testlerde pAmpC enzimlerinin GSBL'lerin açığa çıkmalarını maskeliyor olmaları, GSBL'ye bağlı direnç fenotipini belirlemede bir dezavantaja yol açmaktadır4. Boronik asit bileşiklerinin pAmpC beta-laktamazları inhibe edici özellikleri sayesinde, gerek pAmpC enzimlerini gerekse her iki enzim birlikteliğini gösterecek bazı test yöntemleri geliştirilmiştir5. Ayrıca, sefoksitin direnci ve sefoksitin diskine dayalı uygulanan modifiye Hodge testi, pAmpC enzimlerinin tanısında kullanılabilir4,6. Bu testin avantajı aynı plak üzerinde birkaç suşu tanımlama imkanı sağlamasıdır.
GSBL ve pAmpC enzimi taşıyan suşlarla gelişen enfeksiyonların tedavisi her zaman için sorun olmuştur. Karbapenemler, beta-laktamazlara karşı stabil olmaları sayesinde iyi bir seçenektir; ancak son zamanlarda karbapenemlere karşı özellikle gram-negatif basiller arasında artan bir direnç sorunu ortaya çıkmaya başlamıştır. Bu artışın özellikle GSBL antibiyotiklerin kullanımıyla yakın ilişkili olduğu bilinmektedir7. Disk difüzyon testlerinde tarama amaçlı kullanılan karbapenemler, özellikle daha duyarlı olması nedeniyle ertapenem karbapenemaz açısından bir indikatör niteliğindedir, direnç veya zon içi üreme önemlidir8,9,10. CLSI, KPC-tip karbapenemazların tespiti için merkezinde ertapenem diskinin kullanıldığı modifiye Hodge testini önermiştir3. Ayrıca, bazı çalışmalarda bu enzimlerin boronik asit ile inhibe olma özellikleri de araştırılmıştır11,12.
Bu çalışmanın amacı; GSBL'lerle birlikte ya da tek başına bulunabilen pAmpC beta-laktamazlar ile KPC-tip karbapenemazın varlığını kan izolatı E.coli ve K.pneumoniae suşlarında araştırmaktır.
GEREÇ ve YÖNTEM
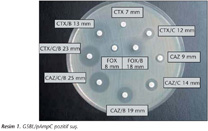
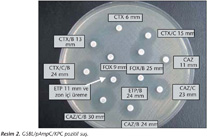
Çalışmaya, Ocak 2001-Mart 2009 tarihleri arasında Hacettepe Üniversitesi Tıp Fakültesi İhsan Doğramacı Çocuk Hastalıkları Hastanesine başvuran hastaların kan örneklerinden izole edilen 99 E.coli ve 114 K.pneumoniae suşu alındı. Testte (a) GSBL tarama ve doğrulama için; seftazidim 30 µg (CAZ), seftazidim + klavulanik asit 30 + 10 µg (CAZ/C), sefotaksim 30 µg (CTX), sefotaksim + klavulanik asit 30 + 10 µg (CTX/C), seftriakson 30 µg (CRO), aztreonam 30 µg (azt); (b) pAmpC beta-laktamaz tarama ve doğrulama için; sefoksitin 30 µg (FOX), sefoksitin + boronik asit (FOX/B), (c) GSBL/pAmpC birlikteliği için; seftazidim + klavulanik asit + boronik asit (CAZ/C/B) ve sefotaksim + klavulanik asit + boronik asit (CTX/C/B); (d) KPC-tip karbapenemaz tarama ve doğrulama için; meropenem 10 µg (MEM), ertapenem 10 µg (ETP), ertapenem + boronik asit (ETP/B) antibiyotik diskleri (BBL, Ankara) ve benzenboronik asit (benzeneboronic acid Merck 10 g, İstanbul) bileşiği kullanıldı.
Benzenboronik Asit Solüsyonunun Hazırlanışı
120 mg benzenboronik asit 3 ml dimetil-sülfoksit (DMSO) içerisinde çözüldükten sonra üzerine 3 ml steril distile su eklenerek stok solüsyon hazırlandı. Diskteki miktarı 400 µg boronik asit olacak şekilde 20 µl stok solüsyondan alınmış sefoksitin, ertapenem ve kombine disklere emdirildi ve diskler oda ısısında 30 dakika kurutulduktan sonra steril bir tüp içinde derin dondurucuya kaldırıldı5,11.
CLSI'nın önerileri doğrultusunda izolatların tarama testleri, Kirby-Bauer disk difüzyon yöntemiyle Mueller-Hinton agar (MHA) besiyerinde yapıldı. Ekimi yapılan plaklar etüvde 35 ± 2°C'de bir gecelik aerop inkübasyona bırakıldı. Tüm testlerde kontrol için ATCC 25922 E.coli ve ATCC 700603 K.pneumoniae standart suşları kullanıldı. Uyarıcı inhibisyon zon çapı ve daha dar zon çapı gösteren suşlar GSBL açısından3, sefoksitine dirençli (≤ 18 mm) suşlar pAmpC açısından6,12, CLSI'ya göre karbapenemlerden herhangi biri için uyarıcı zon çapları ve altında zon çapı gösteren suşlarla, ertapenem zon içi üreme gösteren suşlar ise KPC-tip karbapenemaz açısından şüpheli olarak değerlendirildi3,8.
Doğrulama testi için, şüpheli suşlar MHA plaklarına ekildikten sonra 35 ± 2°C'de bir gece aerop inkübasyon için etüve kaldırıldı. pAmpC pozitif kontrol suşu olarak Fransa'dan temin edilen K.pneumoniae FOR, DHA-2 ve E.coli J53 TC, CMY-2 suşları kullanıldı; ancak KPC-tip beta-laktamazın tespiti için pozitif kontrol suşu temin edilemedi. CAZ/C (veya CTX/C) zon çapının CAZ (veya CTX) inhibisyon zon çapında ≥ 5 mm gösteren suşlar GSBL3, FOX/B diskinin FOX'a göre inhibisyon zon çapının ≥ 5 mm olduğu suşlar pAmpC4 (Resim 1), ETB/B diskinin ETP'ye göre inhibisyon zon çapının ≥ 5 mm olduğu suşlar KPC açısından pozitif olarak değerlendirildi11 (Resim 2). FOX/B inhibisyon zon çapının FOX'a göre ≥ 5 mm olduğu suşlar da, CAZ/C (veya CTX/C) inhibisyon zon çapının CAZ'a (veya CTX) göre ≥ 5 mm olup olmadığı açısından incelendi ve GSBL pozitif ise, pAmpC ve GSBL birlikteliği açısından da pozitif olarak değerlendirildi13 (Şekil 1). Ayrıca, pAmpC enzimine bağlı olarak maskelemenin olabileceği düşünülen, yani GSBL tarama testi pozitif ancak GSBL doğrulama testi negatif ve pAmpC doğrulama testi pozitif olan suşlar için değerlendirme şu şekilde yapıldı: CAZ/C/B (veya CTX/C/B diski) inhibisyon zon çapının, CAZ/B'den (veya CTX/B) ve CAZ/B (veya CTX/B) inhibisyon zon çapının da CAZ'dan (veya CTX) ≥ 5 mm olması durumunda, test edilen izolatta pAmpC enzimine bağlı olarak maskelenmiş GSBL varlığı kabul edildi5.
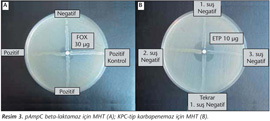
pAmpC beta-laktamaz ve KPC-tip karbapenemaz açısından pozitif olarak değerlendirilen örneklere aynı zamanda modifiye Hodge testi uygulandı. Her iki test için, E.coli ATCC 25922 suşunun McFarland 0.5'in 1/10 bulanıklığındaki süspansiyonu hazırlandı ve 150 mm'lik MHA plağının yüzeyine disk difüzyon yönteminde olduğu gibi ekildi. pAmpC için plağın merkezine sefoksitin diski (FOX 30 µg) yerleştirildi ve bir adet pozitif kontrol suşu olmak üzere dört adet suş bu diskin dört bir kenarından perifere doğru çizgi ekimi şeklinde öze ile ekildi6 (Resim 3). Aynı şekilde KPC-tip karbapenemaz için plağın merkezine ertapenem diski (ETP 10 µg) yerleştirildi ve boronik asitli inhibisyon testi ile pozitif bulunan üç adet suş bu diskin dört bir kenarından perifere doğru çizgi ekimi şeklinde öze ile ekildi. 35°C'de bir gecelik aerop inkübasyondan sonra diskin etrafındaki ortalama ≥ 3 mm'lik çarpık inhibisyon zonu varlığı pozitif olarak kabul edildi3,4,5,6 (Resim 3).
BULGULAR
GSBL İçin Kombine Disk Yöntemi Bulguları
GSBL açısından tarama testi ile pozitif bulunan 26 (%26.2) E.coli ve 70 (%61.4) K.pneumoniae suşunun hepsi GSBL doğrulama testi ile pozitif bulunmuştur.
Boronik Asitli İnhibisyon Testi Bulguları
Tek başına pAmpC beta-laktamaz varlığı: Tarama testinde pozitif bulunan bir E.coli ve iki K.pneumoniae suşunda pAmpC varlığı doğrulama testiyle tespit edilmiştir. Ancak bir K.pneumoniae suşunda pAmpC'nin GSBL varlığını maskelediği saptanmıştır. Böylece tek başına pAmpC varlığı bir E.coli (%1), bir K.pneumoniae (%0.9) suşunda tespit edilmiştir.
Tek başına KPC-tip karbapenemaz varlığı: Tarama testinde zon içi üreme gösteren KPC şüpheli bir E.coli ve bir K.pneumoniae suşu doğrulama testinde enzim varlığı açısından doğrulanmamıştır.
GSBL/pAmpC varlığı: Tarama testinde GSBL ve pAmpC birlikteliği gösteren dört E.coli ve iki K.pneumoniae suşu doğrulama testi ile doğrulanmıştır. Ayrıca, yukarıda ifade edilen bir adet maskelenmiş GSBL enzimi ile birlikte üç adet K.pneumoniae suşunda GSBL/pAmpC birlikteliği saptanmıştır.
GSBL/pAmpC/KPC varlığı: Tarama testleri ile iki E.coli ve bir K.pneumoniae suşunda GSBL/pAmpC/KPC birlikteliği saptanmış, ayrıca K.pneumoniae suşunda ertapenem diskinde zon içi üremeler tespit edilmiştir. Suşlar boronik asitli ertapenem diski ile pozitif olarak doğrulanmıştır. Ancak CLSI önerileri doğrultusunda modifiye Hodge testinin sonuçları kabul edildiği için bu sonuç değerlendirmeye alınmıştır.
Modifiye Hodge Testi Bulguları
pAmpC varlığı: Tarama testi ile pAmpC bulunan yedi E.coli ve beş K.pneumoniae suşu teste alınmış, 12 adet suşun 11'inde ortalama ≥ 3 mm çarpık inhibisyon zonu görülmüştür. Sadece bir E.coli suşunda çarpık inhibisyon zonu görülmemiştir.
KPC-tip karbapenemaz varlığı: Tarama testi ile ertapenem zon içi üreme gösteren ve diğer enzimlerle beraber pozitif bulunan üç E.coli ve iki K.pneumoniae suşu modifiye Hodge testine alınmış, ancak hiçbiri inhibisyon zonunda belirgin bir çarpıklık göstermemiş ve negatif bulunmuşlardır. CLSI önerileri doğrultusunda bu sonuçlar dikkate alınmıştır (%0). Dolayısıyla GSBL/pAmpC birlikteliği E.coli için %6 (6/99) ve K.pneumoniae için %3.5 (4/114) olarak tespit edilmiştir.
Tarama ve doğrulama testlerinin sonuçları Tablo I'de sunulmuştur.
TARTIŞMA
Enzimatik direnç içinde önemli bir fenotip gösteren GSBL'ler Enterobacteriaceae ailesinin üyeleri arasında özellikle E.coli ve K.pneumoniae türlerinde yaygın olarak bulunmaktadır1. Bu enzim ailesi değişik antibiyotik direnç genlerini içeren büyük plazmidler aracılığıyla taşındıkları için çoklu dirence neden olur ve suşlar arasında kolayca yayılabilir. Klinik olarak da önemli enzimlerdir; zira varlıklarının gösterilmesi tedavide kısıtlılığa yol açar2. Bu nedenle hastanelerde GSBL salgılayan bakterilerin sıklığının düzenli olarak izlenmesi ve yayılımının önlenmesi gerekmektedir.
E.coli ve Klebsiella suşlarında GSBL üretimi dünyanın değişik bölgelerinde farklı sıklıkta ortaya çıkmaktadır. Gerek ülkemizde gerekse yurt dışındaki GSBL oranlarında görülen farklılıklar, bakterilerdeki enzim üretim sıklığının belli şartlarla değişiyor olmasıyla ilgilidir. Ayrıca, enzim üretimindeki artışın GSBL antibiyotik kullanımıyla yakın ilişkili ve beta-laktam direncindeki artışla paralel olduğu bilinmektedir10,14. GSBL tespitine yönelik olarak ülkemizde değişik merkezlerde yapılan çalışmalarda farklı oranlar elde edilmiştir. Mumcuoğlu ve arkadaşları15E.coli'de %20 (19/94), Klebsiella suşlarında %44 (27/62), Delialioğlu ve arkadaşları16 E.coli'de %18.3 (94/514), K.pneumoniae'da %29.7 (52/175), Geyik ve arkadaşları17 E.coli'de %32 (10/31), Klebsiella suşlarında %45 (15/33) oranlarında GSBL varlığı saptamışlardır. Ancak kan kültürlerinden izole edilen bakterilerdeki GSBL oranları konusundaki çalışmalar yetersizdir; yapılan az sayıda çalışmada GSBL sıklığı bazı merkezlerde E.coli'de daha yüksek, bazı merkezlerde ise K.pneumoniae'da daha yüksektir. Genel olarak ülkemizde GSBL sıklığı E.coli'de %13-36, Klebsiella suşlarında ise %60-70 oranlarında değişmektedir. Çalışmamızda, GSBL 26 (%26.2) E.coli suşunda ve 70 (%61.4) K.pneumoniae suşunda tespit edilmiştir10,18,19,20. Bu sonuçlar ülkemizdeki verilerle uyumludur.
E.coli ve Klebsiella spp. izolatlarında en sık GSBL enzimlerine rastlanmakla birlikte sefoksitin, sefotetan gibi sefamisinlere direnç sağlayan pAmpC beta-laktamazların önemi her geçen gün artmaktadır. pAmpC beta-laktamazlar, GSBL'lerden daha geniş bir spektrumda ilaç direncine yol açmaları nedeniyle klinik olarak önemli bir gruptur21. pAmpC beta-laktamazların dünyadaki dağılımına bakıldığında bu enzimlerin önemi daha iyi anlaşılmaktadır. Yapılan bazı çalışmalarda pAmpC oranları K.pneumoniae'da %10-30, E.coli suşlarında ise %2-40 aralığında değişmektedir22,23,24. pAmpC enzimleri tek başına bulunabilecekleri gibi GSBL enzimleriyle birlikte de bulunabilir. Bu birliktelikte, laboratuvar testlerinde bazen her iki enzim ailesi fenotipini ayrı ayrı ortaya koyabileceği gibi, bazen pAmpC enzimleri GSBL'lerin ifadesini maskeleyerek saptanmasını önlüyor olabilir. Bu gibi özel durumların açığa kavuşturulması için, GSBL tarama testi pozitif ve sefoksitine dirençli izolatlara pAmpC inhibitörü olan boronik asitin kullanıldığı çalışmalarda GSBL ve pAmpC birlikteliğini gösteren sonuçlar alınmıştır4,5,13,14,15,16,17,18,19,20,21,22,23,24,25,26. Çalışmamızda 6 (%6.0) E.coli ve 4 (%3.5) K.pneumoniae olmak üzere toplam 10 suşta pAmpC pozitifliği GSBL ile birlikte tespit edilmiş ve bir K.pneumoniae suşunda GSBL fenotipi maskelenmiş olarak bulunmuştur. Tek başına pAmpC pozitifliği ise, 1 (%1) E.coli ve 1 (%0.9) K.pneumoniae suşunda tespit edilmiştir. Boronik asitli inhibisyon testi yanında modifiye Hodge testi ile de sefoksitin direncinin pAmpC enzimine bağlı olup olmadığı saptanabilir; ancak modifiye Hodge testinin uygulanması hakkında CLSI'nın henüz bir önerisi yoktur. Yong ve arkadaşlarının6 çalışmasında MHT testinin performansı değerlendirilmiş, duyarlılık ve özgüllük sırasıyla %100 ve %94.9 olarak saptanmış, ayrıca pAmpC pozitifliği için inhibisyon zon sınır değeri ≥ 3 mm olarak tespit edilmiştir. Bizim çalışmamızda modifiye Hodge testi, tarama testi ile pAmpC pozitif bulunan tüm suşlarda uygulanmış ve bir suş dışında tümü pozitif olarak saptanmıştır. Aynı suşlarda yapılan boronik asitli inhibisyon testi ile tüm suşlar doğrulanmıştır. Uygulanan her iki yöntem CLSI tarafından önerilmiş olmasa da, çalışma bu yöntemlerin performansını göstermede önemlidir. Gerçekte pAmpC beta-laktamazların varlığını tespit etmede polimeraz zincir reaksiyonu (PCR) altın standarttır; ancak çalışmamızda, laboratuvar ortamında pratik olan bu yöntemlerin etkinliğinin test edilmesi amaçlandığından PCR yöntemi uygulanmamıştır.
GSBL ve pAmpC enzimi taşıyan suşlarla gelişen enfeksiyonların tedavisi her zaman için sorun olmuştur. Karbapenemler, bu beta-laktamazların hidrolizine karşı stabil olmaları sebebiyle dirençli gram-negatif bakterilerin yol açtığı enfeksiyonların tedavisinde iyi bir seçenek olmuştur7. Ancak son zamanlarda karbapenemlere karşı da direnç sorunu ortaya çıkmaya başlamıştır. KPC-tip karbapenemazının K.pneumoniae suşları arasında giderek yayılım göstermeye başladığı, yapılan birkaç çalışmada gösterilmiştir11,27,28,29. Yunanistan'da yapılan çalışmalarda KPC-2 ile birlikte GSBL enzimleri tespit edilmiştir11,27. Bize yakın bir ülkede KPC enzimi taşıyan suşların görülmesi, ülkemiz açısından risk taşımaktadır. Karbapeneme dirençli suşların yayılımlarını kontrol altına almak için bu enzimin yol açtığı direncin izlenmesi gerekmektedir. Disk difüzyon testlerinde kullanılan karbapenemler, karbapenemaz açısından bir indikatör niteliğinde olup, tarama amaçlı değerlendirilebilir. Özellikle gerek direnç fenotipinin belirlenmesinde gerekse tedavide kullanılmasından dolayı ertapenemin önemi gittikçe artmaktadır10. Anderson ve arkadaşları8 yapmış oldukları bir çalışmada, 31 KPC pozitif Enterobacteriaceae izolatında karbapenem duyarlılıklarını çeşitli test yöntemleriyle çalışmışlar ve ertapenemi en duyarlı indikatör olarak tespit etmişlerdir8. Bunun yanında duyarlılık testlerinde ertapenemin zon içinde ince üremelerinin görülmesi KPC-tip karbapenemaz varlığı açısından uyarıcıdır. Çalışmamızda, tarama testinde iki E.coli ve bir K.pneumoniae suşunda ertapenem direnci saptanmıştır. Ertapeneme direnç gösteren bu suşlar boronik asit ile duyarlı inhibisyon zonu göstermişlerdir. Ayrıca, ertapeneme dirençli K.pneumoniae suşunda zon içi üremeler tespit edilmiştir. CLSI ayrıca doğrulama testi olarak, ertapenem diskinin kullanıldığı modifiye Hodge testini tanımlamıştır3. Yöntem, tarama testinde ertapenem direncini teyid etmektedir ve laboratuvarlar için uygulanabilecek kolaylıktadır. Yalnız sonuçların değerlendirilme aşaması deneyim gerektirmektedir12. Bizim çalışmamızda modifiye Hodge testi, ertapeneme dirençli üç suş için uygulanmış, ancak belirgin bir çarpık inhibisyon zonu elde edilememiştir. Ayrıca, testte KPC için pozitif kontrol suşunun temin edilememesi önemli bir eksikliktir. Buna karşılık testin değerlendirilmesinde bir sorun yaşanmamıştır. Her üç suşun da GSBL ve pAmpC enzimleriyle birlikte bulunması ve modifiye Hodge testi ile negatif bulunması ertapenem direncinin başka bir mekanizmadan kaynaklanmış olduğunu düşündürmektedir.
Günümüzde, GSBL ile birlikte pAmpC enzimlerinin bulunabilmeleri durumunda henüz uygulanabilecek standart bir yöntem yoktur. Bu nedenle son zamanlarda artış gösteren ve GSBL'lerle birlikte bulunabilen pAmpC enzimlerinin rutin testlerle tanımlanmaları için uygun duyarlılıkta test yöntemlerinin kullanılması gerekmektedir. Bu açıdan boronik asitli inhibisyon test yöntemleri, uygulanabilir, yorumlanması kolay ve pratik yöntemlerdir. Ayrıca, CLSI tarafından standardize edilen modifiye Hodge testi, KPC-tip karbapenemazların tespiti için kullanılabilecek uygun bir yöntemdir.
KAYNAKLAR
- Winn W Jr, Allen S, Janda W, Koneman E, et al. (eds). Koneman's Color Atlas and Textbook of Diagnostic Microbiology. Chapter 5-6. 2006, 6th ed. Lippincott Williams and Wilkins, Baltimore.
- Gupta V. An update on newer beta-lactamases. Indian J Med Res 2007; 126(5): 417-27. [Özet] [PDF]
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 19th Informational Supplement. 2009, M100-S19. CLSI, Wayne, PA.
- Hemalatha V, Padma M, Sekar U, Vinodh TM, Arunkumar AS. Detection of AmpC beta-lactamases production in Escherichia coli and Klebsiella by an inhibitor based method. Indian J Med Res 2007; 126(3): 220-3. [Özet] [PDF]
- Coudron PE. Inhibitor-based methods for detection of plasmid-mediated AmpC beta-lactamases in Klebsiella spp., Escherichia coli, and Proteus mirabilis. J Clin Microbiol 2005; 43(8): 4163-7. [Özet] [Tam Metin] [PDF]
- Yong D, Park R, Yum JH, Lee K, et al. Further modification of the Hodge test to screen AmpC beta-lactamase (CMY-1)-producing strains of Escherichia coli and Klebsiella pneumoniae. J Microbiol Methods 2002; 51(3): 407-10. [Özet]
-
Yigit H, Queenan AM, Anderson GJ, et al. Novel carbapenem-hydrolyzing
beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella
pneumoniae. Antimicrob Agents Chemother 2001; 45(4): 1151-61.
[Özet] [Tam Metin] [PDF] - Anderson KF, Lonsway DR, Rasheed JK, et al. Evaluation of methods to identify the Klebsiella pneumoniae carbapenemase in Enterobacteriaceae. J Clin Microbiol 2007; 45(8): 2723-5. [Özet] [Tam Metin] [PDF]
- McGettigan SE, Andreacchio K, Edelstein PH. Specificity of ertapenem susceptibility screening for detection of Klebsiella pneumoniae carbapenemases. J Clin Microbiol 2009; 47(3): 785-6. [Özet] [Tam Metin] [PDF]
- Tunçcan ÖG, Keten DT, Dizbay M, Hızel K. Hastane kaynaklı E.coli ve Klebsiella suşlarının ertapenem ve diğer antibiyotiklere duyarlılığı. ANKEM 2008; 22(4): 188-92. [Özet] [PDF]
- Tsakris A, Kristo I, Poulou A, Markou F, Ikonomidis A, Pournaras S. First occurrence of KPC-2-possessing Klebsiella pneumoniae in a Greek hospital and recommendation for detection with boronic acid disc tests. J Antimicrob Chemother 2008; 62(6): 1257-60. [Özet] [Tam Metin] [PDF]
- Doi Y, Potoski BA, Adams-Haduch JM, Sidjabat HE, Pasculle AW, Paterson DL. Simple disk-based method for detection of Klebsiella pneumoniae carbapenemase-type beta-lactamase by use of a boronic acid compound. J Clin Microbiol 2008; 46(12): 4083-6. [Özet] [Tam Metin] [PDF]
- Song W, Jeong SH, Kim J, Kim H, Shin DH. Use of boronic acid disk methods to detect the combined expression of plasmid-mediated AmpC beta-lactamases and extended-spectrum beta-lactamases in clinical isolates of Klebsiella spp., Salmonella spp., and Proteus mirabilis. Diagn Microbiol Infect Dis 2007; 57(3): 315-8. [Özet]
- Akçam FZ, Gönen İ, Kaya O, Yaylı G. Hastane infeksiyonu etkeni enterobakterilerde duyarlılık ve GSBL sıklığının araştırılması. Süleyman Demirel Üni Tıp Fak Derg 2004; 11(1): 6-9. [PDF]
- Mumcuoğlu İ, Gündüz T, Baydur H. Escherichia, Klebsiella ve Proteus suşlarında genişlemiş spektrumlu beta-laktamaz varlığı ve çeşitli antibiyotiklere direnç durumu. ANKEM 2004; 18(1): 9-11. [Özet] [PDF]
- Delialioğlu N, Öcal ND, Emekdaş G. Çeşitli klinik örneklerden izole edilen Escherichia coli ve Klebsiella türlerinde genişlemiş spektrumlu beta-laktamaz oranları. ANKEM 2005; 19(2): 84-7. [Özet] [PDF]
- Geyik MF, Kökoğlu ÖF, Uçmak H, Çelen MK, Hoşoğlu S, Ayaz C. Hastane kaynaklı gram-negatif bakterilerde genişlemiş spektrumlu beta-laktamazlar. İnfeksiyon Derg 2002; 16(2): 175-8. [Özet] [PDF]
- Al-Muhtaseb M, Kaygusuz A. Kan kültürlerinden izole edilen Escherichia coli ve Klebsiella pneumoniae suşlarında genişlemiş spektrumlu beta-laktamaz (GSBL) sıklığı. ANKEM 2008; 22(4): 175-182. [Özet] [PDF]
- Ünlü GV, Ünlü M, Bakıcı MZ, Gür D. Kan kültürlerinden soyutlanan gram negatif bakterilerin çeşitli antibiyotiklere direnci ve genişlemiş spektrumlu beta-laktamaz oranları. İnfeksiyon Dergisi 2003; 17(4): 459-63. [Özet] [PDF]
- Işık F, Arslan U, Tuncer İ. Klinik örneklerden soyutlanan Klebsiella türlerinde genişlemiş spektrumlu beta-laktamaz varlığı ve antibiyotik duyarlılığı. İnfeksiyon Dergisi 2007; 21 (1): 33-8. [Özet] [PDF]
- Arora S, Bal M. AmpC beta-lactamase producing bacterial isolates from Kolkata hospital. Indian J Med Res 2005; 122(3): 224-33. [Özet] [PDF]
- Ding H, Yang Y, Lu Q, Wang Y, Chen Y, Deng L. The prevalence of plasmid-mediated AmpC beta-lactamases among clinical isolates of Escherichia coli and Klebsiella pneumoniae from five children's hospitals in China. Eur J Clin Microbiol Infect Dis 2008; 27(10): 915-21. [Özet]
- Subha A, Devi VR, Ananthan S. AmpC beta-lactamase producing multidrug resistant strains of Klebsiella spp. and E.coli isolated from children under five in Chennai. Indian J Med Res 2003; 117(1): 13-8. [Özet]
-
Coudron PE, Moland ES, Thomson KS. Occurence and detection of AmpC beta-lactamases
among Escherichia coli, Klebsiella pneumoniae and Proteus
mirabilis isolates at a veterans medical center. J Clin Microbiol 2000;
38(5): 1791-6.
[Özet] [Tam Metin] [PDF] - Yan J, Hsueh P, Lu J, Chang F, et al. Extended-spectrum beta-lactamases and plasmid-mediated AmpC enzymes among clinical isolates of Escherichia coli and Klebsiella pneumoniae from seven medical centers in Taiwan. Antimicrob Agents Chemother 2006; 50(5): 1861-4. [Özet] [Tam Metin] [PDF]
- Song W, Bae IK, Lee YN, Lee CH, Lee SH, Jeong SH. Detection of extended-spectrum beta-lactamases by using boronic acid as an AmpC beta-lactamase inhibitor in clinical isolates of Klebsiella spp. and Escherichia coli. J Clin Microbiol 2007; 45(4): 1180-4. [Özet] [Tam Metin] [PDF]
- Maltezou HC, Giakkoupi P, Maragos A, Bolikas M. Outbreak of infections due to KPC-2-producing Klebsiella pneumoniae in a hospital in Crete (Greece). J Infect 2009; 58(3): 213-9. [Özet]
- Wei ZQ, Du XX, Yu YS, Shen P, Chen YG, Li LJ. Plasmid-mediated KPC-2 in a Klebsiella pneumoniae isolate from China. Antimicrob Agents Chemother 2007; 51(2): 763-5. [Özet] [Tam Metin] [PDF]
- Sundin DR. Hidden beta-lactamases in the Enterobacteriaceae - Dropping the extra disks for detection, Part II. Clin Microbiol Newsletter 2009; 31(7): 47-52.
İletişim (Correspondence):
Uzm. Dr. Atakan Baykal,
Refik Saydam Hıfzıssıhha Merkezi Başkanlığı,
Viroloji Laboratuvarı,
Adnan Saygun Caddesi No: 55
06100 Sıhhiye, Ankara, Türkiye.
Tel (Phone): +90 312 458 2000,
E-posta (E-mail): baykalatakan@yahoo.com