Türkiye'de
Yedi İldeki Hastanelerin Yoğun Bakım Ünitelerinden İzole Edilen MRSA Suşlarında
VISA-VRSA Araştırılması ve Antibiyotik Duyarlılık Durumlarının Saptanması*
Evaluation
of Antibiotic Susceptibilities and VISA-VRSA Rates Among MRSA Strains Isolated
from
Hospitalized Patients in Intensive Care Units of Hospitals in Seven Provinces
of Turkey
Salih
CESUR1, Hasan IRMAK1, Hüsniye ŞİMŞEK2, Nilay
ÇÖPLÜ2, Hasan KILIÇ3, Uğur ARSLAN4,
Gülçin BAYRAMOĞLU5, Betil Özhak BAYSAN6, Zeynep GÜLAY7,
Salih HOŞOĞLU8, Mustafa BERKTAŞ9,
Serap GENCER10, Ali Pekcan DEMİRÖZ1, Berrin ESEN2,
Nihal KARABİBER3, Faruk AYDIN5, Ata Nevzat YALÇIN11
1 Ankara Eğitim ve Araştırma Hastanesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği, Ankara.
1 Ankara Training and Research Hospital, Department of Infectious Diseases and Clinical Microbiology, Ankara, Turkey.
2 Refik Saydam Hıfzıssıhha Merkezi, Salgın Hastalıklar Araştırma Müdürlüğü, Ankara.
2 Refik Saydam National Public Health Agency, Department of Communicable Diseases Research, Ankara, Turkey.
3 Türkiye Yüksek İhtisas Hastanesi, Mikrobiyoloji ve Klinik Mikrobiyoloji Laboratuvarı, Ankara.
3 Türkiye Yüksek İhtisas Hospital, Microbiology and Clinical Microbiology Laboratory, Ankara, Turkey.
4 Selçuk Üniversitesi Meram Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Konya.
4 Selcuk University Faculty of Meram Medicine, Department of Medical Microbiology, Konya, Turkey.
5 Karadeniz Teknik Üniversitesi TıpFakültesi Farabi Hastanesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Trabzon.
5 Karadeniz Technical University Faculty of Medicine Farabi Hospital, Department of Medical Microbiology, Trabzon, Turkey.
6 Akdeniz Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Antalya.
6 Akdeniz University Faculty of Medicine, Department of Medical Microbiology, Antalya, Turkey.
7 Dokuz Eylül Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
7 Dokuz Eylul University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
8 Dicle Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Diyarbakır.
8 Dicle University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Diyarbakir, Turkey.
9 Van Eğitim ve Araştırma Hastanesi, Mikrobiyoloji ve Klinik Mikrobiyoloji Laboratuvarı, Van.
9 Van Training and Research Hospital, Microbiology and Clinical Microbiology Laboratory, Van, Turkey.
10 Dr. Lütfi Kırdar Kartal Eğitim ve Araştırma Hastanesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği, İstanbul.
10 Dr. Lutfi Kirdar Kartal Training and Research Hospital, Infectious Diseases and Clinical Microbiology Clinic,
Istanbul, Turkey.
11 Akdeniz Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Antalya.
11 Akdeniz University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Antalya, Turkey.
* Bu çalışma, Sağlık Bakanlığı Strateji Geliştirme Başkanlığı tarafından desteklenmiş ve XXX. Türk Mikrobiyoloji Kongresi (21-25 Ekim 2008, Bodrum)'nde sözlü olarak sunulmuştur.
ÖZET
Bu çalışmada, ülkemizin farklı coğrafi bölgelerindeki hastanelerin yoğun bakım ünitelerinde yatan hastalardan izole edilen metisiline dirençli Staphylococcus aureus (MRSA) suşları içerisinde, vankomisine orta düzeyde duyarlı S.aureus (VISA) ve vankomisine dirençli S.aureus (VRSA) suşlarının varlığının araştırılması ve izolatların tedavide kullanılan alternatif ilaçlardan teikoplanin, linezolid, tigesiklin, kinupristin-dalfopristin ve daptomisin için minimum inhibitör konsantrasyonu (MİK) değerlerinin saptanması amaçlanmıştır. Çalışmaya, Türkiye'de yedi farklı bölgeyi temsil eden sekiz şehirde [Ankara (n= 52), Konya (n= 49), Antalya (n= 40), İstanbul (n= 7), İzmir (n= 37), Diyarbakır (n= 15), Van (n= 12), Trabzon (n= 48)] bulunan toplam dokuz merkezde izole edilen, toplam 260 MRSA suşu (113 alt solunum yolu örneği, 90 kan, 24 yara, 17 kateter, 13 burun sürüntüsü, iki idrar, bir beyin omurilik sıvısı) alınmıştır. Metisilin direnci, suşların izole edildiği hastanelerde sefoksitin disk difüzyon yöntemiyle belirlenmiş; Refik Saydam Hıfzıssıhha Merkezi Başkanlığında oksasilin tuz agar tarama yöntemiyle doğrulanmıştır. Suşlarda VISA ve VRSA araştırması vankomisin agar tarama testi ve E-test yöntemi kullanılarak gerçekleştirilmiştir. MRSA suşlarının diğer antibiyotiklere duyarlılıkları da E-test yöntemiyle belirlenmiştir. Çalışılan 260 MRSA suşunun hiçbirinde VRSA veya VISA varlığı saptanmamıştır. Tüm suşlar teikoplanin ve linezolide duyarlı bulunmuş; daptomisin, tigesiklin ve kinupristin-dalfopristin duyarlılık oranları ise sırasıyla; %99.6, %96.9 ve %95 olarak belirlenmiştir. Çalışılan suşlar arasında VISA ve VRSA olmaması umut verici bulunmuş; bu tip suşların gelişimini önlemek için tedavide linezolid, kinupristin-dalfopristin, daptomisin ve tigesiklin gibi yeni antibiyotiklerin seçenek olarak kullanılmasının yararlı olacağı düşünülmüştür.
Anahtar sözcükler: Metisilin; direnç; Staphylococcus aureus; E-test; antibiyotik duyarlılık; MRSA; VISA; Türkiye.
ABSTRACT
The aim of this study was to determine whether vancomycin resistant Staphylococcus aureus (VRSA) and vancomycin intermediate susceptible S.aureus (VISA) strains were present among methicillin-resistant S.aureus (MRSA) strains isolated from patients hospitalised at intensive care units (ICU) of hospitals located at different regions of Turkey and to determine the minimum inhibitory concentration (MIC) values of teicoplanin, linezolid, tigecycline, quinupristin-dalfopristin and daptomycin, which are alternative drugs for the treatment of MRSA infections. A total of 260 MRSA clinical strains (isolated from 113 lower respiratory tract, 90 blood, 24 wound, 17 catheter, 13 nasal swabs, two urine and one CSF sample) were collected from nine health-care centers in eight provinces [Ankara (n= 52), Konya (n= 49), Antalya (n= 40), Istanbul (n= 7), Izmir (37), Diyarbakir (n= 15), Van (n= 12), Trabzon (n= 48)] selected as representatives of the seven different geographical regions of Turkey. Methicillin resistance was determined by cefoxitin disk diffusion in the hospitals where the strains were isolated and confirmed by oxacillin salt agar screening at the Refik Saydam National Public Health Agency. Screening for VISA and VRSA was conducted using the agar screening test and E-test. Susceptibility of the MRSA strains to other antibiotics was also determined by E-test method. None of the 260 MRSA strains were determined to be VRSA or VISA. All were susceptible to teicoplanin and linezolid, and susceptibility rates to daptomycin, tigecycline and quinupristin-dalfopristin were 99.6%, 96.9%, and 95%, respectively. Absence of VISA and VRSA among the MRSA strains surveyed currently seemed hopeful, however, continuous surveillance is necessary. In order to prevent the development of VISA and VRSA strains the use of linezolid, tigecycline, quinupristin-dalfopristin and daptomycin should be encouraged as alternative agents of treatment of MRSA infections.
Key words: Methicillin; resistance; Staphylococcus aureus; E-test; antibiotic susceptibility; MRSA; VISA; Turkey.
Geliş Tarihi (Received): 29.10.2011 • Kabul Ediliş Tarihi (Accepted): 19.12.2011
GİRİŞ
Yoğun bakım ünitesinde görülen enfeksiyonlar yüksek mortalite ve morbidite oranlarına neden olur ve sıklıkla dirençli mikroorganizmalara bağlı olarak gelişir. Bu mikroorganizmalardan birisi de metisiline dirençli Staphylococcus aureus (MRSA) olup, nozokomiyal enfeksiyonların başlıca etkenlerinden biridir1. Türkiye'de nozokomiyal enfeksiyonların yaklaşık %30-38'i MRSA ile ilişkilidir2. MRSA enfeksiyonlarının tedavisinde vankomisinin sık kullanımı sonucunda, yakın zamanda dünyanın çeşitli bölgelerinden vankomisine orta duyarlı S.aureus (VISA) ve vankomisine dirençli S.aureus (VRSA) suşları bildirilmiştir3,4,5,6,7,8,9. Bu etkenlerin neden olduğu enfeksiyonların tedavisinde kullanılabilecek antibiyotikler; teikoplanin, linezolid, tigesiklin, kinupristin-dalfopristin ve daptomisindir10,11. "Clinical and Laboratory Standards Institute CLSI)", vankomisin direncini saptamada disk difüzyon yöntemini önermemekte; bu amaçla vankomisin agar tarama yöntemi, sıvı mikrodilüsyon veya E-test yöntemlerinin kullanılması gerektiğini belirtmektedir12. Vankomisin için minimum inhibitör konsantrasyonu (MİK) değeri 4-8 µg/ml olan suşlar VISA; MİK ≥ 16 µg/ml olan suşlar ise VRSA olarak kabul edilmektedir12.
Bu çalışmada, ülkemizin farklı coğrafi bölgelerinde yer alan sekiz ildeki hastanelerin yoğun bakım ünitelerinde yatan hastalardan izole edilen MRSA suşları içerisinde, VISA ve VRSA suşlarının varlığının belirlenmesi ve izolatların vankomisin, teikoplanin, linezolid, tigesiklin, kinupristin-dalfopristin ve daptomisin için MİK değerlerinin E-test yöntemiyle saptanması amaçlanmıştır.
GEREÇ ve YÖNTEM
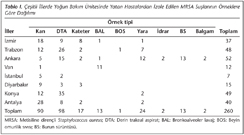
Bu çalışma 2008-2009 yılları arasında Refik Saydam Hıfzıssıhha Merkezi Başkanlığı, Salgın Hastalıklar Araştırma Müdürlüğü Laboratuvarında gerçekleştirildi. Çalışmaya, Türkiye'deki yedi coğrafi bölgeden, Ankara, Konya, Antalya, İstanbul, İzmir, Diyarbakır, Van ve Trabzon olmak üzere toplam sekiz ilden gönderilen ve yoğun bakım ünitesinde yatan her bir hastadan izole edilen toplam 260 MRSA suşu dahil edildi (Tablo I). Suşlar, çalışmaya katılan dokuz merkezden (altı üniversite, üç eğitim ve araştırma hastanesi), yağsız süt içeren kriyoviyal tüpler veya boncuklu tüplerle soğuk zincir taşıma kurallarına uyularak gönderildi ve çalışma gününe kadar -20°C'de saklandı.
Çalışılacağı zaman MRSA suşlarının kanlı agar besiyerine taze pasajları yapıldı. Pasaj sonrasında izole edilen tek kolonilerin metisilin direncini doğrulamak amacıyla oksasilin tuz agarı tarama yöntemi uygulandı. Bu amaçla; kanlı agarda 24 saat inkübe edilen S.aureus kolonilerinden örnek alınarak Mueller-Hinton sıvı (MHB) besiyerinde doğrudan koloni süspansiyonu yöntemiyle 0.5 McFarland bulanıklık standardına ayarlanan inokülum, NaCl (%4 w/v; 0.68 mol/L) ve 6 µg/ml oksasilin içeren Mueller-Hinton agara 10-15 mm çapında inoküle edilerek 35°C'de 24 saat inkübe edildi. Küçük kolonilerin (> 1 koloni) veya zayıf (ince) üremenin saptanması MRSA olarak değerlendirildi13.
MRSA izolatları arasında vankomisin direncinin taranması amacıyla vankomisin agar tarama yöntemi uygulandı. Kanlı agarda 24 saat inkübe edilen S.aureus kolonilerinden inokülum hazırlandı. MHB besiyerinde doğrudan koloni süspansiyonu yöntemiyle 0.5 McFarland bulanıklık standardına ayarlanan inokülum, 6 µg/ml vankomisin içeren beyin-kalp infüzyon agar besiyerine bir eküvyon yardımıyla 10-15 mm çapında ekildi. Plaklar 35°C'de 24 saat inkübe edildi ve azalmış vankomisin duyarlılığını düşündürecek küçük kolonilerin (> 1 koloni) veya zayıf (ince) üremenin varlığı açısından incelendi. Birden fazla sayıda koloni ya da ince üreme saptanması vankomisine azalmış duyarlılık olarak değerlendirildi13 ve doğrulanmak üzere E-test yöntemiyle MİK değerleri saptandı.
E-test yöntemi için; kanlı agarda 24 saat inkübe edilen S.aureus suşlarından, MHB besiyerinde 0.5 McFarland bulanıklık standardına göre hazırlanan bakteri süspansiyonu, 150 mm'lik Mueller-Hinton agar plakları üzerine inoküle edildi. Plak yüzeyine E-test şeritleri yerleştirildi ve plaklar 35°C'de 24 saat inkübe edildikten sonra MİK değerleri saptandı. Tüm değerlendirmeler CLSI kriterlerine göre gerçekleştirildi12,14.
Kalite kontrol suşları olarak Enterococcus faecalis ATCC 51299 (vankomisine dirençli) ve S.aureus ATCC 29213 (vankomisine duyarlı) kullanıldı.
BULGULAR
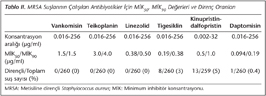
Çalışmaya alınan toplam 260 MRSA suşu arasında VISA ve VRSA varlığı saptanmamıştır. MRSA suşlarının hepsi vankomisin, teikoplanin ve linezolide duyarlı bulunmuş; suşların %99.6 (259/260)'sının daptomisine, %96.9 (252/260)'unun tigesikline, %95 (246/259)'inin ise kinupristin-dalfopristine duyarlı olduğu belirlenmiştir. Suşların MİK50 ve MİK90 değerleri Tablo II'de görülmektedir.
TARTIŞMA
Gram-pozitif bakterilerde direnç oranlarındaki artış ve antimikrobiyal tedavi seçeneklerindeki sınırlılık, tedavide önemli kısıtlamalara neden olmuştur. MRSA gibi çoklu ilaca dirençli bakterilerin neden olduğu enfeksiyonlar özellikle sorun oluşturur10. Vankomisinin MRSA enfeksiyonlarında yaygın olarak kullanımı pek çok ülkede vankomisin duyarlılığında azalmaya yol açmıştır. Japonya'da ilk olarak 1997 yılında bildirilen VISA suşundan sonra, glikopeptidlere dirençli stafilokok suşları önemli bir endişe kaynağı haline gelmiştir. Aynı yıllarda heterodirençli VISA (hVISA) olarak tanımlanan yeni bir vankomisin direnci tanımlanmıştır3,4. "Centers for Disease Control and Prevention (CDC)" tarafından ilk VRSA suşunun bildirimini takiben, dünyadaki çok sayıda laboratuvardan da VRSA suşları bildirilmiştir5,6,7,8,9. Vankomisine orta duyarlı S.aureus (VISA) ve hVISA suşları Türkiye'den de rapor edilmiştir15,16.
Glikopeptid tedavisi sırasında VISA ve hVISA suşlarına bağlı olarak tedavi başarısızlıkları olduğu bildirilmiştir. Bu nedenle nozokomiyal enfeksiyonlardan izole edilen MRSA suşlarının vankomisin duyarlılığı açısından uygun yöntemlerle dikkatlice test edilmesi önerilmektedir. İlaveten VISA, hVISA ve VRSA ile enfekte hastalar izole edilmeli ve enfeksiyon kontrol önlemleri uygulanmalıdır10.
Sunduğumuz çalışmada, yoğun bakım ünitesinde yatan hastalardan izole edilen MRSA suşlarının hiçbirinde vankomisine duyarlılığı azalmış suşlar veya vankomisine dirençli suşlar saptanmamıştır. Benzer şekilde suşların tamamı vankomisin, teikoplanin ve linezolide duyarlıdır. Yakın zamanda gram-pozitif bakteri enfeksiyonlarının tedavisi için linezolid, tigesiklin, kinupristin-dalfopristin ve daptomisin gibi yeni antibiyotikler geliştirilmiştir11. Çalışmamızda MRSA suşlarının bu yeni antibiyotiklere karşı da duyarlılıkları araştırılmış; daptomisin, tigesiklin ve kinupristin-dalfopristine duyarlılık oranları sırasıyla %99.6, %96.9 ve %95 olarak bulunmuştur. Sunulan çalışmada, diğer araştırıcıların bildirdiği gibi MRSA suşlarında linezolide %100 duyarlılık saptanmıştır17,18. Ancak bazı araştırıcılar, MRSA suşlarında linezolide %0.1 oranında direnç bildirmektedirler19,20.
Yapılan çalışmaların çoğunda MRSA suşlarında tigesikline direnç saptanmazken18,21, bazı çalışmalarda %2'den daha az oranda direnç bildirilmiştir14,22. Ülkemizden Öksüz ve arkadaşları23, MRSA suşlarında E-test yöntemiyle yaptıkları çalışmada tigesikline %2 oranında direnç bildirmişlerdir. Çalışmamızda saptadığımız %3 oranındaki tigesiklin direnci, ülkemizde ve yurt dışında yapılan çalışmaların sonuçlarıyla uyumludur. MRSA izolatlarında kinupristin-dalfopristin direncini Baysallar ve arkadaşları24 %2, Tünger ve arkadaşları19 ise %2.3 olarak belirtmektedir. Bizim çalışmamızda saptanan kinupristin-dalfopristin direnç oranı (%5), diğer çalışmalarda bildirilen %0-2.5 arasındaki direnç oranından biraz yüksektir17,25.
Geniş sayıda yapılan çalışmalarda, daptomisinin etkinliğinin çok iyi olduğu gösterilmiştir, ancak uzun dönem tedavide direnç geliştiği bildirilmiştir18,26,27,28. Afşar ve arkadaşları29 kan kültüründen izole edilen 64 MRSA suşunun tamamını daptomisine duyarlı olarak belirlemişlerdir (MİK ≤ 1 µg/ml). Suşların MİK50 ve MİK90 değerleri sırasıyla; 0.125, 0.5 ve 0.125-1 µg/ml olarak saptanmıştır. Sadece bir suşta daptomisin MİK değeri 1 µg/ml olarak bildirilmiştir.
Çalışmamızda toplam 260 suşun sadece 1 (%0.38)'inde daptomisin direnci saptanmıştır. Ülkemizde yapılan çalışmalarda daptomisine direnç bildirilmemiştir. Sunduğumuz çalışma, Türkiye'de daptomisine direncin bildirildiği ilk çalışma olup, saptanan direnç oranı yurt dışından bildirilen oranlarla uyumludur. Nitekim Fransa ve İspanya'da yapılan çalışmalarda, birer MRSA suşunda daptomisin direnci saptanmıştır30,31.
Sonuç olarak çalışmamızda, ülkemizin farklı bölgelerindeki hastanelerin yoğun bakım ünitelerinde yatan hastalardan izole edilen MRSA suşları arasında VISA ve VRSA varlığına rastlanmamıştır. Glikopeptid grubu antibiyotikler MRSA enfeksiyonlarının tedavisinde ilk seçenektir; ancak VISA ve VRSA suşlarının gelişimini önlemek için tedavide linezolid, kinupristin-dalfopristin, daptomisin ve tigesiklin gibi in vitro duyarlılık oranları yüksek yeni antibiyotiklerin seçenek olarak kullanılmasının yararlı olacağı kanısına varılmıştır.
KAYNAKLAR
- Fridkin SK, Welbel SF, Weinstein RA. Magnitude and prevention of nosocomial infections in the intensive care unit. Infect Dis Clin North Am 1997; 11(2): 479-96. [Özet]
- Sande-Bruinsma NV, Grundmann H, Verloo D, et al. Antimicrobial drug use and resistance in Europe. Emerg Infect Dis 2008; 14(11): 1722-30. [Özet] [Tam Metin] [PDF]
- Hiramatsu K, Aritaka N, Hanaki H, et al. Dissemination in Japanase hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin. Lancet 1997; 350(9092): 1670-3. [Özet]
- Hiramatsu K, Hanaki H, Ino T, Yabuta K, Oguri T, Tenover FC. Methicillin-resistant Staphylococcus aureus clinical strain with reduced susceptibility. J Antimicrob Chemother 1997; 40(1): 135-6. [PDF]
- Centers for Disease Control and Prevention. Staphylococcus aureus resistant to vancomycin- United States 2002. MMWR 2002; 51(26): 565-7. [Özet] [Tam Metin]
- Tiwari HK, Sen MR. Emergence of vancomycin resistant Staphylococcus aureus (VRSA) from a tertiary care hospital from northern part of India. BMC Infect Dis 2006; 6: 156. [Özet] [Tam Metin] [PDF]
- Tenover FC, Weigel LM, Appelbaum PC, et al. Vancomycin-resistant Staphylococcus aureus isolate from a patient in Pennsylvania. Antimicrob Agents Chemother 2004; 48(1): 275-80. [Özet] [Tam Metin] [PDF]
- Sievert DM, Rudrik JT, Patel JB, McDonald LC, Wilkins MJ, Hageman JB. Vancomycin-resistant Staphylococcus aureus in the United States, 2002-2006. Clin Infect Dis 2008; 46(5): 668-74. [Özet] [Tam Metin] [PDF]
- Aligholi M, Emaneini M, Jabalameli F, Shahsavan S, Dabiri H, Sadaght H. Emergence of high-level vancomycin-resistant Staphylococcus aureus in the Imam Khomeini Hospital in Tehran. Med Princ Pract 2008; 17(5): 432-4. [Özet]
-
Appelbaum PC. MRSA the tip of the iceberg. Clin Microbiol Infect 2006;
12(Suppl 2): 3-10.
[Özet] [Tam Metin] [PDF] - Garau J, Bouza E, Chastre J, Gudiol F, Harbarth S. Management of methicillin-resistant Staphylococcus aureus infections. Clin Microbiol Infect 2009; 15(2): 125-36. [Özet] [Tam Metin] [PDF]
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Nineteenth Information Supplement, 2009. M100-S19. CLSI, Wayne, PA.
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved Standard, M7-A7. 2006, 7th ed. CLSI, Wayne, PA.
- Mendes RE, Sader HS, Deshpande L, Jones RN. Antimicrobial activity of tigecycline against community-acquired methicillin-resistant Staphylococcus aureus isolates recovered from North American Medical Centers. Diagn Microbiol Infect Dis 2008; 60(4): 433-6. [Özet]
-
Sancak B, Ercis S, Menemenlioglu D, Colakoglu S, Hascelik G.
Methicillin-resistant Staphylococcus aureus heterogeneously resistant to
vancomycin in a Turkish university hospital. J Antimicrob Chemother 2005;
56(3): 519-23.
[Özet] [Tam Metin] [PDF] - Nakipoglu Y, Derbentli S, Cagatay AA, Katranci H. Investigation of Staphylococcus strains with heterogeneous resistance to glycopeptides in a Turkish university hospital. BMC Infect Dis 2005; 5: 31. [Özet] [Tam Metin] [PDF]
- Millan L, Cerda P, Rubio MC, et al. In vitro activity of telithromycin, quinupristin/dalfopristin, linezolid and comparator antimicrobial agents against Staphylococcus aureus clinical isolates. J Chemother 2004; 16(3): 230-7. [Özet]
- Denis O, Deplano A, Nonhoff C, et al. In vitro activities of ceftobiprole, tigecycline, daptomycin, and 19 other antimicrobials against methicillin-resistant Staphylococcus aureus strains from a national survey of Belgian hospitals. Antimicrob Agents Chemother 2006; 50(8): 2680-5. [Özet] [Tam Metin] [PDF]
- Tunger A, Aydemir S, Uluer S, Cilli F. In vitro activity of linezolid & quinupristin/dalfopristin against gram-positive cocci. Indian J Med Res 2004; 120(6): 546-52. [Özet] [PDF]
- Dizbay M, Sipahi AB, Günal Ö ve ark. Metisiline dirençli Staphylococcus aureus izolatlarında glikopeptid ve linezolid direncinin araştırılması. ANKEM 2007; 21(1): 23-6. [Özet] [PDF]
-
Kresken M, Leitner E, Seifert H, Peters G, von Eiff C. Susceptibility of
clinical isolates of frequently encountered bacterial species to tigecycline
one year after the introduction of this new class of antibiotics: results of
the second multicentre surveillance trial in Germany (G-TEST II, 2007). Eur J
Clin Microbiol Infect Dis 2009; 28(8): 1007-11.
[Özet] [Tam Metin] [PDF] - Kaya O, Akçam FZ, Temel EN. In vitro activities of linezolid and tigecycline against methicillin- resistant Staphylococcus aureus strains. Microb Drugs Resist 2008; 14(2): 151-3. [Özet]
- Öksüz L, Gürler N. Klinik örneklerden izole edilen metisiline dirençli stafilokok suşlarının son yıllarda kullanıma giren antibiyotiklere in-vitro duyarlılık sonuçları. ANKEM 2009; 23(2): 71-7. [Özet] [PDF]
- Kılıç A, Baysallar M, Küçükkaraaslan A, Aydoğan H, Doğancı L. Metisiline dirençli Staphylococcus aureus suşlarının kinupristin/dalfopristine in vitro duyarlılığı. İnfeksiyon Dergisi 2004; 18: 453-6.
- Abb J. In vitro activity of linezolid, quinupristin-dalfopristin, vancomycin, teicoplanin, moxifloxacin and mupirocin against methicillin-resistant Staphylococcus aureus: comparative evaluation by the E-test and a broth microdilution method. Diagn Microbiol Infect Dis 2002; 43(4): 319-21. [Özet]
- Picazo JJ, Betriu C, Culebras E, Rodriguez-Avial I, Gomez M, Lopez F; VIRA Study Group. Activity of daptomycin against staphylococci collected from bloodstream infections in Spanish Medical Centers. Diagn Microbiol Infect Dis 2009; 64(4): 448-51. [Özet]
- Mangili A, Bica I, Snydman DR, Hamer DH. Daptomycin-resistant, methicillin-resistant Staphylococcus aureus bacteremia. Clin Infect Dis 2005; 40(7): 1058-60. [Özet] [Tam Metin] [PDF]
- Skiest DJ. Treatment failure resulting from resistance of Staphylococcus aureus to daptomycin. J Clin Microbiol 2006; 44(2): 655-6. [Özet] [Tam Metin] [PDF]
- Afşar İ, Güngör S, Şener AG, Demirci M. Daptomisinin kan kültürlerinden izole edilen metisiline dirençli Staphylococcus aureus suşlarına in vitro etkinliği. Mikrobiyol Bul 2011; 45(4): 755-7. [Özet] [Tam Metin] [PDF]
- Picazo JJ, Betriu C, Rodriguez-Avial I, et al. Comparative activity of daptomycin against clinical isolates of methicillin-resistant Staphylococcus aureus and coagulase-negative staphylococci. Enferm Infecc Microbiol Clin 2010; 28(1): 13-6. [Özet]
- Sotto A, Laouini D, Bouziges N, Jourdan N, Richard JL, Lavigne JP. In vitro activity of daptomycin against strains isolated from diabetic foot ulcers. Pathol Biol (Paris) 2010; 58(1): 73-7. [Özet]
İletişim (Correspondence):
Doç. Dr. Salih Cesur,
Ankara Eğitim ve Araştırma Hastanesi,
Enfeksiyon Hastalıkları ve
Klinik Mikrobiyoloji Kliniği,
Ulucanlar, Ankara, Türkiye.
Tel (Phone): +90 312 595 3000,
E-posta (E-mail): scesur89@yahoo.com