Pseudomonas aeruginosa Suşlarında
Antibiyotik Duyarlılık Oranları ve
Beta-Laktam Direnç Mekanizmalarının Tiplendirilmesi
Antibiotic
Susceptibility Rates and Beta-Lactam
Resistance Mechanisms of Pseudomonas aeruginosa Strains
Zerrin AKTAŞ1, Dilek SATANA1, Çiğdem KAYACAN1, Barış CAN2, Nevriye GÖNÜLLÜ3, Ömer KÜÇÜKBASMACI3
1 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
1 Istanbul University Faculty of Istanbul Medicine, Department of Medical Microbiology, Istanbul, Turkey.
2 TEV Sultanbeyli Devlet Hastanesi, Tıbbi Mikrobiyoloji Laboratuvarı, İstanbul.
2 TEV Sultanbeyli State Hospital, Medical Microbiology Laboratory, Istanbul, Turkey.
3 İstanbul Üniversitesi Cerrahpaşa Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
3 Istanbul University Faculty of Cerrahpasa Medicine, Department of Medical Microbiology, Istanbul, Turkey.
ÖZET
Pseudomonas aeruginosa bakteremi, deri ve yara enfeksiyonları, özellikle kistik fibrozlu hastalarda pulmoner hastalıklar, nozokomiyal üriner sistem enfeksiyonları, endokardit ve menenjit gibi ciddi ve hayatı tehdit eden enfeksiyonların en iyi bilinen etkenlerinden biridir. P.aeruginosa'da geniş spektrumlu beta-laktamlara direncin başlıca nedenleri sefalosporinazların aşırı sentezlenmesi ve/veya Sınıf A, B ve D beta-laktamazlardır. Son zamanlarda PER-1 enzimi Türkiye, Fransa, İtalya, Romanya, Macaristan, Belçika, Rusya, Güney Kore ve Hindistan'dan bildirilmiştir. OXA tipi beta-laktamazlar da, P.aeruginosa'nın klinik izolatlarında çeşitli coğrafik bölgelerden artan oranlarda bildirilmektedir. Bu çalışmada, çeşitli klinik örneklerden izole edilen P.aeruginosa suşlarının antibiyotiklere duyarlılıklarının belirlenmesi ve beta-laktam direncine neden olan beta-laktamaz enzimlerinin tiplendirilmesi amaçlanmıştır. Çeşitli klinik örneklerden (37 idrar, 21 kan, 10 balgam, 5 bronkoalveoler lavaj, 5 apse, 5 yara sürüntüsü, 4 endotrakeal aspirat, 3 boğaz sürüntüsü, 2 kateter ucu, 1 plevra, 1 batın içi sıvısı) izole edilen toplam 100 P.aeruginosa suşu çalışmaya alınmıştır. Suşların çeşitli antibiyotiklere karşı duyarlılıkları "Clinical and Laboratory Standards Institute (CLSI)" önerilerine göre disk difüzyon ve agar dilüsyon yöntemiyle araştırılmış; beta-laktamaz enzimlerinin saptanmasında izoelektrik odaklama (IEF) yöntemi kullanılmıştır. Suşların PSE, PER-1, OXA-10 benzeri beta-laktamaz genleri ve MEX-R genleri polimeraz zincir reaksiyonu (PCR) ile araştırılmıştır. Çalışmamızda, MİK90 değerlerine göre en etkili antibiyotiğin imipenem (8 µg/ml) olduğu görülmüş; amikasin, siprofloksasin, sefepim, sefpirom, piperasilin + tazobaktam, piperasilin, seftazidim, tikarsilin, aztreonam ve tikarsilin + klavulanik asit için MİK90 değerleri sırasıyla; 32, 64, 64, 64, 128/4, 512, 512, 512, 512, 512/2 µg/ml olarak bulunmuştur. Çift disk sinerji yöntemiyle izolatların yedisinde genişlemiş spektrumlu beta-laktamaz pozitifliği saptanmıştır. İzolatların %10'u imipeneme duyarlı, %9'u orta duyarlı olarak tespit edilmiştir. Bu suşlarda metallo-beta-laktamaz (MBL) enziminin varlığı MBL E-test yöntemiyle araştırılmış ve fenotipik olarak bu enzimin varlığı gözlenmemiştir. PCR yöntemiyle P.aeruginosa suşlarının %11'inde PER-1, %11'inde OXA-10 benzeri, %4'ünde ise PER- ve OXA-10 benzeri beta-laktamaz varlığı aynı anda saptanmıştır. Suşların hiçbirinde PSE geni bulunmamış; MEX-R geni ise izolatların %52'sinde gösterilmiştir. P.aeruginosa suşlarında saptanan direnç oldukça kompleks yapıdadır. Direnç mekanizmalarının belirlenmesi, antimikrobiyal tedavinin doğru ve uygun şekilde seçilmesine ve birçok antibiyotiğin daha uzun yıllar kullanımına olanak sağlayacak, dirençli suşların ortaya çıkmasını azaltacaktır.
Anahtar sözcükler: Pseudomonas aeruginosa; PER-1; OXA tipi beta-laktamaz; MEX-R; direnç geni.
ABSTRACT
Pseudomonas aeruginosa is a well-known cause of severe and potentially life-threatening infections including bacteremia, skin and wound infections, pulmonary disease, especially among indivuals with cycstic fibrosis, nosocomial urinary tract infections, endocarditis and meningitis. The mechanism of resistance to broad-spectrum beta-lactams in P.aeruginosa are overexpression of cephalosporinases and/or class A, B and D beta-lactamases. Recently PER-1 type beta-lactamase has been reported from Turkey, France, Italy, Romania, Hungary, Belgium, Russia, South Korea and India. OXA beta-lactamases have increasingly been reported in clinical strains of P.aeruginosa from various geographical origins. This study was aimed to investigate the antibiotic susceptibility of various P.aeruginosa clinical strains and to define the beta-lactamase enzymes leading to resistance. In this study, a total of 100 P.aeruginosa strains isolated from various clinical specimens (37 urine, 21 blood, 10 sputum, 5 bronchoalveolar lavage, 5 abscess, 5 wound swabs, 4 endotracheal aspirate, 3 throat swabs, 2 catheter tips, one of each pleural and peritoneal fluid) were included. According to Clinical and Laboratory Standards Institute (CLSI) recommendations, susceptibilities of isolates to various antibiotics were investigated by disk diffusion and agar dilution method, and beta-lactamase enzymes were detected by isoelectric focusing (IEF) method. PSE, PER-1, OXA-10-like beta-lactamase genes and MEX-R genes of isolates were investigated by polymerase chain reaction (PCR). According to MIC90 values, the most effective antibiotics were found to be imipenem (8 µg/ml). The MIC90 values of amikacin, ciprofloxacin, cefepime, cefpirome, piperacillin + tazobactam, piperacillin, ceftazidime, ticarcilin, aztreonam and ticarcilin + clavulanic acid were 32, 64, 64, 64, 128/4, 512, 512, 512, 512 and 512/2 µg/ml, respectively. Seven of the isolates were found to be ESBL positive by double-disk synergy method. It was detected that 10% of the isolates were imipenem-susceptible and 9% were intermediate susceptible. Phenotypical investigation of metallo-beta-lactamase enzyme in these strains by MBL E-test method did not reveal a positive result. PER-1 and OXA-10 like beta-lactamases were detected each in 11% of the isolates, and co-presence of PER-like and OXA-10 like enzymes were shown in 4% of the isolates. PSE gene was not found in any of the strains. The MEX-R gene was identified in 52% of the isolates. Antibiotic resistance mechanisms in P.aeruginosa strains seems to be complex. Determination of the resistance mechanisms and antibiotic susceptibility rates in P.aeruginosa will guide the proper antimicrobial therapy, reducing the emergence of resistant strains.
Key words: P.aeruginosa; PER-1; OXA-like beta-lactamase gene; MEX-R gene.
Geliş Tarihi (Received): 26.01.2012 • Kabul Ediliş Tarihi (Accepted): 22.04.2012
GİRİŞ
Pseudomonas aeruginosa'da tikarsilin direnci C sınıfındaki sefalosporinazların aşırı üretimi, MexA-MexB-OprM efluks sisteminin fazla eksprese edilmesi veya hareketli genetik elementlerin kodladığı beta-laktamazların sentezlenmesine bağlı olarak gelişebilir. Daha sıklıkla karşılaşılan bu enzimler PSE (CARB) grubunun (Ambler sınıf A) karbenisilinaz ve oksasilinaz (Ambler sınıf D) enzimleridir. Bu enzimler karboksipenisilinler ve üreidopenisilinlere direnç gelişmesine neden olur. P.aeruginosa'da günümüze kadar dört adet PSE enzimi [PSE-1 (CARB-2), PSE-4 (CARB-1), CARB-3 ve CARB-4] bildirilmiştir. PSE-1, PSE-4 ve CARB-3 birbirlerinden bir veya iki aminoasit değişikliğiyle farklıdır ve CARB-4 ile %86.3 oranında benzerlik gösterir1.
Genişlemiş spektrumlu beta-laktamazlar (GSBL) (sınıf A/grup 2be enzimler) özellikle Enterobacteriaceae üyelerinde bulunmakla birlikte, 1980'li yıllardan beri P.aeruginosa suşlarında da bildirilmekte ve giderek yaygınlaşmaktadır. Bu tür enzimler üçüncü kuşak sefalosporinleri hidrolize eder ve P.aeruginosa'da günümüze kadar birçok enzim bildirilmiştir. Bunlar TEM, SHV ve bunların türevleri (TEM-4, TEM-21, TEM-42, SHV-2A, SHV-5, SHV-12), PER-1, VEB-1, GES-1, GES-2 ve IBC tipi beta-laktamazlardır2.
PER-1 enzimi sıklıkla ülkemizden, VEB tipi beta-laktamazlar Güneydoğu Asya ülkelerinden, GES ve IBC tipi beta-laktamazlar ise Fransa, Yunanistan ve Güney Afrika'dan bildirilmiştir2,3. Bu türde esas olarak Ambler grup D'de yer alan ve daha çok P.aeruginosa'da bulunanan OXA tipi (sınıf D) GSBL'ler yer almaktadır ve bu grupta beş farklı oksasilinaz bildirilmiştir. Beta-laktamaz inhibitörleri tarafından zayıf bir biçimde inhibe edilirler. OXA-I grubu OXA-5, OXA-7, OXA-10 ve türevleri (OXA-11, OXA-14, OXA-16, OXA-17) ile OXA-13 ve türevlerini (OXA-19, OXA-28); OXA-II grubu OXA-2, OXA-3, OXA-15 ve OXA-20'yi; OXA-III grubu OXA-1, OXA-4, OXA-30 ve OXA-31'i; OXA-IV grubu OXA-9'u; OXA-V grubu ise LCR-1 enzimini içerir4,5,6,7. Bu beş gruptan başka OXA-18 diğer oksasilinazlarla çok düşük aminoasit benzerliği gösterir8. Klavulanik asit ve geniş spektrumlu sefalosporinlerin kullanıldığı çift disk sinerji testi Enterobacteriaceae türlerinde GSBL varlığının gösterilmesi için duyarlı ve özgül bir yöntem olmasına karşın, P.aeruginosa'daki uygulaması açısından standardize edilmemiştir ve CLSI'nın9 önerileri halen bu bakteriyi kapsamamaktadır. Başarılı olamama nedenleri arasında; kromozomal enzimlerin aşırı üretimi sonucunda çift disk sinerji testinde yalancı negatif sonuç alınması, izolatın aynı zamanda metallo-beta-laktamaz (IMP, VIM, SPM ve GIM ailesi üyeleri gibi), genişlemiş spektrumlu oksasilinaz veya GES-2 gibi klavulanik aside göreceli olarak dirençli bir başka beta-laktamaz üretmesi, geçirgenlikte azalma veya aktif pompa sistemleri gibi diğer direnç mekanizmalarının varlığı sayılabilir. Bazı durumlarda imipenemin AmpC tipi enzimleri indüklemesi, bu sinerjinin görülmesini engelleyebilir. İzolatların direnç/duyarlılık fenotipleri, izoelektrik odaklama yöntemi enzim tipleri açısından yol gösterici olmaktadır. Tanımlama için enzim kinetikleri, substrat hidroliz ve inhibisyon özellikleri spektrofotometrik yöntemlerle saptanabilir. Yaygın olarak uygulanmakla beraber izoelektrik noktalar sadece enzim ailesi hakkında bir fikir verebilir.
Bu çalışmada, klinik örneklerden izole edilen P.aeruginosa suşlarının çeşitli antibiyotiklere duyarlılıklarının belirlenmesi; beta-laktamaz enzimlerinin saptanması; PSE, PER-1, OXA-10-benzeri beta-laktamaz genleri ve MEX-R genlerinin araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, laboratuvarımıza gönderilen çeşitli klinik örneklerden izole edilen 100 P.aeruginosa suşu alındı. Suşların tanımlaması; koloni morfolojisi, Gram boyama, hareket testi, oksidaz testi, üç şekerli (TSI) besiyerini fermente etme özelliği, 42°C'de üreme özelliği, pigment oluşturma, yeşil pigmentin kloroformda erime özelliği ve gerektiğinde API GN kiti (BioMerieux, Fransa) kullanılarak yapıldı.
Suşların; piperasilin, piperasilin + tazobaktam, seftazidim, tikarsilin, tikarsilin + klavulanik asit, sefepim, aztreonam, sefpirom, imipinem, amikasin ve siprofloksasine karşı minimum inhibitör konsantrasyonu (MİK) değerleri, agar dilüsyon yöntemiyle CLSI9 önerileri doğrultusunda araştırıldı.
Çift disk sinerji yönteminde; izolatların McFarland 0.5 standardı yoğunluğuna göre hazırlanan süspansiyonları Mueller-Hinton agar plağına yayıldı. Plağın ortasına bir amoksisilin-klavulanik asit diski (AMC; 20/10 µg) ile etrafına disk merkezleri arasındaki uzaklık 20 mm olacak şekilde seftazidim (30 µg), aztreonam (30 µg) ve sefepim (30 µg) diskleri yerleştirildi. Bir gece 35°C'de inkübasyondan sonra, sefalosporin veya aztreonam etrafındaki inhibisyon zonunun AMC diskine doğru genişlemesi veya arada bakterinin üremediği bir sinerji alanının bulunması, GSBL varlığı olarak değerlendirildi.
Agarda dilüsyon yönteminde piperasilin ve tikarsilinin MİK değerleri, hem tek başlarına kullanılarak hem de klavulanik asit (4 µg/ml) ve tazobaktam (2 µg/ml) varlığında saptandı. Klavulanik asit ve tazobaktam varlığında MİK değerlerinde ≥ 3 dilüsyon (sekiz kat) azalma GSBL göstergesi olarak kabul edildi. İmipeneme direnç saptanan suşlarda metallo-beta-laktamaz (MBL) varlığı E-test yöntemiyle araştırıldı. Bu yöntemde bir ucunda 4-256 µg/ml konsantrasyonda imipenem, diğer ucunda 1-64 µg/ml konsantrasyonda imipenem + EDTA içeren E-test şeritleri (AB Biodisk, İsveç) kullanıldı. İnhibisyon zonunun şeridi kestiği nokta antibiyotiğin mikroorganizma için MİK değeri olarak belirlendi. İmipenem ve imipenem + EDTA değerleri birbirleriyle oranlandığında, MİK değerlerinde ≥ 8 kat azalma olması MBL varlığını gösterdi10 (MBL aktivitesi GSBL'lerden farklı olarak, EDTA ile inhibe olurken, beta-laktamaz inhibitörlerinden klavulanik asit, sulbaktam ve tazobaktamla inhibe olmamaktadır). Kalite kontrol olarak P.aeruginosa ATCC 27853, Escherichia coli ATCC 25922 ve Klebsiella pneumoniae ATCC 700603 suşları kullanıldı.
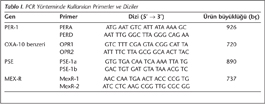
Suşlarda PER-1, OXA-10-benzeri, PSE ve MEX-R genleri, özgül primerler kullanılarak polimeraz zincir reaksiyonu (PCR) ile araştırıldı (Tablo I)11,12.
Suşlardan DNA eldesi için kaynatma yöntemi kullanıldı. Bu amaçla; bakterinin triptik soy buyyonda üremiş 18-24 saatlik saf kültüründen bir ml alınarak ependorf tüpüne aktarıldı ve 10 dakika 13.000 rpm'de çevrilerek üst sıvı atıldı. Dipte kalan çökelti üzerine 200 µl distile su ilave edilerek 10 dakika kaynatıldı ve tekrar 10 dakika 13.000 rpm'de santrifüj edildi. Daha sonra üst sıvıdan 150 µl alınarak -70°C'de saklandı. Bu çözelti kalıp DNA olarak kullanıldı.
Toplamda 50 µl olan amplifikasyon karışımı; 5 µl 10X amplifikasyon tamponu, 10 µl (2 mM) dNTP karışımı, 1.5 µl (50 pmol) primer, 5 µl (2.5 mM) MgCl2, 1 µl (1 U) Taq DNA polimeraz, 26 µl distile su ve 2 µl DNA ekstraksiyon ürünü olacak şekilde hazırlandı. Amplifikasyon programları; PER-1 için: 94°C'de 10 dakika; 94°C'de 60 saniye, 42°C'de 60 saniye, 72°C'de 60 saniye toplam 35 siklus ve sonra 72°C'de 7 dakika; OXA-10 benzeri için: 94°C'de 10 dakika; 94°C'de 60 saniye, 55°C'de 60 saniye, 72°C'de 60 saniye toplam 35 siklus ve sonra 72°C'de 7 dakika; PSE-1 ve MEX-R için: 95°C'de 5 dakika; 95°C'de 45 saniye, 50°C (PSE için) 56°C (MEX-R için)'de 45 saniye, 72°C'de 60 saniye toplam 35 siklus ve sonra 72°C'de 7 dakika olarak uygulandı. Amplifikasyon ürünleri, 0.5 M TBE ile hazırlanmış ve etidyum bromürle boyanmış %1'lik agaroz jelde yürütüldü ve ultraviyole ışık altında DNA moleküler ağırlık standardı (fx174 Hae III) ile karşılaştırılarak değerlendirildi.
İzolatların içerdikleri beta-laktamazların saptanması amacıyla izoelektrik odaklama (IEF) yöntemi kullanıldı13. Bu amaçla, triptik soy agarda üremiş bakterilerden 3-4 koloni alınarak 150 ml triptik soy buyyonda 37°C'de çalkalamalı etüvde 18 saat inkübe edildi. Bakteri kültürleri +4°C'de 4000 rpm'de 30 dakika santrifüj edilerek üst sıvı atıldı ve bakteri çökeltisi %1 glisin içinde süspanse edilerek sonike edildi. Sonikatlar 14.000 rpm, +4°C'de 30 dakika santrifüj edildi ve beta-laktamaz enzimlerini içeren üst sıvı alınarak -70°C'de saklandı. Enzim ekstreleri amfolenli (pH= 3.5-10) poliakrilamid jellerde [Model 111 MINI IEF Cell (Bio-Rad) cihazı] yürütüldükten sonra enzim bantları nitrosefin çözeltisi emdirilmiş filtre kağıtları yardımıyla görünür hale getirildi. İzoelektrik noktalar (pI), referans proteinler (IEF standards; Bio-Rad) ve daha önce pI değerleri bilinen enzimler (TEM-1= 5.4; TEM-8= 5.6; SHV-3= 7; CMY-1= 8; CMY-2= 9) ile karşılaştırılarak değerlendirildi.
BULGULAR
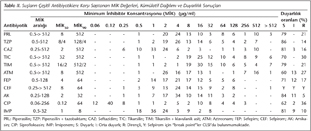
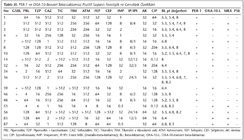
Çalışmaya alınan P.aeruginosa suşları; idrar (n= 37), kan (n= 21), balgam (n= 10), bronkoalveoler lavaj (n= 5), apse (n= 5), yara sürüntüsü (n= 5), endotrakeal aspirat (n= 4), boğaz sürüntüsü (n= 3), kateter ucu (n= 2), plevra (n= 1) ve batın içi sıvısı (n= 1) örneklerinden izole edilmiştir. İzolatların antibiyotiklere karşı saptanan MİK değerlerinin kümülatif dağılımı ve antibiyotik duyarlılık sonuçları Tablo II'de verilmiştir. Suşların antibiyotiklere karşı agar dilüsyon yöntemiyle saptanan MİK değerleri; imipeneme orta duyarlı ve dirençli suşlarda MBL aktivitesini saptamak için kullanılan E-test yöntemiyle belirlenen imipenem/imipenem + EDTA MİK sonuçları, çift disk sinerji yöntemiyle saptanan GSBL pozitifliği; IEF yöntemiyle saptanan enzimlerin pI değerleri; PCR yöntemiyle PER-1, OXA-10-benzeri, PSE ve MEX-R genlerinin varlığı ise Tablo III'te gösterilmiştir.
MİK90 değerlerine göre en etkili antibiyotikler imipenem (8 µg/µl) > amikasin (32 µg/ml) > siprofloksasin = sefepim = sefpirom (64 µg/ml) > piperasilin + tazobaktam (128/4 µg/ml) > piperasilin = seftazidim = tikarsilin = aztreonam (512 µg/ml) = tikarsilin + klavulanik asit (512/2 µg/ml) olarak bulunmuştur.
Çift disk sinerji yöntemiyle izolatların yedisinde GSBL pozitifliği belirlenmiştir. İzolatların %10'u imipeneme duyarlı, %9'u orta duyarlı olarak saptanmıştır. Bu suşlarda ayrıca MBL varlığı MBL E-test yöntemiyle araştırılmış ve fenotipik olarak bu enzimin varlığı gözlenmemiştir.
İzoelektrik odaklama yöntemiyle suşların 42'sinde tek bant, 20'sinde iki bant, sekizinde üç bant, ikisinde dört bant, birinde beş bant, ikisinde altı bant belirlenmiş; 25 suşta ise bant saptanamamıştır.
PCR yöntemiyle suşların hiçbirinde PSE geni saptanamamış; 52'sinde Mex-R geni tespit edilmiştir. İzolatların 11'inde PER-1, 11'inde OXA-10-benzeri beta-laktamaz varlığı izlenmiş; üç izolatta ise PER-1 ve OXA-10-benzeri beta-laktamaz aynı anda saptanmıştır. PER-1 pozitif olarak saptanan 11 suştan bir tanesi seftazidime ve amikasine duyarlı diğer beta-laktam antibiyotiklere dirençli olarak bulunmuştur. OXA-10-benzeri beta-laktamaz pozitifliği saptanan 11 suştan altısının seftazidime duyarlı olduğu belirlenmiştir. Ayrıca, bir suşun test edilen bütün antibiyotiklere duyarlı olduğu gözlenmiştir.
TARTIŞMA
P.aeruginosa çeşitli beta-laktam antibiyotiklere intrensek dirençli olmasının yanı sıra diğer birçok mekanizma (örn. azalmış dış membran geçirgenliği; penisilin bağlayan proteinlerin modifikasyonları; GSBL, MBL veya diğer enzimlerin üretimi; efluks sistemleri; azalmış porin ekspresyonu) ile de antibiyotiklere direnç kazanır14. P.aeruginosa enfeksiyonları, özellikle immün süpresif hastalarda yüksek mortalite ile seyretmektedir. Tedavi sırasında dirençli mutantların oluşma riski çok yüksektir ve bu, mortaliteyi artıran başka bir nedendir. P.aeruginosa enfeksiyonlarının tedavisinde aminoglikozid veya florokinolonlarla kombinasyon şeklinde beta-laktam antibiyotikler çok önemli bir yer tutmaktadır. Bu hastalarda antibiyotik seçiminin doğru yapılması, tedavi sırasında mutantların oluşumunu önlemektedir15.
P.aeruginosa'da bulunabilecek GSBL'lerden ülkemiz için en önemli olanları PER-1 ve OXA tipi enzimlerdir. PER ve OXA tipi beta-laktamaz genlerinin çoğu plazmid, transpozon veya integron kontrolündedir. PER-1 enzimi klavulanik asit ve tazobaktama duyarlıdır. AmpC tipi beta enzimler ise beta-laktamaz inhibitörlerine dirençlidir. Ülkemizde PER ve OXA türü GSBL'ler diğer ülkelere göre daha yüksek oranlarda bildirilmektedir11. PER-2 tipi GSBL Güney Amerika ülkelerinden yaygın olarak bildirilmektedir16. PER-1 enzimi içeren P.aeruginosa'nın en belirgin özellikleri, izolatların seftazidim, penisilin, sefotaksim, seftibuten, aztreonama dirençli; karbapenem ve sefamisinlere duyarlı olmalarıdır17. Ülkemizde P.aeruginosa suşlarında seftazidim direnci yüksek oranda bildirilmektedir18.
PER-1 enzimi ilk kez Fransa'da bir Türk hastadan izole edilen bir P.aeruginosa suşunda bulunmuş, kromozomal bir enzim olarak bildirilmiştir3. Daha sonra ülkemizde yapılan çalışmalarda PER-1 enzimi P.aeruginosa, Acinetobacter spp., Salmonella Typhimurium, Providencia rettgeri ve Klebsiella pneumoniae suşlarında bildirilmiştir11,19. Bu bakterilerle nozokomiyal enfeksiyon geliştiren hastalarda, bakterilerin PER-1 enzimi taşıyor olması mortalite açısından istatistiksel olarak anlamlı ölçüde belirleyici olarak saptanmıştır20. PER-1 enziminin Türkiye dışında, dünyada prevalansı tam olarak bilinmemekle beraber Fransa, İtalya, Belçika, Rusya, Romanya, Macaristan, Hindistan ve Kore'den PER-1 pozitif P.aeruginosa, Acinetobacter spp., Proteus mirabilis, Alcaligenes faecalis ve Providencia stuartii suşları bildirilmiştir21,22. Yurdumuzda yapılan çok merkezli iki çalışmada P.aeruginosa izolatlarının %11 ve %55.4'ünün, Acinetobacter spp.'nin de %46 ve %31'inin PER-1 türü GSBL salgıladığı bildirilmiştir19,23. Hastanemizde yaptığımız başka bir çalışmada, yoğun bakım ünitesinde yatan hastalardan izole edilen seftazidime dirençli P.aeruginosa izolatlarının %82 (42/49)'sinde PER-1 beta-laktamaz, %55 (27/49)'inde OXA-10 beta-laktamaz, PER-1 pozitif izolatların %60 (20/42)'ında aynı zamanda OXA-10 beta-laktamaz saptanmıştır11. Bu çalışmada seftazidime direnç oranı %16 olup MİK90 değeri 512 µg/ml olarak bulunmuştur. İncelenen suşların %11'inde PER-1, %11'inde OXA-10-benzeri ve %4'ünde PER-1 ve OXA-10-benzeri beta-laktamaz aynı anda saptanmıştır. PER-1 pozitif olan suşlardan birisi (36 no'lu suş) sadece seftazidime duyarlı, diğer antibiyotiklere dirençli olarak saptanmıştır. OXA-10-benzeri beta-laktamaz pozitifliği saptanan 11 suştan altısı seftazidime duyarlı olarak belirlenmiştir. Seftazidim duyarlılığı disk difüzyon ve E-test yöntemiyle tekrarlanmış ve sonuçlar aynı bulunmuştur. PER-1 pozitif suşların pI değeri 5.3 olarak belirlenmiştir. Seftazidime duyarlı suşlarda da PER-1 ve OXA-10-benzeri beta-laktamazların saptanması ilgi çekicidir.
Çift disk sinerji testi PER-1 ve OXA-10 tipi beta-laktamazları saptamada yetersiz kalmaktadır. Bizim çalışmamızda P.aeruginosa suşlarında çift disk sinerji yöntemiyle GSBL pozitifliği %7 olarak saptanmıştır. Anabilim dalımızda yapılan başka bir çalışmada, yoğun bakım hastalarından izole edilen seftazidime dirençli P.aeruginosa izolatlarında bu oran %37 olarak saptanmıştır11. Yong ve arkadaşlarının24 yaptığı bir çalışmada, PER-1 pozitif olan 53 A.baumannii izolatının 17 (%32)'sinde çift disk sinerji yöntemiyle GSBL pozitifliği saptanmıştır.
Yaygın olarak kullanılmakla beraber izoelektrik noktaların saptanması sadece enzim ailesi hakkında bir fikir verebilir. Örneğin; pI 5.2-5.7 TEM, pI 7.4-8.2 SHV, pI 5.5-8.2 OXA ve pI 8-9 AmpC tipi enzimler olarak kabul edilmektedir. Aynı pI değerine sahip birden fazla enzim bildirilmektedir. Örneğin; PER-1 enziminin pI değeri 5.3, 5.4, TEM-1 beta-laktamaz için ise pI değeri 5.4 olarak bildirilmektedir. Bizim çalışmamızda pI değeri > 7 olarak saptanan bantların AmpC beta-laktamazlarla ilgili olduğu düşünülmektedir. pI noktaları 6.4, 6.8 ve 8 olarak saptanan değerlerin OXA-10-benzeri beta-laktamazlarla ilişkili olduğu düşünülmektedir.
OXA grubu enzimler, Ambler grup D'de yer alan ve daha çok P.aeruginosa'da bulunan GSBL'lerdir. Bu enzimlerin OXA-1'den OXA-10'a kadar olanları dar spektrumlu enzimlerdir ve tercih ettikleri substrat oksasilin ve kloksasilindir. Aminoasit dizilerindeki nokta mutasyonları sonucu oksiimino-sefalosporinleri hidrolize edebilen geniş spektrumlu enzimler haline gelmişlerdir. OXA-11, OXA-14, OXA-15, OXA-16 ve OXA-17 beta-laktamazları ilk defa Hacettepe Üniversitesinde P.aeruginosa suşlarında tanımlanmıştır6. Bizim yaptığımız başka bir çalışmada sekanslama yöntemi kullanılarak, sadece OXA-10 beta-laktamaz saptanmış, diğer türevler saptanmamıştır11. OXA tipi beta-laktamazlarla ilgili çalışmalar daha çok Türkiye6,11 ve Fransa'dan bildirilmiştir25. Bu tip beta-laktamazlar çoğunlukla P.aeruginosa'da bazen de Enterobacteriaceae ailesinin diğer üyelerinde rapor edilmiştir. Dünyada ilk OXA-48 enzimi imipeneme dirençli bir K.pneumoniae suşunda kendi hastanemizden bildirilmiştir26. Son yıllarda Enterobacteriaceae ailesinde OXA-48 enzimi, ülkemizde ve dünyada giderek artan oranlarda bildirilmektedir27. Hastanemizde yaptığımız yukarıda bahsedilen çalışmada11 OXA-10 enzimi yoğun bakım ünitesinde %55 oranında saptanmıştır. Yalnız yoğun bakım hastaları olmayıp farklı hasta gruplarına ait örneklerle yürütülen bu çalışmada ise OXA-10 varlığı %11 olarak saptanmıştır. GSBL epidemiyolojisi hasta, hastanın bulunduğu ünite ve hastane ile coğrafik bölge ve ülkeye göre farklı olabilir. Prevalans belirlenirken bu özellikler göz önünde bulundurulmalıdır. Bu çalışmada dikkat çekici nokta, daha önce de belirtildiği gibi seftazidime duyarlı suşlarda da OXA-10 pozitifliğinin saptanmasıdır. Seftazidime duyarlı olan suşlardan birisi hariç (53 no'lu suş) diğer suşlar beta-laktam antibiyotiklerden bazılarına dirençli olarak bulunmuştur.
Çalışmamızda izolatların hiçbirinde PSE geni saptanmamıştır. De Champs ve arkadaşlarının28 Fransa'da yaptıkları çalışmada, seftazidime direnç oranı %6.2 olarak bulunmuştur. Bu araştırıcılar, seftazidime dirençli 34 P.aeruginosa izolatının ikisinde PSE-1 (CARB-2) beta-laktamaz tespit etmişler ve bu suşların pI değerini 5.7 olarak bildirmişlerdir28.
Bugüne kadar P.aeruginosa'da çeşitli pompa sistemleri (MexAB-OprM, MexCD-OprJ, MexEF-OprN, MexXY, MexJK, MexGHI-OpmD) bildirilmiştir. Bunlardan MexAB-OprM ve MexXY, antibiyotiklere dirençte anahtar rol oynar. MexAB-OprM sistemi, imipenem dışındaki beta-laktam antibiyotikler, florokinolonlar, tetrasiklinler, makrolidler, kloramfenikol, novobiyosin ve trimetoprim-sülfametoksazole dirençten sorumludur. MexAB-OprM'nin fazla üretimi P.aeruginosa'nın klinik izolatlarında önemli çoklu ilaç direncine neden olabilir. Bu sistem çeşitli antibiyotiklerle birlikte biyosidler, boyalar, deterjanlar ve organik çözücüler gibi birçok kimyasalı dışarı pompalar. Ayrıca bu mekanizmanın, bakterinin virülansını artırdığı bildirilmektedir. MexAB-OprM varlığında beta-laktam antibiyotiklere karşı dirençte 4-6 kat artış gözlenmektedir. Pompa sistemi için substrat niteliği taşıyan herhangi bir antibiyotikle tedavi edilen hastalarda pompa sisteminin "aşırı ekspresyonu" meydana gelmektedir. Ayrıca, MexAB-OprM sistemini düzenleyen MexR genindeki nokta mutasyonları sonucu oluşan "naIB" mutant P.aeruginosa suşlarında MexAB-OprM'nin aşırı sentezlendiği ve çoğul antibiyotik direncinin geliştiği gösterilmiştir29. Çalışmamızda, suşların %52sinin MexA-MexB-OprM operonunun düzenleyici bölgesi olan MexR bölgesine sahip oldukları saptanmıştır. Bu suşların da yedisinde (2, 3, 56, 73, 83, 87 ve 96 no'lu suşlar) beta-laktam direncinin yanı sıra amikasin ve siprofloksasin direnci de saptanmıştır. Bu suşlarda antibiyotik direncine sebep olan birçok mekanizmanın birarada olduğu gözlenmektedir. Beta-laktam direncinin yanı sıra kinolon ve aminoglikozid direncinin de olması, bunların mutant suşlar olabileceğini ve MexAB-OprM sisteminin aşırı sentezlendiğini düşündürmektedir. Bu mekanizmanın da tam olarak saptanabilmesi için daha ayrıntılı çalışmalara gerek vardır. Hocquet ve arkadaşları30 yaptıkları çalışmada, 201 hastadan izole ettikleri ve genotipik olarak birbiriyle ilişki olduğunu saptadıkları 18 çoğul dirençli P.aeruginosa suşunda beta-laktam direncinin, intrensek AmpC beta-laktamazın derepresyonu ile ilgili olduğunu bildirmişler; aynı zamanda MexR genindeki mutasyon sonucu 14 izolatta MexA-OprM sisteminin aşırı sentezlendiğini göstermişlerdir.
Sonuç olarak çalışmamızda, P.aeruginosa suşlarının %11'inde PER-1, %11'inde OXA-10-benzeri, %4'ünde PER-1 ve OXA-10-benzeri beta-laktamaz aynı anda saptanmış; hiçbir suşta PSE genine rastlanmamış ve izolatların %52'sinin MEX-R geni içerdiği belirlenmiştir. Dolayısıyla P.aeruginosa suşlarında saptanan direncin oldukça kompleks yapıda olduğu dikkate alınırsa, antimikrobiyal tedavinin doğru ve uygun şekilde seçilmesi, birçok antibiyotiğin daha uzun yıllar kullanımına olanak sağlayacak, dirençli suşların ortaya çıkmasını azaltacaktır.
KAYNAKLAR
-
Bert F, Branger C, Lambert-Zechovsky N. Identification of PSE and OXA beta-lactamase
genes in Pseudomonas aeruginosa using PCR-restriction fragment length
polymorphism. J Antimicrob Chemother 2002; 50(1): 11-8.
[Özet] [Tam Metin] [PDF] -
Poirel L, Weldhagen GF, Naas T, De Champs C, Nordmann P. GES-2 a class
beta-lactamase from Pseudomonas aeruginosa with increased hydrolysis of
imipenem. Antimicrob Agents Chemother 2001; 45(9): 2598-603.
[Özet] [Tam Metin] [PDF] - Nordmann P, Ronco E, Naas T, Duport C, Michel-Briand Y, Labia R. Characterization of a novel extended-spectrum beta-lactamase from Pseudomonas aeruginosa. Antimicrob Agents Chemother 1993; 37(5): 962-9. [Özet] [PDF]
- Huovinen P, Huovinen S, Jacoby GA. Sequence of PSE-2 beta-lactamase. Antimicrob Agents Chemother 1988; 32(1): 134-6. [Özet] [PDF]
- Poirel L, Girlich D, Naas T, Nordmann P. OXA-28, an extended-spectrum variant of OXA-10 beta-lactamase from Pseudomonas aeruginosa and its plasmid- and integron-located gene. Antimicrob Agents Chemother 2001; 45(2): 447-53. [Özet] [Tam Metin] [PDF]
-
Danel F, Hall LM, Duke B, Gur D, Livermore DM. OXA-17, a further
extended-spectrum variant of OXA-10 beta-lactamase, isolated from Pseudomonas
aeruginosa. Antimicrob Agents Chemother 1999; 43(6): 1362-6.
[Özet] [Tam Metin] [PDF] -
Aubert D, Poirel L, Chevalier J, Leotard S, Pages JM, Nordmann P.
Oxacillinase-mediated resistance to cefepime and susceptibility to ceftazidime
in Pseudomonas aeruginosa. Antimicrob Agents Chemother 2001; 45(6):
1615-20.
[Özet] [Tam Metin] [PDF] - Kalai Blagui S, Achour W, Abbassi MS, Bejaoui M, Abdeladhim A, Ben Hassen A. Nosocomial outbreak of OXA-18-producing Pseudomonas aeruginosa in Tunisia. Clin Microbiol Infect 2007; 13(8): 794-800. [Özet] [Tam Metin] [PDF]
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 18th Informational Supplement. M100-S18, 2008. CLSI, Wayne, PA.
- Walsh TR, Toleman MA, Poirel L, Nordmann P. Metallo-beta-lactamases: the quiet before the storm? Clin Microbiol Rev 2005; 18(2): 306-25. [Özet] [Tam Metin] [PDF]
- Aktaş Z, Poirel L, Salcioğlu M, et al. PER-1 and OXA-10-like beta-lactamases in ceftazidime-resistant Pseudomonas aeruginosa isolates from intensive care unit patients in Istanbul; Turkey. Clin Microbiol Infect 2005; 11(3): 193-8. [Özet] [Tam Metin] [PDF]
-
Dubois V, Arpin C, Melon M, et al. Nosocomial outbreak due to a
multiresistant strain of Pseudomonas aeruginosa P12: efficacy of
cefepime-amikacin therapy and analysis of beta-lactam resistance. J Clin
Microbiol 2001; 39(6): 2072-8.
[Özet] [Tam Metin] [PDF] - Mathew M, Harris A, Marshall M, Ross G. The use of analytical isoelectric focusing for detection and identification of beta-lactamases. J Gen Microbiol 1975; 88(1): 169-78. [Özet] [PDF]
- Weldhagen GF, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother 2003; 47(8): 2385-92. [Özet] [PDF]
- Deplano A, Denis O, Poirel L, et al. Molecular characterization of an epidemic clone of panantibiotic-resistant Pseudomonas aeruginosa. J Clin Microbiol 2005; 43(3): 1198-204. [Özet] [Tam Metin] [PDF]
- Bauernfeind A, Stemplinger I, Jungwirth R, et al. Characterization of beta-lactamase gene blaPER-2, which encodes an extended-spectrum class A beta-lactamase. Antimicrob Agents Chemother 1996; 40(3): 616-20. [Özet] [PDF]
-
Poirel L, Cabanne L, Vahaboglu H, Nordmann P. Genetic environment and
expression of the extended-spectrum beta-lactamase blaPER-1
gene in gram-negative bacteria. Antimicrob Agents Chemother 2005; 49(5):
1708-13.
[Özet] [Tam Metin] [PDF] -
Aksaray S, Dokuzoguz B, Guvener E, et al. Surveillance of antimicrobial
resistance among gram-negative isolates from intensive care units in eight
hospitals in Turkey. J Antimicrob Chemother 2000; 45(5): 695-9.
[Özet] [Tam Metin] [PDF] - Vahaboglu H, Öztürk R, Aygun G, et al. Widespread detection of PER-1 type extended-spectrum beta-lactamase among nosocomial Acinetobacter and Pseudomonas aeruginosa isolates in Turkey: a nation-wide multicenter study. Antimicrob Agents Chemother 1997; 41(10): 2265-9. [Özet] [PDF]
- Arman D. Genişletilmiş spektrumlu beta-laktamazlar ve klinik önemi, s: 85-94. Ulusoy S, Leblebicioğlu H, Akova M (ed), Önemli ve Sorunlu Gram-Negatif Bakteri İnfeksiyonları. 2004. Bilimsel Tıp Yayınevi, Ankara.
-
Pagani L, Mantengoli E, Migliavacca R, et al. Multifocal detection of
multidrug-resistant Pseudomonas aeruginosa producing the PER-1
extended-spectrum beta-lactamase in northern Italy. J Clin Microbiol 2004;
42(6): 2523-9.
[Özet] [Tam Metin] [PDF] - Lartigue MF, Fortineau N, Nordmann P. Spread of novel expanded-spectrum beta-lactamases in Enterobacteriaceae in a university hospital in the Paris area, France. Clin Microbiol Infect 2005; 11(7): 588-91. [Özet] [Tam Metin] [PDF]
- Kolayli F, Gacar G, Karadenizli A, Sanic A, Vahaboglu H; Study Group. PER-1 is still widespread in Turkish hospitals among Pseudomonas aeruginosa and Acinetobacter spp. FEMS Microbiol Lett 2005; 249(2): 241-5. [Özet]
- Yong D, Shin JH, Kim S, et al. High prevalence of PER-1 extended-spectrum beta-lactamase producing Acinetobacter baumannii in Korea. Antimicrob Agents Chemother 2003; 47(5): 1749-51. [Özet] [Tam Metin] [PDF]
- Naas T, Namdari F, Bogaerts P, Huang TD, Glupczynski Y, Nordmann P. Genetic structure associated with blaOXA-18, encoding a clavulanic acid-inhibited extended-spectrum oxacillinase. Antimicrob Agents Chemother 2008; 52(11): 3898-904. [Özet] [Tam Metin] [PDF]
- Poirel L, Heritier C, Tolun V, Nordmann P. Emergence of oxacillinase-mediated resistance to imipenem in Klebsiella pneumoniae. Antimicrob Agents Chemother 2004; 48(1): 15-22. [Özet] [Tam Metin] [PDF]
- Kilic A, Aktas Z, Bedir O, et al. Identification and characterization of OXA-48 producing, carbapenem-resistant Enterobacteriaceae isolates in Turkey. Ann Clin Lab Sci 2011; 41(2): 161-6. [Özet]
-
De Champs C, Poirel L, Bonnet R, et al. Prospective survey of
beta-lactamases produced by ceftazidime-resistant Pseudomonas aeruginosa
isolated in a French hospital in 2000. Antimicrob Agents Chemother 2002; 46(9):
3031-4.
[Özet] [Tam Metin] [PDF] - Sobel ML, Hocquet D, Cao L, Plesiat P, Poole K. Mutations in PA3574 (nalD) lead to increased MexAB-OprM expression and multidrug resistance in laboratory and clinical isolates of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2005; 49(5): 1782-6. [Özet] [Tam Metin] [PDF]
- Hocquet D, Bertrand X, Kohler T, Talon D, Plesiat P. Genetic and phenotypic variations of a resistant Pseudomonas aeruginosa epidemic clone. Antimicrob Agents Chemother 2003; 47(6): 1887-94. [Özet] [Tam Metin] [PDF]
İletişim (Correspondence):
Doç. Dr. Zerrin Aktaş,
İstanbul Üniversitesi İstanbul Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Çapa, İstanbul, Türkiye.
Tel (Phone): +90 212 414 2000-32717,
E-posta (E-mail): aktaszerrin@yahoo.com