Kan Donörlerinde Gerçek Zamanlı RT-PCR ile Batı Nil Virusu RNA'sının Araştırılması*
Investigation of West Nile Virus RNA in Blood Donors by Real-Time RT-PCR
Fatih
ŞAHİNER1, İsmail Yaşar AVCI2, Orhan BEDİR1,
Özgür KORU1, Kenan ŞENER1, Mehmet YAPAR1,
Ayhan KUBAR1
1 Gülhane Askeri Tıp Akademisi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gulhane Military Medical Academy, Department of Medical Microbiology, Ankara, Turkey.
2 Gülhane Askeri Tıp Akademisi, Kan Eğitim Merkezi ve Kan Bankası Müdürlüğü, Ankara.
2 Gulhane Military Medical Academy, Blood Training and Donation Center, Ankara, Turkey.
* Bu çalışma, "American Society of Tropical Medicine and Hygiene, 60th Annual Meeting (December 4-8, 2011, Philadelphia, Pennsylvania USA)"de poster olarak sunulmuştur.
ÖZET
Batı Nil virusu (BNV) Flaviviridae ailesinde yer alan zarflı, ikozahedral simetrili bir RNA virusudur. Ana rezervuarı kuşlar olmasına karşın virus insan ve diğer memelilerde de çeşitli enfeksiyonlara neden olmaktadır. BNV enfeksiyonlarının insanlara en sık ve doğal bulaşma yolu sivrisinek ısırmasıdır. Bununla beraber insanlara farklı yollarla da bulaşabilmektedir. Sivrisinek aracılı olmayan bulaşma yollarından en önemlisi virus ile kontamine kan ve kan ürünleridir. Bu çalışmada, kan ve kan ürünleri ile BNV bulaş olasılığının değerlendirilmesi amacıyla, Ankara bölgesindeki sağlıklı kan donörlerinde "in house" gerçek zamanlı revers transkriptaz-polimeraz zincir reaksiyonu (RT-PCR) ile BNV RNA varlığının araştırılması planlanmıştır. Çalışmaya 729 gönüllü kan donörü (yaş ortalaması: 27.7 yıl; 711'i erkek) dahil edilmiştir. Önceki çalışmalarda serokonversiyonun henüz oluşmadığı erken enfeksiyon dönemlerinde virusun kan transfüzyonuyla bulaşabileceği gösterildiğinden, donörlerin seropozitiflik durumu dikkate alınmamıştır. BNV enfeksiyonları sivrisineklerin çoğaldığı yaz ve yaz sonu dönemlerinde daha sık görüldüğünden çalışmamız Ağustos-Eylül 2009 döneminde gerçekleştirilmiştir. Katılımcıların 702 (%96.3)'si Ankara ve ilçelerinde ikamet etmekte olup, 569 (%78)'u arboviral enfeksiyon riski olan (açık alanda bulunma, sivrisinek ve kene ile temas) kişilerden oluşmaktadır. Gerçek zamanlı RT-PCR analizleri sonucunda, çalışmaya dahil edilen serum örneklerinin hiçbirisinde BNV RNA varlığı saptanmamıştır. Çalışmamızın sonuçlarına göre özellikle Ankara bölgesi için kan ve kan ürünleri ile BNV bulaş riskinin düşük olduğu söylenebilir. Ancak bölgemizde yapılan çalışmalarda; kan donörlerinde BNV seropozitifliğinin %0.56-2.4 oranları arasında saptanmış olması, bölgemizde muhtemel ve doğrulanmış BNV enfeksiyonlarının bildirilmiş olması ve ayrıca yakın zamanda çevremizdeki bazı ülkelerde BNV salgınlarının görülmesi nedeniyle BNV bulaş riski göz ardı edilmemelidir.
Anahtar sözcükler: Batı Nil virusu; kan donörü; gerçek zamanlı RT-PCR.
ABSTRACT
West Nile virus (WNV), a member of Flaviviridae family, is an enveloped, icosahedral symmetric RNA virus. Primary reservoir hosts of WNV are birds, but the virus can cause various infections in humans and other mammals. The most common and natural transmission way of WNV infections is mosquito bites, however, humans can be infected by different routes. The most important non-mosquito transmission route is contaminated blood and blood products. In this study, we aimed to investigate the risk of WNV transmission through blood and blood products in Ankara, Turkey. The presence of WNV RNA was investigated by in house real-time reverse transcriptase-polymerase chain reaction (RT-PCR) in serum samples obtained from 729 healthy blood donors (mean age: 27.7 years; 711 were male), regardless of the donor's seropositivity status since the virus can be transmitted at the early stages of infection when seroconversion has not yet developed. Serum samples were collected in August-September 2009, the period when these infections are more frequent due to mosquito activity. The vast majority of donors (n= 702, 96.3%) have been inhabiting in Ankara and 569 (78%) of donors have had risk factors for arboviral infections (e.g. outdoor activity, mosquito and tick bites). WNV RNA was not detected by real-time RT-PCR analysis in any serum sample included in this study. According to the results of our study, it can be said that the risk of WNV transmission through blood and blood products is low in Ankara. However, WNV seropositivity was detected within the range of 0.56 to 2.4% among blood donors in previous studies and probable and confirmed WNV infections have been reported in our region. In addition, WNV outbreaks have emerged in some countries neighbouring Turkey recently. Thus, the risk of WNV transmission through blood and blood products should not be ignored and blood donor questionnaires should be evaluated in detail.
Key words: West Nile virus; blood donor; real-time RT-PCR.
Geliş Tarihi (Received): 22.12.2011 • Kabul Ediliş Tarihi (Accepted): 16.02.2012
GİRİŞ
Batı Nil virusu (BNV) Flaviviridae ailesi, Flavivirus cinsi içinde sınıflandırılan, yaklaşık 45 nm büyüklüğünde, zarflı, ikozahedral simetrili ve tek zincirli, pozitif polariteli RNA genomu içeren bir arbovirustur1. BNV'nin doğal yaşam döngüsünde kuşlar ana rezervuar konaklardır; insan, at ve diğer omurgalılar ise vireminin düşük düzeylerde olması nedeniyle viral döngüde minimal etkileri olan rastlantısal konaklardır1. BNV'nin temel bulaşı özellikle Culex cinsi sivrisinek ısırığı ile olur; ancak enfeksiyonun insanlara sivrisinek aracılı olmayan yollar (kan/kan ürünlerinin transfüzyonu, organ nakli, diyaliz, intrauterin veya anne sütü, perkütan ve aerosol yol) ile de bulaşabildiği gösterilmiştir1,2,3,4,5,6. BNV enfeksiyonları genellikle asemptomatik olarak geçirilmekle beraber, enfeksiyonun seyri sırasında Batı Nil ateşi veya hastaların %1'inden azında nörodejeneratif değişikliklerle karakterize ciddi hastalıklar da gelişebilmektedir1,2. BNV enfeksiyonlarının tanısı; hasta serumu veya beyin omurilik sıvısı (BOS)'nda virusa özgül IgM ve IgG antikorlarının saptanması, hasta örneklerinde viral RNA'nın gösterilmesi veya virus izolasyonuyla yapılır1.
Dünyanın birçok bölgesinde görülmekle beraber, son zamanlarda yakın coğrafyamızdaki ülkelerde BNV enfeksiyonlarında bir artış izlenmiş ve 2009-2010 yıllarında bazı ülkelerde (Yunanistan, Romanya, Macaristan, Rusya, İsrail, İtalya) salgın boyutunda enfeksiyonlar bildirilmiştir2,7,8. Ülkemizde BNV seroprevalansını belirlemeye yönelik çalışmaların geçmişi 30 yıldan daha uzun sürelidir ve BNV seropozitifliği bölgelere göre değişmek üzere %1-57 arasında bulunmuştur9. Yine ülkemizde yapılan çalışmalarda sağlıklı kan donörlerinde %0.56-2.4 oranlarında BNV seropozitifliği saptanmıştır2,10,11. Ayrıca 2009 yılında Ankara'da, etyolojisi laboratuvar olarak doğrulanan semptomatik BNV enfeksiyonu olguları da tespit edilmiştir12,13,14,15. Ülkemizde doğrulanmış ilk BNV olguları olan bu hastalar uygulanan tedavilerle klinik olarak düzelirken; Ağustos 2010 tarihinde Manisa, Sakarya, İzmir, Aydın ve Isparta'da toplam yedi olguya Batı Nil ateşi tanısı konulmuş ve bunların üçü ölümle sonlanmıştır8. Bu olgular ülkemizde ölümle sonuçlanan laboratuvar olarak kanıtlanmış ilk enfeksiyonlar olması nedeniyle önem taşımaktadır.
Bu çalışmada, kan ve kan ürünleriyle BNV bulaş olasılığının değerlendirilmesi amacıyla, gerçek zamanlı revers transkriptaz polimeraz zincir reaksiyonu (RT-PCR) ile sağlıklı kan donörlerinde BNV RNA'sı araştırılmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, etik kurul onayı ile, 3 Ağustos-23 Eylül 2009 tarihleri arasında Gülhane Askeri Tıp Akademisi Kan Bankası laboratuvarına kan bağışında bulunan sağlıklı gönüllülere ait 729 serum örneği dahil edildi. Serum örneklerinden RNA izolasyonu asit fenol-kloroform-izoamil alkol yöntemine göre yapıldı16. Çalışmada kullanılan primerlerin ve probun dizaynı, OligoYap 4.0 isimli bilgisayar yazılımıyla gerçekleştirildi17. Virusun NSP-5 geni üzerinde yaklaşık 159 baz çift(bç)'lik bir bölgeyi hedefleyen oligoların özgünlükleri internet yardımıyla GenBank'ın BLAST özelliği kullanılarak kontrol edildi ve MWG-Biotech (Almanya) firmasına sentez ettirildi. Primer olarak P1 (ileri): 5'gccaccggaagttgagtaga3' ve P2 (ters): 5'gccgtagcgtggtctgacatt3'; prob olarak (5'Æ3'): FAM-tgcgrctcaaccccaggaggac-BHQ kullanıldı. Probdaki "r" kodu dejeneratif baz yapısını göstermekte olup (A/G), probların dizaynında floresan boya olarak FAM (6-carboxy fluorescein), non-floresan boya olarak da BHQ (black hole quencher) kullanıldı. TaqMan temelli gerçek zamanlı RT-PCR işlemi için ince duvarlı ve real-time PCR cihazının optik okuyucusu için uygun olan 0.2 ml'lik tüpler içinde her bir örnek için üniversal PCR Master Miks (1X) 12.5 µl, her bir primerden 10 pmol, TaqMan prob 4 pmol, 2 U hot start taq DNA polimeraz, 2.5 U revers transkriptaz eklendi ve karışımın hacmi distile su ile 20 µl'ye tamamlandı. Karışıma son olarak 5 µl ekstrakte RNA ilave edildi ve PCR reaksiyonları 25 µl toplam hacimde gerçekleştirildi. PCR döngüleri, Kubar ve arkadaşlarının18 çalışmasına göre uygulandı. Amplifikasyon döngüleri; (i) cDNA sentezi için 50°C'de 30 dakika başlangıç döngüsü, (ii) 95°C 10 dakika 1 döngü [Hot Start Taq DNA Polimeraz (Bioron GmBH, Germany) aktivasyonu için], (iii) 95°C 15 saniye ve 60°C 1 dakika olmak üzere toplam 40 döngü şeklinde gerçekleştirildi. Tüm işlemler ve analizler ABI PRISM 7500 Sequence Detector (Applied Biosystems, ABD) cihazıyla yapıldı.
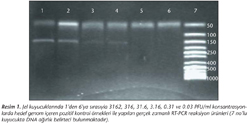
Çalışmada pozitif kontrol olarak, Ankara Üniversitesi Veteriner Fakültesinden temin edilen NY-99 suşunun 103.5 plak oluşturan ünite (PFU)/ml'lik stok solüsyonundan dilüe edilerek hazırlanan örnekler kullanıldı. Optimizasyon çalışmaları sırasında, amplifiye edilen pozitif kontrolün farklı dilüsyonlarına (3162, 316, 31.6, 3.16, 0.31 ve 0.03 PFU/ml) ait PCR ürünleri agaroz jel elektroforezi ile de görüntülendi (Resim 1). Elektroforez için %1.8'lik agaroz jel hazırlandı. Amplikonlar 0.5X TAE buffer içinde 160 voltta 25 dakika sabit akımda yürütüldü ve GelDoc 2000 jel görüntüleme cihazı (BioRad, ABD) ile görüntülenip fotoğraflandı. Amplikon büyüklüklerini belirleyebilmek için GeneRuler 50 bp DNA Ladder (Fermentas, Litvanya) kullanıldı.
BULGULAR
Çalışmamızda, pozitif kontrolün 3162, 316, 31.6, 3.16, 0.31 ve 0.03 PFU/ml konsantrasyon içeren örneklerinden RNA ekstraksiyonunu takiben gerçekleştirilen PCR reaksiyonlarında sırasıyla 29.9, 31.8, 35.9 ve 38.1 CT değerlerinde pozitiflik belirlenirken, son iki dilüsyon negatif bulunmuştur (Resim 1).
Çalışmaya alınan 729 donörün 711'i erkek, 18'i kadın olup, yaşları 21-60 (yaş ortalaması: 27.7) yıl arasında değişmektedir. Kan donörlerinin 702'si Ankara ve ilçelerinde, 27'si ise Ankara dışındaki çeşitli şehirlerde ikamet etmektedir. Donörlerin 569 (%78)'u, arboviral enfeksiyon riski olan (açık alanda bulunma, sivrisinek ve kene ile temas) kişilerden oluşmaktadır. Çalışmamızda, kan donörlerine ait örneklerin hiçbirisinde RT-PCR yöntemiyle BNV RNA varlığı saptanmamıştır.
TARTIŞMA
Amerika Birleşik Devletleri'nde 2002 yılında ortaya çıkan BNV salgını sırasında, 16 viremik kan donöründen trombosit süspansiyonu, eritrosit süspansiyonu veya plazma alan 23 kişide transfüzyon sonrası bulaş olduğu gösterilmiştir3,4. Transfüzyonu takip eden 2-21 gün içinde alıcıların 15'inde BNV ile ilişkili hastalık gelişmiş ve bu donörlerde titresi 0.8-75.1 PFU/ml olan düşük seviyeli viremi varlığı saptanmıştır3,4. Dikkat çekici olan diğer nokta ise, bu donörlerin hiçbirisinde kan bağışı sırasında saptanabilir düzeyde BNV IgM bulunmamış olmasıdır. Bu veriler, kısa süreli ve düşük düzeyli vireminin görüldüğü asemptomatik enfeksiyonlarda BNV'nin kan ve kan ürünleriyle bulaşabildiğini göstermekte ve BNV seropozitifliğinin araştırılmasının bulaşı önlemede yetersiz kaldığını ortaya koymaktadır. Organ nakli ile BNV'nin bulaşabildiği ise 2003 yılında rapor edilmiş; organ donörü olan kişinin organları alınmadan bir gün önce kontamine kan transfüzyonu sonucu enfekte olduğu ve bu donörün organlarının nakledildiği hastalarda klinik BNV enfeksiyonları geliştiği bildirilmiştir5. Yine doğum yaptıktan bir gün sonra BNV ile kontamine kan transfüzyonu nedeniyle enfekte olan bir annede, 11 gün sonra BNV menenjiti gelişmiş ve doğumdan bir gün sonra anne sütü ile beslenmeye başlayan ve asemptomatik kalan bebekte 25 gün sonra BNV IgM varlığı gösterilmiştir6. Tüm bu olgular, kan transfüzyonunun BNV bulaşındaki önemine dikkat çekmektedir. Rabel ve arkadaşlarının19 Mart 2011 tarihinde yayınlanan çalışmalarında, bazı orta Avrupa ülkelerinde 2006-2010 yılları arasında kan donörlerinde BNV seroprevalansının arttığı bildirilmiştir. Ülkemizde ise 2009-2010 yıllarında laboratuvar olarak doğrulanmış ve ölümle sonuçlanan BNV enfeksiyonları bildirilmiştir8,12,13,14,15. Tüm bu veriler ve BNV virülansının arttığına dair bulgular, bu enfeksiyonun ilerleyen yıllarda dünyada ve ülkemizde daha da önem kazanacağını göstermektedir20.
Sivrisinek aktivitesindeki artışa bağlı olarak BNV enfeksiyonları insanlar arasında yaz ve yaz sonu dönemlerinde daha sık görülür1,9. Bunu dikkate alarak çalışmamıza, Ağustos-Eylül 2009 döneminde bağışta bulunan kan donörlerinin örnekleri dahil edilmiştir. Donörlerin %78'inde açık alanda bulunma ve sivrisinek-kene teması hikayesi bulunduğundan, çalışılan grubun arbovirus enfeksiyonları için risk taşıyan bir örneklem olduğu düşünülebilir. Transfüzyonla ilişkili BNV bulaşında donörlerde düşük seviyeli (0.8-75.1 PFU/ml) viremi görüldüğünden dolayı hastalardan alınan serum örneklerinde BNV varlığını araştıracak yöntemin saptama duyarlılığı kritik önem arz etmektedir3,4. Bu çalışmada kullandığımız yöntemin saptama duyarlılığı 35.9 CT ve 38.1 CT değerleri baz alınmak koşuluyla minimum 0.31-3.16 PFU/ml ve üzeri olarak belirlenmiştir. Bununla beraber düşük titreli değerleri saptayabilmek için analizlerin dikkatli olarak yapılması önem arz etmekte olup, gerektiğinde döngü sayısı artırılmalıdır. Her ne kadar çalışmamızda kan donörlerinde BNV RNA varlığı saptanmamış olsa da; BNV enfeksiyonlarında vireminin kısa süreli ve düşük düzeyde olması, bölgemizde yapılan çalışmalarda kan donörlerinde BNV seropozitifliğinin saptanmış olması, yine bulunduğumuz bölge de dahil olmak üzere ülkemizde doğrulanmış BNV enfeksiyonlarının bildirilmesi ve komşu ülkelerde BNV salgınlarının görülmesi gibi nedenlerle, ülkemizde kan/kan ürünleriyle BNV bulaş riski göz ardı edilmemelidir2,10,11,13,14,15. Ülkemizde bölgelere göre seropozitiflik oranlarının farklı olması nedeniyle bu riskin her bölge için değişebileceği ve ayrıca salgın durumlarında kan transfüzyonuyla bulaş riskinin arttığı unutulmamalıdır9,21.
TEŞEKKÜR
Pozitif kontrol olarak kullandığımız virus suşunun teminindeki destekleri dolayısıyla Ankara Üniversitesi Veteriner Fakültesi, Viroloji Anabilim Dalı Öğretim Üyesi Sayın Prof. Dr. Aykut Özkul'a teşekkür ederiz.
KAYNAKLAR
- Petersen LR, Roehrig JT, Sejvar JJ. West Nile virus in the Americas, pp: 3-56. In: Fong IW, Alibek K (eds), New and Evolving Infections of the 21st Century. 2007, Springer Science, New York.
- Ayturan Ş, Aydoğan S, Ergünay K, Özcebe OI, Us D. Hacettepe Üniversitesi Hastanesi kan donörlerinde Batı Nil virusu seroprevalansının araştırılması ve pozitif sonuçların plak redüksiyon nötralizasyon testi ile doğrulanması. Mikrobiyol Bul 2011; 45(1): 113-24. [Özet] [Tam Metin] [PDF]
- Harrington T, Kuehnert MJ, Kamel H, et al. West Nile virus infection transmitted by blood transfusion. Transfusion 2003; 43(8): 1018-22. [Özet]
- Pealer LN, Marfin AA, Petersen LR, et al. Transmission of West Nile virus through blood transfusion in the United States in 2002. N Engl J Med 2003; 349(13): 1236-45. [Özet] [Tam Metin] [PDF]
- Iwamoto M, Jernigan DB, Guasch A, et al. Transmission of West Nile virus from an organ donor to four transplant recipients. N Engl J Med 2003; 348(22): 2196-203. [Özet] [Tam Metin] [PDF]
- Centers for Disease Control and Prevention. Possible West Nile virus transmission to an infant through breast-feeding-Michigan, 2002. MMWR 2002; 51(39): 877-8. [Özet]
- European Centre for Disease Control and Prevention. West Nile virus transmission in Europe. Epidemiological Updates, 10 September 2010. http://www.ecdc.europa.eu/en/activities/sciadvice/Pages/Epidemiological_Updates.aspx
- T.C. Sağlık Bakanlığı. Basın Açıklaması. http://www.saglik.gov.tr/TR/belge/1-10898/eski2yeni.html
- Azap A, Meço O. Batı Nil virusu ansefaliti. Klinik Gelişim Dergisi 2010; 23(3): 51-5. [PDF]
- Hızel K, Yenicesu I, Erdal B ve ark. Sağlıklı kan vericilerinde Batı Nil virusu seroprevalansının araştırılması. Mikrobiyol Bul 2010; 44(3): 425-30. [Özet] [PDF]
- Ergünay K, Saygan MB, Aydoğan S, et al. West Nile virus seroprevalence in blood donors from Central Anatolia, Turkey. Vector Borne Zoonotic Dis 2010; 10(8): 771-5. [Özet]
- Arpaci F, Cetin T, Kubar A, et al. West Nile virus infection in a patient with acute graft-versus-host disease. Haematologica 2009; 94(Suppl 2): 687.
- Sener K, Yapar M, Koru O, Kubar A. Detection of West Nile virus in a patient with acute graft-versus-host disease by using a new developed one-step real time RT-PCR. J Clin Virol 2009; 46(Suppl 1): 43-4.
- Ergünay K, Özkul A. Ankara bölgesinde nedeni bilinmeyen santral sinir sistemi enfeksiyonu olgularında saptanan Batı Nil virusu seropozitifliğinin doğrulanması. Mikrobiyol Bul 2011; 45(2): 381-3. [Özet] [Tam Metin] [PDF]
- Ergünay K, Aydoğan S, Menemenlioğlu D, et al. Ankara bölgesinde nedeni bilinmeyen merkezi sinir sistemi enfeksiyonlarında Batı Nil virusunun araştırılması. Mikrobiyol Bul 2010; 44(2): 255-62. [Özet] [PDF]
- Sambrook J, Fritsch EF, Maniatis T. Appendices B16. Molecular Cloning. 1998, 2nd ed. Cold Spring Harbor Laboratory Press, New York.
- Yapar M, Aydogan H, Pahsa A, et al. Rapid and quantitative detection of Crimean-Congo haemorrhagic fever virus by one-step real-time reverse transcriptase-PCR. Japanese J Infect Dis 2005; 58(6): 358-62. [Özet] [PDF]
- Kubar A, Yapar M, Besirbellioglu B, Avcı IY, Guney C. Rapid and quantitative detection of mumps virus RNA by one-step real-time RT-PCR. Diagn Microbiol Infect Dis 2004; 49(2): 83-8. [Özet]
- Rabel PO, Planitzer CB, Farcet MR, et al. Increasing West Nile virus antibody titres in central European plasma donors from 2006 to 2010. Euro Surveill 2011; 16(10): pii: 19812. [Özet]
- Murray KO, Mertens E, Despres P. West Nile virus and its emergence in the United States of America. Vet Res 2010; 41(6): 67. [Özet] [Tam Metin] [PDF]
- Biggerstaff BJ, Petersen LR. Estimated risk of transmission of the West Nile virus through blood transfusion in the US, 2002. Transfusion 2003; 43(8): 1007-17. [Özet]
İletişim (Correspondence):
Uzm. Dr. Fatih Şahiner,
Gülhane Askeri Tıp Akademisi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
06490 Ankara, Türkiye.
Tel (Phone): +90 312 304 3403,
E-posta (E-mail): sahinermikro@gmail.com