Hastane ve Toplum Kaynaklı Staphylococcus aureus İzolatlarında
Çeşitli Virülans Faktörlerinin Gerçek Zamanlı PCR Yöntemiyle Araştırılması*
Investigation
of Various Virulence Factors Among the Hospital and Community-Acquired
Staphylococcus aureus Isolates by Real-Time PCR Method
Soner
YILMAZ1, Abdullah KILIÇ1, Alper KARAGÖZ2,
Orhan BEDİR1, Aylin ÜSKÜDAR GÜÇLÜ1,
Ahmet Celal BAŞUSTAOĞLU1
1 Gülhane Askeri Tıp Akademisi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gulhane Military Academy of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 Türkiye Halk Sağlığı Kurumu, Moleküler Mikrobiyoloji Laboratuvarı, Ankara.
2 Public Health Institution of Turkey, Molecular Microbiology Laboratory, Ankara, Turkey.
* Bu çalışma, GATA Araştırma Bilimsel Kurulunun kabul ettiği 13 Kasım 2009 tarih ve AR-2009/57 no'lu proje kapsamında gerçekleştirilmiştir.
ÖZET
Staphylococcus aureus, toplumda görülen deri ve yumuşak doku enfeksiyonlarının en sık nedenlerinden biri ve hastane kaynaklı enfeksiyonların en önemli nedenidir. Bu çalışmada çeşitli klinik örneklerden elde edilen toplum ve hastane kaynaklı S.aureus izolatlarında stafilokokal enterotoksin A-D (sırasıyla SEA, SEB, SEC ve SED), toksik şok sendromu toksin-1 (TŞST-1), Panton-Valentin lökosidin (PVL) toksinleri ile SCCmec fenotiplerinin [metisiline dirençli S.aureus (MRSA) izolatlarında] tespit edilmesi ve hastane ve toplum kaynaklı izolatlar arasındaki genotipik ilişkinin gösterilmesi amaçlanmıştır. Çalışmada Gülhane Askeri Tıp Akademisi Mikrobiyoloji Laboratuvarında 2007-2010 yılları arasında farklı klinik örneklerden izole edilen 147 S.aureus suşuna ait virülans faktörleri gerçek zamanlı polimeraz zincir reaksiyonu yöntemi ile araştırılmıştır. Hastane ve toplum kaynaklı izolatlar arasındaki genotipik ilişki MLVA (multiple locus variable number of tandem repeat analysis) yöntemi kullanılarak tespit edilmiştir. Çalışmaya alınan 147 S.aureus izolatının 72 (%48.9)'si hastane kaynaklı, 75 (%51.1)'i toplum kaynaklı olarak tanımlanmıştır. İzolatlardan 93 (%63.2)'ü en az bir adet (77 izolatta bir adet, 16 izolatta birden fazla) toksine sahiptir. Toksin tespit edilen izolatların %59.1 (55/93)'i hastane kaynaklı, %40.9 (38/93)'u ise toplum kaynaklıdır. İzolatların 59 (%40.1)'unda SEA, 8 (%5.4)'inde SEB, 12 (%8.1)'sinde SEC, 8 (%5.4)'inde SED, 17 (%11.5)'sinde TŞST-1 ve 6 (%4.0)'sında PVL tespit edilmiştir. Metisilin direnci hastane kaynaklı izolatların %61.1 (44/72)'inde, toplum kaynaklı izolatların %6.7 (5/75)'sinde saptanmıştır. Çalışmamızda hastane kaynaklı MRSA suşlarında %90.9 (40/44) oranında SCCmec tip III, toplum kaynaklı MRSA suşlarında %40 (2/5) oranında SCCmec tip IV varlığı bulunmuştur. SEA tespit edilen izolatların çoğunun (40/47, %85.1) hastane kaynaklı olup metisiline dirençli oldukları belirlenmiştir. MLVA yöntemine göre hastane ve toplum kaynaklı grupların kümeleşme oranları, klon sayıları, özgün profil sayıları sırasıyla %73.6 ve %57.3, %34 ve %47, %19 ve %32 olarak saptanmıştır. Sonuç olarak, hastane kaynaklı MRSA izolatlarında yüksek oranda SEA tespit edilmesi, bu toksin ile antibiyotik direnç gelişimi arasında bir ilişki olabileceğini düşündürmüştür.
Anahtar sözcükler: Staphylococcus aureus; virülans faktörleri; MLVA tiplendirme.
ABSTRACT
Staphylococcus aureus is the most common cause of skin and soft tissue infections in the community and the most important cause of nosocomial infections. In this research, it was aimed to detect the presence of staphylococcal enterotoxin A to D (SEA, SEB, SEC and SED, respectively), toxic shock syndrome toxin-1 (TSST-1), Panton-Valentine leukocidin (PVL) and SCCmec phenotype in methicillin-resistant S.aureus (MRSA) isolates and to demonstrate the genotypic association between hospital acquired and community acquired isolates. In the study the virulence factors of 147 S.aureus strains isolated from various clinical samples at Gulhane Military Medical Academy Hospital Microbiology Laboratory between 2007 and 2010 were investigated by real-time polymerase chain reaction. MLVA (multiple locus variable number of tandem repeat analysis) method was used to demonstrate the genotypic association between hospital- and community-acquired isolates. Seventy-two (%48.9) of 147 S.aureus isolates were determined as community acquired and 75 (%51.1) as hospital acquired. Ninety-three (63.2%) isolates possesed at least one toxin (77 strains harboured one, and 16 strains harboured more than one). Of the isolates in which toxin was detected 59.1% (55/93) were hospital acquired, 40.9% (38/93) were community acquired. SEA was determined in 59 (40.1%), SEB in 8 (5.4%), SEC in 12 (8.1%), SED in 8 (5.4%), TSST-1 in 17 (11.5%) and PVL in 6 (4.0%) of the isolates. Methicillin resistance was determined in 61.1% (44/72) of the hospital acquired isolates and 6.7% of the (5/75) community acquired isolates. In our study, SCCmec type III was detected in 90.9% (40/44) of hospital acquired MRSA isolates and SCCmec type IV in 40.0% (2/5) of community acquired MRSA isolates. Most of the strains (40/47; 85.1%) carrying SEA were hospital acquired, and they were determined as methicillin-resistant. According to MLVA, hospital and community acquired groups' clustering rates, number of clones, number of unique profile were determined as; 73.6% and 57.3%; 34% and 47%; 19% and 32%, respectively. It was concluded that high prevalence of SEA toxin in hospital acquired MRSA isolates indicated that there was a possible association between the presence of toxin and antimicrobial resistance.
Key words: Staphylococcus aureus; virulence factors; MLVA typing.
Geliş Tarihi (Received): 31.01.2012 • Kabul Ediliş Tarihi (Accepted): 12.06.2012
GİRİŞ
Staphylococcus aureus, tüm dünyada toplum ve hastane kaynaklı enfeksiyonların en önemli etkenlerinden biri olup, hastane kaynaklı pnömoni ve cerrahi yara enfeksiyonlarının en sık; kan akımı, kardiyovasküler, göz, kulak, burun ve boğaz enfeksiyonlarının ikinci sıklıkla nedenidir1,2. Bu enfeksiyonlarda, S.aureus'un hücre yüzeyinde bulunan ve hücre dışına salgılanan virülans faktörleri önemli rol oynamaktadır. S.aureus izolatlarının virülansı, tek başına bu biyolojik faktörlerden herhangi birisine bağlı olmayıp birkaçının beraber oluşturduğu etkiler sonucu oluşmaktadır. S.aureus beş farklı sitolitik ya da membran yıkıcı toksin [alfa, beta, gama, delta ve Panton Valentin lökosidin (PVL)], iki eksfolyatif toksin (A ve B), sekiz enterotoksin (A-E, G-I) ve toksik şok sendromu toksin-1 (TŞST-1) gibi çok sayıda toksin oluşturmaktadır3. Stafilokokal enterotoksinler (SE)'in neden olduğu gıda zehirlenmeleri, gıda kaynaklı gelişen hastalıkların en sık ikinci nedenidir4. Stafilokokların oluşturduğu bir başka toksin olan TŞST-1, özellikle menstrüel dönemde gelişen toksik şok sendromu olgularının %90'ından fazlasında tespit edilmektedir5.
S.aureus'un önemli virülans faktörlerinden biri de PVL'dir. PVL'nin özellikle polimorfonükleer lökositler (PMNL) üzerinde açtığı porlar sayesinde hücre lizisine neden olarak etkisini gösterdiği tahmin edilmektedir3. PVL toksinine sahip olan izolatların ciddi deri ve yumuşak doku enfeksiyonları ile nekrotizan pnömonilere neden olduğu bilinmektedir6. S.aureus'un sahip olduğu yapısal ya da kazanılmış antimikrobiyal ilaç direnç özelliği de önemli bir virülans faktörü olarak gösterilmektedir7. Metisiline dirençli S.aureus (MRSA) dünya genelinde epidemi ve endemilere yol açan bir bakteri haline gelmiştir.
Bu çalışmanın amacı, çeşitli klinik örneklerden elde edilen toplum ve hastane kaynaklı S.aureus izolatlarında stafilokokal enterotoksinler (SEA, SEB, SEC ve SED), TŞST-1, PVL varlığının ve SCCmec fenotiplerinin (MRSA izolatlarında) gerçek zamanlı polimeraz zincir reaksiyonu (Rt-PCR) yöntemi ile tespit edilmesi ve MLVA (multiple-locus variable-number tandem-repeat analysis) yöntemiyle hastane ve toplum kaynaklı izolatlar arasındaki klonal ilişkinin incelenmesidir.
GEREÇ ve YÖNTEM
Bakteriyel İzolatlar, Tanımlama ve Antibiyotik Direnci
Çalışmaya Gülhane Askeri Tıp Akademisi Tıbbi Mikrobiyoloji Anabilim Dalı Başkanlığı Mikrobiyoloji Laboratuvarına Kasım 2007-Aralık 2010 tarihleri arasında kliniklerde yatan ve polikliniklere başvuran hastalardan gönderilen örneklerden izole edilen toplam 147 adet S.aureus izolatı dahil edildi. Her hastadan tek bir izolat alındı. Hastane kaynaklı enfeksiyonlar CDC kriterlerine göre tanımlandı8. S.aureus üremesi olan hastaların yattıkları klinik, klinik örneğin alındığı yer ve tarih bilgileri kaydedildi.
Laboratuvara gelen örnekler tiplerine göre uygun besiyerlerine ekildi. Üreyen kolonilerden koloni morfolojileri stafilokoklara uyan, Gram ile pozitif boyanan ve katalaz testi pozitif olanlara koagülaz testi uygulandı. Tavşan plazmasında koagülasyona neden olan suşlar S.aureus olarak kabul edildi9. Geleneksel tanımlamanın doğrulanması ve antibiyogram işlemi Phoenix 100 (Becton Dickinson, ABD) otomatize sistemiyle yapıldı10. Oksasilin direnci, CLSI (Clinical and Laboratory Standards Institute) önerileri doğrultusunda sefoksitin diski kullanılarak disk difüzyon yöntemi ile araştırıldı11. Çalışmanın diğer aşamaları için saf izolatlar %10'luk skim milk solüsyonunda (Sigma, ABD) -80°C'de saklandı.
Toksin Genlerinin ve SCCmec Tiplerinin Rt-PCR ile Tespiti
Koyun kanlı agar besiyerinde 24 saatlik inkübasyon sonrasında saf olarak üremiş S.aureus kolonilerinden 0.5 McFarland bulanıklık olacak şekilde süspansiyon hazırlandı. Buradan 1 µl bakteri süspansiyonu 24 µl'lik 1X PCR tamponu [0.2 mM dNTP (Sigma, ABD), 4 mM MgCl2 (Sigma, ABD), primerlerin her birinden 0.5 µl (50 pmol/ml) (Metabion, Almanya), her bir florofor probdan 0.25 µl (100 pmol/ml) (Metabion, Almanya), 0.2 µl Super Hot Taq DNA polimeraz (Bioron, ABD) (5 U/µl)] karışımına eklenerek 25 µl'lik toplam hacim elde edildi. PCR döngüleri 95°C'de 10 dakika başlangıç denatürasyonu, 40 siklus; 95°C'de 15 saniye denatürasyon, 60°C'de 1 dakika bağlanma ve uzama olarak ayarlandı12. Çalışmada S.aureus'a ait toksinleri kodlayan genlerin varlığını ve MRSA suşlarında SCCmec tipini belirlemek amacıyla kullanılan primer dizileri Tablo I'de verildi13. Multipleks PCR için beş ayrı multipleks PCR karışımı hazırlandı. Birinci multipleks karışımı sea, seb, sec, ikincisi sed ve tst, üçüncüsü SCCmec tip I ve SCCmec tip II, dördüncüsü SCCmec tip III ve SCCmec tip IV, sonuncusu SCCmec tip V ve pvl genlerinin belirlenebilmesi için hazırlandı. Hedef gen bölgelerinin tespitinde pozitif kontrol olarak sea için S.aureus ATCC 10652, seb için S.aureus ATCC 10654, sec için S.aureus ATCC 10655, sed için S.aureus ATCC 10656, pvl için S.aureus Hershey MC 901, tst ve SCCmec tip II için S.aureus N315, SCCmec tip I için S.aureus NCTC 10442, SCCmec tip III için S.aureus 85/2082, SCCmec tip IV için S.aureus JCSC 4744 suşları kullanıldı.
S.aureus İzolatlarının Moleküler Tiplendirilmesi
S.aureus DNA izolasyonu fenol:kloroform:izoamilalkol yöntemi kullanılarak yapıldı14. MLVA yönteminde farklı genotiplere ait izolatları belirlemek amacıyla kullanılan primerler Tablo II'de gösterildi15,16. Bu yöntem için iki ayrı PCR karışımı hazırlandı. ilk karışımda 45 µl 2X PCR tamponuna [0.2 µl Taq DNA polimeraz (Bioron, ABD) (5 U/µl) 2 mM MgCl2 (Sigma, ABD), 0.2 mM dNTP (Sigma, ABD), SspA-F, SspA-R primerlerinden 10'ar pmol (Alpha DNA, ABD), Siru-21-F, Siru-21-R primerlerinden 1.25'er pmol (Alpha DNA, ABD), Clfb-F, Clfb-R primerlerinden 1'er pmol (Alpha DNA, ABD)] kalıp DNA'dan 5 µl eklenerek 50 µl'lik toplam hacim elde edildi. İkinci karışımda ise 45 µl 2X PCR tamponu [0.2 µl Taq DNA polimeraz (5 U/ µl) (Bioron,ABD), 2 mM MgCl2 (Sigma, ABD) 0.2 mM dNTP (Sigma, ABD), Spa-F, Spa-R, ClfA-F, ClfA-R primerlerinin her birinden 10'ar pmol (Alpha DNA, ABD)] kalıp DNA'dan 5 µl eklenerek 50 µl'lik toplam hacim elde edildi. PCR döngüleri 95°C'de 10 dakika başlangıç denatürasyonu; 40 siklus; 95°C'de 15 saniye, 60°C'de 1 dakika, 72°C'de 30 saniye, 72°C'de 5 dakika son uzama olacak şekilde ayarlandı15. Elektroforez işlemini takiben örneklere ait DNA bantları görüntüleme cihazında Trackit 100 bp DNA Ladder (In vitro Gen, ABD) belirteçleri ile karşılaştırıldıktan sonra elde edilen sayısal değerler Bionumerics (Applied Maths, Belçika) 6.0.1 versiyonlu program kullanılarak değerlendirildi. MLVA yöntemi her gen bölgesine ait sıralı tekrar sayısının farklı olabilmesi esasına dayandığı için en az bir banda ait değişiklik farklı bir genotip olarak değerlendirildi16.
İstatistiksel Analiz
Verilerin analizi SPSS 11.5 paket programında yapıldı. Kullanılacak test yöntemi örnek sayısı dikkate alınarak birtakım kriterlere göre belirlendi. Tanımlayıcı istatistikler gözlem sayısı ve yüzde şeklinde verildi. Kategorik karşılaştırmalar için Pearson ki-kare ve Fisher'in kesin testi kullanıldı; p≤ 0.05 ise sonuçlar anlamlı kabul edildi17.
BULGULAR
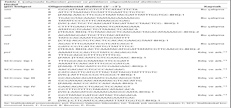
Bu çalışmaya, toplum kaynaklı 75 (%51.1) ve hastane kaynaklı 72 (%48.9) olmak üzere toplam 147 S.aureus izolatı dahil edilmiştir. Metisilin direnci hastane kaynaklı izolatların %61.1 (44/72)'inde, toplum kaynaklı izolatların %6.75 (n= 5/75)'inde tespit edilmiştir. Hastane kaynaklı izolatlar en sık kan örneklerinden (35/72, %48.7), toplum kaynaklı örnekler ise en sık idrar örneklerinden (34/75, %45.3) izole edilmiştir. MRSA izolatları değerlendirildiğinde ise hastane kaynaklı izolatların en sık kan örneklerinden (18/44, %40.9), toplum kaynaklı olanların ise idrar örneklerinden izole edildiği görülmüştür (Tablo III).
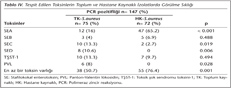
Toplam 147 izolatın 93 (%63.2)'ünde bir veya birden fazla toksin varlığı saptanmış; bu izolatların 77'sinde sadece bir toksin tespit edilirken, 16'sında birden fazla toksin tespit edilmiştir. Toksin tespit edilen izolatların %59.1 (55/93)'i hastane kaynaklı, %40.9 (38/93)'u ise toplum kaynaklıdır. SEA toplam 147 izolatın 59 (%40.1)'unda, SEB 8 (%5.4)'inde, SEC 12 (%8.1)'sinde, SED 8 (%5.4)'inde, TŞST-1 17 (%11.5)'sinde ve PVL 6 (%4)'sında tespit edilmiştir. Birden fazla toksin içeren izolatlarda en sık SEA ile TŞST-1 kombinasyonunun (6/16, %37.5) olduğu izlenmiştir. Bunu sırasıyla SEA + SEB (3/16, %18.7) ve SEB + PVL birlikteliği (2/16, %12.5) takip etmiştir. SEC ile TSŞT-1; SED ile TSŞT-1, SED ile PVL ise yalnızca birer izolatta beraber olarak tespit edilmiştir. Sadece bir suşta SEC, TSŞT-1 ve PVL'nin her üçü birarada saptanmıştır. PVL saptanan altı suşun tamamı toplum kaynaklı S.aureus olup, üç tanesi apse, iki tanesi yara, bir tanesi de idrar örneğinden izole edilmiştir.
Çalışmada tespit edilen toksinlerin hastane ve toplum kaynaklı izolatlar arasındaki dağılımı incelendiğinde, hastane kaynaklı izolatlarda toksin bulunma sıklığının daha fazla olduğu ve bu iki kaynak grup arasında SEA, SEC, SED ile PVL dağılımı açısından istatistiksel olarak anlamlı farklar olduğu tespit edilmiştir (Tablo IV).
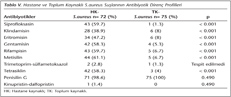
Hastane kaynaklı (HK) ve toplum kaynaklı (TK) izolatların antibiyotiklere direnç durumlarına bakıldığında; tüm izolatların vankomisin, teikoplanin ve linezolide duyarlı olduğu görülmüştür. HK izolatlar, kinupristin-dalfopristin, trimetoprim-sülfametoksazol ve penisilin G dışındaki antibiyotiklere TK izolatlara göre istatistiksel olarak anlamlı oranda daha dirençli bulunmuştur (p< 0.05) (Tablo V). Metisilin direnci HK izolatların %61.1 (44/72)'inde, TK izolatların %6.75 (n= 5/75)'inde tespit edilmiştir. TK grupta metisiline dirençli olan suşların 2'sinde SCCmec tip IV kromozomal gen kaset bölgesi saptanırken, üç izolat tiplendirilememiştir. HK grupta metisiline dirençli olan toplam 44 izolatın 40'ında (%90.9) SCCmec tip III, birinde (%2.2) tip IV bulunmuş; üç izolat tiplendirilememiştir. Toksin varlığı ile izolatların antimikrobiyal direnç profilleri arasındaki ilişki incelendiğinde; SEA taşıyan izolatların %74.5 (44/59)'inde çoklu ilaç direnci tespit edilirken, diğer toksin taşıyan izolatların hiçbirinde çoklu ilaç direnci tespit edilememiştir. HK izolatlar içerisinde SEA pozitif izolatların %85.7 (40/47)'sinin metisiline dirençli olduğu görülmüştür. HK-MRSA'ların %95.4 (42/44)'ünde SEA tespit edilmiştir.
MLVA yöntemiyle yapılan filogenetik analiz değerlendirildiğinde; izolatların 67 farklı klona sahip olup, bu klonlar içerisinde 37'sinin özgül profil sergilerken diğer 30 klonun içerisinde birden fazla izolat bulunan küme yapısında olduğu görülmüştür. Küme içerisinde yer alan izolatların sayısı ise 110'dur. Dolayısıyla kümeleşme oranı %74.8 (110/147) olarak tespit edilmiştir. Küme genişliği ise 2 ila 12 izolat arasında değişmektedir (Şekil I). Hastane kaynaklı 72 izolatın MLVA yöntemi ile yapılan filogenetik analizinde toplam 34 farklı klon tespit edilirken, bunların 19'unun özgün profile sahip olduğu [altısı MRSA, 13'ü metisiline duyarlı S.aureus (MSSA)] 15'inin küme yaptığı ve bu kümeler içerisindeki izolat sayısının 53 olduğu (53/72, %73.6) tespit edilmiştir. Küme genişliği ise 2-11 izolat arasında değişmektedir. Toplum kaynaklı 75 izolatın MLVA yöntemi ile yapılan filogenetik analizi değerlendirildiğinde ise farklı klon sayısının (47 klon) ve özgün profil sayısının (32 özgün profil) hastane kaynaklı izolatlardan fazla olduğu, küme sayısının aynı olduğu (15 küme), kümeler içerisindeki izolat sayısının ise daha az olduğu (43/75, %57.3) görülmüştür. Küme genişliği ise 2 ila 4 izolat arasında değişmektedir.
TARTIŞMA
S.aureus hem sağlıklı kişiler hem de çeşitli nedenlerden dolayı bağışıklık sistemi zayıflamış kişilerde hastane ve toplum kaynaklı enfeksiyonlara neden olan en önemli etkenlerden biridir18. Çalışmamızda HK ve TK S.aureus suşlarında önemli olduğu düşünülen virulans faktörleri araştırılarak iki grubun birbiriyle olan genotipik ilişkisi incelenmiştir. Toplum kaynaklı MRSA ve MSSA izolatlarının yaptığı enfeksiyonlar genel olarak birbirine benzemekte ve bu izolatlar en sık deri ve yumuşak doku enfeksiyonları (DYDE)'na neden olmaktadır19. Naimi ve arkadaşlarının20 yaptığı çalışmada TK-MRSA izolatlarının neden olduğu enfeksiyonlar arasında DYDE %75 sıklıkla ilk sırada gelmektedir. Herold ve arkadaşlarının21 yaptığı çalışmada da %49.1 sıklıkla DYDE ilk sırada gelirken bu enfeksiyonları derin doku enfeksiyonları (%25.8) izlemektedir. Çalışmamızda, diğer çalışmaların aksine toplum kaynaklı MRSA ve MSSA izolatları en sık olarak idrar örneklerinden (34/75, %45.3) izole edilmiştir. Bu durumun ciddi DYDE'nin gelişmesine yol açan S.aureus'larda var olan PVL'nin izolatlarımızın çoğunda bulunmamasından kaynaklandığı düşünülmüştür.
HK S.aureus izolatlarının en sık olarak bakteriyemi şeklinde klinik tablo oluşturduğu bildirilmektedir21,22. İtalya'da yapılan bir çalışmada HK S.aureus izolatlarının tüm klinik tablolar içerisinde %60.2 oranında bakteriyemiye neden olduğu tespit edilmiştir23. Klevens ve arkadaşlarının24 çalışmasında da HK-MRSA enfeksiyonları içerisinde bakteriyemi %75.6'lık sıklıkla yine en sık tespit edilen enfeksiyon olmuştur. Çalışmamızda, HK S.aureus'ların diğer çalışmalarla uyumlu olarak en sık bakteriyemiye (%48.7) ikinci sıklıkla ise DYDE'ye (%22.2) neden olduğu tespit edilmiştir. HK izolatlar TK izolatlarla kıyaslandığında daha invazif enfeksiyonlar oluşturduğu görülmüştür. Bu durumun özellikle HK izolatların çoğunun metisilline dirençli olmalarına ve en az bir toksin taşıyan izolat sayısının daha fazla olmasına bağlı olduğu düşünülmüştür (p< 0.001).
Çalışmamızda, TK ve HK suşlarda stafilokokal enterotoksinler grubunda yer alan toksinler (SEA, SEB, SEC ve SED) ile PVL ve TŞST-1 sıklığı araştırılmıştır. Bu toksinlerin seçilmesindeki amaç toksinlerin süperantijen özelliğinde olup immün sistemi oldukça güçlü bir şekilde etkileyebilmeleridir3. Kim ve arkadaşları25 tarafından yapılan çalışmada toksinlerden en az birinin tespit edildiği izolatların tüm izolatlara oranı %73.4, Hu ve arkadaşlarının26 çalışmasında ise %62.4 olarak bildirilmiştir. Demir ve arkadaşlarının27 çalışmasında, çeşitli klinik örneklerden izole edilmiş 120 S.aureus izolatının %61.4'ünde en az bir toksin tespit edilmiştir. Çalışmamızda, tüm izolatlar değerlendirildiğinde en az bir toksine sahip izolat oranı (%63.2) hem yurt içi hem de yurt dışı çalışmalarla uyumlu bulunmuştur. Araştırılan toksinler içerisinde farklı toksinler değişik oranlarda tespit edilebilmektedir. Ülkemizde yapılan bir çalışmada27 SEA %26.4, Japonya26 ve İtalya'da23 yapılan çalışmalarda SEC sırasıyla %43.4 ve %58.9, Çin'de25 yapılan çalışmada ise TŞST-1 %40.8 oranıyla en sık tespit edilen toksin olmuştur. Çalışmamızda SEA en çok tespit edilen toksindir (59 izolat; %40.1). SEA taşıyan izolatların 47 (%79.6)'si hastane, 12'si ise toplum kaynaklıdır (p< 0.001). Bu veriler, toksinlerin bulunma sıklığının coğrafi özelliklere göre değişkenlik gösterebildiğini vurgulamaktadır.
HK ve TK izolatların toksin profilleriyle ilgili olarak yapılmış çok fazla çalışma olmamakla beraber, İtalya'da yapılan bir çalışmada SEC varlığı TK ve HK izolatlarının sırasıyla %75.5 ve %53.2'sinde, TŞST-1 varlığı ise %8.1 ve %27.7'sinde tespit edilmiş ve bu farklar istatistiksel olarak anlamlı bulunmuştur23. Çalışmamızda ise araştırılan toksinler içerisinde SEA, HK izolatlarda (p< 0.001), SEC ve SED ise TK izolatlarda (sırasıyla p= 0.019 ve p= 0.006) istatistiksel olarak anlamlı bir fark yaratacak şekilde daha sık tespit edilmiştir.
PVL, sıklıkla TK-MRSA suşlarında tespit edilen bir virulans belirteci olup çoğunlukla nekrotizan pnömoni ve ciddi DYDE ile ilişkilidir28. 2005 yılında İngiltere'de yapılan epidemiyolojik bir çalışmada29 S.aureus izolatlarında PVL sıklığı %1.6, Fransa'da30 ise %2 olarak tespit edilmiştir. PVL 2003-2006 yıllarını kapsayan dönemde hastanemizde yapılan çalışmada MRSA izolatları arasında %1.3 (5/370) oranında tespit edilmiştir12. Türkiye'de yapılan farklı çalışmalarda PVL'nin S.aureus izolatlarında saptanma oranının %2-3.9 arasında değiştiği bildirilmektedir9,31. Çalışmamızda izole edilen HK suşlarda PVL saptanmamış olmakla beraber, bu toksini taşıyan suşların ek virülans özelliği kazandığı bilindiğinden6 HK-MRSA suşlarında bu toksinin varlığının takip edilmesi gerekmektedir.
Son yıllarda yapılan çalışmalarda TK S.aureus izolatlarında da metisilin direncinin artmakta olduğu görülmektedir32. Çalışmamızda bu oran %6.7 olarak bulunurken yurt içinde yapılan iki farklı çalışmada bu oranlar %21.6 ve %27 olarak tespit edilmiştir33,34. Yurt dışında bu oran Scazzocchio ve arkadaşlarının23 çalışmasında %19.1, Groom ve arkadaşlarının35 çalışmasında ise %58.9 olarak bildirilmiştir. Yurt içi ve dışından yapılan çalışmalarla kıyaslandığında çalışmamızda yer alan TK izolatlar arasındaki düşük metisilin direnci oranı dikkat çekmektedir.
Metisiline dirençli olan izolatların SCCmec tipleri incelendiğinde, tip IV ve V'in genellikle TK-MRSA izolatlarında, SCCmec tip I, II ve III'ün ise HK suşlardan izole edilmesi, yakın zamana kadar bu tiplendirmeyi HK ve TK MRSA izolatlarını birbirinden ayırt etmek için kullanılabilir kılmaktaydı36. SCCmec tip IV ve V taşıyan suşların HK yayılım yapma potansiyeliyle beraber hastane ortamında görülmesi, SCCmec tip I, II, III taşıyan suşların da nihayetinde toplum içerisinde yayılabileceğini düşündürmektedir12,37. Bu nedenle SCCmec tiplendirmesi TK ve HK MRSA izolatlarının klonal yayılımını birbirinden ayırt edebilecek bir yöntem olarak değerlendirilmemektedir12. Çalışmamızda HK-MRSA suşlarında %90.9 (40/44) oranında SCCmec tip III, %2.2 (1/44) oranında SCCmec tip IV, TK-MRSA suşlarında ise %40 (2/5) SCCmec tip IV tespit edilirken geri kalan izolatların tiplendirilmesi yapılamamıştır.
Toksin varlığı ile izolatların antimikrobiyal direnç profilleri beraber değerlendirildiğinde, SEA taşıyan izolatların %74.5 (44/59)'inde çoklu ilaç direnci tespit edilmiştir. Özellikle HK izolatlar değerlendirildiğinde SEA pozitif izolatların %85.7 (40/47)'sinin metisiline dirençli olduğu görülmüştür. HK-MRSA izolatları genel olarak beta-laktam grubunun dışında kalan antibiyotiklere çoklu ilaç direnci göstermektedir38. HK-MRSA'ların 42'sinde SEA varlığının gösterilmesi, direnç gelişimi ile SEA varlığı arasında bir ilişkinin olabileceğini düşündürmektedir. SEA dışında kalan toksinler değerlendirildiğinde izolatların SEB, SEC, SED ve TŞST-1 toksinlerinden birisine sahip olsa bile herhangi bir direnç paterni ile ilişkilendirilemediği görülmüştür. SE'ler ile direnç arasındaki ilişkinin gösterilebilmesi için bu toksin genlerinin izolatlardaki kromozomal yerleşimlerinin ileri yöntemlerle incelenmesi gerekmektedir.
MLVA yöntemi ile stafilokokların genotipik tiplendirme sonuçları PFGE ve diğer tiplendirme yöntemlerinin sonuçlarıyla paralellik göstermektedir14,39. Çalışmamızda MLVA analizi sonucunda HK grubun içerisindeki izolatların %73.6, TK olanların ise %57.3 oranında kümeleşme yaptığı tespit edilmiştir. Bu sonuç HK izolatların genetik homojenitesinin TK izolatlara kıyasla yüksek, heterojenitesinin ise düşük olduğunu göstermektedir. Her iki gruptaki izolatların yarısından fazlasının küme içerisinde bulunması ise aktif ya da devam eden bulaşı göstermektedir. Detaylı yapılan kümeleşme analizleri S.aureus izolatlarının gerek hastane gerekse de toplum içerisinde yayılımını önlemek maksadıyla geliştirilen kontrol stratejileri için çok önemli bilgiler sağlayacaktır. Tüm izolatların filogenetik analizi incelendiğinde kümeleşme oranı %74.8 olarak bulunmuştur. Bu oran, toplum ve hastane kaynaklı izolatlarda ayrı ayrı değerlendirildiğinde düşmektedir (HK grup %73.6, TK grup %57.3). Bu sonuç HK ve TK izolatların beraber aynı küme içerisinde yer aldığı ve suşlar HK ve TK olarak gruplara ayrıldığında kendi grubu içerisinde bu suşların özgün profil sergilediği şeklinde yorumlanmıştır. HK izolatlar içerisinde metisiline dirençli ve duyarlı olan suşlar incelendiğinde 44 adet HK-MRSA içerisinde özgün profili olan 6 izolat varken, 28 adet HK-MSSA içerisinde bu sayı 13 olarak bulunmuştur. Buradan da anlaşılabileceği gibi hastane kaynaklı grup içerisinde metisiline dirençli olan izolatların genotipik ilişkisi metisiline duyarlı olan izolatlara göre daha kuvvetlidir.
TEŞEKKÜR
Çalışmanın tüm aşamalarındaki yardımlarından ötürü Dr. Bio. Aylin Üsküdar Güçlü, Bio. Sinem Kaya İnan ve laboratuvar teknisyeni Yakup Alptekin'e teşekkürlerimizi sunarız.
KAYNAKLAR
- Nhan TX, Leclercq R, Cattoir V. Prevalence of toxin genes in consecutive clinical isolates of Staphylococcus aureus and clinical impact. Eur J Clin Microbiol Infect Dis 2011; 30(6): 719-25. [Özet]
- Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guideline for prevention of surgical site infection. Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidemiol 1999; 20(4): 250-78.
- Bohach GA. Staphylococcus aureus exotoxins, pp: 464-77. In: Vincent AF, Richard PN, Joseph JF (eds), Gram-Positive Pathogens. 2006, 2th ed. ASM Press, Washigton, DC.
-
Pinchuk IV, Beswick EJ, Reyes VE. Staphylococcal enterotoxins. Toxins
2010; 2(8): 2177-97.
[Özet] [Tam Metin] [PDF] - Manders SM. Toxin-mediated streptococcal and staphylococcal disease. J Am Acad Dermatol 1998; 39(3): 383-98. [Özet]
- Boyle-Vavra S, Daum RS. Community-acquired methicillin-resistant Staphylococcus aureus: the role of Panton-Valentine leukocidin. Lab Invest 2006; 87(1): 3-9. [Özet] [Tam Metin] [PDF]
- Deresinski S. Methicillin-resistant Staphylococcus aureus: an evolutionary, epidemiologic, and therapeutic odyssey. Clin Infect Dis 2005; 40(4): 562-73. [Özet] [Tam Metin] [PDF]
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008; 36(5): 309-32.
- Cirit OS. Staphylococcus aureus klinik izolatlarında Panton-Valentin lökosidin varlığının araştırılması. Uzmanlık Tezi, 2009. Ondokuz Mayıs Üniversitesi Tıp Fakültesi, Samsun.
- Layer F, Ghebremedhin B, Moder KA, König W, König B. Comparative study using various methods for identification of Staphylococcus species in clinical specimens. J Clin Microbiol 2006; 44(8): 2824-30. [Özet] [Tam Metin] [PDF]
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 20th Informational Supplement. Document M100-S20, 2010. CLSI, Wayne, PA.
- Kiliç A, Guclu AU, Senses Z, Bedir O, Aydogan H, Basustaoglu AC. Staphylococcal cassette chromosome mec (SCCmec) characterization and Panton-Valentine leukocidin gene occurrence for methicillin-resistant Staphylococcus aureus in Turkey, from 2003 to 2006. Antonie Van Leeuwenhoek 2008; 94(4): 607-14. [Özet]
-
Kiliç A, Li H, Stratton CW, Tang YW. Antimicrobial susceptibility
patterns and staphylococcal cassette chromosome mec types of, as well as
Panton-Valentine leukocidin occurrence among, methicillin-resistant Staphylococcus
aureus isolates from children and adults in middle Tennessee. J Clin
Microbiol 2006; 44(12): 4436-40.
[Özet] [Tam Metin] [PDF] - Kumar R, Yadav BR, Dev K, Singh RS. A simple protocol for DNA extraction from Staphylococcus aureus. http://www.protocol-online.org/prot/Protocols/A-Simple-Protocol-for-DNA-Extraction-from-Staphylococcus-Aureus-4999.html
- Sabat A, Krzyszton-Russjan J, Strzalka W, et al. New method for typing Staphylococcus aureus strains: multiple-locus variable-number tandem repeat analysis of polymorphism and genetic relationships of clinical isolates. J Clin Microbiol 2003; 41(4): 1801-4. [Özet] [Tam Metin] [PDF]
-
Rasschaert G, Vanderhaeghen W, Dewaele I, et al. Comparison of
fingerprinting methods for typing methicillin-resistant Staphylococcus
aureus sequence type 398. J Clin Microbiol 2009; 47(10): 3313-22.
[Özet] [Tam Metin] [PDF] - Baranovich T, Zaraket H, Shabana II, Nevzorova V, Turcutyuicov V. Molecular characterization and susceptibility of methicillin-resistant and methicillin-susceptible Staphylococcus aureus isolates from hospitals and the community in Vladivostok, Russia. Clin Microbiol Infect 2010; 16(6):575-82. [Özet] [Tam Metin] [PDF]
- Van der Mee-Marquet N, Blanchard M, Domelier AS, Quentin R. Virulence and antibiotic susceptibility of Staphylococcus aureus strains isolated from various origins. Pathol Biol (Paris) 2004; 52(10): 579-83. [Özet]
- Padmanabhan RA, Fraser TG. The emergence of methicillin-resistant Staphylococcus aureus in the community. Cleve Clin J Med 2005; 72(3): 235-41. [Özet] [PDF]
- Naimi TS, LeDell KH, Como-Sabetti K, et al. Comparison of community- and health care-associated methicillin-resistant Staphylococcus aureus infection. JAMA 2003; 290(22): 2976-84. [Özet]
- Herold BC, Immergluck LC, Maranan MC, et al. Community-acquired methicillin-resistant Staphylococcus aureus in children with no identified predisposing risk. JAMA 1998; 279(8): 593-8. [Özet]
-
Popovich KJ, Weinstein RA, Hota B. Are community-associated
methicillin-resistant Staphylococcus aureus (MRSA) strains replacing
traditional nosocomial MRSA strains? Clin Infect Dis 2008; 46(6): 787-94.
[Özet] [Tam Metin] [PDF] - Scazzocchio F, Aquilanti L, Tabacchini C, Lebba V, Passariello C. Microbiological and molecular characterization of nosocomial and community Staphylococcus aureus isolates. Epidemiol Infect 2011; 139(4): 613-22. [Özet]
- Klevens RM, Morrison MA, Nadle J, et al. Active bacterial core surveillance (ABCs) MRSA investigators, invasive methicillin-resistant Staphylococcus aureus infections in the United States. JAMA 2007; 298(15): 1763-71. [Özet]
- Kim JS, Song W, Kim HS, et al. Association between the methicillin resistance of clinical isolates of Staphylococcus aureus, their staphylococcal cassette chromosome mec (SCCmec) subtype classification, and their toxin gene profiles. Diagn Microbiol Infect Dis 2006; 56(3): 289-95. [Özet]
-
Hu DL, Omoe K, Inoue F, et al. Comparative prevalence of superantigenic
toxin genes in meticillin-resistant and meticillin-susceptible Staphylococcus
aureus isolates. Med Microbiol 2008; 57(Pt 9):1106-12.
[Özet] [Tam Metin] [PDF] - Demir C, Aslantaş O, Duran N, Ocak S, Ozer B. Investigation of toxin genes in Staphylococcus aureus strains isolated in Mustafa Kemal University Hospital. Turk J Med Sci 2011; 41 (2): 343-52. [Özet] [PDF]
- Boussaud V, Parrot A, Mayaud C, et al. Life-threatening hemoptysis in adults with community-acquired pneumonia due to Panton-Valentine leukocidin-secreting Staphylococcus aureus. Intensive Care Med 2003; 29(10):1840-3. [Özet]
- Holmes A, Ganner M, McGuane S, Pitt TL, Cookson BD, Kearns AM. Staphylococcus aureus isolates carrying Panton-Valentine leucocidin genes in England and Wales: frequency, characterization, and association with clinical disease. J Clin Microbiol 2005; 43(5): 2384-90. [Özet] [Tam Metin] [PDF]
-
Issartel B, Tristan A, Lechevallier S, et al. Frequent carriage of
Panton-Valentine leucocidin genes by Staphylococcus aureus isolates from
surgically drained abscesses. J Clin Microbiol 2005; 43(7): 3203-7.
[Özet] [Tam Metin] [PDF] - Karahan ZC, Tekeli A, Adaleti R, Koyuncu E, Dolapci I, Akan OA. Investigation of Panton-Valentine leukocidin genes and SCCmec types in clinical Staphylococcus aureus isolates from Turkey. Microb Drug Resist 2008; 14(3): 203-10. [Özet]
-
Maree CL, Daum RS, Boyle-Vavra S, Matayoshi K, Miller LG.
Community-associated methicillin-resistant Staphylococcus aureus
isolates causing healthcare-associated infections. Emerg Infect Dis 2007;
13(2): 236-42.
[Özet] [Tam Metin] [PDF] - Altoparlak Ü, Uslu H, Kireççi E, Aktaş F. Klinik örneklerden izole edilen stafilokoklarda antibiyotik direnci. Ankem Derg 2002; 16(1): 69-72. [PDF]
- Kurutepe S, Sürücüoğlu S, Gazi H, Özbakkaloğlu B, Teker A. Metisiline dirençli ve duyarlı Staphylococcus aureus suşlarının antibiyotiklere direnç oranları. İnfeksiyon Derg 2007; 21(4): 187-91. [Özet] [PDF]
- Groom AV, Wolsey DH, Naimi TS, Smith K, et al. Community-acquired methicillin-resistant Staphylococcus aureus in a rural American Indian community. JAMA 2001; 286(10):1201-5. [Özet]
- Okuma K, Iwakawa K, Turnidge JD, et al. Dissemination of new methicillin-resistant Staphylococcus aureus clones in the community. Microbiol 2002; 40(11): 4289-94. [Özet] [Tam Metin] [PDF]
-
Seybold U, Halvosa JS, White N, Voris V, Ray SM, Blumberg HM. Emergence
of and risk factors for methicillin-resistant Staphylococcus aureus of
community origin in intensive care nurseries. Pediatrics 2008; 122(5): 1039-46.
[Özet] [Tam Metin] [PDF] -
Fey PD, Saïd-Salim B, Rupp ME, et al. Comparative molecular analysis of
community- or hospital-acquired methicillin-resistant Staphylococcus aureus.
Antimicrob Agents Chemother 2003; 47(1): 196-203.
[Özet] [Tam Metin] [PDF] - Malachowa N, DeLeo FR. Mobile genetic elements of Staphylococcus aureus. Cell Mol Life Sci 2010; 67(18): 3057-71. [Özet] [Tam Metin] [PDF]
İletişim (Correspondence):
Uzm. Dr. Soner Yılmaz,
Gülhane Askeri Tıp Akademisi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
06018 Etlik, Ankara, Türkiye.
Tel (Phone): +90 312 304 4902,
E-posta (E-mail): soyilmaz@gata.edu.tr