Epstein-Barr Virus Enfeksiyonlarının Tanısında PCR Sonuçlarının Değerlendirilmesi*
Evaluation of PCR Results in the Diagnosis of Epstein-Barr Virus Infections
Sanem KARADAĞ GEÇGEL1, Alparslan ERSOY2, Betül Berrin SEVİNİR3, Melda SINIRTAŞ4, Güher GÖRAL4
1 Osmaniye Devlet Hastanesi, Mikrobiyoloji Bölümü, Osmaniye.
1 Osmaniye State Hospital, Department of Microbiology, Osmaniye, Turkey.
2 Uludağ Üniversitesi Tıp Fakültesi, Nefroloji Bilim Dalı, Bursa.
2 Uludağ University Faculty of Medicine, Department of Nephrology, Bursa, Turkey.
3 Uludağ Üniversitesi Tıp Fakültesi, Çocuk Onkoloji Bilim Dalı, Bursa.
3 Uludağ University Faculty of Medicine, Department of Pediatric Oncology, Bursa, Turkey.
4 Uludağ Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Bursa.
4 Uludağ University Faculty of Medicine, Department of Medical Microbiology, Bursa, Turkey.
* Bu çalışma, Uludağ Üniversitesi Bilimsel Araştırma Projeleri Komisyonu [Proje no: UAP(T)-2009/7] tarafından desteklenmiştir.
ÖZET
Epstein-Barr virus (EBV), öncelikle enfeksiyöz mononükleoz ve ayrıca çeşitli lenfomalar ve posttransplant lenfoproliferatif hastalığın (PTLD) etiyolojisinden sorumlu, latent enfeksiyon oluşturan bir herpes virustur. EBV enfeksiyonlarının laboratuvar tanısı; atipik lenfositlerin, heterofil antikorların, virusun kapsid antijeni (VCA), nükleer antijeni (EBNA) ve erken antijeni (EA)'ne karşı oluşan özgül antikorların ve viral DNA'nın saptanmasına dayanır. Ülkemizde yetişkin popülasyondaki seropozitiflik oranının çok yüksek (%80-95) olması nedeniyle, transplant alıcıları veya onkoloji hastaları gibi özellikle immünsüpresif hasta gruplarında EBV reaktivasyonunun belirlenmesinde rutin serolojik testler yetersiz kalabilir. Bu gibi durumlarda VCA IgG avidite testi ve moleküler yöntemlerden yararlanılmaktadır. Bu çalışmada, renal transplant ve çocuk onkoloji hastalarında EBV enfeksiyonlarının tanı ve takibinde serolojik yöntemlerin yanı sıra gerçek zamanlı polimeraz zincir reaksiyonu (Rt-PCR) ile viral DNA düzeylerinin belirlenmesi amaçlanmıştır. Çalışmaya, 62 erişkin renal transplant alıcısı, 37 çocuk onkoloji hastası ile EBV seropozitif immün kompetan sağlıklı 50 birey (28'i çocuk, 22'si erişkin) dahil edilmiştir. Transplant alıcılarından transplantasyon öncesi bir kez, transplantasyon sonrası üç kez (birinci hafta, birinci ay ve üçüncü ay) olmak üzere toplam dört kez; çocuk onkoloji hastalarından tedavi öncesi bir kez, immünsüpresif tedaviye başlandıktan sonra üç kez (birinci ay, üçüncü ay ve altıncı ay) olmak üzere toplam dört kez; kontrol grubundan ise bir kez kan örneği alınmıştır. Serum örneklerinde EBV serolojik profilleri Paul-Bunnel ve immünoblot testleri ile; VCA IgG avidite testi ELISA ile ve EBV-DNA düzeyi Rt-PCR yöntemiyle araştırılmıştır. Renal transplant grubundaki hastaların 3 (%4.8)'ünde EBV-DNA pozitif bulunmuştur. Bu hastalarda CD4/CD8 oranları transplantasyon öncesi değerlerine göre transplantasyon sonrası birinci hafta ve üçüncü ayda anlamlı olarak düşük bulunmakla birlikte PTLD ve organ reddi gelişmemiştir. Çocuk onkoloji grubundaki hastaların 3 (%8.1)'ünde EBV-DNA pozitif bulunmuş; bu durum Hodgkin lenfoma tanısıyla takip edilen iki çocukta hastalık, diğerinde ise reaktivasyon ile ilişkilendirilmiştir. Kontrol grubundaki olguların ise 10 (%20)'unda EBV-DNA pozitifliği tespit edilmiştir. İmmünoblot sonuçları akut enfeksiyon serolojisi ile uyumlu olan erişkin kontrol olgularında EBV-DNA pozitifliği, Paul-Bunnel pozitifliği ve düşük avidite sonuçları arasındaki uyum istatistiksel olarak anlamlıdır. Çocuk kontrol grubunda ise bu serolojik profil ile sadece düşük avidite arasındaki uyum anlamlı kabul edilmiştir. Sonuç olarak bu çalışmada erişkin renal transplant hastalarında transplantasyonu takip eden üç aylık dönemde EBV ile ilişkili PTLD ve akut rejeksiyon riskinin bulunmadığı; EBV ile ilişkili malignitesi bulunan çocuklarda tedavi öncesi Rt-PCR ile EBV-DNA araştırılmasının tanı, takip ve prognozu değerlendirmede yararlı olabileceği; immünsüpresif hastalarda EBV reaktivasyonunu saptamak için serolojik sonuçların avidite ve PCR testleri ile desteklenmesi gerektiği düşünülmüştür.
Anahtar sözcükler: Epstein-Barr virus; immünsüpresyon; Paul-Bunnel; immünoblot; VCA; IgG avidite; gerçek zamanlı PCR.
ABSTRACT
Epstein-Barr virus (EBV), a herpesvirus leading to latent infections, is principally responsible for infectious mononucleosis, and also plays role in the etiology of various lymphomas and post-transplantation lymphoproliferative disease (PTLD). Laboratory diagnosis of EBV infections depends on the detection of atypical lymphocytes, heterophile antibodies, specific antibodies against viral capsid (VCA), nuclear (EBNA) and early (EA) antigens, and of the viral DNA. Since the seropositivity rate in adult population is very high (80-95%) in our country, routine serologic tests may be insufficient to characterize EBV reactivation in immunosuppressive subjects, such as transplant recipients or oncology patients. In those cases VCA IgG avidity test and molecular methods are more useful. This study was conducted to determine the role of viral DNA levels detected by real-time polymerase chain reaction (Rt-PCR) and serological tests for the diagnosis and follow up of EBV infections in renal transplant recipients and pediatric oncology patients. A total of 62 adult renal transplant recipients, 37 children with oncological diseases, and 50 EBV-seropositive immunocompetent healthy subjects (28 children, 22 adults) as controls, were included in the study. Four blood samples, once before transplantation and three times thereafter (at first week, first and third months) were collected from transplant recipients; in pediatric oncology patients blood samples were collected four times, once before immunosuppressive treatment and three times thereafter (at first, third and sixth months), while the control group had a single blood sample collected. Serological profiles for EBV were searched by Paul-Bunnel and immunoblotting tests; VCA IgG avidity by ELISA and viral load by Rt-PCR. EBV-DNA was found positive in 3 (4.8%) of the renal transplant patients. While in these patients the CD4/CD8 ratio was significantly lowered in the first week and third month post-transplant, no PTLD or organ rejection developed. EBV-DNA was positive in 3 (8.1%) of the pediatric oncology patients. This positivity was attributed to Hodgkin's disease in two of these cases and to reactivation in the third case. EBV-DNA positivity was present in 10 (20%) of the control subjects. In the adult controls whose immunoblot results were compatible with the serologic pattern of an acute infection, the correlation among positive EBV-DNA, positive Paul-Bunnel and low IgG avidity results was statistically significant. As for children in the control group, this serologic profile was significantly correlated with low IgG avidity only. The data obtained from this study indicated that no risk of EBV-related PTLD or acute rejection was found in the first three months in the adult renal transplant patients. In children with EBV-related malignancy the search for EBV-DNA by RtPCR before therapy may be useful in the diagnosis, follow-up and prognostic evaluation. Serologic results should be supported by IgG avidity and PCR in order to ascertain the presence of EBV reactivation in immunosuppressive patients.
Key words: Epstein-Barr virus; immunosuppression; Paul-Bunnel; immunoblotting; VCA; IgG avidity; real-time PCR.
Geliş Tarihi (Received): 12.03.2012 • Kabul Ediliş Tarihi (Accepted): 19.07.2012
GİRİŞ
Epstein-Barr virus (EBV), başta enfeksiyöz mononükleoz (EM) olmak üzere Burkitt lenfoma ve nazofarengeal karsinoma gibi malignitelerin ayrıca transplantasyon sonrası immünsüpresif konakta ortaya çıkan posttransplant lenfoproliferatif hastalığın (PTLH) etiyolojisinden sorumlu herpes grubundan bir virustur1. EBV enfeksiyonlarının laboratuvar tanısı atipik lenfositlerin, heterofil antikorların, virus antijenlerine karşı oluşan özgül antikorların ve viral DNA'nın saptanmasıyla mümkündür.
Paul-Bunnel testi (PBT), hastalığın ilk haftasından itibaren serumda bulunabilen ve 2-3. haftalarda saptanma olasılığı artan heterofil antikorların gösterilmesinde kullanılan bir hemaglütinasyon testidir. EM geçiren erişkinlerin %90'ında bulunabilen bu antikorların çocuk yaş grubunda yeterince yükselmemesi ya da geç yükselmesi PBT'nin kullanımında yaşa özgü bir kısıtlılık getirmektedir2. Heterofil antikorların saptanamadığı durumlarda EBV'ye özgül serolojik testlerden yararlanılmakta ve virusun majör antijenlerine [viral kapsid antijen (VCA), nükleer antijen (EBNA), erken antijen (EA)] karşı oluşan IgG ve/veya IgM antikorları araştırılmaktadır3,4. Ancak yeni enfeksiyonların %20-30'unda anti-EA antikorları bulunmamakta ve anti-EBNA antikorları genellikle konvalesan dönemde ortaya çıkmaktadır. Buna karşın anti-VCA antikorları, olguların %90-94'ünde saptanabilmekte ve enfeksiyon döneminin belirlenmesinde yardımcı olmaktadır5. EBV serolojisinin yorumlanamadığı olgularda ise EBV-VCA IgG avidite, Western Blot (WB) ve polimeraz zincir reaksiyonu (PCR) gibi testlerden yararlanılmaktadır3,6,7.
EBV, latent enfeksiyon oluşturan bir virustur. Ülkemizde yetişkin popülasyonun %80-95'inde EBV seropozitifliği mevcuttur4,8. Bu nedenle transplant alıcıları veya onkoloji hastaları gibi özellikle immünsüpresif hasta gruplarında EBV reaktivasyonunun belirlenmesi önem taşımaktadır2,9. EBV reaktivasyonunda rutin serolojik testler yetersiz kalabilmekte; bu nedenle uygun örnekte viral DNA'nın PCR ile saptanması prognozu belirlemek açısından yararlı olabilmektedir3. Bu çalışma, renal transplant ve çocuk onkoloji hastalarında EBV enfeksiyonlarının tanı ve takibinde gerçek zamanlı PCR (Rt-PCR) ile viral DNA düzeylerini belirlemek amacıyla yapılmıştır.
GEREÇ ve YÖNTEM
Lokal Tıbbi Araştırmalar Etik Kurulunun izni ile yapılan bu çalışmaya, renal transplant alıcılarından oluşan ve transplantasyondan sonraki üç aylık dönemde transplantasyon ünitesinde takip edilen tümü erişkin 62 hasta (renal transplant grubu); çocuk onkoloji kliniğinde yeni tanı alan ve immünsüpresyon tedavisine başlandıktan sonraki altı aylık dönemde takip edilen 37 hasta (çocuk onkoloji grubu) ile merkez mikrobiyoloji ELISA/seroloji laboratuvarlarına EBV serolojisinin belirlenmesi için kan örneği gönderilen ve seropozitiflik saptanan 50 kişi (kontrol grubu) dahil edildi. Çocuk onkoloji hastalarından dokuzu lenfoma (beşi Hodgkin, ikisi Burkitt, ikisi Hodgkin-dışı), altısı beyin tümörü, sekizi kemik ve yumuşak doku sarkomu, üçü nöroblastom, beşi Wilms tümörü, altısı diğer maligniteler (germ hücreli tümör iki, nazofarenks karsinomu bir, malign histiyositoz bir, kolon karsinomu bir, hepatoblastom bir) primer tanısıyla takip edilen olgulardı. Kontrol grubu immünsüpresif tedavi uygulanmayan veya herhangi bir malignitesi bulunmayan poliklinik/klinik hastalarından rastgele oluşturuldu; 28 (%56)'i çocuk, 22 (%44)'si ise erişkin yaş grubunda idi.
Renal transplant alıcılarından transplantasyon öncesi bir kez, transplantasyon sonrası üç kez (birinci hafta, birinci ay ve üçüncü ayda) olmak üzere toplam dört kez; çocuk onkoloji hastalarından tedavi öncesi bir kez, immünsüpresif tedaviye başlandıktan sonra üç kez (birinci ay, üçüncü ay ve altıncı ayda) olmak üzere toplam dört kez; kontrol grubundan ise bir kez kan örneği alındı. Gönüllülere ait kan örneklerinin alımına 17.06.2009 tarihinde başlandı, periyodik örnek alımı 31.01.2011 tarihinde tamamlandı.
Serum örnekleri EBV VCA-IgG avidite ve Rt-PCR testleri için çalışılıncaya kadar -20°C'de saklandı. Heterofil antikor ve özgül EBV antikor testleri aynı/ertesi gün sırasıyla PBT ve immünoblot yöntemleriyle uygulandı. PBT'de ≥ 1/56 pozitif sonuç EBV enfeksiyonu lehine yorumlandı. Anti-VCA, anti-EBNA ve anti-EA antikorlarını (IgG ve IgM) saptamak için Euroline anti-EBV-profile 2 (Euroimmun, Almanya) immünoblot kiti kullanıldı. İmmünoblot sonuçlarına göre seronegatif; akut enfeksiyon [VCA IgM (+), VCA IgG (+/-), EBNA IgG (-), EA IgG (+/-)]; geçirilmiş enfeksiyon [VCA IgG (+), VCA IgM (-), EBNA IgG (+), EA IgG (-)] ve reaktivasyon [VCA IgG (+),VCA IgM (+/-), EBNA IgG (+), EA IgG (+)] olmak üzere dört grup serolojik profil belirlendi. VCA-IgG avidite testi mikro ELISA kiti (Euroimmun, Almanya) ile çalışıldı. Testin çalışma prensibine göre rölatif avidite indeksi (RAİ) hesaplandı ve RAİ < %40 ise düşük, %40-60 ise sınırda, > %60 ise yüksek avidite olarak değerlendirildi.
Rt-PCR için serum örneklerinden EBV-DNA izolasyonu QIAamp DNA minikit (QIAGEN, Almanya) ile gerçekleştirildi. Elde edilen DNA örnekleri çalışılıncaya kadar -20°C'de saklandı. Rt-PCR için Artus EBV RG PCR kiti (QIAGEN, Almanya) ve Rotor-Gene RG-3000 cihazı (Avustralya) kullanıldı. Veriler Rotor-Gene 3000 6.0.23 analiz programında değerlendirildi. Kitin hedef bölgesi EBNA-1 geninin 97 baz çiftlik bölgesi olup analitik duyarlılığı 510 kopya/ml'dir. Kitapçığında kitin kantitasyon için dinamik aralığının belirlenmediği; Herpes simpleks virus (HSV)-1 ve HSV-2, varisella-zoster virus, sitomegalovirus, Human T Cell Leukemia Virus-1 ve -2 ile çapraz reaksiyon vermediği ifade edilmektedir. Ayrıca takip eden ölçümlerde EBV-DNA pozitifliği veya EBV-DNA düzeylerinde artış saptanan renal transplant hastalarında eş zamanlı T hücre oranlarına (CD4/CD8) bakılarak immünsüpresyon durumu belirlendi.
Çalışmanın istatistiksel analizleri SPSS 13.0 (Chicago, IL) programında yapıldı. Değişik parametreler için Wilcoxon sıra toplam testi, Mann Whitney-U testi, Fisher'in kesin ki-kare testi ve McNemar testi kullanıldı; p< 0.05 anlamlı kabul edildi.
BULGULAR
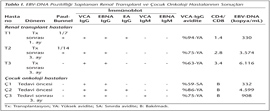
Renal transplant grubundaki hastaların 3 (%4.8)'ü ile çocuk onkoloji grubundaki hastaların 3 (%8.1)'ünde Rt-PCR ile EBV-DNA pozitifliği bulunmuştur (Tablo I). EBV-DNA pozitif renal transplant hastalarının hiçbirinde EBV enfeksiyonuna bağlı olarak PTLH ve organ reddi gelişmemiştir. Tedavi öncesi EBV-DNA pozitifliği saptanan iki çocuğun Hodgkin lenfoma, tedavi sonrası üçüncü ayda EBV-DNA pozitifliği saptanan bir çocuğun ise malign histiyositoz tanılarıyla takip edilen hastalar olduğu belirlenmiştir.
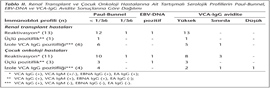
İmmünoblot sonuçlarına göre; renal transplant grubunda yer alan 62 hastadan 42 (%67.7)'sinin tüm serum örneklerinde geçirilmiş enfeksiyon serolojisi saptanmıştır. Bu grupta bulunan diğer hastaların 13 (%20.9)'ünde reaktivasyon serolojisi, 6 (%9.6)'sında izole VCA-IgG pozitifliği, birinde ise üçlü pozitiflik [VCA IgG (+), VCA IgM (+), EBNA IgG (+), EA IgG (-)] belirlenmiştir. İmmünoblot sonuçları reaktivasyon serolojisi ile uyumlu bulunan hastaların tümünde yüksek avidite indeksi saptanmıştır (Tablo II). Sadece bir hastada (T1) eş zamanlı EBV-DNA sonucu 330 kopya/ml olup, CD4/CD8 1.4'tür (Tablo I, II). Bu hastanın akciğer enfeksiyonu nedeniyle kaybedilmesi sonucu transplantasyon sonrası üçüncü ay serum örneği alınamamıştır.
Renal transplant hastalarında CD4/CD8 oranları, transplantasyon öncesi değerlerine göre transplantasyon sonrası birinci hafta ve üçüncü ayda anlamlı olarak düşük bulunmuştur (sırasıyla p= 0.030, p= 0.01). İmmünoblot ile reaktivasyon serolojisi saptanan hastalarda transplantasyon sonrası üçüncü ay CD4/CD8 oranları transplantasyon öncesi değerlerine göre anlamlı olarak düşüktür (p= 0.05). Transplantasyon öncesine göre transplantasyon sonrası üçüncü ay CD4/CD8 yüzde değişim değerleri immünoblot ile reaktivasyon serolojisi saptanan hastalarda %48, diğer serolojik profillerin saptandığı hastalarla ise %13 olarak bulunmuştur (p= 0.008).
Renal transplant grubunda bulunan ve transplantasyon öncesi serum örneklerinde VCA-IgG düşük avidite saptanan 3 (%4.8) hastada eş zamanlı immünoblot testleri geçirilmiş enfeksiyon serolojisiyle uyumlu olup Paul-Bunnel (PB) titresi < 1/56, EBV-DNA negatif sonuç vermiştir. Takip eden diğer örneklerinde serolojik profil ve PCR sonucu değişmemiş ancak VCA-IgG avidite sonuçları değişkenlik göstermiştir.
Çocuk onkoloji grubunda yer alan 37 hastadan 4 (%10.8)'ünün tüm serum örneklerinde immünoblot ve PB ile seronegatiflik saptanmış; 15 (%40.5)'inin ise tüm serum örneklerinde immünoblot sonuçları geçirilmiş enfeksiyon serolojisi ile uyumlu bulunmuştur. Ayrıca tedavi öncesi serumlarında immünoblot ile akut enfeksiyon serolojisi belirlenen 3 (%8.1) hastada eş zamanlı Rt-PCR ile EBV-DNA negatif tespit edilmiştir. Bu grupta bulunan ve farklı dönem serum örneklerinde immünoblot ile tartışmalı serolojik profillerin saptandığı hastalara ait sonuçlar Tablo II'de gösterilmiştir. Bu gruptaki toplam 11 (%29.7) hastada immünoblot sonuçları reaktivasyon serolojisiyle uyumlu olup, bunlardan üçünün tüm serum örneklerinde, sekizinin ise sadece bir örneğinde reaktivasyon serolojisi belirlenmiştir (birinde tedavi sonrası birinci ay, birinde tedavi sonrası üçüncü ay, altısında ise tedavi sonrası altıncı ay). Reaktivasyon profili, tedavi sonrası altıncı ayda tedavi öncesine göre istatistiksel olarak anlamlı artış göstermiştir (p= 0.031). Tüm serum örneklerinde immünoblot sonuçları reaktivasyon serolojisi ile uyumlu bulunan bir hastanın (Ç2) tedavi öncesi örneğinde EBV-DNA düzeyi 4.599 kopya/ml olarak saptanmıştır (Tablo I, II).
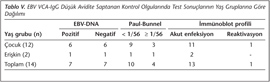
EBV seropozitif kontrol grubu değerlendirildiğinde EBV-DNA pozitiflik oranı %20 (10/50) olarak saptanmış, bu hastaların ikisinin erişkin, sekizinin çocuk olduğu izlenmiştir (Tablo III). İmmünoblot ile 14 erişkin, 11 çocuk olmak üzere toplam 25 (%50) kontrolde geçirilmiş enfeksiyon serolojisi belirlenmiştir. Bu profilin saptandığı çocukların %81'inde yüksek IgG aviditesi bulunmuştur (p< 0.001) (Tablo IV). Kontrol grubundaki diğer bireylerin 14 (%28)'ü akut enfeksiyon, 6 (%12)'sı reaktivasyon serolojisi ile uyumludur; 2 (%4)'sinde izole IgG pozitifliği, 3 (%6)'ünde ise üçlü pozitiflik saptanmıştır (Tablo IV, V).
Kontrol grubunda immünoblot sonuçları akut enfeksiyon serolojisiyle uyumlu; üçü erişkin, 11'i çocuk toplam 14 hastanın 7 (K1, K4, K6, K7, K8, K9, K10)'sinde EBV-DNA pozitif (%50) bulunmuş; bu hastaların altısında düşük avidite, beşinde PB titresi ≥ 1/56 olarak saptanmıştır (Tablo III). EBV-DNA negatif bulunan diğer yedi hastada ise VCA-IgG düşük aviditeli, PB titresi < 1/56'dır. Akut enfeksiyon profili gösteren 14 hastanın 13 (%93)'ünde VCA-IgG düşük aviditeye sahiptir (çocuk hastalar için p< 0.001, erişkin hastalar için p= 0.038) (Tablo IV). Ayrıca immünoblot sonuçları akut enfeksiyon serolojisi ile uyumlu olan erişkin kontrol hastalarında PB ve EBV-DNA pozitifliği istatistiksel olarak anlamlıdır (p= 0.013) (Tablo IV).
Kontrol grubunda yer alan dördü çocuk, ikisi erişkin toplam 6 (%12) hastada PB titresi ≥ 1/56 bulunmuş; bu hastaların 5 (K1, K6, K7, K8, K10)'inde (%83.3) EBV-DNA'nın pozitif ve serolojik profilin akut enfeksiyon ile uyumlu olduğu görülmüş; 4 (K1, K6, K7, K8) (%66.6)'ünde düşük aviditeli VCA-IgG saptanmıştır (Tablo III). Bu grupta bulunan 12'si çocuk, ikisi erişkin toplam 14 hastada VCA-IgG avidite indeksi düşük bulunmuştur. Hastaların 7 (%50)'sinde EBV-DNA pozitif, 4 (%28)'ünde PB ≥ 1/56, 13 (%93)'ünde immünoblot sonucu akut enfeksiyon serolojisiyle uyumludur (Tablo V).
TARTIŞMA
İmmünkompetan ve immünsüpresif kişilerde -farklı tedavi stratejilerini gerektirdiğinden- EBV enfeksiyonlarının tanısında kullanılacak yöntemlerin seçimi önem taşır. Özellikle immünsüpresif hastalarda terapötik müdahale zamanı kritik bir öneme sahiptir. Bu nedenle EBV replikasyonunu erken saptayan, pozitif prediktif değeri yüksek olan ve tedavinin izlenmesine olanak sağlayan tanı yöntemleri seçilmelidir. Ancak böylece etkin bir preemptif tedavi gerçekleştirilebilir. Bu amaçla EBV veya EBV-DNA'sını saptayabilen direkt tanı yöntemlerinden yararlanılır3. İmmünkompetan kişilerde ise EBV enfeksiyonu tanısında serolojik profilin belirlenmesi anahtar rol oynar. Tanıda genellikle serolojik testlerden yararlanılan bu grupta, EBV serolojisi değişkenlik göstermekle birlikte sonuçları yorumlamak mümkün olabilmektedir3.
Günümüzde EBV ile ilişkili PTLH'nin ön/kesin tanısı, tedavi etkinliğinin belirlenmesi ve önlenmesinde EBV-DNA ölçümünden yararlanılmaktadır1. Bu nedenle transplantasyondan önce seronegatif olan yüksek riskli hastalarda viral yükün belirlenmesi önem taşır. Viral DNA klinik bulgular oluşmadan aylar önce saptanabilmekte, böylece yüksek riskli hastalarda preemptif tedavi planlanabilmektedir10,11. Bununla birlikte bazı transplant hastalarında yüksek EBV-DNA yüküne rağmen aylar veya yıllarca PTLH gelişmediği bildirilmiştir. Ayrıca transplantasyon sonrası uzun süreli takiplerde yüksek viral yükün saptandığı asemptomatik EBV reaktivasyonu da gösterilmiştir1. Cavallo ve arkadaşları12 erişkin yaş grubundaki renal transplant hastalarını transplantasyondan sonra bir yıl izlemişler; hastaların %24.8'inde EBV-DNA pozitifliği bildirmişlerdir. EBV-DNA pozitifliğini ilk üç ayda (%11.8), 3-12 ay (%7.8) dönemine göre daha yüksek oranda saptamışlar; genellikle viral yükün düşük düzeylerde bulunduğunu ve hastaların hiçbirinde PTLH gelişmediğini vurgulamışlardır12. Çalışmamızda erişkin renal transplant hastalarının tümünde transplantasyon öncesi EBV seropozitifliği mevcut olup, transplantasyon sonrası EBV-DNA pozitifliği saptanan üç hastadan ölen alıcıda viral yük düzeyi düşüktür. Viral yükü yüksek olan iki hastada ise takip süresince PTLH gelişmemiştir.
Jabs ve arkadaşları13 23 renal transplant hastasının 13'ünde immünsüpresif tedaviden sonraki ilk hafta içinde Rt-PCR ile EBV reaktivasyonu saptamışlar; bu hastaların 10'unda 2-45 gün sonra organ reddi geliştiğini; erken EBV reaktivasyonu ile akut rejeksiyon arasında istatistiksel olarak anlamlı ilişki olduğunu bildirmişlerdir. EBV-DNA pozitif 13 hastanın dördünde, EBV-DNA negatif 10 hastanın ise üçünde reaktivasyon serolojisi belirlemişler ve bu hasta grubunda serolojinin erken EBV reaktivasyonu tanısında yardımcı olmadığını vurgulamışlardır. Çalışmamızda da immünoblot sonucu reaktivasyon serolojisi ile uyumlu 13 renal transplant hastasından 12'sinde EBV-DNA negatif olup organ reddi gelişmemiştir (Tablo II).
Burkitt lenfoma, nazofarengeal karsinoma, Hodgkin ve Hodgkin dışı lenfoma gibi maligniteler ile EBV arasındaki etiyolojik ilişki uzun zamandan beri bilinmektedir. EBV ile ilişkili malignitelerde bazı kofaktörlerin de etkisi bulunmakla birlikte bu hastalarda tedavi öncesi ve/veya sonrası dönemde EBV-DNA'sının saptanması, hem etiyolojinin hem de prognozun belirlenmesinde önemli olabilmektedir14. Çalışmamızda çocuk onkoloji grubunda bulunan ve tedavi öncesi serumlarında EBV-DNA varlığı saptanan iki hasta (Ç1, Ç2) Hodgkin lenfoma tanısı ile takip ve tedavi edilen hastalardır (Tablo II). Her iki hastanın tedavi sonrası birinci, üçüncü ve altıncı ay serum örneklerinde immünoblot sonuçları değişmemiş, EBV-DNA ise negatifleşmiştir. Hastaların bir yılı aşkın süredir remisyonda olduğu belirlenmiştir. Hasta sayısı yeterli olmamakla birlikte, EBV ile ilişkili malignitesi olan çocuk hastalarda tedavi öncesi EBV-DNA araştırılmasının tanı, takip ve prognozu değerlendirmek açısından yararlı olabileceği gözlenmiştir. Nitekim Michálek ve arkadaşları15 çocuk onkoloji hastalarında EBV enfeksiyonlarının tanısında seroloji ve DNA analizinin birlikte değerlendirilmesi gerektiğini tek başına serolojik testlerin tanıda yeterli olmadığını vurgulamışlardır. Çalışmamızda da hasta sayısı yeterli olmamakla birlikte, çocuk onkoloji hastalarında özellikle EBV reaktivasyonunu değerlendirmek amacıyla serolojik sonuçların avidite ve PCR testleriyle desteklenmesi gerektiği izlenmiştir.
Akut EBV enfeksiyonunda kanda çoğunlukla EBV-DNA saptanırken, sağlıklı seropozitif bireylerin serum/plazmalarında nadiren EBV-DNA'ya rastlanmaktadır. Bu nedenle primer EBV enfeksiyonu tanısı için plazma ve serumun en uygun örnekler olduğu bildirilmekte; bu örneklerde saptanan EBV yükünün hastalığın şiddetiyle uyumlu olduğu rapor edilmektedir1,6. Çalışmamızda, immünkompetan kişilerden oluşan kontrol grubundaki bir çocukta (K5) immünoblot sonucu reaktivasyon serolojisiyle uyumlu bulunmuştur. Bu olgunun periferik kan ve klinik bulguları akut EM ile uyumlu olup Rt-PCR ve avidite test sonuçları tabloyu desteklemiş; hastanın kliniği ile viral yük düzeyi arasında korelasyon saptanmıştır (Tablo III). Bauer ve arkadaşları6, akut EBV enfeksiyonu olan 1-47 yaş arasındaki 98 immünkompetan hastayı değerlendirdikleri çalışmada, serolojik olarak tartışmalı EBV enfeksiyonlarında, sadece erken dönem serum örneklerinde EBV-DNA pozitifliği ile düşük avidite arasında korelasyon olduğunu bildirmişler; EBV-DNA pozitifliğinin hastalıkla ilişkisini düşük aviditeye göre daha anlamlı bulmuşlardır.
Çalışmamızda kontrol grubunda yer alan ve EBV-DNA düzeyi 1.415 kopya/ml saptanan çocuk hastada (K2) immünoblot sonucu geçirilmiş enfeksiyon serolojisi ile uyumludur (Tablo III). Bu olgu ekstremitelerindeki döküntü nedeniyle beşinci hastalık tanısı almıştır. EBV-DNA 177 kopya/ml bulunan ve immünoblot ile izole VCA IgG pozitifliği saptanan diğer olguda (K3) PBT pozitif, VCA-IgG sınırda avidite olarak değerlendirilmiş, olgunun kliniği akut EBV enfeksiyonunu desteklemiştir (Tablo III). Bu sonuçlar, özellikle çocuk yaş grubunda akut EBV enfeksiyonu tanısında serolojik testlerin yetersiz kalabileceğini; bu hastalarda avidite testi ve viral yük tayininin yararlı olabileceğini göstermiştir. Nitekim Chan ve arkadaşları7 da, primer EBV enfeksiyonu tanısında EBV-DNA testinin duyarlılık, özgüllük, pozitif ve negatif prediktif değerlerini sırasıyla %80, %94, %95 ve %79 bulmuşlar; primer EBV enfeksiyonu tanısında avidite testi ile birlikte genişletilmiş serolojiyi altın standart olarak değerlendirmişlerdir.
Çalışmamızda renal transplant grubunda 3 (%4.8) hastada, çocuk onkoloji grubunda ise bir hastada VCA-IgG aviditesi düşük bulunmuştur. Bu hastaların hiçbirinde eş zamanlı EBV-DNA pozitifliği ve yüksek (≥ 1/56) PB titresi saptanmamış; immünoblot sonuçları ise değişkenlik göstermiştir. Kontrol grubunda yer alan ve düşük avidite saptanan 14 hastadan 7 (%50)'sinde EBV-DNA pozitif; 4 (%28)'ünde PB ≥ 1/56; 13 (%93)'ünde immünoblot sonucu akut enfeksiyon serolojisiyle uyumlu bulunmuştur (Tablo V). Bulgularımız, özellikle immünkompetan hastalarda akut enfeksiyonu doğrulamak açısından avidite testinin önemini vurgulamıştır.
Akut EBV enfeksiyonunun, önceden geçirilmiş enfeksiyon ya da reaktivasyondan ayırt edilmesinde serolojik profilin değeri vardır3,4. Ancak akut enfeksiyon geçiren çocukların %12-17'sinde VCA IgM antikorlarının saptanmadığı; erişkinlerin de az bir kısmında VCA IgM'nin oluşmadığı veya gecikebildiği bildirilmektedir6. Ayrıca immünsüpresyon sırasında EBNA-1 antikorlarının kaybolması veya oluşmaması nedeniyle akut enfeksiyondan sonra uzun süre EBNA-1 IgG negatif kalabilir. Bazı ender olgularda anti-VCA IgM pozitifliği uzun sürebilir, hatta EBNA-1 antikorlarının oluştuğu dönemde bile saptanabilir. Bu durumda akut ve geçirilmiş enfeksiyonlarda benzer serolojik profil görülebilir. Ayrıca izole VCA IgG, VCA IgM ve EBNA IgG pozitiflikleri veya üçünün birlikte pozitif saptanması, doğrulanması gereken tartışmalı profiller olarak kabul edilmektedir. Serolojik testlerle elde edilen tartışmalı sonuçların VCA IgG avidite, floresan antikor testleri ve moleküler yöntemlerle birlikte yorumlanması gerekmektedir2,3,16,17. Nystad ve arkadaşları2, akut EBV enfeksiyonu ön tanısı ile takip edilen ve üçlü pozitifliğin (VCA IgG, VCA IgM, EBNA IgG) saptandığı hastalarda yaptıkları doğrulama sonunda, bu profilin %23 oranında reaktivasyon, %49 oranında akut enfeksiyonu gösterdiğini bildirmişler; bu serolojik profilde VCA IgG aviditesinin yüksek olması ve heterofil antikor bulunmamasını reaktivasyonun bir göstergesi olarak yorumlamışlardır. Çalışmamızda da renal transplant grubunda bir, çocuk onkoloji grubunda üç, kontrol grubunda ise üç çocuk olgu olmak üzere toplam yedi olguda immünoblot ile üçlü pozitiflik tespit edilmiştir (Tablo II, IV). Yorumlanması genellikle tartışmalı olan bu serolojik profilin saptandığı hastaların tümünde eş zamanlı PB titresi < 1/56'dır. Hastaların altısında yüksek, birinde sınırda avidite saptanmış; sadece bir hastanın (Ç3) eş zamanlı Rt-PCR testinde EBV-DNA 908 kopya/ml olarak bulunmuştur (Tablo I, II). İmmünoblot ile üçlü pozitiflik saptanan hastaların PB ve avidite test sonuçları akut enfeksiyondan çok reaktivasyonu desteklemiştir. Bununla birlikte reaktivasyonda beklenen EBV-DNA pozitifliği sadece immünsüpresif bir çocuk onkoloji hastasında saptanmıştır. Bu sonuçlar, tartışmalı serolojik profilleri değerlendirmede avidite testinin yetersiz kalabileceğini, özellikle immünsüpresif hastalarda doğrulama amacıyla EBV-DNA testlerinin daha yararlı olduğunu göstermiştir.
İzole VCA IgG pozitifliği; akut enfeksiyonda VCA IgM antikorlarının gecikmesi veya erken kaybolması, geçirilmiş enfeksiyonda ise EBNA IgG'nin kaybolması veya oluşmaması nedeniyle karşımıza çıkmaktadır. Bu serolojik profil, EBV enfeksiyonlarının sınıflandırmasını güçleştirmektedir. Paschale ve arkadaşları18, izole VCA IgG pozitifliğini heterofil antikor pozitifliğiyle ilişkilendirmişler ve bu profilin çoğunlukla erişkin hastalarda geçirilmiş enfeksiyonu gösterdiğini; < 10 yaş çocuklarda ise akut enfeksiyonu desteklemekle birlikte hastaların üçte birinde geçirilmiş enfeksiyon görülebileceğini bildirmişlerdir. Çalışmamızda renal transplant grubunda altı, çocuk onkoloji grubunda dört, kontrol grubunda ise iki çocuk olguda olmak üzere toplam 12 olguda immünoblot ile izole VCA IgG pozitifliği saptanmıştır (Tablo II, IV). Hastaların tümünde eş zamanlı PB titresi < 1/56 olup, VCA-IgG avidite testleri değişkenlik göstermiştir. Rt-PCR ile hastaların 11'inde EBV-DNA negatif, kontrol grubundaki bir çocukta ise pozitif bulunmuştur. Bu profil EBV-DNA ve PB negatifliği ile birlikte değerlendirildiğinde, immünsüpresif erişkin renal transplant hastalarında geçirilmiş enfeksiyonu desteklemiştir. Ancak çocuk onkoloji hastalarında bu durum akut enfeksiyon lehine yorumlanmamış; sadece kontrol grubunda bulunan ve EBV-DNA pozitifliği saptanan bir çocukta akut enfeksiyon ile ilişkilendirilmiştir. Bu sonuçlar, izole VCA-IgG pozitifliğini yorumlamada heterofil antikorların yanı sıra özellikle çocuk yaş grubunda viral yük araştırılmasının yararlı olabildiğini göstermiştir.
Sonuç olarak, erişkin renal transplant ve çocuk onkoloji hastaları ile immün kompetan kontrol grubunda serolojik ve moleküler yöntemler ile EBV enfeksiyonlarının değerlendirildiği bu çalışmada; immünsüpresif olgularda akut enfeksiyon ve reaktivasyonların belirlenmesinde serolojinin tek başına yetersiz kalabileceği; serolojik sonuçların VCA-IgG avidite ve Rt-PCR testleri ile desteklenmesi gerektiği ve özellikle immün sistemi baskılanmış hastalarda viral yük tespitinin tanı, takip ve prognozu değerlendirmede büyük önem taşıdığı kanısına varılmıştır.
KAYNAKLAR
- Kimura H, Ito Y, Suzuki R, Nishiyama Y. Measuring Epstein-Barr virus (EBV) load: the significance and application for each EBV associated disease. Rev Med Virol 2008; 18(5): 305-19. [Özet]
- Nystad T, Myrmel H. Prevalence of primary versus reactivated Epstein-Barr virus infection in patients with VCA IgG-, VCA IgM- and EBNA-1-antibodies and suspected infectious mononucleosis. J Clin Virol 2007; 38(4): 292-7. [Özet]
- Hess RD. Routine Epstein-Barr virus diagnostics from the laboratory perspective: still challenging after 35 years. J Clin Microbiol 2004; 42(8): 3381-7. [Tam Metin] [PDF]
- Fidan I, Yüksel S, Imir T. Değişik yaş gruplarında Epstein-Barr virus antikorlarının araştırılması. İnfeksiyon Derg 2005; 19(4): 453-6. [Özet] [PDF]
- Ağaçfidan A, Bozacı M, Badur S. Epstein Barr virusu infeksiyonlarının tanısında kullanılan serolojik yöntemlerin değerlendirilmesi. Klimik Derg 1991; 4(3): 133-5. [Özet]
- Bauer CC, Aberle S, Popow-Kraupp T, Kapitan M, Hofmann H, Puchhammer-Stöckl E. Serum Epstein-Barr virus DNA load in primary Epstein-Barr virus infection. J Med Virol 2005; 75(1): 54-8. [Özet]
- Chan KH, Ng MH, Seto WH, Peiris JS. Epstein-Barr virus (EBV) DNA in sera of patients with primary EBV infection. J Clin Microbiol 2001; 39(11): 4152-4. [Özet] [Tam Metin] [PDF]
- Eren Topkaya A, Benli Aksungar F, Özakkaş F, Çapan Akıncı N. Bir enfeksiyöz mononükleoz olgusu. Turkiye Klinikleri J Med Sci 2007; 27(2): 279-81. [Özet] [PDF]
- Gartner BC, Hess RD, Bandt D, et al. Evaluation of four commercially available Epstein-Barr virus enzyme immunoassays with an immunofluorescense assay as the reference methods. Clin Diag Lab Immunol 2003; 10(1): 78-82. [Özet] [Tam Metin]
- Fan H, Gulley ML. Epstein-Barr viral load measurement as a marker of EBV-related disease. Mol Diagn 2001; 6(4): 279-89. [Özet]
- Ozçay F, Arslan H, Bilezikçi B, Sevmiş S, Moray G, Haberal M. The role of valacyclovir on Epstein-Barr virus viral loads in pediatric liver transplantation patients. Transplant Proc 2009; 41(7): 2878-80. [Özet]
- Cavallo R, Elia M, Gruosso V, Curtoni A, Costa C, Bergallo M. Molecular epidemiology of Epstein-Barr virus in adult kidney transplant recipients. Transplant Proc 2010; 42(7): 2527-30. [Özet]
- Jabs WJ, Maurmann S, Wagner HJ, et al. Time course and frequency of Epstein-Barr virus reactivation after kidney transplantation: linkage to renal allograft rejection. J Infect Dis 2004; 190(9): 1600-4. [Özet] [Tam Metin] [PDF]
- Naresh KN, Johnson J, Srinivas V, et al. Epstein-Barr virus association in classical Hodgkin's disease provides survival advantage to patients and correlates with higher expression of proliferation markers in Reed-Sternberg cells. Ann Oncol 2000; 1181): 91-6. [Özet] [PDF]
- Michálek J, Horvath R. High incidence of Epstein-Barr virus, cytomegalovirus and human herpesvirus 6 infections in children with cancer. BMC Pediatr 2002; 2: 1. [Özet] [Tam Metin] [PDF]
-
Sener AG, Afsar I, Pinar E. Evaluation of Epstein-Barr virus antibodies,
anti-VCA avidity by immunofluorescence and immunoblot assays for assessment of
Epstein-Barr virus immunologic state. J Virol Methods 2009; 159(2): 300-2.
[Özet] - Altuğlu I, Aksoy A, Zeytinoğlu A, Orman M. Evaluation of immunoblot-based assay for detecting Epstein-Barr virus viral capsid antibodies. Mikrobiyol Bul 2010; 44(2): 231-6. [Özet] [PDF]
- De Paschale M, Agrappi C, Manco MT, Mirri P, Vigano EF, Clerici P. Seroepidemiology of EBV and interpretation of the isolated VCA IgG' pattern. J Med Virol 2009; 81(2): 325-31. [Özet]
İletişim (Correspondence):
Prof. Dr. Güher Göral,
Uludağ Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
16059 Nilüfer, Bursa, Türkiye.
Tel (Phone): +90 532 512 1527,
E-posta (E-mail): guher@uludag.edu.tr