Metisiline Dirençli Staphylococcus aureus İzolatlarında
Heterojen Makrolid Direnci:
Direnç Mekanizmasının ve Klonalitenin Araştırılması
Heterogeneous
Macrolide Resistance in Methicillin-Resistant Staphylococcus aureus:
Investigation of Resistance Mechanisms and Clonality
Tuğrul HOŞBUL1, Bülent BOZDOĞAN2, Tunçer HAZNEDAROĞLU3, Mustafa ÖZYURT3
1 Gölcük Asker Hastanesi, Tıbbi Tahlil Laboratuvarı, Gölcük, Kocaeli.
1 Golcuk Military Hospital, Medical Diagnosis Laboratory, Golcuk, Kocaeli, Turkey.
2 Adnan Menderes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Aydın.
2 Adnan Menderes University Faculty of Medicine, Department of Medical Microbiology, Aydin, Turkey.
3 Gülhane Askeri Tıp Akademisi, Haydarpaşa Eğitim Hastanesi Tıbbi Mikrobiyoloji Servisi, İstanbul.
3 Gulhane Military Medical Academy, Haydarpasa Education Hospital, Department of Medical Microbiology, Istanbul, Turkey.
ÖZET
Staphylococcus aureus, hastane enfeksiyonlarına neden olan önemli patojenlerden biridir ve kullanılan antibiyotiklere çoklu direnç kazanmanın yanı sıra klonal olarak yayılma özelliğine sahiptir. Bu çalışmanın amacı, bir üçüncü basamak eğitim hastanesinde 2006-2008 yılları arasında yatan hastalara ait klinik örneklerden izole edilen 41 metisiline dirençli S.aureus (MRSA) suşunda gözlenen heterojen makrolid direncinin mekanizmasının ve izolatlar arasındaki klonal ilişkinin araştırılmasıdır. Eritromisin, klaritromisin ve azitromisin antibiyotik disklerine ait inhibisyon zonu içerisinde üreme gözlenen izolatlar heterojen makrolid, linkozamid ve streptogramin-B (hMLSB) direnç fenotipine sahip izolatlar olarak tanımlanmıştır. Aynı yıllarda izole edilmiş hMLSB direnç fenotipi sergilemeyen makrolidlere dirençli 63 MRSA izolatı da kontrol grubu olarak çalışmaya dahil edilmiştir. İzolatlarda metisilin, eritromisin, azitromisin, klaritromisin, klindamisin, kinupristin-dalfopristin, penisilin, vankomisin, teikoplanin, linezolid, gentamisin, amikasin, siprofloksasin, trimetoprim-sülfametoksazol, kloramfenikol, rifampin, tetrasiklin ve telitromisin direnci CLSI kriterlerine uygun olarak disk difüzyon yöntemiyle araştırılmıştır. hMLSB fenotipine sahip izolatlarda eritromisin, klindamisin ve kinupristin-dalfopristin duyarlılıkları ayrıca Vitek-2 otomatize sistemi (bioMerieux, Fransa) ile belirlenmiştir. İzolatlarda ermA, ermB, ermC, msrA/B direnç genlerinin varlığı PCR ile araştırılmıştır. Çalışmamızda erm(A), hMLSB direncinden sorumlu tek direnç geni olarak saptanmış ve izolatlarda erm(A) geninin regülatör bölgesi DNA dizi analiziyle incelenmiştir. Regülatör bölgelerinin dizi analizleri sonucunda 34 izolatta 149. pozisyondaki "guanin" baz delesyonu, 16 izolatta ise "C368G" ve "T377C" olmak üzere iki nokta mutasyonu belirlenmiştir. Değişken alanlı jel elektroforezi (PFGE) analizi sonucunda makrolidlere heterojen dirençli izolatlarda yaygın bir klon ve varyantları saptanmıştır. Ancak bu klon kontrol grubu izolatları arasında da yaygın klon olarak bulunmuştur. İlginç olarak tüm heterojen makrolid dirençli izolatlar otomatize sistem tarafından eritromisin, klindamisin ve kinupristin-dalfopristine duyarlı olarak rapor edilmiştir. Sonuçta, heterojen makrolid dirençli izolatlara özgül bir klon saptanmamıştır. Her ne kadar hMLSB fenotipi gözlenen tüm izolatlarda erm(A) direnç geni saptansa da, bu izolatların regülatör bölgelerinde özgül ve yaygın bir genetik değişiklik belirlenmemiştir. Çalışmanın en önemli bulgusu, otomatize sistemin hMLSB fenotipini uygun olarak saptayamadığının gösterilmiş olmasıdır. Bunun yanı sıra disk difüzyon yönteminde inkübasyon süresinin uzatılmasının (en az 24 saat) hMLSB fenotipinin saptanmasına katkı sağlayabileceği düşünülmüştür.
Anahtar sözcükler: Staphylococcus aureus; makrolid; linkozamid; streptogamin; direnç; heterojen makrolid direnci; klonalite.
ABSTRACT
Staphylococcus aureus is one of the most important pathogens leading to hospital infections and has ability to gain multiple resistance to most of the antibiotics used as well as ability to spread clonally. In this study we aimed to investigate the mechanism of heterogenous macrolide resistance and clonality of 41 methicillin-resistant S.aureus (MRSA) strains isolated from clinical samples of inpatients between 2006 and 2008 in a tertiary care training hospital. Heterogenous macrolide resistance is defined as the isolates with colonies in the inhibiton zone of erythromycin, azithromycin, claritromycin discs, and named as hMLSB (heterogeneous macrolides, lincosamides, streptogramin-B) phenotype. A total of 63 macrolide-resistant MRSA strains isolated during the same period with non-hMLSB phenotype were included in the study as a control group. The susceptibilties of isolates to methicillin, erythromycin, azithromycin, claritromycin, clindamycin, quinupristin-dalfopristin, penicillin, vancomycin, teicoplanin, linezolide, gentamicin, amikacin, ciprofloxacin, trimethoprim-sulphamethoxazole, chloramphenicol, rifampin, tetracycline and telithromycin were determined by disc diffusion method according to the CLSI criteria. hMLSB isolates were also tested for erythromycin, clindamycin and quinupristin-dalfopristin susceptibility by Vitek-2 automated system (bioMerieux, France). Presence of erm(A), erm(B), erm(C), msr(A/B) resistance genes were investigated by PCR. The regulatory region of the erm(A) gene, which was found to be the only molecular mechanism of hMLSB, was sequenced. Sequence analysis of regulatory regions showed deletion of "guanine" base at position 149 in 34 strains and two point mutations namely "C368G" and "T377C" in 16 strains. Pulsed-field gel electrophoresis (PFGE) analysis indicated presence of a common clone and its variants; however this clone was also common among control group strains. Interestingly all heterogeneous macrolide resistant isolates were reported as susceptible to erythromycin, clindamycin, quinupristin-dalfopristin by the automated system. As a result a clone specific to heterogenous macrolide resistant strains was not detected. Although all hMLSB strains had erm(A) gene, a specific and common genetic modification could not be found in regulatory region of the isolates. The most important finding of this study is the detection of inability of the automated system to properly reflect the hMLSB phenotype. In addition it was suggested that longer incubation (at least 24 hours) of the antibiotic susceptibility test plates could help identification of hMLSB phenotype in disc diffusion tests.
Key words: Staphylococcus aureus; macrolide; lincosamide; streptogramin; resistance; heterogeneous macrolide resistance; clonality.
Geliş Tarihi (Received): 23.08.2012 • Kabul Ediliş Tarihi (Accepted): 25.12.2012
GİRİŞ
StaphyIococcus aureus birçok ülkede ciddi hastane ve toplum kökenli enfeksiyonlara neden olan önemli patojenlerden birisidir. Özellikle metisiline dirençli S.aureus (MRSA) izolatlarında gittikçe artan oranda görülen çoklu antibiyotik direnci tedavide zorluklara ve maliyet artışına neden olmaktadır. Günümüzde MRSA enfeksiyonlarının tedavisi daha önemli hale gelmiştir1,2. Bu amaçla kullanılan başlıca antibiyotikler glikopeptidler ve oksazolidinonlar olup, tetrasiklinler, aminoglikozidler, trimetoprim-sülfametoksazol, makrolid, linkozamid ve kinupristin-dalfopristin gibi antibiyotikler de tedavide kullanılan alternatif ajanlardır. Özellikle toplum kökenli stafilokok enfeksiyonlarında makrolid, linkozamid ve streptogramin (MLS) grubu antibiyotikler sıklıkla kullanılmaktadır3,4.
MLS grubu antibiyotikler, kimyasal yapıları farklı ancak protein sentezinin inhibisyonu suretiyle benzer etki mekanizmasına sahiptir. Bu grup antibiyotiklere direnç, hedef bölge değişikliği, enzimatik inaktivasyon ve aktif olarak ilacın dışa atılması sonucu gelişebilmektedir. S.aureus izolatlarında MLS grubu antibiyotiklere direnç gelişiminden en sık sorumlu olan mekanizma hedef değişikliğidir5,6,7. Hedef bölge değişikliği, erm (eritromisin ribozom metilaz) geninin kodladığı enzimlerin etkisiyle, MLS grubu antibiyotiklerin hedef bölgesi olan 23S rRNA'daki adenin rezidülerine metil grubunun eklenmesi sonucu veya 23S rRNA V. kangalının merkez kısmında ya da L4 ve L22 gibi ribozomal proteinlerdeki mutasyonlar sonucunda olmaktadır. Birçok erm geni kromozomal yerleşimli olup transpozonlar aracılığıyla taşınırken, bir kısmı da plazmid kaynaklı olarak taşınmaktadır. erm geninin ekspresyonu yapısal veya indüklenebilir karakterdedir. Yapısal ekspresyon indükleyicilerin varlığı veya yokluğundan bağımsız olarak sıklıkla erm genlerinin regülatör bölgelerindeki nokta mutasyonları, delesyon veya duplikasyon gibi değişiklikler sonucunda görülür8,9,10. Yapısal direncin görüldüğü izolatlar tüm makrolidlere, linkozamidlere ve streptogramin B'ye karşı direnç gösterir. İndüklenebilir ekspresyonda izolatlar 14 ve 15 üyeli makrolidlere dirençli; 16 üyeli makrolidler, linkozamid ve streptograminlere ise duyarlıdır. Makrolidlerle birlikte, linkozamid ve streptograminlere de direncin gelişmesi nedeniyle bu direnç tipi makrolid, linkozamid ve streptogramin-B (MLSB) direnci olarak adlandırılır. Dirence neden olan mekanizmayla ilişkili olarak MLSB direnci, laboratuvar değerlendirmeleri sırasında yapısal (konstitütif, cMLSB) veya indüklenebilir (iMLSB) direnç fenotipinde gözlenebilir11,12,13.
Hastanemiz MRSA izolatlarına ait disk difüzyon duyarlılık testlerinin değerlendirilmesi sırasında, bilinen makrolid direnç fenotipinin haricinde, makrolid antibiyotiklerinin inhibisyon zonu içerisinde küçük koloni üremelerinin gözlendiği bir direnç fenotipi saptanmıştır (Resim 1A). Ülkemizde ilk kez Karabiber ve arkadaşları14 tarafından tanımlanan ve heterojen MLSB (hMLSB) direnci olarak adlandırılan bu fenotipten sorumlu direncin mekanizmasına ilişkin ayrıntılı genetik analiz verilerine literatürde ulaşılamamıştır. Çalışmamız heterojen makrolid direncinin mekanizmasının ve suşlar arası klonal ilişkinin araştırılmasına yönelik olarak yürütülen ilk çalışma olması yönüyle önemlidir.
GEREÇ ve YÖNTEM
İzolatlar
Çalışmaya, Ocak 2006-Aralık 2008 tarihleri arasında hastanemizin Tıbbi Mikrobiyoloji Laboratuvarında izole edilen, disk difüzyon testi değerlendirmelerinde 14 ve 15-üyeli makrolidlere ait inhibisyon zonu içerisinde koloni üremeleri gözlenen 41 klinik MRSA izolatı dahil edildi. Aynı döneme ait 21'i iMLSB, 42'si ise cMLSB fenotipinde olmak üzere toplam 63 makrolide dirençli MRSA izolatı da kontrol grubu olarak kullanıldı. Tekrarlayan izolatlar çalışma dışında bırakıldı. Hastanemizin metisiline duyarlı S.aureus (MSSA) izolatlarında hMLSB fenotipinin gözlenmemesi nedeniyle çalışmaya MSSA izolatları dahil edilmedi. İzolatlar, konvansiyonel yöntemlere ek olarak S.aureus'un ısıya dirençli nükleaz genini kodlayan nuc(A) geninin gösterilmesiyle tanımlandı.
Antibiyotik Duyarlılık Testleri
İzolatların antibiyotik duyarlılıkları "Clinical and Laboratory Standards Institute (CLSI)" kriterlerine göre sefoksitin (30 µg), eritromisin (15 µg), klaritromisin (15 µg), azitromisin (15 µg), klindamisin (2 µg), kinupristin-dalfopristin (15 µg), penisilin (10U), vankomisin (30 µg), teikoplanin (30 µg), linezolid (30 µg), gentamisin (10 µg), amikasin (30 µg), siprofloksasin (5 µg), trimetoprim-sülfametoksazol (1.25/23.75 µg), kloramfenikol (30 µg), rifampin (5 µg), tetrasiklin (30 µg) ve telitromisin (15 µg) diskleri kullanılarak disk difüzyon yöntemiyle araştırıldı15. iMLSB direnç fenotipinin tanımlanması eritromisin ve klindamisin disklerinin kullanıldığı "D test" ile gerçekleştirildi. Eritromisin, klaritromisin, azitromisin ve klindamisin diskleri hMLSB direncini saptamak için kullanıldı. S.aureus ATCC 25923 ve daha önceden MLS direnç fenotipleri bilinen izolatlar kontrol izolatları olarak kullanıldı. İnhibisyon zonu içerisinde küçük koloni üremelerinin daha iyi görülmesi amacıyla inkübasyon süreleri 36 saate kadar uzatıldı. Heterojen makrolid dirençli (HMD) izolatların eritromisin, klindamisin ve kinupristin-dalfopristin duyarlılıkları ayrıca Vitek-2 otomatize sistemiyle (bioMerieux, Fransa) üreticilerin önerileri doğrultusunda belirlendi. HMD izolatların makrolid direncinin stabilitesi, bu özellikteki iki izolatın tek koloni ekiminden elde edilmiş 10'ar izolatın 15 gün boyunca pasajları sonunda D-test yöntemiyle araştırıldı.
Polimeraz Zincir Reaksiyonu (PCR) ile Direnç Genlerinin Araştırılması
Bu amaçla nuc(A), mecA, erm(A), erm(B), erm(C) ve msr(A) genlerine özgül primerler kullanıldı (Tablo I). Çalışmada nuc(A) geni izolatların tanımlanması, mecA geni metisilin direncinin, erm(A), erm(B), erm(C) ve msr(A) genleri ise makrolid direncinin saptanması amacıyla kullanıldı16,17,18. Kısaca, beyin kalp infüzyon sıvı besiyerine izolatların tek koloni ekimi yapıldı ve besiyeri 37°C'de 18 saat inkübe edildi. İnkübasyon süresinin sonunda süspansiyon 5000xg'de 3 dakika santrifüj edildi. Çökeltiden ticari ekstraksiyon kiti (Invitrogen, ABD) kullanılarak DNA elde edildi. Amplifikasyon tepkimeleri; 3 µl Taq buffer (10 X; Fermentas, Litvanya), 2.4 µl MgCI (25 mM; iNtRON Biotechnology, Kore), 0.6 µl dNTP karışımı (10 mM; Gene Mark, Tayvan), her bir primerden 0.12 µl (100 pmol; Iontek, Türkiye), 0.18 µl Taq polimeraz (5 U/µl, iNtRON Biotechnology, Kore), 2 µl DNA eldesi ve 21.58 µl steril su olacak şekilde toplam 30 µl hacimde gerçekleştirildi. Tüm tepkimeler; 95°C'de 5 dakika başlangıç denatürasyonunu takiben, 95°C'de 30 saniye denatürasyon, 54°C'de 30 saniye bağlanma, 72°C'de bir dakika uzama döngüsü içeren 35 döngü ve 72°C'de beş dakika son uzama olacak şekilde programlanarak gerçek zamanlı PCR (Icycler-BioRad, ABD) cihazında yürütüldü. Amplikonlar, yatay agaroz jel elektroforez işlemi ile analiz edildi. Bant büyüklüklerinin saptanması için DNA belirteci (Gel pilot 100 bç, Qiagen, ABD) eş zamanlı olarak jele yüklendi. Ürünler %1.5'lik agaroz jelde 1X TAE tamponu içinde 100 V akım altında 45 dakika süreyle yürütüldü. Elektroforez sonrası agaroz jel 2 µg/ml etidyum bromür içeren 500 ml distile suda 15 dakika boyandı. DNA bantları, görüntüleme cihazında (Molecular Imager Gel DOC XR+, BioRad, ABD) görüntülendi ve değerlendirildi.
Değişken Alanlı Jel Elektroforezi (Pulsed Field Gel Electrophoresis; PFGE)
Heterojen makrolid direnci saptanan 41 izolat arasındaki klonal ilişki, daha önce Türkyılmaz ve arkadaşlarının19 tarif ettikleri şekilde PFGE yöntemiyle araştırıldı. PFGE, aynı dönemde izole edilen kontrol grubundaki izolatlara da uygulandı. Bu yöntem, genomik DNA'nın SmaI enzimiyle kesilmesi sonucu gerçekleştirildi ve PFGE jelinin etidyum bromür ile boyanması sonrası görüntüleme cihazında değerlendirildi (Molecular Imager Gel DOC XR+, BioRad, ABD). PFGE paternleri arasındaki ilişki Tenover kriterlerine göre yorumlandı. Buna göre bant farkı izlenmeyen izolatlar aynı klon, 1-6 arasında bant farkı gözlenen izolatlar varyant, ≥ 7 bant farkı saptanan izolatlar ise farklı izolatlar olarak değerlendirildi20.
erm(A) Regülator Bölgesinin DNA Dizi Analizi
Heterojen makrolid direncine sahip izolatlarda erm(A) direnç geninin regülatör bölgesi lider peptidi de içerecek şekilde "Gen Bankası AJ276730" referans alınarak tasarlanan özgül primerlerle (ermALP1: 5' CGT TGG GGA TAA AAC TTC 3' ve ermALP2: 5' TTC GTG TGA TTC AAT ATT TC 3') analiz edildi (Şekil 1). PCR işlemi, makrolid direnç genlerinin araştırıldığı PCR bileşen konsantrasyonları ve döngüleri protokolünün aynısı olacak şekilde 4 µl örnek DNA'sı ve 46 µl PCR karışımı olmak üzere toplamda 50 µl hacim içeren 0.2 ml'lik mikrosantrifüj tüplerinde uygulandı. Elde edilen 527 baz çifti (bç) büyüklüğündeki PCR ürünlerinin DNA dizi analizi özel bir laboratuvarda (İontek, Türkiye) gerçekleştirildi.
İki yönlü dizilenmiş amplikonların dizilerinden "konsensus dizisi" belirlendi. Bu amaçla, ters primerle elde edilen dizinin "revers komplemanı" BioEdit programı kullanılarak elde edildi. Konsensus diziler birbirleri ve erm(A) regülatör bölgesi ile ClustalW programı kullanılarak karşılaştırıldı. Regülatör bölgede mutasyonlara göre oluşabilecek sekonder yapıların belirlenmesi için "mfold 3.2" programı kullanıldı21.
BULGULAR
Heterojen Makrolid Dirençli (HMD) İzolatlar ve Özellikleri
Çalışmadaki tüm hMLSB fenotipindeki izolatlar, eritromisin, klaritromisin ve azitromisin içeren disklerin inhibisyon zonu içerisinde küçük koloniler oluşturarak üremiştir (Resim 1A). İnhibisyon zonu içindeki kolonilerin eritromisin ve klindamisine duyarlılıkları disk difüzyon yöntemiyle araştırıldığında, ilginç olarak bu kolonilerin iMLSB fenotipinde oldukları belirlenmiştir (Resim 1B). Heterojen direnç fenotipinin yıllara göre dağılımı değerlendirildiğinde; 2006, 2007 ve 2008 yılı izolatlarında sırasıyla %57.5 (23/40), %26.7 (8/30) ve %28.6 (10/35) oranında olduğu saptanmıştır.
Heterojen fenotipin inkübasyon süresiyle olan ilişkisi incelendiğinde, 18. saatte zon içindeki kolonilerin zayıf üreme gösterdikleri ve dikkatli bir değerlendirme ile saptanabildikleri gözlenmiştir. İnkübasyon süresinin 24. ve 36. saate uzatılması sonucunda yapılan değerlendirmelerde, uzamış inkübasyon süresiyle doğru orantılı olarak kolonilerin belirgin şekilde görülebilir hale geldiği izlenmiştir.
Heterojen dirençli izolatların makrolid direncinin stabilitesi, izolatların tek koloni ekiminden elde edilen kolonilerin 15 günlük seri pasajları sonunda D-test yöntemiyle değerlendirilmiştir. Bu sürenin sonunda izolatların hMLSB fenotipini göstermeye devam ettikleri saptanmıştır. Aynı şekilde zon içindeki varyant koloniler test edildiğinde, bu kolonilerin de bu süre sonunda iMLSB fenotipini korudukları belirlenmiştir.
Heterojen dirençli izolatların tümünde aynı antibiyotik duyarlılık profili saptanmıştır (Tablo II). Bu izolatların Vitek-2 otomatize sistemi ile eritromisin ve kinupristin-dalfopristin MİK değerleri ≤ 0.25-0.5 µg/ml aralığında, klindamisin MİK değerleri ise ≤ 0.25 µg/ml olarak bulunmuş; tüm izolatlar otomatize sistemle test edilen üç antibiyotiğe karşı duyarlı saptanmıştır.
HMD izolatlarda araştırılan direnç genlerinden sadece erm(A)'nın varlığı belirlenmiş; erm(B), erm(C) veya msr(A) direnç geni saptanmamıştır. Buna göre erm(A), heterojen makrolid direncinden sorumlu tek mekanizma olarak değerlendirilmiştir. Kontrol grubundaki izolatların %93.7 (59/63)'sinde erm(A), %58.7 (37/63)'sinde erm(A) ve erm(C) birlikteliği, %6.3 (4/63)'ünde erm(B) direnç geni saptanırken, msr(A) direnç geni saptanmamıştır.
Klonalite
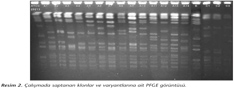
Toplam 104 izolatın (41 hMLSB, 42 cMLSB, 21 iMLSB) klonal ilişkisi PFGE ile araştırılmış ve üç farklı klon saptanmıştır. Çalışmada saptanan klonlar ve varyantlarına ait PFGE görüntüsü Resim 2'de verilmiştir. Hem heterojen makrolid dirençli suşlarda hem de çalışmadaki diğer suşlarda egemen bir klonun (A) ve varyantlarının varlığı belirlenmiştir (Tablo III). Sonuçta heterojen makrolid dirençli izolatlara özgül bir klon varlığı bulunmamıştır. Bu durum hastanemizde saptadığımız heterojen makrolid direncinin klonal bir yayılım olmadığını göstermektedir.
erm(A) Regülatör Bölgesinin Dizi Analizinin Yorumlanması
HMD izolatların regülatör bölgelerinin dizi analizleri yapılarak, Gen Bankası AJ276730 no'lu erm(A) gen dizisinin regülatör bölgesiyle karşılaştırılmıştır. Buna göre izolatların 34'ünde erm(A) geninin 149. bazı olan "guanin"de delesyon belirlenmiş; 16 izolatta iki nokta mutasyonu (C368G ve T377C) saptanmış, 13 izolatta ise baz delesyonu ve iki nokta mutasyonu birlikteliği görülmüştür.
Saptanan mutasyonların, lider peptid (256-303) veya erm(A) için kodlayan bölgede veya bu genlerin ribozom bağlayan bölgelerinde (RBS) olmadığı belirlenmiştir. Mutasyonların mRNA sekonder yapısındaki enerji tutarı üzerinde etkisi olabilmektedir. Bu nedenle çalışmada mutasyonlu ve mutasyonsuz bölgelerdeki ayrılma enerjisi farklılıkları "RNA folding" programıyla ölçülmüş, toplam enerjide fark olmadığı bulunmuştur. Mutasyonsuz erm(A) regülatör bölgesinde -110.9 kcal/mol olan ayrılma enerjisi, mutasyonlu bölge için -112 kcal/mol olarak saptanmıştır. Bununla birlikte nokta mutasyonların saptandığı 361-527 bazlarının bulunduğu bölge RNA folding programıyla çalışıldığında ayrılma enerjisinde farklılık olduğu görülmüştür. Mutasyonsuz halde ayrılma enerjisi -29.9 iken mutasyonlu halde -35.7 olarak bulunmuştur (Şekil 2).
TARTIŞMA
MLS grubu antibiyotikler kimyasal yapıları farklı, ancak protein sentezinin inhibisyonu suretiyle benzer etki mekanizmasına sahiptir. Dirence neden olan mekanizmayla ilişkili olarak MLS direnci, laboratuvar değerlendirmeleri sırasında yapısal veya indüklenebilir direnç fenotipinde gözlenebilir. MLS grubu antibiyotiklere karşı bilinen direnç fenotiplerinin dışında farklı direnç fenotiplerinin varlığı da çeşitli çalışmalarda bildirilmektedir14,22,23. Çalışmamıza benzer şekilde, Yoon ve arkadaşları23 2008 yılında, klindamisin veya josamisinin eritromisine bakan kenarındaki zonda bir küntleşme (D zonu) ile zon içinde "foggy" (buğulu) olarak tanımladıkları, zayıf ama homojen bir üremeden bahsetmişler ve bu fenotipi "foggy D-shape" olarak isimlendirmişlerdir. Bu araştırıcılar, çalışmadaki izolatların tümünde, bizim çalışmamızda olduğu gibi yalnızca erm(A) direnç genini saptamışlar ve bu geni regülatör bölgeyi de içerecek şekilde dizilemişlerdir23. DNA dizi analizi sonucu homojen ve heterojen nükleotid dizileri olmak üzere iki grubun varlığı ile 25 bç'lik mutasyonel değişiklikler belirlemişlerdir23. İzolatlarda indüklenebilir ve yapısal fenotipin birlikteliğini göstermişler, bu durumun iki farklı erm(A) gen birlikteliği veya bir erm(A) geninin iki farklı karakterde ekspresyonu sonucunda ortaya çıkabileceği yorumunu getirmişlerdir.
Çalışmamızda izole edilen heterojen makrolid dirençli (HMD) klinik MRSA suşları, fenotipik olarak günümüzde tanımlanmış indüklenebilir ve yapısal direnç fenotiplerinden farklı bulunmuştur. Bu fenotip daha önce Karabiber ve arkadaşları14 tarafından Yüksek İhtisas Hastanesi izolatları arasında tanımlanmış; ancak literatürde bu suşların direnç mekanizmasına yönelik ayrıntılı genetik analiz verilerine ulaşılamamıştır. Dolayısıyla hMLSB fenotipinin direnç mekanizmasının ve suşların klonal yayılımının araştırılması ilk kez bu çalışmada gerçekleştirilmiştir. Çalışmamızda erm(A), hMLSB fenotipinden sorumlu direnç geni olarak belirlenmiş, ancak erm(A) geninin regülatör bölgesinin dizi analizinde bu fenotipi açıklayacak yaygın ve özgül bir genetik değişiklik saptanmamıştır. Her ne kadar bazı izolatlarda bir baz delesyonu ve/veya bazılarında iki nokta mutasyonu birlikteliği görülse de, saptanan delesyonun lider peptid veya RBS bölgesinde bulunmadığı ve ikincil yapıdaki enerji potansiyelini değiştirmediği için, bu mutasyonların erm(A) ekspresyonu üzerine etkisinin olmadığı düşünülmüştür. Regülatör bölgede saptanan iki nokta mutasyonu lider peptidden sonraki bölgede, erm(A) geninin başlangıç kodonundan öncesine karşılık gelmektedir. Bu mutasyonların yer aldığı bölge, sekonder yapı oluşumu açısından incelendiğinde, mutasyonların varlığında ayrılma için gerekli enerjinin arttığı görülmüştür. Bununla birlikte söz konusu değişikliğin de hMLSB fenotipini açıklayıcı düzeyde olmadığı düşünülmektedir. hMLSB fenotipinde mRNA sentezinin de regülasyona dahil olduğu ve antibiyotiksiz ortamda bu sentezin de ikincil bir regülasyon sistemiyle yapılmasının engellendiği düşünülmektedir.
Hastanemizde heterojen direnç fenotipinin yıllara göre dağılımı incelendiğinde, 2006, 2007 ve 2008 yılı izolatlarında sırasıyla %57.5, %26.7 ve %28.6 oranlarında olduğu görülmektedir. Bu direnç halen hastanemiz MRSA izolatlarında saptanmakta olup, en son 2011 yılında yapılan bir değerlendirmede, MRSA suşlarının %46.7 (14/30)'sinde heterojen direnç fenotipi belirlenmiştir (yayınlanmamış veri). Ancak ilginç olarak hastanemizde izole edilen MSSA izolatlarında hMLSB fenotipine rastlanmamıştır. Hastanemiz MRSA izolatlarında gözlenen hMLSB fenotipinin izolatlar arası klonal yayılımı araştırıldığında, izolatlar tek klonun varyantları olarak ilişkili bulunmuştur. Ancak bu klon hastanemizin diğer MRSA izolatları arasında egemen klon olarak saptanmıştır. Bu bulgu, hastanemizde saptanan heterojen makrolid direncinin klonal bir yayılım göstermediğini düşündürmektedir.
Heterojen makrolid direnç fenotipinin stabilitesi araştırıldığında, makrolid türü antibiyotiklerle temas etmeyen koloninin seri pasajları sonucunda hMLSB fenotipini koruduğu gözlenmiştir. Bununla birlikte, eritromisin inhibisyon zonu içinde üreyen kolonilerden seri pasaj yapıldığında heterojen fenotipe tekrar dönüşüm olmadığı ve bu izolatların da iMLSB fenotipini korudukları görülmüştür. Bu durum, hMLSB fenotipine sahip bakterilerde var olan genotipin korunduğunu, ancak ekspresyon düzeyini etkileyen ikincil faktörlerin de bulunabileceğini düşündürmektedir. HMD izolatların tümünde erm(A) direnç geninin saptanması ve makrolid inhibisyon zonu içinde üreyen kolonilerinin saf kültür pasajlarından gerçekleştirilen antibiyotik duyarlılık testlerinde iMLSB fenotipinin bulunması dikkat çekicidir. Bu durum, heterojen makrolid direnci taşıyan MRSA enfeksiyonlarının tedavisinde, makrolidlerin veya klindamisinin tercih edilmesi halinde tedavide başarısızlığa yol açabilecek bir faktör olması nedeniyle son derece önemlidir.
Sonuç olarak, çalışmamızda hMLSB direncinin klonal olmadığı gibi erm(A) regülatör bölgesindeki genetik değişikliğe de bağlı olmadığı gösterilmiştir. Bulgularımız, direncin ekspresyona bağlı olduğunu, ekspresyon düzeyindeki farklılığın ise regülatör bölge dışında olabileceğini düşündürmektedir. Bu çalışmada hMLSB fenotipinde translasyon aşamasını etkileyecek genetik bir farklılık bulunamamış; ileri çalışmalarda regülasyonun farklı bir düzeyde olması ve transkripsiyon aşamasında mRNA sentezini engelleyen bir regülasyon olasılığının araştırılmasıyla konuya ışık tutulabileceği sonucuna varılmıştır. Bu çalışmada elde edilen bir diğer önemli sonuç, otomatize sistemlerin hMLSB özelliği gösteren izolatların eritromisin ve klindamisin duyarlılıklarını değerlendirmede yetersiz kalabildiğini göstermesidir. Bunun yanı sıra, heterojen makrolid direncinin saptanmasında disk difüzyon yöntemi için CLSI'nın önerdiği 18 saatlik inkübasyon süresinin yeterli olamayabileceği, inkübasyon süresinin uzatılmasının (en az 24 saat) hMLSB fenotipinin saptanmasına katkı sağlayabileceği düşünülmüştür.
KAYNAKLAR
- Durai R, Ng PC, Hoque H. Methicillin-resistant Staphylococcus aureus: an update. AORN J 2010; 91(5): 599-606.
- Klevens RM, Morrison MA, Nadle J. Invasive methicillin-resistant Staphylococcus aureus infections in the United States. JAMA 2007; 298(15): 1763-71.
- Pan A, Lorenzotti S, Zoncada A. Registered and investigational drugs for the treatment of methicillin-resistant Staphylococcus aureus infection. Recent Pat Antiinfect Drug Discov 2008; 3(1): 10-33.
- Fiebelkorn KR, Crawford SA, McElmeel ML, et al. Practical disk diffusion method for detection of inducible clindamycin resistance in Staphylococcus aureus and coagulase-negative staphylococci. J Clin Microbiol 2003; 41(10): 4740-44.
- Roberts MC, Sutcliffe J, Courvalin P, Jensen LB, Rood J, Seppala H. Nomenclature for macrolide and macrolide-lincosamide-streptogramin B resistance determinants. Antimicrob Agents Chemother 1999; 43(12): 2823-30.
- Pechere JC. Macrolide resistance mechanisms in gram-positive cocci. Int J Antimicrob Agents 2001; 18(Suppl 1): S25-8.
- Weisblum B. Erythromycin resistance by ribosome modification. Antimicrob Agents Chemother 1995; 39(3): 577-85.
- Vester B, Douthwaite S. Macrolide resistance conferred by base substitutions in 23S rRNA. Antimicrob Agents Chemother 2001; 45(1): 1-12.
- Jalava J, Marttila H. Application of molecular genetic methods in macrolide, lincosamide and streptogramin resistance diagnostics and in detection of drug-resistant Mycobacterium tuberculosis. APMIS 2004; 112(11-12): 838-55.
- Leclercq R. Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements and their clinical implications. Clin Infect Dis 2002; 34(4): 482-92.
- Fernandes CJ, O'Sullivan MV, Cai Y, et al. Agar dilution method for detection of inducible clindamycin resistance in Staphylococcus spp. J Clin Microbiol 2007; 45(12): 4018-20.
- Janapatla RP, Yan JJ, Huang AH, et al. Inducible clindamycin resistance in Staphylococcus aureus isolates causing bacteremia at a university hospital in southern Taiwan. Diagn Microbiol Infect Dis 2007; 58(2): 203-9.
- Forrest GN, Oldach DW. Macrolides and clindamycin, pp: 214-33. In: Gorbach SL, Bartlett JG, Blacklow NR (eds), Infectious Diseases. 2004, 3rd ed. Lippincott Williams & Wilkins, Philadelphia.
- Karabiber N, Dinc BM. Çeşitli klinik örneklerden izole edilen MRSA suşlarının antibiyotiplendirilmesi ve eritromisin zon içi üreme gösteren MRSA suşları. ANKEM 2007; 21(1): 50-8.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Nineteenth Informational Supplement M100-S19, 2009. CLSI, Wayne, PA.
- Brakstad OG, Aasbakk K, Maeland JA. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene. J Clin Microbiol 1992; 30(7): 1654-60.
- Murakami K, Minamide W, Wada K. Identification of methicillin-resistant strains of staphylococci by polymerase chain reaction. J Clin Microbiol 1991; 29(10): 2240-4.
- Nawaz MS, Khan SA, Khan AA, Khambaty FM, Cerniglia CE. Comparative molecular analysis of erythromycin-resistance determinants in staphylococcal isolates of poultry and human origin. Mol Cell Probes 2000; 14(5): 311-9.
- Türkyilmaz S, Tekbiyik S, Oryasin E, Bozdogan B. Molecular epidemiology and antimicrobial resistance mechanisms of methicillin-resistant Staphylococcus aureus isolated from bovine milk. Zoonoses Public Health 2009; 57(3): 197-203.
- Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995; 33(9): 2233-9.
- Zuker M. Mfold web server for nucleic acid folding and hybridization prediction. Nucleic Acids Res 2003; 31(13): 3406-15.
- Hamilton-Miller JM, Shah S. Patterns of phenotyphic resistance to the macrolide-lincosamide-ketolide-streptogramin group of antibiotics in staphylococci. J Antimicrob Chemother 2000; 46(6): 941-9.
- Yoon EJ, Kwon AR, Min YH, Choi EC. Foggy D-shaped zone of inhibition in Staphylococcus aureus owing to a dual character of both inducible and constitutive resistance to macrolide-lincosamide-streptogramin B. J Antimicrob Chemother 2008; 61(3): 533-40.
İletişim (Correspondence):
Uzm. Dr. Tuğrul Hoşbul,
Gölcük Asker Hastanesi,
Tıbbi Tahlil Laboratuvarı,
41950, Gölcük, Kocaeli, Türkiye.
Tel (Phone): +90 262 414 6601-7830,
E-posta (E-mail): tugrulhosbul@mynet.com