Tüberküloz Hastalarında Sitokin Gen Polimorfizmi ve Genetik Yatkınlığın Belirlenmesi*
Determination of the Cytokine Gene Polymorphism and Genetic Susceptibility in Tuberculosis Patients
Mahmut ÜLGER1, Gürol EMEKDAŞ1, Gönül ASLAN1, Dilaver TAŞ2, Ahmet İLVAN3, Seda TEZCAN1,
Mukadder ÇALIKOĞLU3, M. Emin ERDAL4, Zafer KARTALOĞLU2
1 Mersin Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Mersin.
1 Mersin University Faculty of Medicine, Department of Medical Microbiology, Mersin, Turkey.
2 Gülhane Askeri Tıp Akademisi Haydarpaşa Eğitim Hastanesi, Göğüs Hastalıkları Servisi, İstanbul.
2 Gulhane Military Academy of Medicine, Haydarpasa Education Hospital, Department of Chest Diseases, Istanbul, Turkey.
3 Mersin Üniversitesi Tıp Fakültesi, Göğüs Hastalıkları Anabilim Dalı, Mersin.
3 Mersin University Faculty of Medicine, Department of Chest Diseases, Mersin, Turkey.
4 Mersin Üniversitesi Tıp Fakültesi, Tıbbi Biyoloji ve Genetik Anabilim Dalı, Mersin.
4 Mersin University Faculty of Medicine, Department of Medical Biology and Genetics, Mersin, Turkey.
* Bu çalışma, Mersin Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalında doktora tezi olarak hazırlanmış ve Mersin Üniversitesi Bilimsel Araştırma Projeleri Birimi tarafından [Proje No: BAP-SBE TM (MÜ) 2010-4 DR] desteklenmiştir.
ÖZET
Tüberküloz biyolojik, sosyoekonomik ve çevresel faktörlerin birlikte rol oynadığı karmaşık bir hastalıktır. Mycobacterium tuberculosis ile enfekte kişilerin sadece %10'unda aktif hastalık gelişmesi nedeniyle, konak genetiğinin tüberküloz için risk faktörlerini etkileyebileceği öne sürülmüştür. Bu çalışmada, hastalığa karşı duyarlılık veya direnç ile ilişkili olduğu belirtilen, sitokin üretiminden sorumlu gen bölgelerindeki tek nükleotid polimorfizm varlığının "Amplification Refractory Mutational System" (ARMS) polimeraz zincir reaksiyonu (PCR) ve PCR-"Restriction Fragment Length Polymorphism (RFLP)" yöntemleriyle araştırılması amaçlanmıştır. Tek nükleotid polimorfizm varlığı tümör nekrozis faktör alfa (TNF-α) geni promotor -308 G>A (rs1800629) bölgesinde, interferon gama (IFN-γ) geni +874 T>A (rs61923114) bölgesinde, interlökin (IL)-12B p40 geni 1188 A>C (rs3212227) bölgesinde, IL-10 geni promotor -1082 G>A (rs1800896) bölgesinde ve IL-4 geni promotor -590 C>T (rs2243250) bölgesinde araştırılmıştır. Çalışmaya, klinik örneklerinin kültüründe M.tuberculosis kompleksi izole edilen 84 tüberküloz hastası (71 erkek, 13 kadın; ortalama yaş: 32.57 ± 15.94 yıl) ile kontrol grubu olarak 110 sağlıklı kan donörü (93 erkek, 17 kadın; ortalama yaş: 29.40 ± 11.56 yıl) dahil edilmiştir. Hastaların 76 (%90.5)'sı akciğer, 8 (%9.5)'i akciğer dışı tüberküloz olarak tanı almıştır. Hastaların 79 (%94.1)'u yeni tanı konmuş, 5 (%5.9)'i ise daha önceden geçirilmiş tüberküloz öyküsü (nüks tüberküloz) olan olgulardır. Hastaların 58 (%69)'inde ise aside dirençli basil (ARB) pozitifliği saptanmıştır. Tek nükleotid polimorfizmi sonuçlarına göre TNF-α geni promotor -308 G>A bölgesi polimorfizmi için sağlıklı kontrol grubu Hardy-Weinberg dağılımı bakımından dengedeyken, hasta grubu dengede olmadığından bu iki grubun gen frekansları bakımından karşılaştırılması yapılamamıştır. IFN-γ geni +874 T>A bölgesi, IL-12B p40 geni 1188 A>C bölgesi, IL-10 geni promotor -1082 G>A bölgesi ve IL-4 geni promotor -590 C>T bölgesi polimorfizmleri sonucu allel ve genotip dağılımlarında hasta ve sağlıklı kontrol grubu arasında istatistiksel olarak anlamlı bir fark bulunamamıştır (p> 0.05). ARB pozitif (n= 58) ve negatif (n= 26) hastalar ve akciğer tüberkülozlu ARB pozitif (n= 56) ve negatif (n= 20) olan hastalar arasında da istatistiksel olarak anlamlı bir fark saptanmamıştır (p> 0.05). Sonuç olarak, çalışılan popülasyonda sitokin salınımından sorumlu gen bölgelerindeki tek nükleotid polimorfizm varlığı ile tüberküloza direnç ya da duyarlılıkla ilgili istatistiksel olarak anlamlı bir ilişki bulunamamıştır. Yaptığımız bu çalışmada, sadece sitokin salınımından sorumlu bazı gen bölgelerindeki tek nükleotid polimorfizmleri araştırılmıştır. Bu sebeple gerek sitokin salınımını kontrol eden genlerdeki gerekse bu sitokinlerin bağlandıkları reseptörlerdeki polimorfizmlerin daha ayrıntılı olarak araştırılması gerekmektedir. Çalışma nispeten küçük bir popülasyonda gerçekleştirilmiş olup, elde ettiğimiz bulguların, ülkemizde tüberküloz immünolojisinin moleküler epidemiyolojisine önemli katkı sağlayacağı düşünülmüştür.
Anahtar sözcükler: Mycobacterium tuberculosis; tüberküloz; sitokin; gen polimorfizmi; genetik yatkınlık.
ABSTRACT
Tuberculosis (TB) is a complicated disease in which biological, socioeconomical and environmental factors play role. Since only 10% of the individuals infected with Mycobacterium tuberculosis develop active disease, it has been suggested that host genetic factors may influence the risk for the development of TB. In this study, we aimed to investigate the presence and role of single nucleotide polymorphisms in the gene regions responsible for cytokine production, since these factors are considered to be associated with susceptibility or resistance to disease development. Single nucleotide polymorphisms were investigated by Amplification Refractory Mutational System (ARMS) Polymerase Chain Reaction (PCR) and PCR-Restriction Fragment Length Polymorphism (RFLP) methods. The presence of single nucleotide polymorphisms were analyzed in tumor necrosis factor alpha (TNF-α) gene promoter -308 G>A (rs1800629) region, interferon gamma (IFN-γ) gene +874 T>A (rs61923114) region, interleukin (IL)-12B p40 gene 1188 A>C (rs3212227) region, IL-10 gene promoter -1082 G>A (rs1800896) region and IL-4 gene promoter -590 C>T (rs2243250) region. A total of 84 patients (71 male, 13 female; mean age: 32.57 ± 15.94 years) whose clinical samples yielded M.tuberculosis complex growth, and 110 healthy blood donors (93 male, 17 female; mean age: 29.40 ± 11.56 years) as control group were included in this study. Of the patients, 76 (90.5%) were diagnosed as pulmonary and 8 (9.5%) as extrapulmonary TB. While 79 (94.1%) patients were newly diagnosed as TB, 5 (5.9%) patients had a TB history (relapsed TB). It was detected that acid-fast bacilli (AFB) were positive in 58 (69%) patients. According to the single nucleotide polymorphism results, gene frequencies could not be compared for TNF-α gene promoter -308 G>A region since healthy controls were in Hardy-Weinberg equilibrium while the patients were not. There were no statistically significant differences in allele and genotype distribution between the patients and healthy controls in IFN-γ gene +874 T>A region, IL-12B p40 gene 1188 A>C region, IL-10 gene promoter -1082 G>A region and IL-4 gene promoter -590 C>T region (p> 0.05). There were also no statistically significant differences between AFB positive (n= 58) and negative (n= 26) patients, and AFB positive (n= 56) and negative (n= 20) pulmonary TB patients (p> 0.05). In conclusion, no statistically significant differences were found associated with the susceptibility or resistance to TB with single nucleotide polymorphisms in the gene regions responsible for cytokine production in the study population. Only some of the single nucleotide polymorphisms of the gene regions responsible for cytokine release were investigated in our study. Therefore further detailed studies to investigate the polymorphisms in the genes that control the cytokine release and receptors specific for these cytokines, should be conducted. Although this study was performed in a relatively small sized population, these findings might provide a significant contribution to the epidemiologic data about the molecular immunology of TB in Turkey.
Key words: Mycobacterium tuberculosis; tuberculosis; cytokine; gene polymorphism; genetic susceptibility.
Geliş Tarihi (Received): 15.08.2012 • Kabul Ediliş Tarihi (Accepted): 06.01.2013
GİRİŞ
Tüberküloz (TB), günümüzde halen yüksek mortalite ile seyreden enfeksiyon hastalıklarının başında gelmektedir. Her yıl yaklaşık 8.9-9.9 milyon kişi Mycobacterium tuberculosis ile enfekte olmakta ve yaklaşık 1.3 milyon kişi enfeksiyon nedeniyle kaybedilmektedir. Enfekte kişilerin yaklaşık %5-10'unda hastalığın klinik formu gelişmektedir. Bu hastaların çok azında insan immünyetmezlik virüsü (HIV) pozitifliği ya da diyabet gibi risk faktörleri tanımlanmış; diğer hastalarda ise genetik yatkınlık ve çevresel faktörlerin aktif TB gelişimine katkıda bulunduğu bildirilmiştir1,2.
M.tuberculosis ile enfeksiyon sonrası oluşan immün yanıt, basil ile konak savunma mekanizmaları arasındaki dengeyi yansıtmaktadır. M.tuberculosis enfeksiyonu sırasında, basile maruziyetin üçüncü haftasında salgılanan ve makrofajları aktive eden Th1 tipi sitokinlerin koruyucu immünitede çok önemli oldukları gösterilmiştir3. Bunlardan birisi olan interferon gama (IFN-γ), makrofaj aktivasyonu ve MHC sınıf II ile birlikte antitümör ve antimikrobisidal aktivitelerin uyarılmasındaki en önemli sitokindir3. IFN-γ geninde mutasyon bulunan kişiler, M.tuberculosis ve patojenik olmayan mikobakteri enfeksiyonlarına karşı duyarlıdırlar. Yapılan çalışmalarda, IFN-γ geninin +874 timin (T)> adenin (A) ve 3' "untranslated region" (UTR) 5644 A> guanin (G) bölgelerindeki tek nükleotid polimorfizmlerinin TB'ye duyarlılık ile ilişkisi gösterilmiştir4. Tümör nekrozis faktör alfa (TNF-α) ise, inflamatuvar yanıtın başlatılması, düzenlenmesi ve devam ettirilmesinde önemli rolü olan güçlü bir proinflamatuvar ve immünoregülatör sitokindir. TNF-α ayrıca mikobakteriyel enfeksiyonlara karşı oluşturulan yanıtta apoptozun başlatılmasında gereklidir. TNF-α geni promotor -1031 T> sitozin (C), -863 C>A, -857 T>C, -308 G>A ve -238 G>A tek nükleotid polimorfizmleri ile TB'ye duyarlılık arasındaki ilişkiyi gösteren çeşitli çalışmalar bulunmaktadır3.
İnterlökin (IL)-12, p35 ve p40 alt ünitelerinden oluşan heterodimerik bir sitokin olup, IL-12A geni p35, IL-12B geni ise p40 alt ünitesini kodlar5. Bu sitokin, hücre içi yerleşen patojenlere karşı uzun dönem korunmayı düzenleyen bellek/efektör Th1 hücrelerinin oluşturulmasında önemlidir. IL-12B 3' UTR +1188 ve 3' UTR +16974 A>C gen bölgesi polimorfizmleri ile TB arasındaki ilişkinin varlığı değişik çalışmalarda araştırılmıştır6. IL-10 ise, M.tuberculosis'in fagosite edilmesinden sonra makrofajlar ve T lenfositleri tarafından üretilen antiinflamatuvar bir sitokindir. Bu sitokin, M.tuberculosis'e karşı oluşturulan Th1 yanıtını baskılamakta, makrofajlarda M.tuberculosis ile uyarılan apoptozu azaltmaktadır IL-10 ayrıca, IFN-γ, TNF-α ve IL-12 gibi proinflamatuvar sitokin yanıtını da azaltır. Çeşitli çalışmalarda, IL-10 geni promotor bölgesindeki -3575 T>A, -2763 C>A, -1082 A>G, -819 C>T ve -592 C>A tek nükleotid polimorfizmleri ile TB'ye duyarlılık arasındaki ilişki vurgulanmaktadır7. Th2 tipi antiinflamatuvar bir sitokin olan IL-4, genellikle TB'nin ilerlemiş safhalarında yükselmekte ve koruyucu Th1 yanıtını azaltmaktadır. İlerleyen hastalıkta immünopatolojinin azalmasından ziyade artmasına sebep olmaktadır8. IL-4 promotor -1089 T>G, -590 C>T, -33 T>C ve IL-4 intron 3 "Variable Number of Tandem Repeats (VNTR)" gen bölgelerindeki polimorfizmlerin TB'ye karşı duyarlılıklarının araştırıldığı çalışmalar mevcuttur9.
TB'ye genetik yatkınlık üzerine yaptığımız bu çalışmada, hastalığa karşı duyarlılık veya direnç ile ilişkili olduğu belirtilen, sitokin üretiminden sorumlu gen bölgelerindeki tek nükleotid polimorfizm varlığının "Amplification Refractory Mutational System (ARMS)" polimeraz zincir reaksiyonu (PCR) ve "PCR-Restriction Fragment Length Polymorphism (RFLP)" yöntemleriyle araştırılması amaçlanmıştır. Tek nükleotid polimorfizm varlığı; Th1 tipi proinflamatuvar sitokinler (TNF-α geni promotor -308 G>A bölgesi, IFN-γ geni +874 T>A bölgesi, IL-12B p40 geni 1188 A>C bölgesi) ile Th2 tipi antiinflamatuvar sitokinlerde (IL-10 geni promotor -1082 G>A bölgesi, IL-4 geni promotor -590 C>T bölgesi) incelenmiştir.
GEREÇ ve YÖNTEM
Hastalar ve Örnekler
Bu çalışmaya, 2011 yılında Mersin Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı ve Gülhane Askeri Tıp Akademisi Haydarpaşa Eğitim Hastanesi Göğüs Hastalıkları Servisinde, klinik örneklerinden M.tuberculosis kompleksi (MTC) izole edilen sırasıyla 37 ve 47 hasta olmak üzere toplam 84 TB hastası alındı. MTC izolasyonu, katı (Löwenstein-Jensen) ve/veya sıvı (BACTEC 460 TB ve/veya BACTEC MGIT 960, Becton Dickinson, ABD) besiyerleri kullanılarak gerçekleştirildi.
Sağlıklı kontrol grubu olarak, Mersin Üniversitesi Sağlık Araştırma ve Uygulama Merkezi Kan Merkezine başvuran 110 kan donörü çalışmaya dahil edildi. Kontrol grubu seçilirken cinsiyet ve yaş ortalamalarının hasta grubu ile uyumlu olmasına dikkat edildi.
Mersin Üniversitesi Tıp Fakültesi Dekanlığı, Etik Kurul Başkanlığının onayı (17.04.2009 tarih ve 2009/56-04 sayı) ile gerçekleştirilen bu çalışmada katılımcıların bilgilendirilmiş onamları alındı. Çalışmaya dahil edilen TB'li hasta ve sağlıklı donörlerden 3-4 ml periferik kan örneği, içerisinde antikoagülan (EDTA) bulunan tüplere alındı.
Genomik DNA Ekstraksiyonu ve Tek Nükleotid Polimorfizmlerinin Belirlenmesi
Hasta ve kontrollerden alınan tam kan örneklerindeki lenfosit ve granülositlerden genomik DNA ekstraksiyonu "Roche High Pure PCR Template Preparation Kit" (Roche 11 796 828 001)'i kullanılarak üretici firmanın önerileri doğrultusunda gerçekleştirildi.
Çalışmada, TNF-α geni promotor -308 G>A (rs1800629) bölgesi, IFN-γ geni +874 T>A (rs61923114) bölgesi, IL-12B p40 geni 1188 A>C (rs3212227) bölgesi, IL-10 geni promotor -1082 G>A (rs1800896) bölgesi ve IL-4 geni promotor -590 C>T (rs2243250) bölgelerindeki tek nükleotid polimorfizm varlığı araştırıldı10,11,12,13. Araştırılan gen bölgelerine göre kullanılan yöntemler, primerler ve kesim enzimleriyle ürün uzunlukları Tablo I'de gösterildi.
ARMS PCR yönteminde her bir allelin amplifikasyonu, 50 µl'lik reaksiyon hacimlerinde [5 µl 10X PCR tampon, 2.5 µmol/µl MgCl2, 0.2 µmol/µl dNTP karışımı, 0.25 pmol/µl her bir primer (IFN-γ geni +874 T/A ve IL-10 geni promotor -1082 G/A için ilave olarak 0.25 pmol/µl her bir internal kontrol primeri), 1.25 U Taq DNA polimeraz, 5 µl örnek DNA'sı] gerçekleştirildi.
Isı döngü cihazında (Eppendorf, Mastercycler, Almanya) amplifikasyon koşulları; TNF-α için 95°C'de 10 dakika başlangıç denatürasyonu, 10 döngü 95°C'de 15 saniye denatürasyon, 64°C'de 50 saniye bağlanma, 72°C'de 40 saniye uzama, bunu takiben 20 döngü 95°C'de 20 saniye denatürasyon, 59°C'de 50 saniye bağlanma, 72°C'de 50 saniye uzama ve 72°C'de 5 dakika son uzama şeklinde uygulandı. IFN-γ ve IL-10 için 95°C'de 10 dakika başlangıç denatürasyonu, 10 döngü 95°C'de 15 saniye denatürasyon, 62°C'de 50 saniye bağlanma, 72°C'de 40 saniye uzama, bunu takiben 20 döngü 95°C'de 20 saniye denatürasyon, 56°C'de 50 saniye bağlanma, 72°C'de 50 saniye uzama ve 72°C'de 5 dakika son uzama şeklinde uygulandı.
PCR-RFLP yönteminde her bir örneğin PCR amplifikasyonu (IL-12B p40 ve IL-4 için) 50 µl'lik reaksiyon hacimlerinde (5 µl 10X PCR tampon, 2.5 µmol/µl MgCl2, 0.2 µmol/µl dNTP karışımı, 0.25 pmol/µl her bir primer, 1.25 U Taq DNA polimeraz, 5 µl örnek DNA'sı) gerçekleştirildi. IL-12B p40 için amplifikasyon koşulları; 95°C'de 10 dakika başlangıç denatürasyonu, 30 döngü 95°C'de 30 saniye denatürasyon, 43°C'de 30 saniye bağlanma, 72°C'de 1 dakika uzama ve 72°C'de 7 dakika son uzama şeklinde uygulandı. IL-4 için ise amplifikasyon koşulları; 95°C'de 10 dakika başlangıç denatürasyonu, 30 döngü 95°C'de 50 saniye denatürasyon, 62°C'de 50 saniye bağlanma, 72°C'de 50 saniye uzama ve 72°C'de 5 dakika son uzama şeklinde uygulandı.
IL-12B p40 RFLP analizi için, ayrı reaksiyon tüplerinde PCR ürünlerinin 7 µl'si 2 ünite (0.2 µl) TaqI (Fermentas, #ER0671), 1 µl 10X kesim tamponu (TaqI) ve 1.8 µl nükleaz içermeyen steril su ile karıştırıldıktan sonra 65°C'de 4-16 saat inkübe edildi.
IL-4 RFLP analizi için, ayrı reaksiyon tüplerinde PCR ürünlerinin 5 µl'si 1 ünite (0.5 µl) BsmFI (Fermentas, #ER1811), 1 µl 10X kesim tamponu (Tango), 0.2 µl 50X kesim tamponu [S-adenosyl-L-methionine (SAM)] ve 3.3 µl nükleaz içermeyen steril su ile karıştırıldıktan sonra 37°C'de 4-16 saat inkübe edildi. ARMS PCR ve PCR-RFLP ürünleri, %1.5'lik agaroz jel elektroforezinden sonra 0.5 µg/ml etidyum bromür ile boyandıktan sonra ultraviyole transilüminatörde görüntülendi. Oluşan bantların büyüklüğü moleküler ağırlık standardı (GeneRuler 100 baz çifti [bç] DNA Ladder, #SM0241, Fermentas) ile kıyaslanarak değerlendirildi.
İstatistiksel Analiz
Hastalık ile genotiplerin ve allellerin ilişkileri ayrı ayrı ki-kare veya "likelihood ratio" testiyle incelendi. Anlamlı bulunan genotip ve allel frekansları için odds oranı hesaplandı. Genotipler bakımından grupların Hardy-Weinberg dengesi kontrol edildi. Sürekli değişkenler için tanımlayıcı istatistikler ortalama ve standart sapma cinsinden, kategorik değişkenler için ise frekans ve yüzde olarak verildi. İstatistiksel analizler SPSS v.11.5.1 ve MedCalc v.11.5.0 paket programlarıyla yapıldı. İstatistiksel analizlerde p< 0.05 anlamlı kabul edildi.
BULGULAR
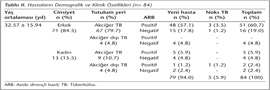
Çalışmaya dahil edilen 84 hastanın 71 (%84.5)'i erkek, 13 (%15.5)'ü kadın olup, yaş ortalamaları 32.57 ± 15.94 (yaş aralığı: 13-72) yıl olarak belirlenmiştir. Sağlıklı kontrol grubunu oluşturan 110 kişinin ise 93 (%84.5)'ü erkek, 17 (%15.5)'si kadın olup, yaş ortalamaları 29.40 ± 11.56 (yaş aralığı:18-57) yıldır. Hastaların demografik ve klinik özellikleri Tablo II'de gösterilmiştir.
Tek Nükleotid Polimorfizmi Sonuçları
Agaroz jel elektroforezi sonrası oluşan bant paternlerinin incelenmesiyle hasta ve sağlıklı kontrol gruplarındaki allel ve genotip dağılımı Tablo III'te verilmiştir. TNF-α promotor -308 G>A (rs1800629) gen bölgesinde, hasta ve kontrol gruplarında en sık G alleline rastlanmış; bu bölgedeki allel ve genotip dağılımı sonuçlarına göre, sağlıklı kontrol grubu Hardy-Weinberg dağılımı bakımından dengedeyken, hasta grubu dengede olmadığından bu iki grubun gen frekansları bakımından istatistiksel karşılaştırılması yapılamamıştır (Tablo III). IFN-γ geni +874 T>A (rs61923114) gen bölgesinde A alleli, hasta ve kontrol grubunda daha sık olarak bulunmuş, allel (p= 0.26) ve genotip (p= 0.43) dağılımı bakımından hasta grubu ile sağlıklı kontrol grubu arasında istatistiksel olarak anlamlı bir fark saptanmamıştır (Tablo III). IL-10 geni promotor -1082 G>A (rs1800896) tek nükleotid polimorfizmi için genotip dağılımı bakımından karşılaştırılma yapılırken, hasta grubunda AA ve GG genotipi olmadığı için istatistiksel karşılaştırma sadece GA genotipi için yapılmıştır. Sonuçta, hasta ve kontrol grupları arasında allel (p= 0.80) ve genotip (p= 0.80) dağılımı bakımından istatistiksel olarak anlamlı bir fark bulunamamıştır. Ayrıca bu gen bölgesi için popülasyonun Hardy-Weinberg dağılımı bakımından dengede olmadığı izlenmiştir (Tablo III). IL-12B p40 geni 1188 A>C (rs3212227) gen bölgesinde A alleli, hasta ve kontrol grubunda daha sık belirlenmiş; allel (p= 0.92) ve genotip (p= 0.82) dağılımı bakımından gruplar arasında istatistiksel olarak anlamlı bir fark bulunamamıştır (Tablo III). IL-4 geni promotor -590 C>T (rs2243250) gen bölgesinde C alleli, hasta ve kontrol grubunda daha sık olarak saptanmış; allel (p= 0.27) ve genotip (p= 0.14) dağılımı bakımından gruplar arasında istatistiksel olarak anlamlı bir fark olmadığı görülmüştür (Tablo III).
Tek nükleotid polimorfizm varlığı ARMS PCR yöntemiyle araştırılan gen bölgelerinin (TNF-α geni promotor -308 G>A, IFN-γ geni +874 T>A, IL-10 geni promotor -1082 G> A) PCR ürünleri ile PCR amplifikasyonunun gerçekleştiğini göstermek için insan büyüme hormonu nükleotid dizisinin 426 bç'lik bölgesinin amplifikasyon ürünlerinin %1.5'lik agaroz jel elektroforez görüntüleri Resim 1'de gösterilmiştir. PCR-RFLP yöntemi ile araştırılan gen bölgelerinin (IL-12B p40 geni 1188 A>C, IL-4 geni promotor -590 C>T) PCR ve kesim ürünlerinin %1.5'lik agaroz jel elektroforez görüntüleri ise Resim 2'de verilmiştir.
Tek nükleotid polimorfizmi analizlerinden elde edilen sonuçlara göre, akciğer ve akciğer dışı TB gruplarındaki hasta sayılarıyla, yeni tanı konmuş hasta ile eski hasta sayıları istatistiksel olarak karşılaştırmaya uygun olmadığı için bu grupların kendi aralarında TB'ye genetik yatkınlık bakımından allel ve genotip dağılımı için bir karşılaştırma yapılamamıştır.
Hasta grubu, ARB pozitif (n= 58) ve negatif (n= 26) olarak iki gruba ayrıldığında, bu iki grup arasında, polimorfizm varlığı araştırılan gen bölgeleri için allel ve genotip dağılımları bakımından istatistiksel olarak anlamlı bir fark bulunmamıştır. Ancak bu analiz, TNF-α geni promotor -308 G>A ve IL-10 geni promotor -1082 G>A tek nükleotid polimorfizmi için yapılamamıştır (Tablo IV).
Çalışmada akciğer TB tanısı alan 76 (%90.5) hasta ARB pozitif (n= 56) ve negatif (n= 20) olarak iki gruba ayrıldığında, bu iki grup arasında da, polimorfizm varlığı araştırılan gen bölgeleri için allel ve genotip dağılımları bakımından istatistiksel olarak anlamlı bir fark saptanmamıştır. Ancak bu analiz, TNF-α geni promotor -308 G>A ve IL-10 geni promotor -1082 G>A tek nükleotid polimorfizmi için yapılamamıştır (Tablo V).
TARTIŞMA
TB, biyolojik, sosyoekonomik ve çevresel faktörlerin birlikte rol oynadığı karmaşık bir hastalık olup, önemli bir küresel sağlık problemi olarak varlığını korumaktadır14. Enfeksiyon hastalıklarında konak genetik faktörlerin rolünün ortaya çıkarılması, enfeksiyonlara yatkınlıkta bireysel direnç ya da duyarlılığın nedenlerini açıklayabilmektedir15,16. TB'ye karşı immün yanıt, antijen sunan hücreler ile lenfositler arasındaki etkileşim ve bu hücre tiplerinden salgılanan sitokinlerle düzenlenmektedir. Sitokinler düşük derecede genetik değişim göstermelerine rağmen, enfeksiyon hastalıklarına karşı duyarlılığı etkileyen konak faktörleri arasında yer almaktadır. Sitokin genlerinin promotor ya da kodlama bölgelerindeki polimorfizmleri içeren birçok çalışma bulunmaktadır. Bu genlerdeki mutasyonlar, transkripsiyonel aktivasyonu etkileyen transkripsiyon faktör tanıma bölgelerinde değişikliğe ve değişen düzeyde sitokin üretimine sebep olabilmektedir16,17. Sunulan bu çalışmanın amacı, TB'ye karşı duyarlılık veya direnç ile ilişkili olduğu belirtilen, sitokin üretiminden sorumlu gen bölgelerindeki tek nükleotid polimorfizm varlığının araştırılmasıdır. Çalışma sonucunda, hasta ve sağlıklı kontrol grubu arasında, sitokin üretiminden sorumlu gen bölgelerindeki tek nükleotid polimorfizmi sonuçlarına göre allel ve genotip dağılımı bakımından istatistiksel olarak anlamlı bir fark tespit edilememiştir (Tablo III).
IL-10 geni promotor bölgesi -1082 G>A tek nükleotid polimorfizm varlığı ile TB'ye genetik yatkınlık üzerine Kolombiya18 ve Hindistan'da19 TB'li hastalar ve sağlıklı bireylerde yapılan çalışmalarda istatistiksel olarak anlamlı bir ilişki saptandığı bildirilmiştir. Diğer yandan Çin20 ve Mısır'da21 yapılan çalışmalarda istatistiksel olarak anlamlı bir farkın bulunmadığı vurgulanmıştır. Ülkemizde ise bu gen bölgesindeki polimorfizm varlığı ile TB'ye duyarlılık arasında anlamlı bir ilişkinin olduğunu bildiren çalışmalar bulunmaktadır22,23,24,25. Bu çalışmalardan elde edilen verilerin aksine bizim çalışmamız sonucunda, hasta grubu ile sağlıklı kontrol grubu arasında IL-10 geni promotor bölgesi -1082 G>A tek nükleotid polimorfizmi sonuçları bakımından istatistiksel olarak anlamlı bir fark bulunmadığı ve çalışılan popülasyonun dengede olmadığı belirlenmiştir. Bunun sebebinin, çalıştığımız hasta ve sağlıklı kontrol popülasyonunun diğer çalışmalara dahil edilenlerden farklı olmasından kaynaklanabileceği düşünülmektedir. Çünkü bu tip genetik çalışmalara dahil edilen popülasyonlardaki bireylerin allel ve genotip frekanslarının farklılık gösterebileceği ve aynı ülkenin değişik popülasyonlarında yapılan çalışma sonuçlarının birbiriyle uyumlu olmadığı bildirilmektedir17,24,26. IFN-γ +874 T>A tek nükleotid polimorfizmi için bunun gibi birbiriyle uyumlu olmayan sonuçlara ülkemizde23,25,27,28 ve Hindistan'da8,29 yapılan çalışmalarda da rastlanmıştır. Yine, Hindistan'da TNF-α geni promotor -308 G>A tek nükleotid polimorfizm varlığı ile ilgili yapılan çalışmalarda birbiriyle uyumlu olmayan sonuçlar bildirilmiştir3,30. Ülkemizde bu gen bölgesindeki polimorfizm varlığı ile ilgili yapılan çalışmalarda, bizim çalışmamızda olduğu gibi, istatistiksel olarak anlamlı bir ilişkinin tespit edilemediği belirtilmiştir23,24,25.
IL-12B p40 1188 A>C tek nükleotid polimorfizm varlığı ile ilgili ülkemizde yapılan çalışma sayısı azdır. Samsun'da yapılan bir çalışmada, bizim çalışmamızda olduğu gibi, hasta ve kontrol grubu arasında istatistiksel olarak anlamlı bir fark bulunmamıştır25. Aytekin ve arkadaşlarının31 bildirdiği BCG lenfadenitli ve rekürren oral kandidiyazlı yedi aylık bir erkek olguda ise, bizim çalışmamızdan farklı olarak, IL-12 reseptör beta (IL-12Rb) 1 gen bölgesinde yeni bir mutasyon (64+1G>T) varlığı saptanmıştır. Dünya genelinde, bu gen bölgesi ile TB'ye genetik yatkınlık arasında istatistiksel olarak anlamlı ilişkinin tespit edildiği6,32 ve edilemediği33,34 çalışmalar bildirilmiştir. Yine ülkemizde, IL-4 promotor -590 C>T polimorfizm varlığı ile ilgili benzer bir çalışmaya rastlanmamıştır. Bu konu ile ilgili yaptığımız çalışma ülkemiz için bir ilktir. Bu çalışma sonucunda allel ve genotip dağılımlarında hasta ve sağlıklı kontrol grubu arasında istatistiksel olarak anlamlı bir farklılık görülmemekle birlikte, bu sonuçların ülkemizin epidemiyolojik verilerine önemli katkıda bulunacağı düşünülmüştür. Hindistan8 ve İran'da9 akciğer TB'li hastalar ve sağlıklı kontrollerde yapılan çalışmalarda, bu gen bölgesindeki tek nükleotid polimorfizmi ile TB'ye genetik yatkınlık arasında istatistiksel olarak anlamlı ilişkinin olduğu bildirilmekle birlikte, yine Hindistan'da yapılan iki farklı çalışmada genetik yatkınlık ile ilgili istatistiksel olarak anlamlı bir ilişkinin saptanamadığı belirtilmektedir3,35.
Çalışma sonucunda akciğer ve akciğer dışı TB gruplarındaki hasta sayılarıyla, yeni tanı konmuş hasta ile eski hasta sayılarının istatistiksel olarak karşılaştırmaya uygun olmamasından dolayı bu grupların kendi aralarında TB'ye genetik yatkınlık bakımından allel ve genotip dağılımı için karşılaştırmaları yapılamamıştır. Hasta grubu (n= 84) kendi içinde ARB sonuçlarına göre ikiye ayrıldığında, allel ve genotip dağılımları bakımından istatistiksel olarak anlamlı bir fark bulunmamıştır (Tablo IV). Akciğer TB'li hastalar (n= 76) da yine ARB sonuçlarına göre iki gruba ayrıldığında, allel ve genotip dağılımları yönünden gruplar arasında istatistiksel olarak anlamlı fark görülmemiştir (Tablo V).
Sonuç olarak yaptığımız bu çalışmada, Th1 tipi proinflamatuvar sitokin (TNF-α geni promotor -308 G>A bölgesi, IFN-γ geni +874 T>A bölgesi, IL-12B p40 geni 1188 A>C bölgesi) ve Th2 tipi antiinflamatuvar sitokin (IL-10 geni promotor -1082 G>A bölgesi, IL-4 geni promotor -590 C>T bölgesi) gen bölgelerindeki tek nükleotid polimorfizm varlığı ile TB'ye genetik yatkınlık arasında istatistiksel olarak anlamlı bir ilişki bulunamamıştır. Konağın immün sisteminde, sitokin salınımını kontrol eden birçok gen bölgesi ve bu sitokinlerin salgılandıktan sonra fonksiyonlarını yerine getirebilmeleri için değişik hücrelere bağlanmalarını sağlayan çok sayıda reseptör bulunmaktadır. Bizim çalışmamızda sadece sitokin salınımından sorumlu bazı gen bölgelerindeki tek nükleotid polimorfizmleri araştırılmıştır. Bu sebeple gerek sitokin salınımını kontrol eden genlerdeki gerekse bu sitokinlerin bağlandıkları reseptörlerdeki polimorfizmlerin daha ayrıntılı olarak araştırılması gerekmektedir. Yaptığımız çalışma nispeten küçük bir popülasyonda gerçekleştirilmiş olup, çalışmadan elde ettiğimiz bulguların, ülkemizde TB immünolojisinin moleküler epidemiyolojisine önemli katkı sağlayacağı umulmaktadır.
TEŞEKKÜR
Bu çalışmanın istatistiksel analizlerinin yapılmasında emeği geçen Mersin Üniversitesi Tıp Fakültesi Biyoistatistik Anabilim Dalı Araştırma Görevlisi Didem Derici'ye teşekkür ederiz.
KAYNAKLAR
- Li Y, Yuan T, Lu W, Chen M, Cheng X, Deng S. Association of tuberculosis and polymorphisms in the promoter region of macrophage migration inhibitory factor (MIF) in a Southwestern China Han population. Cytokine 2012; 60(1): 64-7.
- Ben-Selma W, Harizi H, Boukadida J. Association of TNF-α and IL-10 polymorphisms with tuberculosis in Tunisian populations. Microbes Infect 2011; 13(10): 837-43.
- Abhimanyu, Mangangcha IR, Jha P, et al. Differential serum cytokine levels are associated with cytokine gene polymorphisms in north Indians with active pulmonary tuberculosis. Infect Genet Evol 2011; 11(5): 1015-22.
- Tian C, Zhang Y, Zhang J, et al. The +874T/A polymorphism in the interferon-g gene and tuberculosis risk: an update by meta-analysis. Hum Immunol 2011; 72(11): 1137-42.
- Qu HQ, Fisher-Hoch SP, McCormick JB. Molecular immunity to mycobacteria: knowledge from the mutation and phenotype spectrum analysis of Mendelian susceptibility to mycobacterial diseases. Int J Infect Dis 2011; 15(5): e305-13.
- Morris GA, Edwards DR, Hill PC, et al. Interleukin 12B (IL12B) genetic variation and pulmonary tuberculosis: a study of cohorts from The Gambia, Guinea-Bissau, United States and Argentina. PLoS One 2011; 6(2): e16656.
- Liang L, Zhao YL, Yue J, et al. Interleukin-10 gene promoter polymorphisms and their protein production in pleural fluid in patients with tuberculosis. FEMS Immunol Med Microbiol 2011; 62(1): 84-90.
- Vidyarani M, Selvaraj P, Prabhu Anand S, Jawahar MS, Adhilakshmi AR, Narayanan PR. Interferon gamma (IFNgamma) & interleukin-4 (IL-4) gene variants & cytokine levels in pulmonary tuberculosis. Indian J Med Res 2006; 124(4): 403-10.
- Amirzargar AA, Rezaei N, Jabbari H, et al. Cytokine single nucleotide polymorphisms in Iranian patients with pulmonary tuberculosis. Eur Cytokine Netw 2006; 17(2): 84-9.
- Oh JH, Yang CS, Noh YK, et al. Polymorphisms of interleukin-10 and tumour necrosis factor-a genes are associated with newly diagnosed and recurrent pulmonary tuberculosis. Respirology 2007; 12(4): 594-8.
- Lopez-Maderuleo D, Arnalich F, Serantes R, et al. Interferon-gamma and interleukin-10 gene polymorphisms in pulmonary tuberculosis. Am J Respir Crit Care Med 2003; 167(7): 970-5.
- Hall MA, McGlinn E, Coakley G, et al. Genetic polymorphism of IL-12 p40 gene in immune-mediated disease. Genes Immun 2000; 1(3): 219-24.
- Li H, Xiaoyan D, Quanhua L, Jie L, Yixiao B. Single-nucleotide polymorphisms in genes predisposing to asthma in children of Chinese Han nationality. J Investig Allergol Clin Immunol 2009; 19(5): 391-5.
- Comas I, Gagneux S. The past and future of tuberculosis research. PLoS Pathog 2009; 5(10): e1000600.
- Hill AV. Aspects of genetic susceptibility to human infectious diseases. Annu Rev Genet 2006; 40: 469-86.
- Yim JJ, Selvaraj P. Genetic susceptibility in tuberculosis. Respirology 2010; 15(2): 241-56.
- Ansari A, Talat N, Jamil B, et al. Cytokine gene polymorphisms across tuberculosis clinical spectrum in Pakistani patients. PLoS One 2009; 4(3): e4778.
- Henao MI, Montes C, París SC, García LF. Cytokine gene polymorphisms in Colombian patients with different clinical presentations of tuberculosis. Tuberculosis 2006; 86(1): 11-9.
- Ramaseri Sunder S, Hanumanth SR, Nagaraju RT, et al. IL-10 high producing genotype predisposes HIV infected individuals to TB infection. Hum Immunol 2012; 73(6): 605-11.
- Wu F, Qu Y, Tang Y, Cao D, Sun P, Xia Z. Lack of association between cytokine gene polymorphisms and silicosis and pulmonary tuberculosis in Chinese iron miners. J Occup Health 2008; 50(6): 445-54.
- Mosaad YM, Soliman OE, Tawhid ZE, Sherif DM. Interferon-gamma +874 T/A and interleukin-10 -1082 A/G single nucleotide polymorphism in Egyptian children with tuberculosis. Scand J Immunol 2010; 72(4): 358-64.
- Yılmaz V, Yentür SP, Saruhan-Direskeneli G. IL-12 and IL-10 polymorphisms and their effects on cytokine production. Cytokine 2005; 30(4): 188-94.
- Oral HB, Budak F, Uzaslan EK, et al. Interleukin-10 (IL-10) gene polymorphism as a potential host susceptibility factor in tuberculosis. Cytokine 2006; 35(3-4): 143-7.
- Ateş Ö, Musellim B, Ongen G, Topal-Sarikaya A. Interleukin-10 and tumor necrosis factor-alpha gene polymorphisms in tuberculosis. J Clin Immunol 2008; 28(3): 232-6.
- Akgunes A, Coban AY, Durupinar B. Human leucocyte antigens and cytokine gene polymorphisms and tuberculosis. Indian J Med Microbiol 2011; 29(1): 28-32.
- Ben-Selma W, Harizi H, Bougmiza I, et al. Interferon gamma +874T/A polymorphism is associated with susceptibility to active pulmonary tuberculosis development in Tunisian patients. DNA Cell Biol 2011; 30(6): 379-87.
- Sallakci N, Coskun M, Berber Z, et al. Interferon-gamma gene+874T-A polymorphism is associated with tuberculosis and gamma interferon response. Tuberculosis (Edinb) 2007; 87(3): 225-30.
- Onay H, Ekmekci AY, Durmaz B, et al. Interferon-gamma gene and interferon-gamma receptor-1 gene polymorphisms in children with tuberculosis from Turkey. Scand J Infect Dis 2010; 42(1): 39-42.
- Prabhu Anand S, Harishankar M, Selvaraj P. Interferon gamma gene +874A/T polymorphism and intracellular interferon gamma expression in pulmonary tuberculosis. Cytokine 2010; 49(2): 130-3.
- Sharma S, Rathored J, Ghosh B, Sharma SK. Genetic polymorphisms in TNF genes and tuberculosis in North Indians. BMC Infect Dis 2010; 10: 165-73.
- Aytekin C, Doğu F, Tuygun N, et al. Bacille Calmette-Guérin lymphadenitis and recurrent oral candidiasis in an infant with a new mutation leading to interleukin-12 receptor beta-1 deficiency. J Investig Allergol Clin Immunol 2011; 21(5): 401-4.
- Morahan G, Kaur G, Singh M, et al. Association of variants in the IL12B gene with leprosy and tuberculosis. Tissue Antigens 2007; 69(Suppl 1): 234-6.
- Ma X, Reich RA, Gonzalez O, et al. No evidence for association between the polymorphism in the 3' untranslated region of interleukin-12B and human susceptibility to tuberculosis. J Infect Dis 2003; 188(8): 1116-8.
- Wang J, Tang S, Shen H. Association of genetic polymorphisms in the IL12-IFNG pathway with susceptibility to and prognosis of pulmonary tuberculosis in a Chinese population. Eur J Clin Microbiol Infect Dis 2010; 29(10): 1291-5.
- Selvaraj P, Alagarasu K, Harishankar M, Vidyarani M, Nisha Rajeswari D, Narayanan PR. Cytokine gene polymorphisms and cytokine levels in pulmonary tuberculosis. Cytokine 2008; 43(1): 26-33.
İletişim (Correspondence):
Dr. Mahmut Ülger,
Mersin Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Çiftlikköy Kampüsü, 33343 Yenişehir, Mersin, Türkiye.
Tel (Phone): +90 324 361 0684-1153,
E-posta (E-mail): mahmutulg@yahoo.com.tr