Yeni, Daha Yeni, En Yeni İnsan Polyomavirusları: Nereye Kadar?
New, Newer, Newest Human Polyomaviruses: How far?
Dürdal US
Hacettepe Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
Hacettepe University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
ÖZET
Polyomaviridae ailesinde yer alan polyomaviruslar, küçük (40-45 nm), çıplak ve ikozahedral simetrili viruslar olup çembersel çift iplikli DNA genomu içerir. Polyomaviruslar, doğada yaygın olarak bulunmakta ve kuş, kemirici, sığır, maymun, insan gibi birçok omurgalı türünü enfekte etmektedir. İnsan polyomavirusları ise, latent enfeksiyon oluşturmaları, immün süpresif hastalarda reaktive olarak ciddi klinik tablolara yol açmaları ve onkojenik potansiyelleri nedeniyle tıbbi öneme sahiptir. İlk polyomavirus (Mouse polyomavirus), 1953 yılında farelerde tümör oluşturan ajan olarak tanımlanmış; bunu 1960 yılında poliovirus aşılarının hazırlanması sırasında kullanılan rhesus maymun böbrek hücrelerinden izole edilen Simian vacuolating virus (SV40) izlemiştir. Önceleri, onkojenik bir virus olduğu bilinen SV40 ile kontamine polio aşılarının uygulandığı kişilerde kanser insidansının artacağı düşünülmüş, ancak daha sonra yapılan çalışmalarda bu ilişki kanıtlanmamıştır. SV40 genomunun bazı insan tümör dokularında saptanmasının yanı sıra sağlıklı kişilerin klinik örneklerinde de gösterilmiş olması ve toplumlarda düşük oranda da olsa (%2-10) seropozitifliğin bulunması, günümüzde SV40'ın kontamine aşılardan bağımsız olarak insanları enfekte edebildiğini düşündürmektedir. İlk insan polyomaviruslarının tanımlanması 1971 yılında birbirinden bağımsız olarak gerçekleşmiş; bunlardan BK virus (BKPyV), böbrek transplantasyonu yapılan bir hastanın idrar örneğinden; JC virus (JCPyV) ise progresif multifokal lökoensefalopatili bir hastanın beyin dokusundan izole edilerek izole edildikleri hastaların baş harfleriyle adlandırılmışlardır. Sonraki 36 yıl boyunca, bu iki virus iyi bilinen insan polyomavirusları olmuş; ancak son altı yılda sofistike moleküler yöntemler ve yeni nesil dizileme teknolojilerinin gelişmesine bağlı olarak yeni tanımlanan insan polyomaviruslarının sayısında dramatik bir artış görülmüştür. 2007 yılında birbirinden bağımsız olarak, akut solunum yolu enfeksiyonu olan çocukların nazofaringeal aspirat örneklerinden izole edilen KI (Karolinska Institute) ve WU (Washington University) polyomavirusları, tanımlandıkları kurumların baş harfleriyle isimlendirilmiştir. Beşinci insan polyomavirusu 2008 yılında Merkel hücre kanseri olan bir hastanın deri tümörü örneğinden izole edilmiş ve Merkel cell polyomavirus (MCPyV) olarak adlandırılmıştır. 2010 yılında üç yeni insan polyomavirusu daha tanımlanmış; bunlardan ikisi sağlıklı kişilerin deri örneklerinden (HPyV6 ve HPyV7), biri ise (Trichodysplasia Spinulosa-associated virus; TSPyV) kalp transplantasyonu yapılan bir hastanın keratotik spikül örneğinden izole edilmiştir. Diğer bir yeni insan polyomavirusu 2011 yılında asemptomatik böbrek transplant alıcısının kan ve idrar örneğinden tanımlanmış ve HPyV9 olarak adlandırılmıştır. 2012 yılının son çeyreğinde ise en yeni olarak üç insan polyomavirusu daha tanımlanmış ve tüm genom dizi analizleri bu üç virusun birbirlerine oldukça yakınlık gösterdiğini ortaya koymuştur. Bunlardan biri, WHIM (Wart, Hypogammaglobulinemia, Infections, Myelokathexis) sendromlu bir hastanın anal kondiloma örneğinden tanımlanan HPyV10; diğeri Malawi'li sağlıklı bir çocuğun dışkı örneğinden tanımlanan Malawi polyomavirus (MWPyV); bir diğeri ise ishali olan Meksika'lı bir çocuğun dışkı örneğinden tanımlanan Mexico polyomavirus (MXPyV)'dur. Son olarak Şubat 2013 tarihli bir yayında, sağlıklı bir çocuğun dışkı örneğinden yeni bir polyomavirusun (Saint Louis polyomavirus; STLPyV) tanımlandığı bildirilmiştir. Seroepidemiyolojik çalışmalar, yeni insan polyomaviruslarının, BKPyV ve JCPyV gibi, toplumlarda yüksek seroprevalansa (ortalama %40-80) sahip olduklarını ve primer enfeksiyonların çocukluk döneminde ve asemptomatik olarak kazanıldığını vurgulamaktadır. Ancak en yeni viruslar olan HPyV10, MWPyV, MXPyV ve STLPyV için yeterli bilgi birikimi mevcut değildir. Bugün için Merkel hücre kanseri ve trichodysplasia spinulosa ile ilişkisi saptanmış olan sırasıyla MCPyV ve TSPyV hariç, diğer yeni insan polyomaviruslarının patojenez ve klinik hastalıklarla ilişkileri tam olarak aydınlatılamamış olup, bunlarla ilgili daha fazla çalışmaya gereksinim vardır. İnsan polyomavirus repertuvarındaki bu hızlı artışın, ileri teknolojilerin kullanımı sayesinde önümüzdeki yıllarda da devam edeceği öngörülmektedir. Bu derleme yazıda, yeni insan polyomaviruslarıyla ilgili olarak son gelişmelerin özetlenmesi amaçlanmıştır.
Anahtar sözcükler: Polyomaviridae; yeni insan polyomavirusları; Merkel cell polyomavirus; Trichodysplasia spinulosa ilişkili polyomavirus.
ABSTRACT
Polyomaviruses, classified in Polyomaviridae family, are non-enveloped small (40-45 nm) viruses with icosahedral symmetry and circular double-stranded DNA genome. Polyomaviruses can infect a variety of vertebrates including birds, rodents, cattle, monkeys and humans. The characteristics such as establishment of latent infections, reactivations during immunosuppression and oncogenic potencies render the human polyomaviruses (HPyVs) of considerable importance for public health. The first polyomavirus (Mouse polyomavirus) has been identified in 1953 as filterable tumor-causing agents in mice, followed by Simian vacuolating virus (SV40) isolated from rhesus monkey kidney cells that had been used for poliovirus vaccine preparation in 1960. Due to the known transforming capacity of SV40, it was initially thought that the incidence of cancer could increase following the administration of SV40-contaminated polio vaccines, however advanced studies yielded inconsistent results, without any evidence to conclude whether or not the contaminated polio vaccine caused cancer. Several studies have reported the detection of SV40 genome in some of the human tumors, as well as in the clinical samples of healthy subjects. In addition SV40 seropositivity was reported in human populations although in low rates (2-10%). These data have raised the possibility that SV40 infects humans and circulates in human populations unrelated to being exposed to the vaccine. The discovery of the first human polyomaviruses was in 1971 independently from eachother, one was BK virus (BKPyV) isolated from the urine sample of a renal transplant patient, and the other was JC virus (JCPyV) isolated from the brain tissue of a petient with progressive multifocal leukoencephalopathy, and both were named after the patients' initials. BK and JC viruses were the only well-known human polyomaviruses throughout 36 years, however dramatical increase in number of newly identified human polyomaviruses was recorded in the last six years due to the use of sophisticated molecular methods and new-generation sequencing technologies. In 2007, two new HPyVs were identified independently from nasopharyngeal aspirates of children with acute respiratory tract infections; one was KI (Karolinska Institute) and the other was WU (Washington University) polyomaviruses, named after the initials of institutes which they were first described. In 2008, the fifth HPyV namely Merkel cell polyomavirus (MCPyV) was isolated from the skin tumor sample of a patient with Merkel cell carcinoma. In 2010, three other novel human polyomaviruses were discovered, two were from skin samples of healthy subjects (HPyV-6 and HPyV-7), and one (Trichodysplasia Spinulosa-associated virus; TSPyV) from keratotic spicule sample of a heart-transplanted patient. Another new HPyV was identified in 2011 named HPyV-9, from the blood and urine samples of an asymptomatic patient with kidney transplant. Most recently, three new HPyVs have been sequentially discovered during the last quarter of 2012. The 10th HPyV (HPyV10) was identified in condyloma samples of an immunocompromised patient with WHIM syndrome (Wart, Hypogammaglobulinemia, Infections, Myelokathexis), 11th virus was isolated from stool sample of a healthy child from Malawi (Malawi polyomavirus; MWPyV), and 12th was described from fecal sample of a diarrheal child from Mexico (Mexico polyomavirus; MXPyV). The whole genome sequence analysis of HPyV10, MWPyV and MXPyV pointed out that they are closely related viruses. The last novel polyomavirus, namely Saint Louis polyomavirus (STLPyV) has been reported in a study published on February 2013, identified from the stool sample of a healthy child. Seroepidemiological studies indicated that most of the novel HPyVs are highly prevalent (average rate: 40-80%) worldwide and likely acquired asymptomatically during childhood, similar to the old ones, BKPyV and JCPyV. However data about HPyV10, MWPyV, MXPyV and STLPyV are not enough as they have been discovered most recently. Similarly, little is known about the pathogenesis, route of infection and the relationship with clinical diseases of novel HPyVs except MCPyV and TSPyV which are known to be responsible for Merkel cell carcinoma and trichodysplasia spinulosa, respectively. The expanding repertoire of human polyomaviruses made us think that many others will be uncovered in the future thanking to the advances in molecular methods. In this review, recent developments subjecting new human polyomaviruses have been summarized.
Key words: Polyomaviridae; new human polyomaviruses; Merkel cell polyomavirus; Trichodysplasia spinulosa-associated polyomavirus.
Geliş Tarihi (Received): 02.01.2013 • Kabul Ediliş Tarihi (Accepted): 11.02.2013
GİRİŞ ve TARİHÇE
Doğada yaygın olarak bulunan ve birçok omurgalı türünü enfekte eden polyomaviruslar, vücutta latent olarak kalmaları, immün sistemi baskılanmış kişilerde reaktive olarak ciddi klinik hastalık oluşturmaları, onkojenik potansiyelleri ve bazı insan tümörleriyle olası ilişkileri nedeniyle insan sağlığı açısından önemli viruslardır. Latince'de polyomavirus, "çok sayıda tümör oluşturan virus" (poly-: çok, -oma: tümör) anlamını taşımaktadır.
Polyomavirusların ilk üyesi olan fare polyomavirusu (Mouse polyomavirus; MPyV), fare tümörleri üzerinde araştırma yapan L.Gross tarafından 1953 yılında "farelerde tümör oluşturan filtre edilebilir bir ajan" olarak tanımlanmıştır1. 1958 yılında S.Steward ve B.Eddy, farelerde tümör oluşturan bu virusu hücre kültürlerinden izole ve karakterize etmiş, polyomavirus olarak tanımladıkları bu virusun fare, hamster ve tavşan gibi kemiricilerde tümör oluşumunu indüklediğini göstermişlerdir2,3. Bu virus, araştırıcıların soyadlarının ilk harflerine istinaden SE polyomavirus olarak isimlendirilmiştir. İlk primat polyomavirusu ise B.H.Sweet ve M.R.Hilleman tarafından 1960 yılında tanımlanmış; Afrika yeşil maymun böbrek hücre kültürlerinden izole edilen bu polyomavirus, hücrelerde vakuol oluşturması ve maymunlarda saptanan kırkıncı virus olması nedeniyle SV40 (Simian vacuolating virus 40) olarak adlandırılmıştır4. Aynı süreçte Dr. Eddy, poliovirus aşılarının hazırlanması sırasında kullanılan rhesus maymun böbrek hücrelerinin bir virus ile kontamine olduğunu saptamış ve bu virusun onkojenik özelliği olan SV40 olduğunu bildirmiştir5. SV40'ın, 1955-1963 yılları arasında kullanılan poliovirus aşılarında mevcut olduğunun saptanması, bu dönem içinde aşılanan 90 milyondan fazla kişi için kanser gelişimi açısından büyük bir risk oluşturabileceğini düşündürmüş, ancak daha sonra yapılan çalışmalarda bu durumu destekleyen hiçbir veri elde edilmemiştir6,7.
İlk insan polyomaviruslarının tanımlanması 1971 yılında birbirinden bağımsız olarak gerçekleşmiştir. Bunlardan biri olan BK virus (BKPyV), böbrek transplantasyonu yapılan nefropatik bir hastanın idrar örneğinden; diğeri olan JC virus (JCPyV) ise, progresif multifokal lökoensefalopati (PML) gelişen Hodgkin lenfomalı bir hastanın beyin dokusundan izole edilmiş ve izole edildikleri hastaların başharfleriyle adlandırılmışlardır8,9. Sonraki 35 yıl içinde, bu virusların yapı ve özellikleri ayrıntılı olarak incelenmiş; vücutta latent olarak kaldıkları ve toplumlarda yüksek seroprevalansa sahip oldukları gösterilmiş; patogenez ve immün sistemi baskılanmış hastalarda neden oldukları klinik tablolar aydınlatılmış, hatta bazı insan tümörleriyle ilişkili oldukları ileri sürülmüştür10,11,12. BKPyV ve JCPyV, uzunca bir süre iyi bilinen iki insan polyomavirusu olmuş; ancak son altı yılda sofistike moleküler yöntemler ve yeni nesil dizileme teknolojilerinin gelişmesine bağlı olarak, yeni tanımlanan insan polyomaviruslarının sayısında büyük bir artış gözlenmiştir13,14,15 (Tablo I).
Yeni insan polyomavirusları olan KI (KIPyV) ve WU (WUPyV), 2007 yılında birbirinden bağımsız olarak, akut solunum yolu enfeksiyonu olan çocukların nazofaringeal aspirat örneklerinden izole edilmişlerdir16,17. Bu viruslar, tanımlandıkları kurumların baş harfleri (KI; Karolinska Institute ve WU; Washington University) ile isimlendirilmiştir. 2008 yılında, Merkel hücre karsinomu olan bir hastanın tümör dokusunda yeni bir polyomavirus genomu saptanmış ve Merkel cell polyomavirus (MCPyV) olarak adlandırılmıştır18. Daha sonra bunu, 2010 yılında sağlıklı erişkinlerin deri ve saç örneklerinden izole edilen iki polyomavirus (HPyV6, HPyV7) ile kalp transplantasyonu yapılan bir hastanın keratotik spikül örneğinden izole edilen bir polyomavirus (Trichodysplasia spinulosa-associated virus; TSPyV) izlemiştir19,20. 2011 yılında ise, böbrek transplantasyonu yapılan asemptomatik bir hastanın kan ve idrar örneğinden tanımlanan yeni polyomavirus HPyV9 olarak isimlendirilmiştir21. 2012 yılına gelindiğinde, en yeni insan polyomavirusları olarak birbirini izleyen üç virusun tanımlandığı görülmektedir. Bunlardan biri, WHIM (Wart, Hypogammaglobulinemia, Infections, Myelokathexis) sendromlu bir hastanın anal kondiloma örneklerinden tanımlanan HPyV10; diğeri Malawili sağlıklı bir çocuğun dışkı örneğinden tanımlanan MWPyV (Malawi polyomavirus); bir diğeri ise ishali olan Meksikalı bir çocuğun dışkı örneğinden tanımlanan MXPyV (Mexico polyomavirus) viruslarıdır22,23,24. En son olarak da 2013 yılının başında, Malawi'de sağlıklı bir çocuğun dışkı örneği ile St.Louis'de ishali olan bir çocuğun dışkı örneğinde yeni bir polyomavirus daha tanımlanmış ve Saint Louis polyomavirus (STLPyV) olarak adlandırılmıştır25. Görüldüğü gibi son yıllarda yeni insan polyomaviruslarının tanımlanmasında hızlı gelişmeler olmakta ve bu durum, yeni teknolojilerin kullanımına paralel olarak devam edecek gibi görünmektedir.
SINIFLANDIRMA
Önceden papillomaviruslar ile birlikte Papovaviridae ailesinde yer alan polyomaviruslar, 2000 yılından itibaren Polyomaviridae ailesi Polyomavirus cinsi içinde sınıflandırılmıştır. Ancak son yıllardaki gelişmelere bağlı olarak, bu ailenin konak özelliklerine göre daha fazla cins içermesi gerektiği önerilmiş ve ICTV (International Committee on Taxonomy of Viruses) tarafından 2011 yılında yapılan yeni sınıflamada Polyomaviridae ailesi Orthopolyomavirus, Wukipolyomavirus ve Avipolyomavirus olarak üç cinse ayrılmıştır26. Bunlardan Wukipolyomavirus sadece insan polyomaviruslarını (KIPyV, WUPyV, HPyV6, HPyV7); Orthopolyomavirus insan (BKPyV, JCPyV, MCPyV, TSPyV, HPyV9), primat (maymun, orangutan, şempanze, goril), kemirici (fare, hamster) ve diğer memeli (yarasa, sığır vb.) polyomaviruslarını; Avipolyomavirus ise kuş polyomaviruslarını içermektedir (Şekil 1). Bu cinsler içinde yer alan virusların tüm genom nükleotid dizi homolojisi %81-84 arasında olup; ICTV'ye göre dizi benzerliği %81'den az olan suşlar yeni bir virus olarak kabul edilmektedir26.
VİRİON YAPISI, GENOM ve GEN ÜRÜNLERİ
Polyomaviruslar, 40-45 nm büyüklüğünde, çıplak, 72 pentamerden oluşan ikozahedral kapsid içeren viruslardır. Viral genom yaklaşık 5.2 kilobaz (kb) büyüklüğünde, çift iplikli çembersel DNA'dan oluşur ve hücreden kazanılan histonlarla ilişkidedir14. Polyomavirusların genomu; erken, geç ve kodlama yapmayan bölge (non-coding control region; NCCR) olmak üzere üç gen bölgesi içerir (Şekil 2A). Erken gen bölgesi, büyük T (large T; LT) ve küçük T (small T; ST) antijenlerini; geç gen bölgesi ise yapısal kapsid proteinleri (VP1, VP2, VP3) ile yapısal olmayan bir proteini (agnoprotein) kodlamaktadır. Ayrıca sadece fare ve hamster polyomaviruslarında bulunan orta T (middle T; MT) antijenini kodlayan bölge, insan polyomaviruslarının hiçbirinde mevcut değildir. Buna karşın BKPyV, JCPyV ve SV40 viruslarında bulunan ve agnoproteini kodlayan gen bölgesi, yeni insan polyomaviruslarında saptanmamaktadır27.
Erken ve geç bölgeleri ayıran NCCR bölgesi viral promotorları ve replikasyon orijinini (ori) içerir; ayrıca LT antijeninin bağlanması için birçok bölgeye sahiptir. NCCR, transkripsiyonun regülasyonunu sağlar; NCCR mutasyonlarının T antijen transkripsiyonu ve replikasyon hızını artırdığı düşünülmektedir14. T antijen ekspresyonu ise transkripsiyon sonrası mikroRNA'lar (miRNA) tarafından modüle edilmektedir. BKPyV, JCPyV ve SV40 tarafından kodlandığı saptanan miRNA'ların, NK hücrelerinin tanıdığı bir ligant olan stresle indüklenen ULBP3 molekülüne bağlandığı ve böylece NK hücrelerinin enfekte hücreleri tanımasını ve öldürmesini önlediği belirlenmiştir28. Ayrıca MCPyV'nin de viral miRNA eksprese ettiği ve ekspresyon düzeyinin, tümör hücrelerinde bulunan viral DNA kopya sayısıyla ilişkili olduğu saptanmıştır29.
Polyomavirusların tümör (T) antijenleri, gerek virusun replikasyonu gerekse hücrenin transformasyonu için büyük önem taşıyan proteinlerdir. T antijenleri esas olarak viral transkripsiyon ve replikasyonda rol oynar30. Virusun replikasyonu konak hücrenin çoğalmasına bağlı olduğundan hücrenin sürekli S fazında tutulması gereklidir. T antijenleri bu görevi üstlenmekte, hücre döngüsünü kontrol eden önemli proteinlere (p53, pRb vb.) bağlanıp onları inaktive ederek hücreyi S fazında tutmaktadır. Bu durum elbette onkojenik transformasyonu da kolaylaştırmaktadır. Büyük ve küçük T antijenleri (sırasıyla; LTAg ve STAg), erken gen bölgesi tarafından kodlanan majör bir transkriptin alternatif kesimi (splicing) yoluyla oluşur. Bu nedenle bu proteinlerin ilk kangalları ortaktır ve J kangalı adı verilen bu ortak bölge CR1 ve DnaJ motiflerini içermektedir12,30 (Şekil 2B). Yeni insan polyomaviruslarında da bu yapılar benzerlik göstermektedir27. J kangalı hücresel faktör HSc70'e bağlanmadan sorumludur. LTAg'nin ikinci kangalı retinoblastoma (Rb) ailesi proteinlerine bağlanan LXCXE; üçüncü kangalı ise molekülün nükleer lokalizasyonu için gerekli olan NLS olup, son kısımda helikaz kangalı yer alır. Helikaz kangalında, ori bölgesine bağlanma motifi, ATPaz kangalı, Zn finger bölgesi ve p53'e bağlanan bölge bulunur (Şekil 2B). LTAg'nin ayrıca IRS (insulin receptor substrate)-1 ve beta-katenin gibi diğer hücresel proteinlere bağlanması da, DNA tamir sisteminin bozulması ve proto-onkogen (örn. c-myc, cyclinD1) transkripsiyonunun artışı gibi mekanizmalarla hücre transformasyonunu kolaylaştırmaktadır. STAg'de ise J kangalından sonra protein fosfataz (PP) 2A'yı bağlayan motif yer alır ve bu bağlanma PP2A'nın inaktivasyonuna, dolayısıyla da hücre proliferasyonunun artmasına yol açar30.
Viral kapsid proteinleri (VP1, VP2 ve VP3), geç gen bölgesi tarafından kodlanan bir primer transkriptin alternatif kesimi yoluyla oluşmaktadır. Kapsidin majör komponenti VP1 olup, beş adet VP1 molekülünün VP2 ya da VP3 ile birleşmesiyle kapsomer; 72 adet VP1 pentamerinin hücre çekirdeğinde kendiliğinden biraraya gelmesiyle de viral kapsid oluşur14. Bütün yeni insan polyomaviruslarında bu üç kapsid proteinini kodlayan dizilerin benzer olduğu ve kapsid oluşumunun aynı mekanizmayla gerçekleştiği düşünülmekte, ancak MCPyV VP3 proteininin fonksiyonel olmadığı belirtilmektedir29. Diğer bir geç gen bölgesi ürünü ise agnoprotein (AP) olup, insan polyomaviruslarından sadece BKPyV ve JCPyV'de bulunmaktadır27. Esas olarak litik enfeksiyon ile ilişkili olan AP virion olgunlaşmasında rol oynar; ancak hücre döngüsünün regülasyonunu bozmak suretiyle de transformasyona katkıda bulunur12,15.
REPLİKASYON DÖNGÜSÜ
Polyomaviruslar, dar bir konak spektrumuna ve kısıtlı hücre tropizmine sahiptir. Bu nedenle üreyebildikleri hücrelerde litik (üretken) enfeksiyon; üreyemedikleri hücrelerde abortif (üretken olmayan) enfeksiyon ya da transformasyon oluştururlar. Polyomavirusların hücre yüzeyi reseptörleri çoğunlukla gangliosidlerin terminal sialik asit (alfa-2,3 veya alfa-2,6) molekülleridir14. Tutunmadan ise majör kapsid proteini olan VP1 sorumludur. Bilinen viruslardan BKPyV, GD1b ve GT1b gangliozidlerini; JCPyV ise GT1b ve serotonin reseptörünü (5HT2AR) kullanmakta ve hücreye sırasıyla kaveol ile ilişkili endositoz ve klatrine bağımlı endositoz ile girmektedir12,28. Ancak yeni insan polyomaviruslarının konak hücre reseptörleri ve hücreye giriş mekanizmaları tam olarak aydınlatılmamıştır. Üzerinde en çok çalışmanın yapıldığı MCPyV için, hücre yüzeyi reseptörlerinin yine glikozaminoglikanlar (örn. GT1b) olduğu, ancak ilk tutunmadan sonra sialik asit ünitelerinin de önem taşıdığı gösterilmiştir29. Polyomavirusların replikasyonu ve virion olgunlaşması hücre çekirdeğinde gerçekleşir; hücreden salınım ise ekzositoz yoluyla olur (Şekil 3).
YENİ İNSAN POLYOMAVİRUSLARI
KI ve WU Polyomavirusları (KIPyV ve WUPyV)
KI ve WU polyomaviruslarının tanımlanması, tesadüfi ve birbirlerinden bağımsız olarak 2007 yılında gerçekleşmiştir. KIPyV, Karolinska Enstitüsünde (Stockholm, İsveç); WUPyV ise Washington Üniversitesinde (St. Louis, ABD) akut solunum yolu enfeksiyonu olan çocukların nazofaringeal aspirat örneklerinden, yeni nesil DNA dizileme teknolojileri (deep sequencing, shotgun sequencing) kullanılarak tanımlanmıştır16,17. Tanımlanmalarını takiben dünyanın birçok bölgesinde yapılan çalışmada, bu virusların üst ve/veya alt solunum yolu enfeksiyonları ile ilişkisi araştırılmaya başlamıştır. Yapılan kontrollü çalışmalarda, KIPyV ve WUPyV için prevalans oranlarının benzer olduğu; solunum yolu hastalığı olan semptomatik kişilerde %1-7, asemptomatik kişilerde ise %4-6 arasında tespit edildiği bildirilmiştir31,32. Çalışmalarda elde edilen bir diğer bulgu da, solunum yolu enfeksiyonlarında KIPyV ve WUPyV'nin diğer solunum yolu viruslarıyla birlikte bulunma oranlarının yüksek (sırasıyla; %74 ve %68-79) olmasıdır32. Klinik örneklerde KIPyV ve WUPyV DNA saptanma oranlarının asemptomatik kişilerde de hastalardakine benzer bulunması ve diğer solunum yolu viruslarıyla birlikte bulunma oranlarının yüksek olması, bu viruslar ile solunum yolu enfeksiyonları arasındaki ilişkinin yorumlanmasını zorlaştırmaktadır. Dolayısıyla KIPyV ve WUPyV enfeksiyonlarının patogenezi ve kliniği ile ilgili bilgiler henüz yeterince açık değildir.
Merkel Cell Polyomavirus (MCPyV)
İnsan polyomavirusları, keşfedildikleri andan itibaren insan kanserleriyle ilişkileri olduğu düşünülen, ancak çelişkili raporlar nedeniyle bu ilişkinin tam olarak kanıtlanamadığı viruslardır10,12,28. Bu nedenle MCPyV'nin tanımlanması, polyomavirusların insan kanserleriyle ilişkili olduğu düşüncesini doğruladığı için heyecan uyandırmıştır.
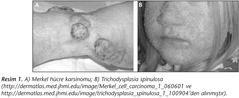
Merkel hücre karsinomu (Merkel Cell Carcinoma; MCC), özellikle ileri yaşlarda ve immün sistemi baskılanmış kişilerde görülen, nadir ancak çok agresif bir deri tümörüdür (Resim 1A). Epidermal kökenli bir nöroendokrin tümörü olan MCC insidansı yüzbinde 0.2-0.5/yıl olup, konağın yaşı, cilt tipi, güneş ışığına -kümülatif- maruziyeti ve immün sistemin durumuyla ilişkili olarak giderek artış göstermektedir29. Feng ve arkadaşları18 2008 yılında, MCC'li bir hastanın tümör dokusunda "dijital transkriptom elemesi" (digital transcriptome subtraction) yöntemiyle MCPyV'yi tanımlamışlardır. Virusun tanımlanmasından sonra çeşitli ülkelerde yapılan birçok çalışmada, MCC'li olguların deri tümörü dokularında %75-100 oranında MCPyV DNA pozitifliği gösterilmiştir14,29,31,32,33. Kanserli olguların hemen hepsinde saptanan MCPyV DNA'sının, lineer ve klonal olarak konak hücre genomuna integre olduğu gösterilmiş, ancak integrasyon bölgesinin rastgele olduğu belirtilmiştir15,29,32. Bugün için çalışmalardan elde edilen tüm veriler, MCPyV'nin Merkel hücre karsinogenezi ile ilişkili olduğunu vurgulamış ve MCPyV, insan kanseriyle ilişkisi en belirgin olarak ortaya konulan polyomavirus unvanını almıştır12,14,15,29.
MCC gelişiminin, konak faktörlerinin yanı sıra, viral genomda birbirini izleyen iki mutasyon sonucu ortaya çıktığı belirtilmektedir. Bunlardan birisi, UV ve iyonize radyasyon etkisiyle olduğu düşünülen ve viral genomun hücre genomuna integrasyonunu sağlayan mutasyon; diğeri ise virusun LT geninde oluşan özgün bir delesyon mutasyonudur12,29. Bu mutasyonlar ile LTAg helikaz kangalını kaybetmekte ve p53'e, bazen de replikasyon orijinine (ori) bağlanma özelliğini yitirmektedir. Bunun sonucu olarak LTAg viral replikasyondaki fonksiyonunu yerine getirememekte, böylece konak hücrede üretken enfeksiyon gerçekleşememekte ve transformasyon ortaya çıkmaktadır33. MCPyV'nin ayrıca, erken gen ekspresyonunu regüle eden bir mikroRNA kodladığı ve bu moleküllerin MCC gelişimi sırasında, T ve B hücre reseptör sinyallerini engelleyerek virus/tümör tanımasını bozduğu belirlenmiştir28.
MCPyV, sağlıklı kişilerin deri örneklerinde yaygın olarak bulunan ve toplumlarda yüksek seropozitifliğe sahip olan bir virustur32,34,35,36. Buna karşın, virusun VP1 proteinine ve özellikle de T antijenlerine karşı oluşan serolojik yanıtın, MCC ile yakın ilişki gösterdiği ifade edilmektedir. Örneğin; MCPyV VP1 ve LTAg'ye karşı antikor pozitifliği MCC'li hastalarda sırasıyla %90 ve %50 iken, bu oranlar hasta olmayan yetişkinlerde %68 ve %0'dır14,37.
DAHA YENİ İNSAN POLYOMAVİRUSLARI
İnsan Polyomavirusu 6 ve 7 (HPyV6 ve HPyV7)
Schowalker ve arkadaşları19 2010 yılında, MCPyV DNA'sını araştırmak amacıyla yaptıkları bir çalışma sırasında, sağlıklı kişilerden alınan alın derisi örneklerinde "dönen çember amplifikasyonu" (Rolling-circle amplification; RCA) yöntemiyle, tesadüfen yeni bir polyomavirus dizisi keşfetmişler ve bu virusu HPyV6 olarak isimlendirmişlerdir. Yine sağlıklı kişilerin deri sürüntüsü örneklerinde, HPyV6 ve MCPyV DNA'larının araştırılması için dizayn edilen yeni bir dejenere PCR primer setiyle yapılan çalışma sırasında, farklı bir polyomavirus genom dizisi daha bulunmuş ve bu da HPyV7 olarak adlandırılmıştır19. Araştırıcılar, sağlıklı 35 olgunun beşinden HPyV6, dördünden de HPyV7'nin tüm genomunu klonlamışlar ve virion salınımının, MCPyV'ye benzer olarak süregen olduğunu ancak viral yükün daha düşük olduğunu göstermişlerdir19. Ayrıca 95 bireyi kapsayan seroprevalans çalışmasında, HPyV6 ve HPyV7 için sırasıyla %69 ve %35 gibi oranlar tespit edilmiştir19. Dolayısıyla bu virusların deri tropizmi gösteren iki yeni insan polyomavirusu olduğu ve toplumlarda yaygın olarak bulunduğu belirlenmiş, ancak bugüne kadar HPyV6 ve HPyV7 ile ilişkili herhangi bir klinik hastalık bildirilmemiştir14,35,36,38.
Trichodysplasia spinulosa ile İlişkili Polyomavirus (TSPyV)
Trichodysplasia spinulosa (TS), immün sistemi zayıf ya da baskılanmış kişilerde görülen nadir bir foliküler deri hastalığıdır. Bu hastalığın viral etkenli olabileceği ilk kez 1999 yılında, kıl folikül hücrelerinde intranükleer yerleşimli papovavirus morfolojisinde viral partiküllerin görülmesiyle öne sürülmüştür39. Bu görüş, 2010 yılında van der Meijden ve arkadaşlarının20, kalp transplantasyonu yapılan 15 yaşında TS'li bir hastanın keratotik spikül örneğinden RCA yöntemiyle yeni bir polyomavirusu tanımlamalarıyla doğrulanmıştır. Araştırıcılar bu virusu, TS ile ilişkili polyomavirus (Trichodysplasia spinulosa-associated virus; TSPyV) olarak adlandırmışlar ve geliştirdikleri özgül kantitatif PCR ile hastanın tedavi öncesi ve tedavi boyunca viral yükünü izlemişlerdir20. Sonuçta, topikal sidofovir tedavisi uygulanan hastanın lezyon örneklerinde TSPyV yükünün azaldığı ve klinik iyileşmenin gerçekleştiği görülmüştür. Daha sonra van der Meijden ve arkadaşları20, TSPyV prevalansının belirlenmesi amacıyla, immün süpresif tedavi alan ancak TS bulguları olmayan böbrek transplantlı hastaların kaş kökü örneklerinde de viral DNA varlığını araştırmışlar ve %4 (3/69) oranında pozitiflik saptamışlardır. TSPyV'nin deri kaynaklı örneklerin dışında plazma, serum, idrar ve beyin omurilik sıvısı gibi diğer klinik örneklerdeki varlığının araştırıldığı çalışmalarda ise olumlu sonuç alınmamış ve bu virusun skuamöz epitelyuma tropizm gösterdiği kanısı oluşmuştur20.
Özellikle solid organ transplantasyonu yapılan hastalarda rastlanılan TS, yüz bölgesinde kademeli olarak papül ve spiküllerin gelişimiyle karakterizedir20 (Resim 1B). Hastalık sırasında kaş ve kirpiklerde alopesi de ortaya çıkabilir. TSPyV'nin tanımlanmasından sonra dünyanın birçok ülkesinde yapılan araştırmalarda, TS lezyonlarında bu virusun varlığı gösterilmiş ve toplumlarda yüksek seroprevalansa sahip olduğu belirlenmiştir14,35,40,41,42. Bir çalışmada, TS'li 11 hastanın hepsinin (%100) lezyon örneklerinde TSPyV DNA varlığı saptanırken, sağlıklı bireylerin sadece %2 (5/249)'sinde saptanmış; hastalardaki viral yükün sağlıklı kontrollerden en az 4 log fazla olduğu izlenmiş; ayrıca hastaların kıl kökü örneklerinde virusun VP1 antijeni tespit edilmiştir42. Konu ile ilgili tüm çalışmaların verileri ışığında, günümüzde TSPyV'nin TS'nin etiyolojik etkeni olduğu kabul edilmektedir14,15,42.
İnsan Polyomavirusu 9 (HPyV9) ve Lenfotropik Polyomavirus (LPyV)
Scuda ve arkadaşları21 2011 yılında, immün süpresif tedavi alan böbrek transplantlı asemptomatik bir hastanın serum örneğinde, bilinen polyomavirusların VP1 geninin korunmuş bölgelerini hedefleyen jenerik PCR ile yeni bir polyomavirus tanımlamışlardır. Klonlama ve dizileme çalışmaları sonucu, maymun kökenli lenfotropik polyomavirusa (LPyV) yakınlık gösterdiği belirlenen bu virus, HPyV9 olarak adlandırılmıştır21. Aynı yıl Sauvage ve arkadaşları43 da, MCC'li hastalarda yaptıkları çalışma sırasında, gerek hastaların gerekse sağlıklı bireylerin deri sürüntüsü örneklerinde "yüksek hacimli dizileme" (High throughput sequencing) yöntemiyle yeni bir polyomavirus saptamışlar ve LPyV'ye benzer olan bu virusun, Scuda ve arkadaşlarının21 henüz tanımladığı HPyV9 olduğunu rapor etmişlerdir.
Lymphotropic polyomavirus (LPyV), orijinal olarak Afrika yeşil maymun lenfoblastoid hücre kültüründen izole edilen, ancak son yıllarda yapılan çalışmalarda insanları da enfekte edebildiği düşünülen bir virustur44. Bu çalışmalarda, yetişkin popülasyonun %15-20'sinde LPyV ile çapraz reaksiyon veren antikorların varlığı ortaya konmuş ve ayrıca sağlıklı kişilerin ve immün süpresif hastaların kan örneklerinde LPyV ve/veya LPyV'ye benzer diziler düşük oranda da olsa (< %10) gösterilmiştir44,45,46. Ancak şimdiye kadar LPyV, insan deri örneklerinde saptanmamış ve klinik bir sendromla ilişkilendirilmemiştir. Bu durum LPyV ile serolojik olarak ilişkili bir benzerinin olduğunu düşündürmektedir ki, yeni tanımlanan HPyV9 bu özellikleri taşımaktadır14,43,46. Gerçekten de yapılan tüm genom dizi analizleri HPyV9'un LPyV ile yakın benzerlik gösterdiğini ortaya koymuştur27. Diğer insan polyomaviruslarına göre HPyV9, toplumlarda görece olarak daha düşük prevalansa sahiptir14,38,46,47. Ancak halen HPyV9 ile herhangi bir klinik hastalık arasında ilişki kurulamamış; virusun replikasyonu ve persistansının gerçekleştiği hücre/dokular belirlenememiş; patojenik potansiyeli ile ilgili konular tam olarak aydınlatılamamıştır.
EN YENİ İNSAN POLYOMAVİRUSLARI
İnsan Polyomavirusu 10 (HPyV10)
Buck ve arkadaşları22, Ekim 2012 tarihinde yayınlanan makalelerinde, nadir bir genetik hastalık olan WHIM sendromlu bir olgunun deri örneğinden onuncu insan polyomavirusunu tanımladıklarını bildirmişlerdir. Konjenital primer bir immün yetmezlik olan bu sendromun özelliği, hastaların insan papillomavirus (HPV) enfeksiyonlarını kontrol etmede yetersiz kalması ve hastalık sırasında çok sayıda HPV lezyonlarının ortaya çıkmasıdır. Bu araştırıcılar, hastanın anüs bölgesindeki kondilomalarda papillomavirus ve polyomavirus saptayabilmek için, tedavi amaçlı uygulanan cerrahi operasyon sonrası, cerrahi materyalden hazırladıkları ekstraktı nükleaz kokteyli ile muamele etmişler ve ultrasantrifüjle virus partiküllerini saflaştırmışlardır22. Virionlardan saflaştırılan DNA'lara rastgele primerlerle RCA (random-primed rolling circle amplification) yöntemi uygulanmış ve elde edilen ürünler çeşitli restriksiyon enzimleriyle kesilerek klonlanmış ve dizilenmiştir. Araştırıcılar elde ettikleri dizilerin, anogenital siğillerin çoğundan sorumlu olan HPV-6 ile uyumlu olduğunu, ancak bazı dizilerin de insan polyomaviruslarıyla homoloji gösterdiğini saptamışlardır22. Daha sonra yapılan ileri çalışmalarla bu virusun yeni bir polyomavirus olduğu belirlenmiş ve HPyV10 olarak isimlendirilmiştir. Buck ve arkadaşları22, HPyV'nin tüm genom dizi analizini tamamladıkları sırada, literatürde başka bir yayında23, insan dışkı örneklerinden yeni bir polyomavirusun tanımlandığını ve MWPyV olarak adlandırıldığını öğrenmişlerdir. Araştırıcılar, MWPyV'nin nükleotid dizilerini, kendi buldukları virus (HPyV10) ile karşılaştırdıklarında dizi benzerliğinin %95-99 arasında olduğunu görmüşler ve tesadüfen ard arda tanımlanan bu iki yeni polyomavirusun birbirleriyle çok yakın ilişkili viruslar olduğunu ifade etmişlerdir22. Literatürde şu an için HPyV10 ile ilgili, Buck ve arkadaşlarının22 raporundan başka özgün çalışma mevcut olmayıp, virusun virolojik ve epidemiyolojik özellikleri ile ilgili çalışma sonuçlarının ilerleyen zamanda yayınlanması beklenmektedir.
Malawi Polyomavirus (MWPyV)
Siebreasse ve arkadaşları23, bağırsak mikrobiyom araştırma projesi kapsamında yaptıkları çalışma sırasında, Malawili 15 aylık sağlıklı bir çocuğun dışkı örneğinde "shotgun sequencing" yöntemiyle yeni bir polyomavirus genomu daha tanımlamışlar ve bulgularını Haziran 2012 tarihinde yayınlamışlardır. Malawi polyomavirus (MWPyV) olarak adlandırılan bu virusun dizi analizi sonuçları, bilinen diğer insan polyomaviruslarından oldukça farklı olduğunu göstermiştir23. Daha sonra araştırıcılar, MWPyV prevalansını saptamak amacıyla dizayn ettikleri gerçek zamanlı PCR ile hastaneye başvuran 0-18 yaş arasındaki ishalli çocuklardan alınan dışkı örneklerini taramışlar ve %2.3 (12/514) oranında pozitiflik bulmuşlardır23. Pozitifliğin saptandığı çocukların 1-5 yaş arasında olduğu ve bazılarında virus salınımının aralıklı olarak devam ettiği dikkati çekmiştir. Bu virusun ishalli çocukların dışkılarında saptanmış olması ve olguların çoğunda bilinen başka bir etiyolojik etkenin bulunmaması, MWPyV'nin gastroenterit ile ilişkili olabileceğini düşündürmekle birlikte, konak/doku tropizmi ve patogenezi ile ilgili ileri araştırmalara gereksinim vardır.
Mexico Polyomavirus (MXPyV)
Yu ve arkadaşları24, Kasım 2012 tarihinde yayınlanan makalelerinde, ishali olan Meksikalı bir çocuğun dışkı örneğinden yeni bir polyomavirus tanımladıklarını bildirmişlerdir. Araştırıcılar, "unbiased deep sequencing" tekniğiyle moleküler karakterizasyonunu yaptıkları bu virusu, ilk izole edildiği olgunun Meksika kökenli olması nedeniyle Mexico polyomavirus (MXPyV) olarak adlandırmışlardır. Tüm genom dizi analizi yapıldığında, MXPyV'nin HPyV10 ile %99.7, MWPyV ile %99.8 homoloji gösterdiği belirlenmiş; bu nedenle Yu ve arkadaşları24, bu üç virusun, polyomavirusların yeni bir alt kümesinin (subclade) ilk üyeleri olarak, diğer insan polyomaviruslarından farklı bir filogenetik dalda toplanması gerektiğini ifade etmişlerdir.
Değişik bölgelerde ve çeşitli klinik örneklerde MXPyV prevalansının gerçek zamanlı PCR yöntemiyle araştırıldığı çalışmalarda, virusun yaygın bir dağılım gösterdiği izlenmiştir24. İshali olan ve olmayan çocukların dışkı örneklerinde MXPyV DNA varlığı, Meksika'da %12.5 (12/96), Kaliforniya'da %3.3 (18/546) ve Şili'de %4.2 (4/96) oranında bulunmuştur24. Meksika'da dışkı örneklerinde virusun saptandığı çocukların %50'sinin başka bir gastroenterit virusu ile de enfekte olduğu belirlenmiş; yapılan analizler sonucu MXPyV varlığı ile ishal arasında bir ilişki saptanmamıştır24. MXPyV'nin immün kompromize hastalarda saptanma sıklığı ile ilgili olarak Kaliforniya'da bir hastanede yapılan taramada ise, 480 transplant alıcısının plazma ve idrar örneklerinin hiçbirinde virus DNA'sı saptanmamıştır24. Dolayısıyla MXPyV patogenezinin belirlenmesi ve klinik hastalık ile ilişkisinin aydınlatılması için de, geniş kapsamlı çalışmalara gereksinim duyulmaktadır.
Saint Louis Polyomavirus (STLPyV)
Şubat 2013 tarihinde yayınlanan makalede, Lim ve arkadaşları25 tarafından tanımlanan yeni bir insan polyomavirusu daha dikkati çekmektedir. Bu araştırıcılar, daha önce MWPyV'yi tanımlayan çalışma grubunda23 olup, yeni polyomavirusun keşfi de, aynı araştırma kapsamında gerçekleşmiştir. Çok merkezli bu çalışma sırasında, Malawi'de sağlıklı bir çocuğun dışkı örneğinde "shotgun pyrosequencing" yöntemiyle farklı bir polyomavirus dizisi saptanmış ve tüm genom dizi analizi yapılarak bilinen tüm polyomaviruslar ile karşılaştırıldığında en yüksek benzerliğin MWPyV ile olduğu görülmüştür. MWPyV ile nükleotid dizi homolojisi %64.2 olan bu virus, ICTV kriterlerine göre yeni bir tür olarak tanımlanmış ve STLPyV olarak isimlendirilmiştir25. STLPyV daha sonra, St. Louis Çocuk Hastanesinde yapılan çalışma sırasında da ishalli bir çocuktan izole edilmiştir25. STLPyV'nin en önemli özelliği, diğer polyomavirus LTAg formlarına benzemeyen ve erken genlerin yeni bir alternatif kesim stratejisiyle oluşan özgün bir LTAg'ye sahip olmasıdır. Araştırıcılar, STLPyV'nin mozaik bir genoma sahip olduğunu ve MWPyV ile aynı atasal rekombinant orijini paylaştığını vurgulamışlardır25. Lim ve arkadaşları25 ayrıca, geliştirdikleri PCR yöntemiyle yaptıkları taramada, St. Louis ve Gambia'da pediatrik dışkı örneklerinde %1 oranında STLPyV pozitifliği saptamışlar, ancak virusun ishal gelişimindeki rolü ile ilgili bir kanıt elde edememişlerdir. STLPyV'nin de MWPyV gibi dışkı örneklerinde tespit edilebiliyor olması, bu virusların primer olarak gastrointestinal tropizm gösterdiğini işaret etmekle birlikte, hastalık ile ilişkilerine dair yanıt bekleyen birçok soru mevcuttur.
EPİDEMİYOLOJİ ve PATOGENEZ
Önceden tanımlanan BK ve JC polyomaviruslarının toplumlarda yaygın olarak bulunduğu ve seropozitiflik oranlarının yüksek olduğu (%50-> %90) iyi bilinmektedir11,12,31,45. Yeni insan polyomavirusları için elde edilen veriler de, bunların BKPyV ve JCPyV'ye benzer olarak yüksek seroprevalansa sahip olduklarını göstermiştir. Yapılan çalışmalarda en yüksek seroprevalans WUPyV, TSPyV ve HPyV6 için (%60-95), en düşük seroprevalans ise HPyV9 için (%15-45) saptanmış; KIPyV, MCPyV ve HPyV7 seropozitifliğinin ortalama %50-87 arasında değiştiği belirtilmiştir14,15,19,32,34,38,40,41,45,46,47,48,49 (Tablo I). Bu çalışmalarda ayrıca, seropozitiflik oranlarının çocuk yaşlarda yükselmeye başladığının saptanması, primer enfeksiyonların genellikle -erken- çocukluk döneminde kazanıldığına işaret etmektedir.
İnsan polyomaviruslarına ait DNA'ların farklı klinik örneklerde bulunduğunun gösterilmesi, yayılımın solunum, oral-fekal ve direkt temas gibi çok çeşitli yollarla olabileceğini düşündürmektedir. Yapılan çalışmalar BKPyV ve JCPyV'nin tükürük, idrar ve dışkıda; KIPyV ve WUPyV'nin çocukların solunum salgılarında ve dışkı örneklerinde; MCPyV'nin çocuk ve erişkinlerin tükürük, nazal sürüntü, solunum yolu örnekleri, lenfoid dokular, idrar ve gastrointestinal sisteminde bulunduğunu göstermiştir19,31,32,35,50,51,52. HPyV6, HPyV7 ve MCPyV, sağlıklı kişilerin deri sürüntü örneklerinde saptanmakta, hatta bu virusların normal deri florasında bulunduğu belirtilmektedir19,36. Ayrıca ilginç olarak, MCPyV DNA'sının insan cildi ile temas eden çevresel örneklerde de %75 gibi yüksek bir oranda bulunduğu rapor edilmiştir53.
İnsan polyomavirusları, sıklıkla asemptomatik olarak geçirilen primer enfeksiyondan sonra vücutta latent olarak kalmakta ve viral replikasyon çok düşük düzeyde de olsa hayat boyu devam etmektedir. BKPyV ve JCPyV reaktivasyonları, immün sistemin baskılandığı/bozulduğu durumlarda gerçekleşmekte ve ciddi klinik hastalıklar ortaya çıkabilmektedir31. Örneğin BKPyV'nin böbrek transplantlı hastalarda nefropati ve kemik iliği transplantlı hastalarda hemorajik sistite; JCPyV'nin ise AIDS'li ve lenfoproliferatif/miyeloproliferatif hastalığı olanlarda PMLE'ye neden olduğu iyi bilinmektedir11. Ancak immün sistemin baskılanmasıyla yeni insan polyomaviruslarının reaktive olmaları arasındaki ilişki yeterince açık değildir. Bunun nedeni, yeni insan polyomaviruslarının (MCPyV ve TSPyV hariç) henüz herhangi bir klinik hastalıkla ilişkilendirilmemiş ve latentlik mekanizmalarının aydınlatılamamış olmasıdır. TSPyV ve MCPyV'nin etiyolojik etken olarak kabul edildiği sırasıyla TS ve MCC'nin patogenezinde ise, immün süpresyonun yanı sıra konağa bağlı diğer faktörlerin (yaş, UV/güneş ışığı, genetik faktörler vb.) de etkin rol oynadığı düşünülmektedir14,15.
En yeni viruslar olan HPyV10, MWPyV, MXPyV ve STLPyV ile ilgili olarak ise seroprevalans ve epidemiyolojik veriler henüz yeterli değildir. Bu virusların ortak özelliğinin, gastrointestinal sistemde bulunmaları olduğuna dikkat çekilmekte, ancak patogenez ve klinik hastalık ile ilişkilerinin açıklanabilmesi için zamana ve ileri çalışmalara gereksinim olduğu vurgulanmaktadır15,25.
SV40, Bir İnsan Patojeni midir?
Doğal konağı olan rhesus makak maymunlarının böbrek dokusunda latent olarak bulunan SV40 virusu, hamster ve fare gibi laboratuvar hayvanlarında tümör gelişimine yol açmaktadır54. Onkojenik potansiyele sahip olan SV40'ın, 1955-1963 yılları arasında kullanılan poliovirus aşılarında kontaminant olarak bulunduğunun belirlenmesinin ardından, bu aşıların uygulandığı kişilerde SV40'a bağlı kanser insidansında artış olabileceği öngörüsü ile çok sayıda çalışma yapılmıştır6,7,54,55. Bu çalışmalardan bazılarında, beyin tümörleri, mezotelyoma, osteosarkoma ve non-Hodgkin lenfoma gibi bazı insan kanserlerinde SV40 genomu ve/veya T antijeninin saptandığı bildirilmiş; ancak virolojik, serolojik ve epidemiyolojik temelli diğer birçok çalışmada elde edilen veriler bu bulguları desteklememiştir6,7,54,55,56,57. Konu ile ilgili olarak, "İmmünizasyon Güvenliğini İnceleme Komitesi (Institute of Medicine Immunization Safety Review Committee)"nin 2002 yılı raporunda; "Elimizdeki kanıtlar SV40 içeren aşılar ile kanser arasındaki nedensel ilişkinin kabul veya reddi için yeterli değildir" ve "SV40'ın transformasyon yapan bir virus olduğunu gösteren kuvvetli biyolojik kanıtlar vardır, ancak SV40 enfeksiyonunun doğal koşullarda insanda kansere neden olabileceği ile ilgili kanıtlar orta düzeydedir" ifadeleri yer almaktadır58. Buna karşın son yıllarda elde edilen veriler, SV40'ın bir insan patojeni olduğu yönündedir54,55. Nitekim yapılan araştırmalarda, sağlıklı kişilere ait çeşitli klinik örneklerde de (kan, idrar, dışkı, tonsil) SV40 genomunun farklı oranlarda (0-%25) bulunduğu; insan popülasyonlarında SV40 seropozitifliğinin -çapraz reaksiyonlar elimine edildikten sonra- ortalama %2-10 (0-%28) oranında olduğu ortaya konmuştur45,52,59,60,61,62,63,64,65. Bu durum SV40'ın, kontamine polio aşısı ile insan popülasyonuna girdiğini ve o zamandan bu yana insanlar arasında horizontal yolla yayılmaya devam ettiğini düşündürmektedir54. Ancak SV40 seropozitifliğinin, hem polio aşısının uygulanmaya başlamasından önce doğan (1954 öncesi), hem de virustan arındırılmış polio aşısının uygulandığı yıllarda (1980 sonrası) doğan kişilerde de saptanmış olması, SV40'ın, kontamine polio aşısı uygulamasından bağımsız olarak insanları enfekte edebilen bir virus olduğu ve düşük oranda da olsa toplumlarda dolaştığı fikrini desteklemektedir55,57,61.
SONUÇ
Son yıllarda geliştirilen duyarlı moleküler yöntemler ve yeni nesil dizileme teknolojileri sayesinde, klinik bir örnekte bilinmeyen genom dizilerinin saptanması mümkün hale gelmiştir13. Bu gelişmelerin bir yansıması olarak, son yıllarda tanımlanan insan polyomaviruslarının sayısında da hızlı bir artış olmuş ve ileriki yıllarda da daha birçok yeni virusun keşfedileceği öngörülmüştür14,15. Yeni tanımlanan insan polyomaviruslarından, klinik hastalık ile ilişkisi en iyi ortaya konmuş olanlar MCPyV ve TSPyV olup, diğerlerinin patogenezi ile ilgili bilgi birikimi için zamana ve daha ileri araştırmalara gerek vardır. Bu araştırmaların, polyomavirusların doğası (latentlik ve onkojenik potansiyelleri) nedeniyle, oluşturdukları akut enfeksiyonların tanımlanmasından ziyade, immün sistemi baskılanmış kişilerdeki hastalıklar ve kanser üzerine yoğunlaşacağı düşünülmektedir. Gelecekte yapılacak olan çalışmalarla, yeni insan polyomaviruslarının hücre tropizmleri, enfeksiyon ve latentlik mekanizmaları, patojenik özellikleri ve enfeksiyonların kontrolünde konağın immün sistemi ve genetik faktörlerin rolü ile ilgili konuların açıklık kazanması umut edilmektedir.
KAYNAKLAR
- Gross L. A filterable agent, recovered from Ak leukemic extracts, causing salivary gland carcinomas in C3H mice. Proc Soc Exp Biol Med 1953; 83(2): 414-21.
- Eddy BE, Stewart SE, Young R, Mider GB. Neoplasms in hamsters induced by mouse tumor agent passed in tissue culture. J Natl Cancer Inst 1958; 20(4): 747-61.
- Eddy BE, Stewart SE. Characteristics of the SE polyoma virus. Am J Public Health Nations Health 1959; 49: 1486-92.
- Sweet BH, Hilleman MR. The vacuolating virus, SV40. Proc Soc Exp Biol Med 1960; 105: 420-7.
- Eddy BE, Borman GS, Grubbs GE, Young RD. Identification of the oncogenic substance in rhesus monkey kidney cell culture as simian virus 40. Virology 1962; 17: 65-75.
- Engels EA. Cancer risk associated with receipt of vaccines contaminated with simian virus 40: epidemiologic research. Expert Rev Vaccines 2005; 4(2): 197-206.
- Shah KV. SV40 and human cancer: a review of recent data. Int J Cancer 2007; 120(2): 215-23.
- Gardner SD, Field AM, Coleman DV, Hulme B. New human papovavirus (B.K.) isolated from urine after renal transplantation. Lancet 1971; 1(7712): 1253-7.
- Padgett BL, Walker DL, ZuRhein GM, Eckroade RJ, Dessel BH. Cultivation of papova-like virus from human brain with progressive multifocal leucoencephalopathy. Lancet 1971; 1(7712): 1257-60.
- Knowles WA. Discovery and epidemiology of the human polyomaviruses BK virus (BKV) and JC virus (JCV). Adv Exp Med Biol 2006; 577: 19-45.
- Boothpur R, Brennan DC. Human polyoma viruses and disease with emphasis on clinical BK and JC. J Clin Virol 2010; 47(4): 306-12.
- Gjoerup O, Chang Y. Update on human polyomaviruses and cancer. Adv Cancer Res 2010; 106: 1-51.
- Capobianchi MR, Giombini E, Rozera G. Next-generation sequencing technology in clinical virology. Clin Microbiol Infect 2013; 19(1): 15-22.
- Feltkamp MC, Kazem S, van der Meijden E, Lauber C, Gorbalenya AE. From Stockholm to Malawi: recent developments in studying human polyomaviruses. J Gen Virol 2013; 94(Pt 3): 482-96.
- Dalianis T, Hirsch HH. Human polyomaviruses in disease and cancer. Virology 2013; 437(2): 63-72.
- Allander T, Andreasson K, Gupta S, et al. Identification of a third human polyomavirus. J Virol 2007; 81(8): 4130-6.
- Gaynor AM, Nissen MD, Whiley DM, et al. Identification of a novel polyomavirus from patients with acute respiratory tract infections. PLoS Pathog 2007; 3(5): e64.
- Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319(5866):1096-100.
- Schowalter RM, Pastrana DV, Pumphrey KA, Moyer AL, Buck CB. Merkel cell polyomavirus and two previously unknown polyomaviruses are chronically shed from human skin. Cell Host Microbe 2010; 7(6): 509-15.
- van der Meijden E, Janssens RW, Lauber C, Bouwes Bavinck JN, Gorbalenya AE, Feltkamp MC. Discovery of a new human polyomavirus associated with trichodysplasia spinulosa in an immunocompromized patient. PLoS Pathog 2010; 6(7): e1001024.
- Scuda N, Hofmann J, Calvignac-Spencer S, et al. A novel human polyomavirus closely related to the african green monkey-derived lymphotropic polyomavirus. J Virol 2011; 85(9): 4586-90.
- Buck CB, Phan GQ, Raiji MT, Murphy PM, McDermott DH, McBride AA. Complete genome sequence of a tenth human polyomavirus. J Virol 2012; 86(19): 10887.
- Siebrasse EA, Reyes A, Lim ES, et al. Identification of MW polyomavirus, a novel polyomavirus in human stool. J Virol 2012; 86(19): 10321-6.
- Yu G, Greninger AL, Isa P, et al. Discovery of a novel polyomavirus in acute diarrheal samples from children. PLoS One 2012; 7(11): e49449.
- Lim ES, Reyes A, Antonio M, et al. Discovery of STL polyomavirus, a polyomavirus of ancestral recombinant origin that encodes a unique T antigen by alternative splicing. Virology 2013; 436(2): 295-303.
- Johne R, Buck CB, Allander T, et al. Taxonomical developments in the family Polyomaviridae. Arch Virol 2011; 156(9): 1627-34.
- Van Ghelue M, Khan MT, Ehlers B, Moens U. Genome analysis of the new human polyomaviruses. Rev Med Virol 2012; 22(6): 354-77.
- Delbue S, Comar M, Ferrante P. Review on the relationship between human polyomaviruses-associated tumors and host immune system. Clin Dev Immunol 2012; 2012: 542092.
- Spurgeon ME, Lambert PF. Merkel cell polyomavirus: a newly discovered human virus with oncogenic potential. Virology 2013; 435(1): 118-30.
- Topalis D, Andrei G, Snoeck R. The large tumor antigen: A "Swiss Army knife" protein possessing the functions required for the polyomavirus life cycle. Antiviral Res 2013; 97(2): 122-36.
- Jiang M, Abend JR, Johnson SF, Imperiale MJ. The role of polyomaviruses in human disease. Virology 2009; 384(2): 266-73.
- Babakir-Mina M, Ciccozzi M, Perno CF, Ciotti M. The novel KI, WU, MC polyomaviruses: possible human pathogens? New Microbiol 2011; 34(1): 1-8.
- Rodig SJ, Cheng J, Wardzala J, et al. Improved detection suggests all Merkel cell carcinomas harbor Merkel polyomavirus. J Clin Invest 2012; 122(12): 4645-53.
- Touzé A, Gaitan J, Arnold F, et al. Generation of Merkel cell polyomavirus (MCV)-like particles and their application to detection of MCV antibodies. J Clin Microbiol 2010; 48(5): 1767-70.
- Moens U, Ludvigsen M, Van Ghelue M. Human polyomaviruses in skin diseases. Patholog Res Int 2011; 2011: 123491.
- Foulongne V, Sauvage V, Hebert C, et al. Human skin microbiota: high diversity of DNA viruses identified on the human skin by high throughput sequencing. PLoS One 2012; 7(6): e38499.
- Carter JJ, Paulson KG, Wipf GC, et al. Association of Merkel cell polyomavirus-specific antibodies with Merkel cell carcinoma. J Natl Cancer Inst 2009; 101(21): 1510-22.
- Nicol JT, Robinot R, Carpentier A, et al. Age-specific seroprevalence of Merkel cell polyomavirus, Human polyomaviruses 6, 7 and 9 and Trichodysplasia Spinulosa-associated polyomavirus. Clin Vaccine Immunol 2013 Jan 9. [Epub ahead of print].
- Haycox CL, Kim S, Fleckman P, et al. Trichodysplasia spinulosa--a newly described folliculocentric viral infection in an immunocompromised host. J Investig Dermatol Symp Proc 1999; 4(3): 268-71.
- Chen T, Mattila PS, Jartti T, Ruuskanen O, Söderlund-Venermo M, Hedman K. Seroepidemiology of the newly found trichodysplasia spinulosa-associated polyomavirus. J Infect Dis 2011; 204(10): 1523-6.
- van der Meijden E, Kazem S, Burgers MM, et al. Seroprevalence of trichodysplasia spinulosa-associated polyomavirus. Emerg Infect Dis 2011; 17(8): 1355-63.
- Kazem S, van der Meijden E, Kooijman S, et al. Trichodysplasia spinulosa is characterized by active polyomavirus infection. J Clin Virol 2012; 53(3): 225-30.
- Sauvage V, Foulongne V, Cheval J, et al. Human polyomavirus related to African green monkey lymphotropic polyomavirus. Emerg Infect Dis 2011; 17(8): 1364-70.
- Delbue S, Tremolada S, Branchetti E, et al. First identification and molecular characterization of lymphotropic polyomavirus in peripheral blood from patients with leukoencephalopathies. J Clin Microbiol 2008; 46(7): 2461-2.
- Kean JM, Rao S, Wang M, Garcea RL. Seroepidemiology of human polyomaviruses. PLoS Pathog 2009; 5(3): e1000363.
- Trusch F, Klein M, Finsterbusch T, Kühn J, Hofmann J, Ehlers B. Seroprevalence of human polyomavirus 9 and cross-reactivity to African green monkey-derived lymphotropic polyomavirus. J Gen Virol 2012; 93(Pt 4): 698-705.
- Nicol JT, Touzé A, Robinot R, et al. Seroprevalence and cross-reactivity of human polyomavirus 9. Emerg Infect Dis 2012; 18(8): 1329-32.
- Kantola K, Sadeghi M, Ewald MJ, et al. Expression and serological characterization of polyomavirus WUPyV and KIPyV structural proteins. Viral Immunol 2010; 23(4): 385-93.
- Viscidi RP, Rollison DE, Sondak VK, et al. Age-specific seroprevalence of Merkel cell polyomavirus, BK virus, and JC virus. Clin Vaccine Immunol 2011; 18(10): 1737-43.
- Bialasiewicz S, Lambert SB, Whiley DM, Nissen MD, Sloots TP. Merkel cell polyomavirus DNA in respiratory specimens from children and adults. Emerg Infect Dis 2009; 15(3): 492-4.
- Bialasiewicz S, Whiley DM, Lambert SB, Nissen MD, Sloots TP. Detection of BK, JC, WU, or KI polyomaviruses in faecal, urine, blood, cerebrospinal fluid and respiratory samples. J Clin Virol 2009; 45(3): 249-54.
- Vanchiere JA, Abudayyeh S, Copeland CM, Lu LB, Graham DY, Butel JS. Polyomavirus shedding in the stool of healthy adults. J Clin Microbiol 2009; 47(8): 2388-91.
- Foulongne V, Courgnaud V, Champeau W, Segondy M. Detection of Merkel cell polyomavirus on environmental surfaces. J Med Virol 2011; 83(8): 1435-9.
- Vilchez RA, Butel JS. Emergent human pathogen simian virus 40 and its role in cancer. Clin Microbiol Rev 2004; 17(3): 495-508.
- Martini F, Corallini A, Balatti V, Sabbioni S, Pancaldi C, Tognon M. Simian virus 40 in humans. Infect Agent Cancer 2007; 2: 13.
- Vilchez RA, Kozinetz CA, Butel JS. Conventional epidemiology and the link between SV40 and human cancers. Lancet Oncol 2003; 4(3): 188-91.
- Shah KV, Galloway DA, Knowles WA, Viscidi RP. Simian virus 40 (SV40) and human cancer: a review of the serological data. Rev Med Virol 2004; 14(4): 231-9.
- Stratton K, Almario DA, McCormick MC. Immunization Safety Review: SV40 Contamination of Polio Vaccine and Cancer (Free Executive Summary). 2002, The National Academies Press, Washington DC. Available at: http://www.nap.edu/catalog/10534.html
- Butel JS, Wong C, Vilchez RA, et al. Detection of antibodies to polyomavirus SV40 in two central European countries. Cent Eur J Public Health 2003; 11(1): 3-8.
- Vanchiere JA, White ZS, Butel JS. Detection of BK virus and simian virus 40 in the urine of healthy children. J Med Virol 2005; 75(3): 447-54.
- Paracchini V, Garte S, Pedotti P, Poli F, Frison S, Taioli E. Molecular identification of simian virus 40 infection in healthy Italian subjects by birth cohort. Mol Med 2005; 11(1-12): 48-51.
- Paracchini V, Garte S, Pedotti P, Taioli E. Review of prevalence of Simian Virus 40 (SV40) genomic infection in healthy subjects. Mutat Res 2006; 612(2): 77-83.
- Patel NC, Vilchez RA, Killen DE, et al. Detection of polyomavirus SV40 in tonsils from immunocompetent children. J Clin Virol 2008; 43(1): 66-72.
- Corallini A, Mazzoni E, Taronna A, et al. Specific antibodies reacting with simian virus 40 capsid protein mimotopes in serum samples from healthy blood donors. Hum Immunol 2012; 73(5): 502-10.
- Wong C, Vilchez RA, Quiroz J, Adam E, Butel JS. Ethnic differences in polyomavirus simian virus 40 seroprevalence among women in Houston, Texas. J Infect 2013; 66(1): 67-74.
İletişim (Correspondence):
Prof. Dr. Dürdal Us,
Hacettepe Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Sıhhiye, 06100 Ankara, Türkiye.
Tel (Phone): +90 312 305 1562,
E-posta (E-mail): durdalus@hacettepe.edu.tr