Pediatrik Renal Transplant Alıcılarında BK Virus Enfeksiyonları*
BK Virus Infections in Pediatric Kidney Transplant Recipients
Derya MUTLU1, İmran SAĞLIK1, Mustafa KOYUN2, Elif ÇOMAK2, Esvet MUTLU1, Arife USLU GÖKÇEOĞLU2,
Serpil ÇAĞLA DOĞAN2, Ayhan DİNÇKAN3, Sakine Halide AKBAŞ4, Bahar AKKAYA5, Sema AKMAN2,
Gültekin SÜLEYMANLAR6, Dilek ÇOLAK1
1 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Antalya.
1 Akdeniz University Medical School Hospital, Department of Medical Microbiology, Antalya, Turkey.
2 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Pediatrik Nefroloji Anabilim Dalı, Antalya.
2 Akdeniz University Medical School Hospital, Department of Pediatric Nephrology, Antalya, Turkey.
3 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Genel Cerrahi Anabilim Dalı, Antalya.
3 Akdeniz University Medical School Hospital, Department of General Surgery, Antalya, Turkey.
4 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Biyokimya Anabilim Dalı, Antalya.
4 Akdeniz University Medical School Hospital, Department of Biochemistry, Antalya, Turkey.
5 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Patoloji Anabilim Dalı, Antalya.
5 Akdeniz University Medical School Hospital, Department of Pathology, Antalya, Turkey
6 Akdeniz Üniversitesi Tıp Fakültesi Hastanesi, Nefroloji Anabilim Dalı, Antalya.
6 Akdeniz University Medical School Hospital, Department of Nephrology, Antalya, Turkey
* Bu çalışmada kullanılan hasta verilerinin bir kısmı, 4. Ulusal Viroloji Kongresi (23-26 Haziran 2011, İstanbul)'nde sunulmuştur.
ÖZET
Primer BK virus (BKV) enfeksiyonları genellikle erken çocukluk döneminde kazanılmakta ve asemptomatik olarak geçirilmektedir. Dünyadaki erişkin popülasyonlarda BKV seroprevalansı %90'a kadar ulaşabilir. Primer enfeksiyondan sonra virus ürogenital sistemde latent olarak kalmaktadır. Renal transplant alıcılarında, BKV'nin neden olduğu primer enfeksiyonlar ve reaktivasyonlar, hastaların %10'unu etkileyebilmekte ve önlem alınmadığı taktirde bu hastaların yarısından fazlası BKV nefropatisi (BKVN) nedeniyle böbreklerini kaybetmektedir. BKVN'ye bağlı greft kaybını engellemenin tek yolu, transplantasyon sonrasında BK virus enfeksiyonlarının takibi ve BKVN geliştiren hastaların erken dönemde tanınıp etkin bir biçimde tedavi edilmeleridir. Bu çalışmada, pediatrik renal transplant alıcılarında, transplantasyon sonrası dönemde, idrar ve plazma örneklerinden, gerçek zamanlı polimeraz zincir reaksiyonu (rtPCR) ile BKV enfeksiyonlarının takibinin ve bazı hastalarda uygulanan renal biyopsilerin değerlendirilmesinin retrospektif olarak analiz edilmesi amaçlanmıştır. Çalışmaya Şubat 2006-Nisan 2011 tarihleri arasında Akdeniz Üniversitesi Hastanesinde renal transplantasyon yapılan 142 pediatrik hasta (63 kız, 79 erkek; yaş ortalaması: 11.7 ± 3.9 yıl) dahil edilmiştir. Hastalardan rutin olarak transplantasyon sonrasındaki üç ay boyunca iki haftada bir, 3-6 ay arası ayda bir, altıncı aydan sonra da üç ayda bir plazma ve idrar örnekleri alınmıştır. İdrar ve plazma örnekleri, serum kreatinin düzeyi yüksekliklerinde ve akut rejeksiyon tedavisi yapılan dönemlerde rutin programa ek olarak alınmıştır. Plazma pozitifliklerinde ve BKVN tedavisi sırasında, örnek alma sıklığı iki haftada bire düşürülmüştür. Otomatize sistemle yapılan DNA ekstraksiyonu sonrasında, virusun VP-1 bölgesi içerisindeki 83 baz çiftlik kısım amplifiye edilmiş; hedef bölgeye ait sinyal tespiti, 5' ve 3' uçları sırasıyla FAM (6-carboxyfluorsecein) ve TAMRA (6-carboxytetramethylrhodamine) ile işaretli Taq-man probu kullanılarak yapılmıştır. Hastaların böbrek biyopsi örneklerinde histopatolojik inceleme, rutin histolojik boyalar ve SV40 antijenine yönelik monoklonal antikor kullanılarak immünohistokimyasal yöntemle uygulanmıştır. İnhibitör saptanmayan 2171 plazma örneğinden 442 (%20)'sinde (aralık: 300-4.5 x 107 kopya/ml; ortalama: 2.0 x 105 ± 2.2 x 106 kopya/ml) ve inhibitör saptanmayan 1995 idrar örneğinden 800 (%40.1)'ünde (aralık: 300 - 3 x 1012 kopya/ml; ortalama: 5.9 x 109 ± 1.1 x 1011 kopya/ml) BKV DNA varlığı belirlenmiştir. Hastaların 114 (%80.3)'ünde en az bir idrar örneğinde BKV DNA tespit edilmiş; bu hastaların da %59.6 (68/114)'sında viremi saptanmıştır. Hastaların %19.7 (28/142)'sinde, BKVN varlığı açısından sahip olduğu yüksek pozitif prediktif değeri nedeniyle eşik olarak kabul edilen 104 kopya/ml değerinin üzerinde viremi düzeyleri izlenmiştir. Bu hastaların tamamında ilk aşamada, renal biyopsiye başvurulmadan, immün baskılayıcı tedavi azaltılmıştır. Azaltılmış immün baskılamaya yanıt vermeyen 9 hastada sidofovir ve/veya leflunomid tedavisine başlanmış ve bu hastalardan 8'ine biyopsi yapılarak BKVN tanısı doğrulanmıştır. Bu sekiz hastadan ikisi BKVN nedeniyle greftlerini kaybetmiştir. Virüri ile çok yüksek oranda karşılaşılması ve bunların büyük çoğunluğunun düşük düzeyde ve geçici olması, tarama programlarında sadece kan örneklerinin kullanımının uygun olabileceğini düşündürmektedir. Antiviral ajanların kullanımının tedavideki etkinliği, bu tedavi stratejisinin immün baskılama azaltımı stratejisine yanıt vermeyen ve böbrek fonksiyonlarının bozulmaya başladığı hasta grubuna uygulanmış olması nedeniyle irdelenememiştir. Bu konunun açığa kavuşması için çok merkezli prospektif çalışmalara ihtiyaç vardır. Renal fonksiyonun ve uygun aralıklarla vireminin takibi ile erken tanının sağlanması BKVN'nin kontrolündeki en etkin yöntem olarak karşımıza çıkmaktadır.
Anahtar sözcükler: BK virus; renal transplantasyon; nefropati.
ABSTRACT
Primary BK virus (BKV) infections acquired mainly during childhood are usually asymptomatic. Several studies revealed its seroprevalence in adult population as high as 90% worldwide. Following primary infection, virus persists as latent infection in the urogenital tract. In renal transplant recipients, primary infection and reactivations affect 10% of patients and without treatment, more than half of these patients lose their grafts. The only way of preventing graft loss due to BKV nephropathy (BKVN), seems to monitor BKV infection after transplantation and to diagnose patients developing BKVN during the early period and treat them accordingly. In this study, we analyzed BKV presence in plasma and urine samples with real-time PCR method and evaluated the renal biopsies of pediatric renal transplant recipients after transplantation, retrospectively. A total of 142 children (63 female, 79 male; mean age: 11.7 ± 3.9 years) who had renal transplantation in Akdeniz University Medical Faculty, Antalya, Turkey, between February 2006 and April 2011 were enrolled in the study. After transplantation, peripheral blood and urine samples were collected bi-weekly for the first three months, monthly till the sixth month and every three months thereafter. BKV DNA was additionally screened in patients with unexplained rise in serum creatinine or in patients receiving anti-rejection therapy. In any plasma positivity or during the BKVN therapy, BKV DNA analysis was done bi-weekly. After DNA extraction by automated system, an 83 base pair fragment in VP1 region was amplified. Signal detection for the target region was performed with a TaqMan probe dual-labelled at the 5' end with 6-carboxyfluorescein (FAM) and the 3' end with 6-carboxytetramethylrhodamine (TAMRA). Histopathological examinations of renal biopsies were done with routine histological stains and immunohistochemical staining with monoclonal antibodies directed to SV40 antigen. From 2171 plasma and 1995 urine samples without PCR inhibitors, 442 (20%) (range: 300-4.5 x 107 copies/ml; mean: 2.0 x 105 ± 2.2 x 106 copies/ml) and 800 (40.1%) (range: 300-3 x 1012 copies/ml; mean: 5.9 x 109 ± 1.1 x 1011 copies/ml) were found positive for BKV DNA, respectively. For 114 (80.3%) patients, at least one urine sample was positive and more than half of those patients (68/114, 59.6%) had viremia. Of the patients, 19.7% (28/142) had viral DNA above 104 copies/ml, which was choosen as a cut-off value for its high positive predictive value for BKVN. For all these 28 patients, prior to renal biopsy, immunosupressive treatment was decreased. Cidofovir and/or leflunomid were initiated to nine patients who did not respond to lowered immunosupressive therapy and eight of them had renal biopsy for the confirmation of BKVN. All renal biopsy results were compatible with BKVN. From these nine patients who were receiving cidofovir and/or leflunomid, two lost their grafts because of BKVN. Since viruria is frequently encountered and the viral load is usually in low quantities and transient, it is more appropriate to use blood samples for screening programmes after renal transplantation. The efficacy of antiviral treatment in BKVN could not be evaluated since it was only applied in patients non-responding to lowered immunosuppressive therapy and had decreased renal functions. Multicenter prospective studies are required to enlighten this important issue. Early diagnosis with close monitoring of renal function and viremia, seems to be the most effective way for controlling BKVN.
Key words: BK virus; renal transplantation; nephropathy.
Geliş Tarihi (Received): 25.01.2013 • Kabul Ediliş Tarihi (Accepted): 20.03.2013
GİRİŞ
Renal transplantasyon, son dönem böbrek yetmezliği olan hastalarda hayat kurtaran bir tedavi yöntemi olması yanında, hastanın yaşam kalitesine de önemli katkı sağlamaktadır1. Son yıllarda, cerrahi işlemlerdeki ilerlemelerin yanında, immün süpresif tedavilerdeki gelişmelerle birlikte, immünolojik hasar önlenebilmekte, akut ve kronik böbrek kayıplarının önüne geçilebilmektedir2. Ancak rejeksiyonların belirgin düzeyde azalmasına rağmen, bu başarı greft sağkalımına aynı oranda yansımamaktadır3. Bunun nedenlerinden biri de hem pediatrik hem de erişkin transplant hastalarında, şu ana kadar bilinen ya da yeni ortaya çıkan enfeksiyon etkenlerine sıklıkla rastlanılmasıdır4. Son 15 yıl içerisinde tanımlanan ve günümüzde renal transplantasyonun başarısının önündeki en önemli engellerden biri olarak görülen BK virus ile ilişkili nefropatinin (BKVN) etkeni olan BK virus (BKV), yeni ortaya çıkan enfeksiyon etkenlerine iyi bir örnektir5. BKVN gelişen hastaların %15-50'sinde greft kaybı olmaktadır6,7.
BKV, Polyomaviridae ailesi içinde bulunan, zarfsız, küçük, ikozahedral kapsidli ve çift iplikli çembersel DNA'ya sahip bir virustur8. Erken çocukluk çağında geçirilen primer BKV enfeksiyonları sırasında üst solunum yolu enfeksiyonu klinik bulguları görülebilmekle birlikte, genellikle asemptomatik seyretmektedir9. Primer enfeksiyon sonrasında virus ürogenital kanalda latent olarak varlığını sürdürmektedir10. Renal transplant hastalarında hem primer enfeksiyonlar hem de reaktivasyonlar böbreğin kaybına kadar gidebilen BKVN'ye neden olmaktadır11. Renal transplant alıcılarındaki BKV enfeksiyonlarının erken dönemde tanınmasının BKVN'ye ilerleyişi engelleyebilmesi, transplantasyon sonrasında enfeksiyonların saptanmasına yönelik rutin takip ve tarama programlarının gerekliliğini ortaya koymaktadır12.
BKVN tanısında idrarda Decoy hücrelerinin analizi ucuz bir test olmakla birlikte, uygulamanın tecrübe gerektirmesi ve yüksek duyarlılığa rağmen özgüllüğünün %30 civarında oluşu, pratik olarak kullanılabilirliğini azaltmaktadır13. Moleküler testler ise, maliyetleri yüksek olsa bile, çok yüksek özgüllükleri ve duyarlılıkları nedeniyle tercih edilen testler olmaktadır. Renal transplant hastaları için yayınlanan rehberler tüm alıcıların BKV enfeksiyonları açısından düzenli aralıklarla takip edilerek taranmalarını önermektedir12.
Bu çalışmada, pediatrik renal transplant alıcılarında, transplantasyon sonrası dönemde, BKV enfeksiyonlarının takibinin retrospektif olarak analiz edilmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
Hastalar
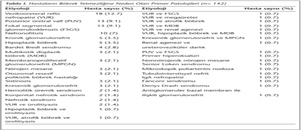
Çalışmaya, Şubat 2006-Nisan 2011 tarihleri arasında renal transplantasyon yapılan, 63'ü kız, 79'u erkek toplam 142 pediatrik renal transplant hastası dahil edildi. Hastaların böbrek yetmezliğine neden olan primer hastalıkları Tablo I'de gösterildi. Hastaların ortalama yaşları 11.7 ± 3.9 yıl, canlı donör sayısı 119 (%84), kadavra donör sayısı 23 (%16) idi. Hastalardan rutin olarak transplantasyon sonrasındaki üç ay boyunca iki haftada bir, altıncı aya kadar ayda bir, altıncı aydan sonra da üç ayda bir plazma ve idrar örnekleri alındı. İdrar ve plazma örnekleri, serum kreatinin düzeyi yüksekliklerinde ve akut rejeksiyon tedavisi yapılan dönemlerde rutin programa ek olarak alındı. Plazma pozitifliklerinde ve BKVN tedavisi sırasında, örnekler iki haftada bir alındı.
BKV DNA Kantitasyonu
BK virus DNA'sı gerçek zamanlı (real-time) PCR (rtPCR) yöntemiyle araştırıldı. Viral nükleik asit ekstraksiyon kiti (EZ1 virus minikit) ve otomatize cihazı (Biorobot EZ1 Advanced, Qiagen, Almanya) kullanılarak, plazma ve idrar örneklerinden DNA ekstraksiyonu yapıldı. Amplifikasyon aşamasında, kantitasyonun sağlanabilmesi için, pBR322 plazmidi içerisine klonlanan Dunlop suşunun tüm dizisini içeren pBKV (ATCC45025) ile, UV spektrofotometre kullanılarak 10'ar katlık değişen konsantrasyonlarda plazmid içeren beş standart kullanıldı. Vats ve arkadaşları14 tarafından tanımlanan primer dizileri kullanılarak virusun VP-1 bölgesi içerisindeki 83 baz çiftlik alan amplifiye edildi. Hedef bölgeye ait sinyal tespiti 5' ve 3' uçları sırasıyla FAM ve TAMRA işaretli Taq-man probu kullanılarak yapıldı. PCR inhibitörü varlığı, internal kontrol olarak, hedef ile aynı tüp içerisinde, gliseraldehit 3 fosfat dehidrogenaz (GAPDH) geni içerisinde yer alan bölgenin amplifikasyonu ve amplifiye edilen bölgenin 5' ve 3' uçları sırasıyla BHQ3 ve Cy5 işaretli Taq-man probuyla tespiti ile test edildi. Hedef dizinin saptanması ve çoğaltılması için kullanılan ve Vats ve arkadaşları14 tarafından tanımlanan primer ve prob dizileri Tablo II'de gösterildi. 95°C'de 12 dakikalık süre sonrasında 95°C'de 15 saniye, 60 ve 40°C'de 1'er dakikadan oluşan 45 döngülük amplifikasyon işlemi, Rotor-Gene (Corbett-Research, Avustralya) rtPCR cihazında yapıldı.
BKV DNA İçeren QCMD Paneli
Kullanılan BKV DNA rtPCR metodunun validasyonu laboratuvarımızda yapıldı15. Performansı ise, 2012 yılına ait QCMD (Quality Control for Molecular Diagnostics) BKV ve JC virus (JCV) dış kalite kontrol programları ile değerlendirildi. QCMD BKV-JCV paneli, BKV alt tip 1'in b altgrubunun iki farklı izolatının VTM (viral transport medium) içerisinde hazırlanan farklı konsantrasyonlarından oluşmaktaydı ve negatif örnekler de içermekteydi.
Renal Allograft Biyopsisi
Tedaviye rağmen viremi düzeylerinde iyileşme olmayan, ya da kreatinin düzeyleri yüksek olan hastalardan böbrek biyopsi örnekleri alındı. Biyopsi örneklerinde histopatolojik inceleme rutin histolojik boyalarla ve SV40 antijenine yönelik monoklonal antikor kullanılarak immünohistokimyasal yöntemle yapıldı.
Tanımlamalar
İdrarda 107 kopya/ml ve plazmada 104 kopya/ml ve üzerindeki değerler, sırasıyla yüksek düzey virüri ve yüksek düzey viremi olarak değerlendirildi16.
BULGULAR
Çalışmamızda 2012 yılına ait QCMD BKV-JCV paneli örneklerinde rtPCR metoduyla %100 başarı sağlanmıştır.
Plazma ve İdrar Örneklerinde BKV DNA Sonuçları
Transplantasyon sonrasında plazma ve idrar örneklerinden BKV enfeksiyonu varlığı için medyan takip süresi 18 aydır. Hasta başına düşen ortalama örnek sayıları plazma ve idrar için sırasıyla 15.5 ve 15.2'dir. Çalışmaya alınan 142 hastaya ait plazma örneklerinin %1.1 (25/2196)'inde, idrar örneklerinin ise %7.5 (162/2157)'inde PCR inhibitörüne rastlandığından bu örnekler değerlendirmeye alınmamış; dolayısıyla 2171 plazma ve 1995 idrar örneği sonucu değerlendirilmiştir. Hastaların 114 (%80.3)'ünde en az bir plazma ve/veya idrar örneğinde BKV DNA'sı saptanmış; bu hastaların da 68 (%59.6)'inde viremi tespit edilmiştir. Plazma örneklerinin 442 (%20)'sinde, idrar örneklerinin ise 800 (%40.1)'ünde BKV DNA varlığı belirlenmiştir. Ortanca BKV DNA değerleri plazma için 3.2 x 103 kopya/ml (aralık 300-4.5 x 107 kopya/ml) ve idrar için 2.9 x 105 kopya/ml (aralık 300-3 x 1012 kopya/ml) olarak saptanmıştır.
Eş zamanlı plazma ve idrar örnekleri gönderilen hastalarda, plazma örneklerinin pozitifliğine her zaman idrar örneklerinin pozitifliği eşlik etmiştir.
Plazma ve idrar örnekleri için ilk pozitifliklerin görülme zamanı sırasıyla ortanca 85. gün (aralık 6-1410) ve 80. gün (aralık 6-1410) olmuştur.
Otuz dokuz (%27.5) hastada yüksek düzey virüri saptanmış, bunların da 28 (%19.7)'inde eş zamanlı plazma örneklerinde yüksek düzey viremi tespit edilmiştir. Yüksek düzeyde viremi olmadan yüksek düzeyde virüri saptanan 11 hastanın 8'inde tek örnekte yüksek düzey virüri saptanmıştır. İki hastanın 2 ve bir hastanın 7 idrar örneğinde yüksek düzey virüri izlenmiştir. Yüksek düzeyde viremi saptanmadan yüksek düzeyde virüri saptanan bu 11 hastanın hiçbirinde serum kreatinin düzeylerinde yükselme görülmemiştir.
Renal Allograft Biyopsi Sonuçları
Kalıcı ve yüksek düzeyde viremisi olan ve tedaviye yanıt vermeyen 8 hastadan alınan renal biyopsi örneklerinde BKVN tanısı konulmuştur. Bu 8 hastadan 2'si BKVN nedeniyle greftlerini kaybetmiştir. Greftlerini kaybeden ve kaybetmeyen hastalara ait viremi ve virüri düzeyleri sırasıyla Şekil 1 ve 2'de gösterilmiştir.
TARTIŞMA
Erişkin renal transplant alıcıları için önemli bir sorun olan BKV enfeksiyonları, pediatrik grupta, primer enfeksiyon olasılığının daha fazla olması sebebiyle, BKVN'ye daha sık sebep olmaktadır17. Yapılan çalışmalar pediatrik renal transplant alıcılarında BKV virüri sıklığının %50'ye kadar çıkabildiğini göstermektedir18. Çalışmamızda, idrar örneklerinden en az birinde virüri saptanan hastalar tüm hastaların %80.3'ü olarak saptanmıştır. Virürinin, çalışmamızda, daha yüksek oranda saptanmasının olası nedenleri arasında Fogeda ve arkadaşlarının18 kullandığı manuel ekstraksiyon yöntemine kıyasla daha yüksek duyarlılığa sahip otomatize ekstraksiyonun kullanılmış olması ve ekstraksiyona daha yüksek örnek hacmi ile başlanmış olması akla gelmektedir. Diğer bir olasılık da bu çalışmada hastaların, renal transplant merkezlerince12 kabul gören sıklıkta takip edilmiş olmaları nedeniyle geçici viremi ve virürilerin de saptanmış olmaları olabilir.
Çalışmamızda idrar örneklerinde, plazma örneklerinden ortanca olarak 5 gün önce pozitifliğe rastlanmıştır. Hirsch ve arkadaşları16 da eş zamanlı idrar ve plazma örneklerinin analiz edildiği bir çalışmada viremiden yaklaşık dört hafta önce virürinin saptandığını göstermişlerdir. Bu çalışmada ayrıca plazma ve idrar örneklerinin %50'den fazlasında ilk pozitiflikler ilk üç ay içerisinde görülmüştür. Hirsch ve arkadaşları16 da ilk üç ayda idrar örneklerinin pozitifliklerinin %80'ine, plazma örnekleri pozitifliklerinin %50'sine ulaşıldığını ortaya koymuşlardır. Ginevri ve arkadaşlarının12 renal transplantasyon yapılan çocuklarda yaptıkları çalışmada ortanca virüri görülme zamanı üç ay olarak bulunmuş, hastaların %77'sinde virüri ve viremi aynı anda görülürken, %23'ünde virüri, viremiden 3.5 ay önce görülmüştür.
Çalışmamızda virürisi olan hastaların yarısından fazlasında viremi de saptanmış ve yapılan çoğu çalışmada olduğu gibi viremiye her zaman virüri eşlik etmiştir12. Fogeda ve arkadaşlarının18 yaptığı çalışmada iki hastada virüri olmadan viremi saptanmış ancak hiçbirinde BKVN gelişmemiştir. Alexander ve arkadaşlarının13 yaptığı çalışmada da iki hastada virüri olmadan viremi saptanmış ve birinde BKVN gelişmiştir. Ancak bu çalışmalarda kullanılan rtPCR yönteminin kalitatif olması nedeniyle viremi ve virüri düzeyleri bilinmemektedir. Çalışmamızda, KDIGO (Kidney Disease: Improving Global Outcomes) tarafından, BKVN için sahip olduğu %90'ın üzerindeki pozitif prediktif değer nedeniyle önemli kabul edilen, 104 kopya/ml plazma viremi düzeyi (yüksek viremi, 2D düzeyinde öneri)19 üzerinde 28 (%19.7) hasta saptanmıştır. Bununla birlikte, BKV DNA saptamaya yönelik gerçek zamanlı testlerde olduğu gibi, uluslararası kantitasyon standardı içermeyen kantitatif testlerde kesin eşik değerlerin kullanımına temkinli yaklaşılmalıdır20. Renal transplant alıcılarının transplant sonrası dönemde, BKVN açısından taranmaları için idrar ya da plazma örneklerinin kullanılması konusunda henüz bir fikir birliğine varılmamıştır. Asemptomatik virürik hastaların çok büyük bir çoğunluğunun BKVN geliştirmeyecek olmaları ve vireminin, saptanabilir virüriden en az dört hafta daha sonra ortaya çıkacak olması KDIGO'nun tarama sırasında sadece plazma örneklerinin kullanılmasını önermesine neden olmuştur19. Çalışmamızda yüksek düzey virüri saptanan, ancak yüksek düzey viremisi olmayan 11 hastanın hiçbirinde BKVN gelişmemesi, KDIGO'nun tarama sırasında sadece kan örneklerinin kullanımı önerisini destekler niteliktedir. Diğer yandan, idrar örneklerinde, çalışmamızda olduğu gibi BKV DNA'nın 1011 kopya/ml değerlerine kadar yüksek düzeylerde bulunabilmesi, idrar örnekleri ile çalışıldığında laboratuvarın, kontaminasyon riski açısından dikkat etmesi gereken bir faktördür.
İdrar ve plazma örneklerinde sırasıyla %7.5 ve %1.1 oranlarında PCR inhibitörüne rastlanması, her iki örnek türünde de inhibitör varlığında yanlış negatif sonuçların raporlanmaması açısından önem taşıdığından, analizlerinde internal kontrol de kullanan PCR testleri tercih edilmelidir.
BKVN tanısında altın standart renal biyopsilerin SV40 antijenine yönelik antikorlar kullanarak immünohistokimyasal olarak boyanmalarıdır. Tanıda altın standart olarak kabul görmesine rağmen, BKVN'nin erken dönemlerinde, fokal dağılımdan dolayı, biyopsi sırasında etkilenmeyen parankimal dokuların örneklenmesi sonucu yanlış negatifliklere rastlanabilmektedir21. Pediatrik grupta rutin renal biyopsilerden genellikle kaçınılması nedeniyle, BKVN için sahip olduğu %90'ın üzerindeki pozitif prediktif değer, 104 kopya/ml plazma viremi düzeyinin tedaviye başlamak için kriter olarak kullanılmasına neden olmaktadır22. Merkezimizde de viremi düzeyleri 104 kopya/ml üzerinde olan 28 hastanın tamamında ilk aşamada, renal biyopsiye başvurulmadan, immün süpresif tedavi azaltılmıştır. Bu strateji, erken dönemde müdahaleyi mümkün kıldığından, enfeksiyon etkenini kontrol altına alacak olan immün sistemin yeniden yapılandırılmasının 4-12 hafta sürmesi nedeniyle, büyük önem taşımaktadır23. İmmün baskılamadaki azaltmaya ek olarak, birçok merkez, in vitro ortamda antipolyomaviral etkinliği gösterilmiş ajanları kullanmaktadır16,24. Bu ajanların, BKVN tedavisinde kullanımları FDA tarafından onaylanmamış olsa da, merkezimizde de azalmış immün baskılamaya yanıt vermeyen dokuz hastada, sidofovir ve/veya leflunomid tedavisine başlanmış ve bu hastalardan sekizine de BKVN tanısının desteklenmesi amacıyla biyopsi yapılmış ve BKVN tanısı desteklenmiştir.
BKVN tanısı konan ve gerek immün süpresyon tedavisi azaltılarak, gerekse antiviral ajanların kullanımı ile müdahale edilen 28 (28/142, %19.7) hastadan ikisi BKVN nedeniyle böbreklerini kaybetmiştir. Greft kaybı oranı, BKVN'nin henüz iyi bilinmediği dönemlerdeki %50'yi aşan kayıplar ile karşılaştırıldığında, tarama ve tedavi stratejilerinin çok önemli olduğunu ve mutlaka transplantasyon yapılan her merkezde olması gerektiğini ortaya koymaktadır25,26. Bu çalışmada antiviral ajanların kullanımının tedavideki etkinliği, bu tedavi stratejisinin immün baskılamanın azaltılmasına yanıt vermeyen ve böbrek fonksiyonlarının bozulmaya başladığı hasta grubuna uygulanması nedeniyle irdelenememiştir. Bu konunun açığa kavuşması için, çok merkezli prospektif çalışmalara ihtiyaç vardır.
Renal transplantasyonda yoğun immün süpresif tedavilerin kullanılmasına devam edilmesi nedeniyle BK virus enfeksiyonları sorun olmaya devam edecektir. Virüri ile, bu çalışmada olduğu gibi çok yüksek oranda karşılaşılması ve bunların büyük çoğunluğunun düşük düzeyde ve geçici olması, tarama programlarında kan örneklerinin kullanımının uygun olduğunu ortaya koymaktadır. Laskin ve arkadaşları27 pediatrik renal transplant alıcılarında yaptıkları analizde, BK virus tarama programında, tek başına plazma örnekleri ile tarama yapmanın, idrar ve plazma örneklerini kullanarak tarama yapmaya kıyasla, hasta başına yıllık maliyeti 2200 USD azalttığını göstermişlerdir. Sağlığa ayrılan bütçenin kısıtlı olduğu ülkemizde laboratuvar testlerinin maliyetleri de büyük önem taşımaktadır. Sonuç olarak, böbrek fonksiyonunun ve sık aralıklarla vireminin takibi ile erken tanının sağlanması BKVN kontrolünde en etkin yöntem olarak karşımıza çıkmaktadır.
KAYNAKLAR
- Sundaram SS, Landgraf JM, Neighbors K, et al. Adolescent health-related quality of life following liver and kidney transplantation. Am J Transplant 2007; 7(4): 982-9.
- Hariharan S, Johnson CP, Bresnahan BA, et al. Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med 2000; 342(9): 605-12.
- Tantravahi J, Womer KL, Kaplan B. Why hasn't eliminating acute rejection improved graft survival? Annu Rev Med 2007; 58: 369-85.
- Dharnidharka VR, Caillard S, Agodoa LY, Abbott KC. Infection frequency and profile in different age groups of kidney transplant recipients. Transplantation 2006; 81(12): 1662-7.
- Hirsch HH. Polyomavirus BK nephropathy: a (re-)emerging complication in renal transplantation. Am J Transplant 2002; 2(1): 25-30.
- Wadei HM, Rule AD, Lewin M, et al. Kidney transplant function and histological clearance of virus following diagnosis of polyomavirus-associated nephropathy (PVAN). Am J Transplant 2006; 6(5 Pt 1): 1025-32.
- Nickeleit V, Hirsch HH, Binet IF, et al. Polyomavirus infection of renal allograft recipients: from latent infection to manifest disease. J Am Soc Nephrol 1999; 10(5): 1080-9.
- Vilchez RA, Kusne S. Molecular and clinical perspectives of polyomaviruses: emerging evidence of importance in non-kidney transplant populations. Liver Transpl 2006; 12(10): 1457-63.
- Mäntyjärvi RA, Meurman OH, Vihma L, Berglund B. A human papovavirus (B.K.), biological properties and seroepidemiology. Ann Clin Res 1973; 5(5): 283-7.
- Heritage J, Chesters PM, McCance DJ. The persistence of papovavirus BK DNA sequences in normal human renal tissue. J Med Virol 1981; 8(2): 143-50.
- Ginevri F, De Santis R, Comoli P, et al. Polyomavirus BK infection in pediatric kidney-allograft recipients: a single-center analysis of incidence, risk factors, and novel therapeutic approaches. Transplantation 2003; 75(8): 1266-70.
- Ginevri F, Azzi A, Hirsch HH, et al. Prospective monitoring of polyomavirus BK replication and impact of pre-emptive intervention in pediatric kidney recipients. Am J Transplant 2007; 7(12): 2727-35.
- Alexander RT, Langlois V, Tellier R, Robinson L, Hebert D. The prevalence of BK viremia and urinary viral shedding in a pediatric renal transplant population: a single-center retrospective analysis. Pediatr Transplant 2006; 10(5): 586-92.
- Vats A, Shapiro R, Singh Randhawa P, et al. Quantitative viral load monitoring and cidofovir therapy for the management of BK virus-associated nephropathy in children and adults. Transplantation 2003; 75(1): 105-12.
- Ozen NS, Mutlu D, Ozcan A, Colak D. Evaluation of analytical performance of real time quantitative BKV PCR assay. J Clin Virol 2009; 46(Suppl 1): S60.
- Hirsch HH, Brennan DC, Drachenberg CB, et al. Polyomavirus-associated nephropathy in renal transplantation: interdisciplinary analyses and recommendations. Transplantation 2005; 79(10): 1277-86.
- Smith JM, McDonald RA, Finn LS, Healey PJ, Davis CL, Limaye AP. Polyomavirus nephropathy in pediatric kidney transplant recipients. Am J Transplant 2004; 4(12): 2109-17.
- Fogeda M, Munoz P, Luque A, Morales MD, Bouza E; BKV Study Group. Cross-sectional study of BK virüs infection in pediatric kidney transplant recipients. Pediatr Transplant 2007; 11(4): 394-401.
- Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009; 9(Suppl 3): S1-155.
- Hoffman NG, Cook L, Atienza EE, Limaye AP, Jerome KR. Marked variability of BK virus load measurement using quantitative real-time PCR among commonly used assays. J Clin Microbiol 2008; 46(8): 2671-80.
- Drachenberg CB, Hirsch HH, Ramos E, Papadimitriou JC. Polyomavirus disease in renal transplantation: review of pathological findings and diagnostic methods. Hum Pathol 2005; 36(12): 1245-55.
- Babel N, Fendt J, Karaivanov S, et al. Sustained BK viruria as an early marker for the development of BKV-associated nephropathy: analysis of 4128 urine and serum samples. Transplantation 2009; 88(1): 89-95.
- Funk GA, Steiger J, Hirsch HH. Rapid dynamics of polyomavirus type BK in renal transplant recipients. J Infect Dis 2006; 193(1): 80-7.
- Rinaldo CH, Hirsch HH. Antivirals for the treatment of polyomavirus BK replication. Expert Rev Anti Infect Ther 2007; 5(1): 105-15.
- Ramos E, Drachenberg CB, Portocarrero M, et al. BK virus nephropathy diagnosis and treatment: experience at the University of Maryland Renal Transplant Program. Clin Transpl 2002: 143-53.
- Binet I, Nickeleit V, Hirsch HH, et al. Polyomavirus disease under new immunosuppressive drugs: a cause of renal graft dysfunction and graft loss. Transplantation 1999; 67(6): 918-22.
- Laskin BL, Goebel J, Starke JR, Schauer DP, Eckman MH. Cost-effectiveness of latent tuberculosis screening before steroid therapy for idiopathic nephrotic syndrome in children. Am J Kidney Dis 2013; 61(1): 22-32.
İletişim (Correspondence):
Prof. Dr. Dilek Çolak,
Akdeniz Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Viroloji Bilim Dalı,
07070, Arapsuyu, Antalya, Türkiye.
Tel (Phone): +90 242 249 6405,
E-posta (E-mail): dcolak@akdeniz.edu.tr