Klinik Örneklerden İzole Edilen Acinetobacter baumannii Suşlarında
Beta-Laktamaz Kaynaklı Direncin Moleküler Karakterizasyonu*
Molecular Characterization of
Beta-Lactamase-Associated Resistance in
Acinetobacter baumannii Strains Isolated from Clinical Samples
Hakan KESKİN1, Alper TEKELİ2, İştar DOLAPÇI2, Duygu ÖCAL2
1 Sinop Atatürk Devlet Hastanesi, Mikrobiyoloji Laboratuvarı, Sinop.
1 Sinop Ataturk State Hospital, Microbiology Laboratory, Sinop, Turkey.
2 Ankara Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
2 Ankara University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
* Bu çalışma, Ankara Üniversitesi Araştırma Fonu tarafından 12B3330006 proje numarasıyla desteklenmiş ve 2. Klinik Mikrobiyoloji Kongresi (9-13 Kasım 2013, Belek, Antalya)'nde poster olarak sunulmuştur.
ÖZET
Acinetobacter baumannii hastanelerde, özellikle yoğun bakım ünitelerinde mortalite ve morbiditeyi artıran, hastane kaynaklı enfeksiyonların önemli bir nedenidir. Bu çalışmanın amacı, klinik örneklerden izole edilen A.baumannii suşlarının antibiyotik duyarlılıklarını, direnç genlerini ve izolatların birbirleriyle olan klonal ilişkilerini değerlendirip, hastanemizde bu bakteriye ilişkin direnç mekanizmalarını ortaya koymaktır. Çalışmaya, Ankara Üniversitesi Tıp Fakültesi İbn-i Sina Hastanesi Merkez Bakteriyoloji Laboratuvarına Nisan 2010-Aralık 2011 tarihleri arasında gönderilen 160 yatan hastaya ait 201 klinik örnekten izole edilen (trakeal aspirat %35.3, kan %27.3, apse %18.4, diğer %19) Acinetobacter suşu alınmıştır. A.baumannii izolatlarının tanımlanması ve amikasin, siprofloksasin, tetrasiklin, sulbaktam/ampisilin, trimetoprim/sülfametoksazol (TMP-SMZ), seftazidim, gentamisin, imipenem, levofloksasin, meropenem, piperasilin/tazobaktam, sefoperazon/sulbaktam, sefepim ve kolistine karşı duyarlılıklarının değerlendirilmesi otomatize sistemler [Vitek 2 (bioMérieux, Fransa) ve BD Phoenix (Becton Dickinson, ABD)] ile yapılmıştır. Beta-laktam direncine neden olan enzimatik mekanizmalar ve integron taşıyıcılığı polimeraz zincir reaksiyonu (PCR) yöntemiyle araştırılmıştır. Türkiye'de sık görülmesi nedeniyle blaPER-1 taşıyıcılığına bakılmıştır. Çalışmamızda, A.baumannii suşlarında çoklu ilaç direnç oranı %94.5 (190/201) olarak saptanmış; en etkili antibiyotiğin kolistin olduğu tespit edilmiş (189/201; %94); onu %32'lik duyarlılık oranı ile amikasin ve TMP-SMZ izlemiştir. Kolistine dirençli 12 izolat E-test (AB Biodisk, İsveç) yöntemiyle tekrar değerlendirildiğinde tümü kolistine dirençli bulunmuştur. Metallo-beta-laktamaz üretimine neden olan genlere ait sonuçlar negatif bulunurken, blaOXA genlerinin değişik oranlarda (OXA-51 %100; OXA-23 %91.5; OXA-58 %7; OXA-24 %2) pozitif olduğu görülmüştür. Suşların 42 (%21)'si blaPER-1 pozitif olarak saptanmış olup, hepsi seftazidime dirençlidir. İzolatlar arası klonal ilişkinin araştırılmasında pulsed-field jel elektroforezi (PFGE) yöntemi kullanılmış; dört farklı ana klonda kümeleşme (genotip A'da 29, genotip B'de 23, genotip C'de 18, genotip D'de 7 izolat) görülmüş, ancak ortak bir salgın izolatı saptanamamıştır. İzolatlar arasında direnç genlerinin geçişinde rol alan sınıf 1 integron varlığı araştırıldığında, 112 (%55.7) izolatta pozitiflik bulunmuştur. Sınıf 1 integron içeren izolatların genotiplere göre dağılımı arasında istatistiksel olarak anlamlı bir fark bulunmamıştır (p> 0.05). Çoklu ilaç direnci gösteren izolatlarda, integron taşıyıcılığı ile tetrasiklin, TMP-SMZ, imipenem, meropenem, sefoperazon/sulbaktam ve sefepim direnci arasındaki ilişki ise istatistiksel olarak anlamlı bulunmuştur (p< 0.05). Bu çalışma ile A.baumannii karbapenem direncinde blaOXA-51 ile birlikte bulunan blaOXA genlerinin önemli bir rol oynadığı, çoklu antibiyotik direncinin bu bakteri ile olan enfeksiyonlarda hala önemli bir problem olduğu ve dirence neden olan genlerin transferinde integronların aracılık edebileceği gösterilmiştir. Sonuç olarak, çok ilaca dirençli A.baumannii izolatlarının hastanemizde oldukça yaygın olduğu görülmüş, elde edilen epidemiyolojik verilerin hastanemizde ileriye yönelik araştırmalar ve tedavi yöntemleri açısından yararlı olabileceği düşünülmüştür.
Anahtar sözcükler: Acinetobacter baumannii; karbapenemaz; direnç genleri; sınıf 1 integron.
ABSTRACT
Acinetobacter baumannii is an important cause of nosocomial infections that particularly increase the mortality and the morbidity at the intensive care units of the hospitals. The aims of this study were to evaluate the resistance genes, antibiotic susceptibility and the clonal relations among Acinetobacter strains isolated from clinical samples and to determine the resistance mechanisms related to these bacteria in our hospital. A total of 201 A.baumannii strains isolated from different clinical samples (35.3% from tracheal aspirate, 27.3% from blood, 18.4% from abscess material, 19% from other samples) of 160 inpatients evaluated at the Ibni Sina Hospital Central Bacteriology Laboratory, Ankara University School of Medicine, Turkey from April 2010 to December 2011, were included in the study. Identification of the isolates and their susceptibility testing against amikacin, ciprofloxacin, tetracycline, sulbactam/ampicillin, trimethoprim/sulfametoxazole (SXT), ceftazidime, gentamicin, imipenem, levofloxacin, meropenem, piperacillin/tazobactam, cefoperazone/sulbactam, cefepime and colistin were performed by the automated systems, namely Vitek 2 (bioMérieux, France) and BD Phoenix (Becton Dickinson, USA). The molecular mechanisms of beta-lactamase resistance and the presence of integrons were analyzed by polymerase chain reaction (PCR). Moreover, since blaPER-1 gene is of high frequency in Turkey, it was also investigated in the isolates. Pulsed-field gel electrophoresis (PFGE) was performed to examine the clonal relations between isolates. Our results indicated that multidrug resistance rate of A.baumannii was 94.5% (190/201), while 94% (189/201) of the isolates were susceptible to colistin thus making it the most potent antimicrobial agent, followed by amikacin and SXT with a susceptibility rate of 32%. Twelve colistin-resistant isolates were further investigated with the E-test method (AB Biodisk, Sweden) and found to be colistin-resistant. While the results were negative for the genes responsible from metallo-beta-lactamase production, positive results were obtained for blaOXA genes at various rates (OXA-51 100%; OXA-23 91.5%; OXA-58 7%; OXA-24 2%). PFGE results revealed four different main clones (29 isolates in genotype A, 23 in genotype B, 18 in genotype C and 7 in genotype D) in the study population. No common epidemic isolate was detected. Class 1 integrons which take part in the transfer of resistance genes were detected in 112 (55.7%) isolates. There was no statistically significant difference between the genotype distributions of class 1 integron positive strains (p> 0.05). The relationship between the presence of integron in multidrug resistant isolates and resistance to tetracyclin, SXT, imipenem, meropenem, cefoperazone/sulbactam and cefepime were found to be statistically significant (p< 0.05). Of the isolates 42 (21%) were positive for blaPER- 1 gene and all were resistant to ceftazidime. This study indicated that blaOXA genes found together with blaOXA-51 genes play an important role in carbapenem resistance of A.baumannii strains. Moreover, multidrug resistance is still an important problem in infections caused by A.baumannii and integrons play a role in the transfer of the resistance genes. In conclusion, multidrug resistant A.baumannii strains were common in our hospital and our epidemiologic data would be helpful for further investigations and in therapeutical approaches.
Key words: Acinetobacter baumannii; carbapenemase; resistance genes; class 1 integron.
Geliş Tarihi (Received): 12.12.2013 • Kabul Ediliş Tarihi (Accepted): 01.06.2014
GİRİŞ
Geniş spektrumlu antibiyotiklerin aşırı kullanımının bir sonucu olarak, günümüzde kullanılan antibiyotiklerin çoğuna dirençli ve hastane enfeksiyonlarının önemli etkenlerden biri olan Acinetobacter spp. enfeksiyonlarının tedavisinin gelecekte çok zor olacağı düşünülmektedir1. Acinetobacter baumannii izolatlarında en sık görülen beta-laktam direnci, beta-laktamaz varlığına bağlıdır2. Beta-laktamazlar içinde en önemlisi, serin oksasilinazlar (Ambler sınıf D: OXA tipleri) ve metallo-beta-laktamazları da (Ambler sınıf B: IMP, VIM, SIM, NDM metallo-beta-laktamazlar) içeren karbapenemazlardır2. Metallo-beta-laktamazlar (MBL), sınıf B beta-laktamazlar olup aztreonam dışında karbapenemler de dahil tüm beta-laktamları hidrolize edici kapasiteye sahiptir. A.baumannii izolatlarında tanımlanan MBL'ler OXA tipi karbapenemazlardan daha az görülmesine karşın karbapenemleri hidrolize edici etkileri 100-1000 kat daha güçlüdür2. PER-1 içeren A.baumannii izolatları ise penisilinlere ve geniş spektrumlu sefalosporinlere yüksek derecede dirençlidir ve Türkiye'de oldukça yaygındır3. Karbapenem direnci, Acinetobacter enfeksiyonlarında tedavi seçeneklerini oldukça kısıtlamış ve tedavide son seçenek olarak kabul edilen polimiksinler sıklıkla kullanılmaya başlanmıştır.
Son yıllarda, dirence neden olan genlerin özel bir bölgeye özgül rekombinasyon mekanizması ile bakteri genomuna entegre olabilen ve bakteriden bakteriye direnç genlerinin geçişinde rol oynayan hareketli DNA elemanlarının varlığı saptanmıştır4. İntegron adı verilen bu hareketli DNA elemanları plazmidler veya transpozonlar üzerinde bulunabilmektedir. Antibiyotiklere karşı olan direncin, izolatlar arasındaki epidemiyolojik yayılma potansiyelinin integronlar aracılığıyla olduğu düşünülmüştür5. İntegronların yapısında bulunan integraz geninin polimeraz zincir reaksiyonu (PCR) yöntemiyle saptanabilmesi A.baumannii izolatlarının epidemik potansiyelini ortaya koymada hızlı ve basit bir teknik olarak görünmektedir5.
Çalışmamızda, A.baumannii'nin sahip olduğu direnç mekanizmalarına yönelik saptanabilecek verilerin hastanemizde ileriye yönelik araştırmalar ve tedavi yöntemleri açısından yararlı olabileceğinden yola çıkılarak; laboratuvarımızda farklı klinik örneklerden elde edilen izolatların antibiyotik duyarlılıklarının ve beta-laktam direncine neden olan mekanizmaların moleküler yöntemlerle belirlenmesi ve izolatlar arasındaki ilişkinin pulsed-field jel elektroforezi (PFGE) ile gösterilmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
İzolatlar, Tanımlama ve Antibiyotik Duyarlılık Testleri
Çalışmaya, Ankara Üniversitesi Tıp Fakültesi İbn-i Sina Hastanesi Merkez Bakteriyoloji Laboratuvarına Nisan 2010-Aralık 2011 tarihleri arasında, çeşitli servislerde (reanimasyon, acil servis, nöroşirürji, genel cerrahi, nöroloji, postoperatif cerrahi, üroloji, nefroloji, dermatoloji, fizik tedavi ve rehabilitasyon, gastroenteroloji, göğüs cerrahi, kardiyoloji, ortopedi, transplantasyon) yatan hastalardan gönderilen örneklerden izole edilen 201 A.baumannii suşu dahil edildi. Klinik örnekler %5 kanlı agar ve EMB (Eosin Methylene Blue) agara ekilerek 37°C'de 18-24 saat inkübe edildi. Kültürde üreyen mikroorganizmaların cins ve tür düzeyinde tayinleri Vitek 2 (bioMérieux, Fransa) ve Phoenix BD (Becton Dickinson, ABD) cihazlarıyla üreticilerin talimatlarına göre yapıldı. Gönderilen 56 örnek Vitek 2 (Nisan-Ekim 2010), 145 örnek Phoenix (Kasım 2010-Aralık 2011) sistemiyle tanımlandı.
İzolatların amikasin, siprofloksasin, tetrasiklin, sulbaktam/ampisilin, trimetoprim/sülfametoksazol (TMP-SMZ), seftazidim, gentamisin, imipenem, levofloksasin, meropenem, piperasilin/tazobaktam, sefoperazon/sulbaktam, sefepim ve kolistine karşı duyarlılıklarının saptanması yine Vitek 2 ve Phoenix BD cihazları ile üreticilerin talimatlarına uygun olarak yapıldı. Kolistine dirençli izolatların duyarlılık testleri, E-test (AB Biodisk, İsveç) yöntemi ile tekrarlandı. Elde edilen minimum inhibitör konsantrasyonu (MİK) değerlerinin yorumları CLSI kriterlerine göre (≤ 2 μg/ml duyarlı, ≥ 4 μg/ml dirençli) yapıldı6. A.baumannii olarak tanımlanan suşların blaOXA-51 genleri PCR ile araştırılarak doğrulaması yapıldı7.
Direnç Genleri ve İntegron Varlığının Gösterilmesi
PCR ile blaOXA-23, blaOXA-24, blaOXA-51 ve blaOXA-58 genlerinin saptanması, önceden tanımlandığı şekilde yapıldı8. MBL genlerinin varlığı, blaIMP, blaVIM, blaSIM ve blaNDM-1 için özgül primerler kullanılarak araştırıldı9,10. İntegron varlığı 5'CS ve 3'CS primerleri kullanılarak tespit edildi11. blaPER-1 PCR, özgül primerlerle önceden tanımlandığı şekilde uygulandı12.
Moleküler Tiplendirme
PFGE analizi ApaI enzimi kullanılarak önceden tarif edildiği şekilde yapıldı13. Bant profilleri Gene Directory (Syngene, İngiltere) programı kullanılarak analiz edildi. UPGMA (Unweighted pair group method with mathematical averaging) yöntemi ve Dice benzerlik katsayısı ile %1 tolerans değeri kullanılarak dendrogram oluşturuldu ve kümelenme analizi yapıldı. Analizde %90-100 uyum gösteren izolatlar aynı; %80-90 arası uyum gösterenler yakın ilişkili; %70-80 arası uyum gösterenler muhtemel ilişkili ve %70'in altında uyum gösterenler ise ilişkisiz olarak değerlendirildi14.
İstatistiksel Analiz
Çok ilaca dirençli izolatlarda sınıf 1 integronlar ve antibiyotik direnci arasındaki ilişki, integron ve PER-1 içeren izolatların genotiplere dağılımı SPSS programı kullanılarak ki-kare testi ile araştırıldı.
BULGULAR
Çalışmaya dahil edilen 201 Acinetobacter suşu 160 hastadan (104 erkek, 56 kadın) izole edilmiş olup, 128'i A.baumannii, 73'ü A.baumannii-A.calcoaceticus kompleks olarak tanımlanmıştır. İzolatlar en çok trakeal aspirat (%35.3), kan (%27.3) ve apse (%18.4) örneklerinden elde edilmiştir. A.baumannii suşlarının en sık izole edildiği servisler reanimasyon (108/201; %53.7) ve acil servis (29/201; %14.4) olmuş, bunları nöroşirürji (25/201;%12.4) ve genel cerrahi klinikleri (13/201; %6.7) izlemiştir.
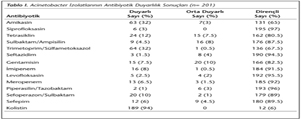
Tüm izolatlara karşı en etkili antibiyotiğin %94 duyarlılık oranı ile kolistin olduğu tespit edilmiş; kolistine dirençli izolatlar E-test yöntemiyle tekrar değerlendirildiğinde tümü (n= 12) dirençli bulunmuştur (9'unda MİK > 32 μg/ml, 3'ünde MİK > 16 μg/ml). On bir izolat dışında Acinetobacter suşlarının antibiyotiklere çoklu ilaç direnci gösterdiği saptanmıştır. İzolatların, test edilen antibiyotiklere karşı duyarlılık oranları Tablo I'de görülmektedir.
Duyarlılık oranları yıllara göre değerlendirildiğinde; kolistin ve amikasinin 2010 yılında çalışılan 32 izolatın tümüne etkili olduğu izlenirken, 2011 yılında kolistinin 125, TMP-SMZ'nin 58 izolata etkili olduğu belirlenmiş; 6 izolat kolistin dahil bütün antibiyotiklere dirençli bulunmuştur. BD Phoenix sistemi ile tanımlanan bu 6 izolatın 3'ü Haziran, 2'si Ekim, 1'i ise Kasım ayında gönderilen örneklerden elde edilmiştir.
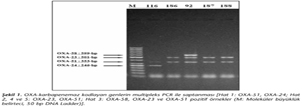
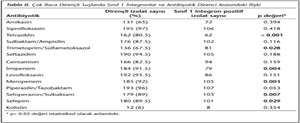
Direnç genlerinin analizinde; bütün izolatların (%100) blaOXA-51 geni taşıdığı görülmüş; 184 (%91.5)'ünün blaOXA-23, 7 (%3.5)'sinin blaOXA-58 ve 2 (%1)sinin blaOXA-24 genine sahip olduğu belirlenmiştir (Şekil 1). Örneklerin hiçbirinde blaIMP, blaVIM, blaSIM, blaNDM genleri saptanamamıştır. Tek başına blaOXA-51 içeren (diğer OXA genlerini içermeyen) 12 izolat bulunmuş; bu izolatların hiçbirinin fenotipik olarak imipenem veya meropeneme dirençli olmadığı gözlenmiştir. İmipenem ve meropeneme dirençli izolatlara bakıldığında, blaOXA-51'in yanında mutlaka oksasilinazları kodlayan diğer genlerden bir veya birkaçının olduğu görülmüştür. İzolatların 112 (%55.7)'si gen kasetleriyle birlikte sınıf 1 integron içermektedir. Çoklu ilaç direnci gösteren izolatlarda, integron taşıyıcılığı ve antibiyotik direnci arasındaki ilişkinin istatistiksel değerlendirmesinde; tetrasiklin, TMP-SMZ, imipenem, meropenem, sefoperazon/sulbaktam ve sefepim direnci ile integron taşıyıcılığı arasında anlamlı ilişki bulunmuştur (Tablo II). Suşların 42 (%21)'si blaPER- 1 pozitif olarak saptanmış olup, hepsi seftazidime dirençlidir.
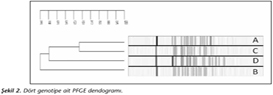
Moleküler tiplendirme sonuçları incelendiğinde, PFGE ile izolatların dört genotip altında kümelendiği görülmüş; genotip A'da 29 (%14.4), genotip B'de 23 (%11.4), genotip C'de 18 (%8.9) ve genotip D'de 7 (%3.4) izolat yer almıştır. Bu gruplara ait izolatların birbirleriyle olan benzerliği %70'in altında bulunmuş, baskın izolata rastlanmamış ve salgın izolatı olarak değerlendirilmemişlerdir (Şekil 2). Yirmi izolat genotip A ile 1-3 (A1), 6 izolat ise 4-6 bant farklı bulunurken (A2); 21 izolat genotip B ile 1-3 (B1), 4 izolat ise 4-6 bant farklıdır (B2). Dört izolat genotip C ile 1-3 (C1), 3 izolat ise 4-6 bant farklı bulunurken (C2); dört izolat genotip D ile 1-3 (D1) bant farklı olarak bulunmuştur. Yirmi beş izolat bahsedilen hiçbir grup ile benzer bant içermemektedir. 2010 yılındaki izolatlar içerisinde genotip A'ya rastlanmamıştır.
Kolistine dirençli izolatların genotipik özellikleri değerlendirildiğinde, %83'ünün genotip A ve A1'e ve hepsinin 2011 yılına ait olduğu görülmüştür. Genotip A'daki kolistine dirençli 4 suş, dört farklı hastadan, 25 Ekim-17 Kasım 2011 tarihleri arasında, acil ve reanimasyon servislerinden gönderilen kan ve trakeal aspirat kültürlerinden izole edilmiştir. Genotip A1'deki 6 suştan 4'ünün 22 Mayıs-29 Haziran arasında reanimasyon servisinden gönderilen kan ve trakeal aspirat kültürlerinden; 2'sinin 14 Ekim-22 Ekim arasında acil ve postoperatif cerrahi servisinden gönderilen kan ve apse kültürlerinden izole edildiği belirlenmiştir. Kolistine dirençli diğer iki suş, nisan ayında aynı hastadan gönderilen iki farklı BOS örneğinden izole edilmiş olup herhangi bir genotip grubuna ait bulunmamıştır.
Sınıf 1 integron gen kasetleri ile PFGE paternleri arasındaki ilişkiye bakıldığında, genotip A'da 15, genotip B'de 19, genotip C'de 9, genotip D'de 3, identik banda sahip olmayan grupta ise 10 izolatın gen kaseti içerdiği saptanmıştır. Sınıf 1 integron içeren izolatların genotiplere göre dağılımı arasında istatistiksel olarak anlamlı bir fark bulunmamıştır (p= 0.068).
TARTIŞMA
Yoğun bakım üniteleri hastane enfeksiyonlarının en sık görüldüğü birimlerdir ve buna paralel olarak Acinetobacter enfeksiyonları da en sık yoğun bakım ünitelerinde görülmektedir. Yapılan çok merkezli bir çalışmada Çiftci ve arkadaşları15 Acinetobacter suşlarının en fazla (%90.3) yoğun bakım ünitesinde yatan hastalardan izole edildiğini bildirmişlerdir. Enfeksiyonlar sıklıkla kontamine nemlendiriciler ve ventilatör aksamından kaynaklanmakta olup, Acinetobacter spp. kan kültürleri ve trakeal aspirat örneklerinden izole edilmektedir16. Çalışmamızda da anesteziyoloji ve reanimasyon yoğun bakım ünitesi %53.7 oranı ile A.baummannii'nin en sık izole edildiği servis olmuş; 71 izolat (%35.3) trakeal aspirat, 55 izolat (%27.3) kan ve 37 izolat da (%18.4) apse/yara örneklerinden izole edilmiştir.
A.baumannii'nin antimikrobiyal duyarlılık oranları farklılıklar göstermekte, sıklıkla beta-laktam antibiyotikler, aminoglikozidler ve florokinolonlara direnç görülmektedir17. Çalışmamızda en fazla florokinolon (siprofloksasine %97, levofloksasine %95.5) ve piperasilin/tazobaktam (%96) direnci görülmüştür. Ülkemizde yapılan çeşitli çalışmalarda, A.baumannii için direnç oranları imipenem için %63, siprofloksasin için %32-87, amikasin için %41-70, sefepim için %46-93.3, ofloksasin için %58, gentamisin için %62-87, TMP-SMZ için %63-75, piperasilin/tazobaktam için %44.1-100, seftriakson için %77-85, piperasilin için %77.5-100, ampisilin/sulbaktam için %65-92.5 olarak bildirilmiştir18,19,20. Çalışmamızda seftazidim, sefepim, ampisilin/sulbaktam ve piperasilin/tazobaktam için direnç oranları sırasıyla; %94.5, %89.5, %87.5 ve %96 olarak bulunmuştur. Üçüncü kuşak sefalosporinlere bu kadar yüksek düzeyde direnç olması, bu antibiyotiklerin toplumda ve hastanede çok yaygın kullanımlarına bağlı olabilir. Bu sonuçlara göre elde edilen direnç oranları, ülkemizde yapılan çeşitli çalışmalardaki üst yüzdelere daha yakın görünmektedir18,19,20.
Çalışmamızda, izolatların %91.5'inin blaOXA-23, %3.5'inin blaOXA-58 ve %1'inin blaOXA-24 geni taşıdığı belirlenmiştir. Türkiye'de yapılan çeşitli çalışmalarda blaOXA-23 ve blaOXA-58 farklı oranlarda saptanmıştır. Gür ve arkadaşları21, Ergin ve arkadaşları22 ile Çiftci ve arkadaşları15 blaOXA-23 genini baskın olarak saptamışken, Külah ve arkadaşları23 blaOXA-58 genini baskın olarak bulmuş, blaOXA-23 ve blaOXA-24 saptayamamıştır. Ayrıca bu çalışmalarda farklı merkezlerin farklı oranlar bildirdiği ve blaOXA-23 görülme oranının son yıllarda arttığı belirtilmektedir. Çalışmamızla da uyumlu olan bu bulgu, blaOXA-23 geninin yaygınlaştığının bir göstergesi olabilir. A.baumannii blaOXA-51 benzeri genlerin sıklıkla kazanılmış blaOXA tipi genlerle birlikte bulunduğu ve uygun koşullarda karbapenem direncinde, en azından sinerjik rolü olabileceği öne sürülmüştür8. Çalışmamızda da benzer şekilde tek başına blaOXA-51 bulunan (diğer OXA genleri bulunmayan) izolatların tamamı (n= 12) imipenem ve meropeneme duyarlı veya orta duyarlı bulunmuştur. Bu izolatlar, beraberinde OXA genlerinden bir veya birkaçını bulundurduğunda imipenem ve meropeneme dirençli hale gelmişlerdir.
PCR analizi ile MBL varlığını saptamak güvenilir bir yöntem olmasına rağmen, her zaman geni saptayamadığına dair yayınlara da rastlamak mümkündür24. Aktaş ve arkadaşları25, 28 P.aeruginosa ve 11 A.baumannii klinik izolatında değişik fenotipik yöntemlerle %0-100 arasında değişen oranlarda MBL pozitifliği saptarken, blaVIM/IMP varlığını hiçbir izolatta gösterememişlerdir. Eser ve arkadaşları26, fenotipik olarak MBL pozitif olan 64 izolatta blaIMP-1 ve blaVIM-2 gen varlığını PCR ile araştırmış ve tüm izolatları negatif bulmuşlardır. Ankara'da yapılan başka bir çalışmada, imipeneme dirençli 79 Acinetobacter izolatının E-test ile %51.9'unun, kombine disk sinerji testi ile %58.2'sinin, çift disk sinerji testi ile %55.7'sinin, modifiye Hodge testi ile %69.6'sının MBL ürettiği saptanmış, PCR yöntemiyle blaIMP-1 geni araştırılmış, ancak pozitiflik bulunamamıştır27. Bizim çalışmamızda da, araştırılan 201 izolatta blaNDM-1, blaIMP, blaSIM ve blaVIM genleri saptanamamıştır. Fenotipik ve genotipik testler arasındaki bu tutarsızlık, karbapenem direncine neden olan başka genlerin veya araştırılan mekanizmaların dışında farklı bir enzimatik yolun bulunması nedeniyle olabilir. Yapılan çalışmalarda PCR için kullanılan farklı primer dizilimleri de sonuçları etkilemiş olabilir. MBL üretiminin gösterilmesi için genotipik testlerin yapılması daha güvenilir olacaktır.
Her ne kadar A.baumannii'de en sık görülen beta-laktam direnci beta-laktamaz varlığına bağlı olsa da, çalışmamızdaki örneklerin sahip olduğu, karbapenemleri de içeren yüksek düzeyde beta-laktam direncini sadece enzimatik mekanizmalar ile açıklamak mümkün olmamıştır. Bu organizmanın karmaşık doğasına uygun olarak, aynı fenotipi oluşturmak üzere birçok mekanizmanın bir arada çalışabileceği bildirilmektedir28. Hujer ve arkadaşlarının29 yaptığı çalışmada, IMP, VIM ve GIM MBL'lere bakılmış ancak yüksek düzeyde karbapenem direncine ait bir kanıt bulunamamış ve çalışmaya dış membran proteinlerine yönelik olarak devam edilmesi önerilmiştir. Benzer şekilde, bizim çalışmamızda da karbapenemleri de içeren beta-laktam direncinden enzimatik mekanizmalarla beraber dış membran proteinleri ve atım pompa sistemlerinin sorumlu olabileceğini düşünmekteyiz.
PER-1 taşıyan A.baumannii izolatları penisilinlere ve geniş spektrumlu sefalosporinlere yüksek düzeyde dirençlidir. Çalışmamızda 201 örneğin %21'inde blaPER-1 pozitif olarak saptanmıştır. Bu oran, ülkemizdeki sonuçlara yakın görülmektedir3. PER-1 taşıyan izolatların hepsi (n= 42) seftazidime dirençlidir. Genotip dağılımına bakıldığında, genotip C'de istatistiksel olarak anlamlı kümeleşme görülmüştür (p= 0.001). Genotip C'ye ait (n= 18) 13 suş, Nisan-Eylül 2010 tarihleri arasında izole edilmiştir. Seftazidime dirençli izolatlarda PER-1 taşıyıcılığının da araştırıldığı çeşitli çalışmalarda, klonal ilişkili izolatların seftazidim direncinde rolü olabileceği ve PER-1 taşıyan izolatların yüksek mortalite ile ilişkili olduğu belirtilmektedir30,31. Saptadığımız seftazidim direncinden genotip C'deki izolatlar sorumlu olabilir; ancak bu izolatların mortaliteye olan katkısına bakmak için ileri araştırmalara ihtiyaç vardır.
Acinetobacter türlerinde sınıf 1 integron varlığı oldukça yaygındır. Çalışmamızda sınıf 1 integron pozitifliği %55.7 oranında bulunmuştur. Yüksek integron taşıyıcılığı, hastanemizdeki klinik örneklerden elde edilen çok ilaca dirençli A.baumannii izolatlarının yayılım potansiyelini göstermesi açısından önemlidir. Acinetobacter'deki integron varlığının beta-laktam, aminoglikozid, kloramfenikol, trimetoprim ve rifampisin direncinde rol oynayabileceği ifade edilmiştir5. TMP-SMZ direncine neden olan genlerin (dhfr) integronlar üzerinde taşındığı bilinmektedir32. Çalışmamızda bütün izolatlar içinde TMP-SMZ'ye duyarlı izolat sayısı 64 (%31) iken, integron içeren izolatlarda duyarlı izolat sayısı 28 (%25)'dir. TMP-SMZ direnci ile sınıf 1 integron taşıyıcılığı arasındaki ilişki istatistiksel olarak anlamlı bulunmuştur (p= 0.028).
A.baumannii salgınlarının araştırılmasında kullanılan PFGE yöntemi, günümüzde epidemiyolojik tiplendirme için altın standart olarak tanımlanmaktadır. Çalışmamızda 2010 yılında genotip C ve D'ye ait izolatlar baskın durumda iken, 2011 yılında genotip A ve B baskın hale geçmiştir. 2011 yılında görülen SXT duyarlılığından büyük ölçüde genotip A ve B'deki izolatlar sorumludur. Genotip A izolatlarının %62.1i, genotip B izolatlarının ise %43.5'i TMP-SMZ'ye duyarlıdır.
Kolistin direnciyle ilgili mekanizmalar ve direncin bakteriler arasında genetik olarak geçiş yolları tam olarak aydınlatılmış değildir. Çalışmamızda otomatize sistemler ile dirençli bulunan izolatlar E-test yöntemiyle tekrar değerlendirilmiş ve tüm izolatlar dirençli saptanmıştır. Bu izolatların %83'ü genotip A ve A1'e, ayrıca bütün kolistine dirençli izolatlar da 2011 yılına aittir. Çetin ve arkadaşlarının33 yaptıkları çalışmada da, bizim çalışmamızdakine benzer şekilde yüksek düzeyde kolistin direnci (%12.1) saptanmıştır. 2011 yılında kolistin direncindeki artışın nedeni, kliniklerde sıklıkla kullanılmaya başlanması olabilir. Antibiyotik duyarlılıklarındaki bu değişikliğin, kliniklerde belirlenmiş antibiyotik tedavi protokolleriyle olan ilişkisini saptamak ve kolistin direncini tam olarak aydınlatabilmek için ileri araştırmalara ihtiyaç vardır.
Çalışmamız, hastanemizde A.baumannii izolatlarının moleküler özelliklerinin ortaya konması açısından bir başlangıç olma niteliğindedir. Bundan sonra bu bakteri ile yapılacak ileri düzey çalışmalar ile; epidemiyolojik veriler, dirence neden olan mekanizmalar ve risk faktörleri daha iyi ortaya konabilecek ve böylece özellikle yoğun bakım ünitelerinde enfeksiyon kontrolünün ve tedavi protokollerinin daha etkin ve verimli olarak gerçekleştirilebilmesine olanak sağlanabilecektir.
KAYNAKLAR
- Hanlon GW. The emergence of multidrug resistant Acinetobacter species: a major concern in the hospital setting. Lett Appl Microbiol 2005; 41(5): 375-8.
- Poirel L, Nordmann P. Carbapenem resistance in Acinetobacter baumannii: mechanisms and epidemiology. Clin Microbiol Infect 2006; 12(9): 826-6.
- Kolayli F, Gacar G, Karadenizli A, Sanic A, Vahaboglu H; Study Group. PER-1 is still widespread in Turkish hospitals among Pseudomonas aeruginosa and Acinetobacter spp. FEMS Microbiol Lett 2005; 249(2): 241-5.
- Levesque C, Piche L, Larose C, Roy PH. PCR mapping of integrons reveals several novel combinations of resistance genes. Antimicrob Agents Chemother 1995; 39(1): 185-91.
- Gaur A, Prakash P, Anupurba S. Possible role of integrase gene polymerase chain reaction as an epidemiological marker: study of multidrug-resistant Acinetobacter baumannii isolated from nosocomial infections. Int J Antimicrob Agents 2007; 29(4): 446-50.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twentieth Informational Supplement, M100-S23, 2013. CLSI, Wayne, PA.
- Turton JF, Woodford N, Glover J, et al. Identification of Acinetobacter baumannii by detection of the blaOXA51-like carbapenemase gene intrinsic to this species. J Clin Microbiol 2006; 44(8): 2974-6.
- Woodford N, Ellington MJ, Coelho JM. Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp. Int J Antimicrob Agents 2006; 27(4): 351-3.
- Mostachio AK, Van der Heidjen I, Rossi F, Levin AS, Costa SF. Multiplex PCR for rapid detection of genes encoding oxacillinases and metallo-beta-lactamases in carbapenem-resistant Acinetobacter spp. J Med Microbiol 2009; 58(Pt 11): 1522-4.
- Nordmann P, Poirel L, Toleman MA. How to detect NDM-1 producers. J Clin Microbiol 2011; 49(2): 718-21.
- Koeleman JG, Stoof J, Van der Bijl MW, et al. Identification of epidemic strains of Acinetobacter baumannii by integrase gene PCR. J Clin Microbiol 2001; 39(1): 8-13.
- Naas, T, Bogaerts P, Bauraing C, et al. Emergence of PER and VEB extended-spectrum beta-lactamases in Acinetobacter baumannii in Belgium. J Antimicrob Chemother 2006; 58(1): 178-82.
- Dolapci I, Karahan ZC, Mumcuoglu I, et al. Investigation of presence of class 1 integrons in clinical isolates of carbapenem-resistant Acinetobacter baumannii. Mikrobiyol Bul 2010; 44(4): 547-52.
- Tenover F, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995; 33(9): 2233-9.
- Çiftci İH, Aşık G, Karakeçe E, et al. Distribution of blaOXA genes in Acinetobacter baumannii strains: a multicenter study. Mikrobiyol Bul 2013; 47(4): 592-602.
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clin Microbiol Rev 2008; 21(3): 538-82.
- Weinbren MJ, Johnson AP, Kaufmann ME, Livermore D. Acinetobacter spp. isolates with reduced susceptibilities to carbapenems in a UK burns unit. J Antimicrob Chemother 1998; 41(5): 574-6.
- Arda B, Yamazhan T, Ulusoy S, Özinel MA. Yoğun bakım ünitelerinden izole edilen non-fermentatif gram negatif bakterilerin antibiyotik duyarlılığındaki 4 yıllık değişim (1995-1999). Ankem Derg 2000; 14(2): 153.
- Tatman Otkun M, Gürcan Ş, Özer B, Türe M. Nozokomiyal Acinetobacter baumannii kökenlerinde 1994'den 2000'e yıllık antibiyotik direnç değişimi. ANKEM 2003; 17(1): 1-6.
- Yaylı G, Aksoy S. Hastane infeksiyonlarından izole edilen Acinetobacter suşlarının antibiyotiklere duyarlılıkları. Türk Mikrobiyol Cem Derg 2003; 33(1): 61-3.
- Gür D, Korten V, Ünal S, et al. Increasing carbapenem resistance due to the clonal dissemination of oxacillinase (OXA-23 and OXA-58)-producing Acinetobacter baumannii: report from the Turkish SENTRY Program sites. J Med Microbiol 2008; 57(12): 1529-32.
- Ergin A, Hasçelik G, Eser OK. Molecular characterization of oxacillinases and genotyping of invasive Acinetobacter baumannii isolates using repetitive extragenic palindromic sequence-based polymerase chain reaction in Ankara between 2004 and 2010. Scand J Infect Dis 2013; 45(1): 26-31.
- Kulah E, Mooij MJ, Comert F, et al. Characterisation of carbapenem-resistant Acinetobacter baumannii outbreak strains producing OXA-58 in Turkey. Int J Antimicrob Agents 2010; 36(2): 114-8.
- Gibb A, Tribudharat C, Moore R, et al. Nosocomial outbreak of carbapenem-resistant Pseudomonas aeruginosa with a new blaIMP allele, blaIMP-7. Antimicrob Agents Chemother 2002; 46(1): 255-8.
- Aktaş Z, Kayacan CB. Investigation of metallo-beta-lactamase producing strains of Pseudomonas aeruginosa and Acinetobacter baumannii by E-test disk synergy and PCR. Scand J Infect Dis 2008; 40(4): 320-5.
- Eser ÖK, Ergin A, Hasçelik G. Erişkin hastalardan izole edilen türlerinde antimikrobiyal direnç ve metallo-beta-laktamaz varlığı. Mikrobiyol Bul 2009; 43(3): 383-90.
- Ulusoy Al M, Mumcuoğlu İ, Aksu N ve ark. İmipenem dirençli Acinetobacter suşlarında metallo-beta-laktamaz üretiminin fenotipik ve genotipik yöntemlerle araştırılması. Türk Mikrobiyol Cem Derg 2011; 41(1): 29-36.
- Fernandez-Cuenca F, Martinez-Martinez L, Conejo MC, et al. Relationship between beta-lactamase production, outer membrane protein and penicillin-binding protein profiles on the activity of carbapenems against clinical isolates of Acinetobacter baumannii. J Antimicrob Chemother 2003; 51(3): 565-74.
- Hujer KM, Hujer AM, Hulten EA, et al. Analysis of antibiotic resistance genes in multidrug-resistant Acinetobacte sp. isolates from military and civilian patients treated at the Walter Reed Army Medical Center. Antimicrob Agents Chemother 2006; 50(12): 4114-23.
- Vahaboğlu H, Coşkunkan F, Tansel O, et al. Clinical importance of extended-spectrum beta-lactamase (PER-1-type) producing Acinetobacter spp. and Pseudomonas aeruginosa strains. J Clin Microbiol 2001; 50(7): 642-5.
- Eraç B, Hoşgör-Limoncu M, Ermertcan Ş, et al. Prevalence of blaPER1 and integrons in ceftazidime-resistant gram-negative bacteria at a university hospital in Turkey. Jpn J Infect Dis 2013; 66(2): 146-8.
- Gu B, Tong M, Zhao W, et al. Prevalence and characterization of class I integrons among Pseudomonas aeruginosa and Acinetobacter baumannii isolates from patients in Nanjing, China. J Clin Microbiol 2007; 45(1): 241-3.
- Sesli Cetin E, Durmaz R, Tetik T, Otlu B, Kaya S, Çalışkan A. Epidemiologic characterization of nosocomial Acinetobacter baumannii infections in a Turkish university hospital by pulsed-field gel electrophoresis. Am J Infect Control 2009; 37(1): 56-64.
İletişim (Correspondence):
Uzm. Dr. Hakan Keskin,
Sinop Atatürk Devlet Hastanesi
Mikrobiyoloji Laboratuvarı,
Osmaniye Köyü Mevki, Sinop, Türkiye.
Tel (Phone): +90 368 271 5570-1145,
E-posta (E-mail): hknkskn81@yahoo.com