Atovakuon ve Astragalus Kombinasyonunun Akut Toksoplazmozlu Fare Modeli Tedavisi ve
IL-2, IL-12, IFN-γ Düzeyleri Üzerindeki Etkileri
Effects of Atovaquone
and Astragalus Combination on the Treatment and IL-2, IL-12, IFN-γ Levels on
Mouse Models of Acute Toxoplasmosis
Neşe SÖNMEZ1, Özden BÜYÜKBABA BORAL1, Kamber KAŞALİ2, Fatma TEKELİ3
1 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
1 Istanbul University Istanbul Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
2 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Biyoistatistik ve Tıp Bilişimi Anabilim Dalı, İstanbul.
2 Istanbul University Istanbul Faculty of Medicine, Department of Biostatistics and Medical Informatics, Istanbul, Turkey.
3 İstanbul Üniversitesi İstanbul Tıp Fakültesi, Deney Hayvanları Biyolojisi ve Biyomedikal Uygulama Teknikleri Anabilim Dalı,
İstanbul.
3 Istanbul University Istanbul Faculty of Medicine, Department of Experimental Animals Biology and
Biomedical Practice Techniques, Istanbul, Turkey.
ÖZET
Toxoplasma gondii, immün sistemi baskılanmış kişiler ile AIDS hastalarında reaktivasyonlara ve toksoplazmik ensefalit gibi ciddi klinik tablolara neden olabilmektedir. Yüksek riskli hasta gruplarında toksoplazmoz tedavisinde çeşitli protokoller uygulanmakla birlikte, özellikle AIDS hastalarında reaktivasyon riski nedeniyle profilaksiye hayat boyu devam edilmesi, istenmeyen etkilere yol açabilmektedir. Atovakuon, yan etkileri az ve toksoplazmoza karşı etkili olduğu bilinen antiprotozoal bir ajandır. Diğer taraftan, immünomodülatör ve antimikrobiyal etkilere sahip olduğu bilinen Astragalus membranaceus kök ekstresinin (AmE), başta makrofajlar olmak üzere fagositer hücrelerin proliferasyon ve aktivasyonunu artırmak ve Th1 tipi yanıtı indüklemek suretiyle immün sistemi güçlendirdiği gösterilmiştir. Bu çalışmada, deneysel olarak T.gondii ile enfekte edilen farelerde, atovakuon ile AmE'nin ayrı ayrı ve kombine olarak uygulanmasının tedavideki etkinliğinin ve IL-2, IL-12, IFN-γ düzeyleri üzerindeki etkilerinin araştırılması amaçlanmıştır. Bunun için, Hayvan Deneyleri Etik Kurulu onayı ile her biri sekiz BALB/c tipi fareden oluşan dört deney grubu oluşturulmuş ve tüm fareler T.gondii RH suşu ile enfekte edilmiştir. Enfeksiyon, farelere 2 x 104/ml trofozoit içeren süspansiyondan intraperitoneal enjeksiyon yolu ile 0.5 ml verilerek oluşturulmuştur. Enfeksiyondan 24 saat sonra, kontrol grubu dışında, atovakuon grubuna 100 mg/kg/gün atovakuon; astragalus grubuna 0.075 mg/g AmE; atovakuon + astragalus (Ato + Astra) grubuna ise 100 mg/kg/gün atovakuon ve 0.075 mg/gr AmE birlikte oral gavaj yolu ile verilmiş ve bu uygulamalara yedi gün süreyle devam edilmiştir. Sekizinci günde tüm fareler uyutularak periton sıvıları alınmış ve Thoma lamında sayım yapılarak 1 ml'deki trofozoit sayıları belirlenmiştir. Ayrıca hayvanların kalp kanları alınarak, serum örneklerinde IL-2, IL-12 ve IFN-γ düzeyleri ticari ELISA (eBioscience, Avusturya) kitleri kullanılarak belirlenmiştir. Ato + Astra kombinasyon grubunda saptanan ortalama trofozoit sayısı; kontrol, atovakuon ve astragalus gruplarındaki trofozoit sayılarına göre anlamlı düzeyde düşük bulunmuştur (p< 0.05). Aynı zamanda atovakuon ve astragalus gruplarındaki trofozoit sayıları da kontrol grubuna göre anlamlı derecede düşüktür (p< 0.05). Astragalus grubunun IL-2 düzeyi, atovakuon, Ato + Astra ve kontrol gruplarına göre anlamlı derecede yüksek bulunurken (p< 0.05); Ato + Astra grubunun IL-2 düzeyi diğer üç gruba göre anlamlı ölçüde düşük olarak saptanmıştır (p< 0.05). Atovakuon, astragalus ve kontrol gruplarının IL-12 düzeyleri; Ato + Astra kombinasyon grubuna göre anlamlı düzeyde yüksek olarak izlenmiştir (p< 0.05). IFN-γ düzeyleri değerlendirildiğinde ise; atovakuon ve Ato + Astra gruplarındaki IFN-γ düzeylerinin kontrol grubuna göre anlamlı derecede yüksek olduğu belirlenmiştir (p< 0.05). Ulaşılabilen literatür taramaları ışığında, akut toksoplazmozun tedavisinde atovakuon + AmE kombinasyonu etkinliğinin incelendiği ilk araştırma olan çalışmamızın bulguları, bu iki madde arasında bir sinerji olduğu fikrini vermiştir. Sonuç olarak, bulgularımızın yapılacak ileri araştırmalar ile desteklenmesi halinde, toksoplazmoz yönünden riskli olan AIDS gibi immün yetmezlikli hastalarda bu kombinasyonun tedavide denenme potansiyeli olabileceği düşünülmüştür.
Anahtar sözcükler: Toxoplasma gondii; Astragalus membranaceus; atovakuon; tedavi; IL-2; IL-12; IFN-γ.
ABSTRACT
Reactivation of Toxoplasma gondii infections and serious clinical manifestations such as encephalitis may develop in immunocompromised subjects and AIDS patients. Different protocols are used for the treatment of toxoplasmosis in high-risk patient groups, however life-long prophylactic therapy against reactivation risk in AIDS patients may lead to several undesired results. Atovaquone is an effective antiprotozoal agent against toxoplasmosis with minor side effects. On the other hand, Astragalus membranaceus root extract (AmE) has been shown to have immunomodulatory and antimicrobial activities, empowering immunity by enhancing proliferation and activation of phagocytic cells mainly macrophages, and inducing Th1 type immune response. The aim of this study was to investigate the effectiveness of atovaquone alone and in combination with AmE, in the treatment of toxoplasmosis, and on the levels of IL-2, IL-12 and IFN-γ in experimentally infected mice with T.gondii. For this purpose, four experimental groups, each consisting of eight BALB/c mice, were set with the approval of Ethics Committee for the Animal Experiments. All the mice were infected with 0.5 ml of a suspension containing 2 x 104/ml trophozoites prepared from T.gondii RH strain by intraperitoneal injection. Twenty-four hours after the infection, atovaquone (100 mg/kg/day) was given to atovaquone group, AmE (0.075 mg/g) to astragalus group and atovaquone (100 mg/kg/day) plus AmE (0.075 mg/g) to Atovaquone + Astragalus (Ato + Astra) group by oral gavage. The mice in the fourth group, which was the control group, were all infected but untreated. The above administrations were carried out for seven days. On the 8th day peritoneal fluids of mice were collected under anaesthesia and trophozoite numbers per 1 ml were detected by counting on the Thoma slide. In addition, the heart bloods of mice were drawn and IL-2, IL-12, IFN-γ levels were determined in serum samples by using commercial ELISA kits (eBioscience, Austria). The mean number of trophozoites in Ato + Astra group was found significantly lower than the number of trophozoites in the other three groups (p< 0.05). The number of trophozoites in the atovaquone and astragalus groups were found significantly lower than the number of trophozoites in the control group (p< 0.05). There was a significant increase in IL-2 levels of astragalus group compared with the other three groups, in addition when IL-2 levels of Ato + Astra group were compared with ones in other three groups, a significant decrease was noticed (p< 0.05). There was a definite increase in IL-12 levels of atovaquone, astragalus and the control groups compared to those in Ato + Astra group (p< 0.05). A significant increase was found in IFN-γ levels in atovaquone and Ato + Astra groups compared with those in the control group (p< 0.05). Within the reach of our literature survey, this study was the first research in which the effectiveness of the combination of atovaquone and AmE was investigated in the treatment of acute toxoplasmosis. The results of our study suggested that there might be a synergy between atovaquone and AmE in the treatment of acute toxoplasmosis. In case these results are supported by further studies, atovaquone and AmE combination may have a potential to be used for therapy in immunocompromized patients such as AIDS patients who have a risk for toxoplasmosis.
Key words: Toxoplasma gondii; Astragalus membranaceus; atovaquone; therapy; IL-2; IL-12; IFN-γ.
Geliş Tarihi (Received): 21.02.2014 • Kabul Ediliş Tarihi (Accepted): 11.09.2014
GİRİŞ
Toksoplazmoz, dünyada yaygın olarak bulunan Toxoplasma gondii'nin; insan, çeşitli memeli hayvanlar ve kuşlarda, nükleusu olan her hücreye yerleşebilmesiyle oluşan bir enfeksiyondur. Sağlıklı bireylerde T.gondii enfeksiyonlarının genellikle asemptomatik seyrettiği, bununla birlikte hastaların %10-20'sinde akut enfeksiyon şeklinde görüldüğü bilinmektedir1. Ülkemizin farklı merkezlerinde yapılan çalışmalarda seropozitiflik oranlarının %28.2-57.6 arasında değişkenlik gösterdiği saptanmıştır2-5. İnsana bulaşma; T.gondii doku kistleri içeren etlerin çiğ veya az pişmiş olarak yenilmesi, kedi dışkısıyla atılan ookistler ile kontamine su ya da gıdaların sindirim yoluyla alınmasıyla olur. Ayrıca hamilelik döneminde anneden fetüse konjenital olarak, tam kan tranfüzyonu, organ transplantasyonu gibi çok çeşitli yollarla da bulaş olabilir. İnsanda özellikle kas, göz ve beyin gibi organ ve dokularda doku kistleri ortaya çıkabilmektedir1. AIDS hastalarında ve immün yetmezliği olan hastalarda görülen toksoplazmoz ise toksoplazmik ensefalite neden olmakta ve ölümle sonlanabilmektedir. İmmün yetmezlikli hastalarda reaktivasyona karşı kullanılan ve hayat boyu devam eden profilaksi, yan etkileri nedeniyle hastanın yaşam kalitesini bozmaktadır6.
Toksoplazmoza karşı konak savunmasında hücresel ve hümoral immün yanıt birlikte rol oynamakta ve hem insan hem de hayvanlarda akut toksoplazmoza karşı dirençte NK ve Th1 hücreleri ile antikorların önem taşıdığı bilinmektedir7. Bu hücrelerin etkileri; interlökin (IL)-1, IL-2, IL-12, interferon-gama (IFN-γ) ve tümör nekroz faktörü (TNF)-α gibi proinflamatuvar sitokinleri salgılamaları sonucu ortaya çıkar7,8. Yapılan çalışmalarda toksoplazmoza karşı en etkili sitokinin IFN-γ olduğu; IFN-γ etkisiyle IL-12, IL-2 ve IL-7 sitokinlerinin de indirekt olarak salgılandığı ve toksoplazmoza karşı koruyucu etkilerinin olduğu gösterilmiştir9.
Atovakuon günümüzde "anti-protozoal" etkisi için kullanılan naftakinon yapısında antiparaziter bir ajandır. Kemik iliği baskılanması veya gastrointestinal floranın bozulması gibi ciddi yan etkileri bildirilmemiştir ve oluşan yan etkilerin ise tedavi sürecinde kendiliğinden kaybolduğu rapor edilmiştir10. Güvenli bir profilinin olması, oral yolla kullanılabilmesi, hepatik metabolizasyonunun olmaması ve yüksek protein bağlanma özelliği önemli avantajları olarak görülmektedir11. Atovakuon, deney hayvanları üzerinde T.gondii trofozoitleri ile doku kistlerine karşı etkili bulunurken, primetamin, sülfadiazin, klindamisin gibi ilaçlarla kombine edildiğinde ise daha etkin olduğu belirlenmiştir12. Atovakuon ile kombine olarak kullanılan Astragalus membranaceus ise, geleneksel Çin tıbbında yüzyıllardır immün sistemi kuvvetlendirmek için kullanılan bir bitkidir13. Yapılan in vivo çalışmalarda A.membranaceus kök ekstresi (AmE)'nin immün sistemi indüklediği, lenfosit blastogenezine etki ettiği ve makrofaj aktivitesini artırdığı gösterilmiştir14. Bu çalışmada, deneysel olarak T.gondii ile enfekte edilen farelerde, atovakuon ve AmE'nin ayrı ayrı ve kombine edilerek uygulanması ile, enfekte farelerdeki trofozoit miktarı, IL-2, IL-12 ve IFN-γ düzeyleri üzerindeki etkilerinin araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmada kullanılan T.gondii RH suşu, Ankara Üniversitesi Tıp Fakültesi, Tıbbi Parazitoloji Bilim Dalından temin edildi. Soğuk zincirde laboratuvarımıza ulaşan T.gondii RH suşu süspansiyonu, çoğaltılmak ve canlılığının kontrolü için BALB/c tipi fare peritonuna inoküle edildi. Üç gün sonra eter ile sedatize edilen farenin periton sıvısı alındı; parazitin varlığı ve canlılığı ışık mikroskobunda kontrol edildi. T.gondii trofozoitlerini içeren periton sıvısı RPMI 1640 besiyerinde, %12 dimetil sülfoksit ve %20 fetal dana serumu (FCS) içeren saklama besiyerinde -80oC'de muhafaza edilerek, en az 3 ay canlılığını korudu14.
Deneylerde 20-25 g BALB/c dişi fareler kullanıldı. Fareler İstanbul Üniversitesi, DETAE, Deney Hayvanları Biyolojisi ve Biyomedikal Uygulama Teknikleri Anabilim Dalı, Hayvan Laboratuvarından temin edildi. Hayvanlar, 20-22oC'de, %50-60 nem oranında, 12 saat aydınlık 12 saat karanlık döngüye sahip ortamda, yem ve suları sağlanarak deney boyunca izlendi. Çalışma için İstanbul Üniversitesi, Hayvan Deneyleri Etik Kurulu'ndan 2011/147 karar numarasıyla onay alındı.
Çalışmadaki fareler, her grupta 8'er adet olacak şekilde dört gruba ayrıldı. 1. Grup: Atovakuon grubu; 2. Grup: Atovakuon + Astragalus (Ato + Astra) kombinasyon grubu; 3. Grup: Astragalus grubu ve 4. Grup: Kontrol grubu olarak adlandırıldı. Çalışma öncesinde, oda ısısına getirilen saklama besiyerinden 2 ml, BALB/c tipi 2 farenin peritonuna inoküle edildi ve trofozoitler üretildi. Pasajdan 72 saat sonra alınan periton sıvılarındaki trofozoitler, Thoma lamında sayılarak 2 x 104 trofozoit/ml olacak şekilde serum fizyolojik ile dilüe edildi ve bu süspansiyondan 0.5 ml periton içine enjekte edilerek tüm deney grubu farelerinde enfeksiyon oluşturuldu16-18.
Enfeksiyondan 24 saat sonra, kontrol grubu hariç diğer üç gruptaki farelere oral gavaj yoluyla, sırasıyla atovakuon, astragalus ve Ato + Astra kombinasyonu uygulandı. Tüm uygulamalara 7 gün boyunca, aynı saatte ve aynı yoldan devam edildi17,18. Atovakuon uygulaması (1. Grup); %0.25 (wt/vol) sodyum karboksi-metil selüloz ve %0.05 (wt/vol) Tween 20'de süspanse edilen ilacın (GlaxoSmithKline, İngiltere), 0.2 ml'de 100 mg/kg oranında verilmesiyle yapıldı17. Astragalus uygulaması (2. Grup); 0.2 ml'de 0.075 mg/g olacak şekilde ılık suda karıştırılarak süspanse edilen AmE'nin (Solgar, Türkiye) verilmesiyle yapıldı18. Ato + Astra kombinasyonu (3. Grup) ise, 100 mg/kg atovakuon 0.2 ml ve 0.075 mg/g AmE 0.2 ml olmak üzere uygulandı.
Yedi gün sonra tüm fareler eter ile sedatize edilerek göğüs ve periton boşlukları açıldı; kalp kanları ile periton sıvıları alındı. Kalp kanları, santrifüj edilerek serumları ayrıldı; ölçülü otomatik pipetle alınıp steril ependorflara konuldu ve -70oC'de saklandı. Periton sıvıları ise, 1 ml steril serum fizyolojik ile yıkanarak alındı ve Thoma lamında sayım yapılarak her farenin 1 ml periton sıvısında bulunan trofozoit sayısı hesaplandı16.
Hayvanların serum örneklerinde IL-2, IL-12 ve IFN-γ düzeyleri, ticari ELISA (eBioscience, Avusturya) kitleri kullanılarak üreticinin önerileri doğrultusunda araştırıldı. Sonuçlar, 620 nm dalga boyu referans alınarak 450 nm dalga boyunda ELISA okuyucusunda okutuldu. Her kitin içermiş olduğu standart örnek dilüsyonlarının absorbans değerleri ile test grubu örneklerinin absorbans değerleri orantılanarak, sitokin düzeyleri pikogram cinsinden hesaplandı.
İstatistiksel değerlendirme için, sürekli değişkenler olan trofozoit sayıları, IL-2, IL-12 ve IFN-γ değerlerinin normal dağılımına Shapiro-Wilk testiyle bakıldı; değişkenlerin normal dağıldığı belirlendi (p< 0.05). Tek yönlü Anova testiyle parametrik olarak değerlendirilen gruplardan en az biri diğerlerinden farklı bulundu (p< 0.05). Hangi gruplar arasında fark olduğunu belirlemek amacıyla Post Hoc ikili karşılaştırma testleri uygulandı. Tek yönlü Anova testlerinde yapılan homojenite incelemesinde varyansları homojen çıkmayan (p< 0.05) parametreler (trofozoit sayısı ve IL-2 grupları) için Post Hoc testlerinden Tamhane's T2; varyansları homojen çıkan (p> 0.05) parametreler (IL-12 ve INF- grupları) için Poct Hoc testlerinden Tukey HSD kullanıldı. İstatistiksel anlamlılık p< 0.05 olarak kabul edildi.
BULGULAR
Araştırmamızda, T.gondii RH suşu ile enfekte edildikten sonra atovakuon, AmE ve atovakuon + AmE kombinasyonu uygulanan üç ayrı tedavi grubu ile enfekte edilip tedavi yapılmayan kontrol grubu farelerinin periton sıvılarındaki ortalama trofozoit sayıları ve serumlarındaki IL-2, IL-12, IFN-γ düzeyleri karşılaştırılmıştır.
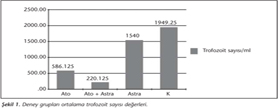
Ortalama trofozoit sayısı (OTS) değerlendirildiğinde, Ato + Astra grubunun OTS diğer üç gruba göre anlamlı derecede düşük (p< 0.05) bulunmuştur. Atovakuon grubu OTS, astragalus ve kontrol gruplarına göre anlamlı derecede düşük (p< 0.05) iken, astragalus grubunun OTS da kontrol grubuna göre anlamlı derecede düşük (p< 0.05) olarak tespit edilmiştir (Tablo I, Şekil 1).
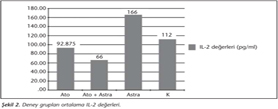
Kontrol grubunun IL-2 düzeyi, astragalus grubundan anlamlı derecede düşük (p< 0.05); Ato + Astra grubundan ise anlamlı derecede yüksek (p< 0.05) olarak saptanmıştır. Atovakuon grubunun IL-2 düzeyi, astragalus grubuna göre anlamlı derecede düşük (p< 0.05) düzeyde bulunurken Ato + Astra grubuna göre ise anlamlı derecede yüksek (p< 0.05) olduğu belirlenmiştir. Ato + Astra grubu IL-2 düzeyi ise diğer 3 deney grubuna göre anlamlı derecede düşüktür (p< 0.05) (Tablo II, Şekil 2).
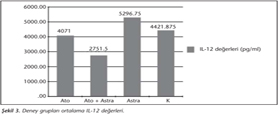
IL-12 düzeyleri incelendiğinde; kontrol grubunda IL-12 düzeyinin, sadece Ato + Astra tedavi grubuna göre anlamlı olarak yüksek (p< 0.05) olduğu görülmüş; astragalus grubunda IL-12 düzeyinin, atovakuon ve Ato + Astra gruplarına göre anlamlı derecede yüksek (p< 0.05) olduğu saptanmıştır. Atovakuon grubunun IL-12 düzeyi ise astragalus grubuna göre anlamlı ölçüde düşük (p< 0.05) iken, Ato + Astra grubuna göre anlamlı derecede yüksektir (p< 0.05). Atovakuon, astragalus ve kontrol gruplarının IL-12 düzeyleri de Ato + Astra kombinasyon grubuna göre anlamlı ölçüde yüksek bulunmuştur (p< 0.05) (Tablo III, Şekil 3).
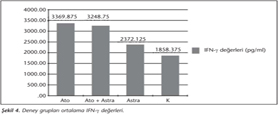
Kontrol grubunda saptanan IFN-γ düzeyinin, atovakuon ve Ato + Astra gruplarına göre anlamlı düzeyde düşük (p< 0.05); atovakuon grubu IFN-γ düzeyinin diğer üç gruba göre yüksek; astragalus grubunun IFN-γ düzeyinin ise atovakuon ve Ato + Astra tedavi gruplarına göre düşük olduğu tespit edilmiştir. Ato + Astra grubunun IFN-γ düzeyi ise sadece kontrol grubuna göre anlamlı derecede yüksektir (p< 0.05) (Tablo IV, Şekil 4).
TARTIŞMA
İmmün sistemi baskılanmış hastalarda toksoplazmoz genellikle santral sinir sisteminde reaktive toksoplazmoz şeklinde kendini gösterir10. İmmün yetmezlikli hastalarda reaktivasyonun en yaygın klinik göstergelerinden olan toksoplazmik ensefalit (TE), tedavi edilmediğinde öldürücü olmaktadır6. Avrupa'da yapılan bir çalışmada, AIDS ve toksoplazmoz pozitif olan hastaların %47'sinde TE görülmüştür12. AIDS ve TE hastalarında primetamin, sülfadiazin ve folinik asit klasik tedavi için veya klindamisin tedavi ve sekonder profilaksi için kullanılmaktadır. Ancak bazı hastalarda bu ilaçlara direnç görülebildiği, mevcut kombinasyonların kullanılmasında ise TE'li hastaların %5-15inde allerjik reaksiyonlar ya da hematolojik toksisitenin ortaya çıktığı gözlenmektedir6,10. AIDS hastalarında ve klasik toksoplazmoz tedavisine yanıt vermeyen hastalarda 750 mg atovakuon, günde 4 kez tablet formunda kullanılmış ve 6 hafta sonunda radyolojik görüntüler ile klinik tabloda iyileşmeler gözlemlenmiştir19. Bulgularımıza benzer şekilde; atovakuonun in vitro hücre kültüründe, T.gondii trofozoitlerine karşı etkili olduğu gösterilmiştir6,10. Yapılan çalışmalarda, akut toksoplazmoz koriyoretiniti oluşturulan hamsterlerde, atovakuon ile primer tedavi olan primetamin-sülfadiazin kombinasyonu, klindamisin ve spiramisinin etkinliği karşılaştırılmış ve akut serebral toksoplazmoz sonrasında kist sayısının azalmasında sadece atovakuonun etkili olduğu bildirilmiştir20,21. Reaktivasyonlara neden olan doku kistlerinin sayısını azaltarak, atovakuonun rekürens riskini azaltmada da rol oynayabileceği fikri desteklenmektedir20. Bu çalışmada da, atovakuon uygulanan gruptaki trofozoit sayısı kontrol grubuna göre anlamlı derecede düşük bulunmuştur (p< 0.05).
Son yıllarda toksoplazmoza karşı geleneksel Çin tıbbi bitkilerinin etkinliği araştırılmış ve çoğunun T.gondii'nin çoğalmasını baskılayıcı etkiye sahip olduğu vurgulanmıştır22. T.gondii trofozoitleri ile enfekte farelerde AmE'nin koruyucu etkisinin araştırıldığı bir çalışmada, AmE'nin farelerdeki yaşam süresini uzatmada etkili olduğu görülmüştür18. Gerek in vitro gerekse in vivo çalışmalar, AmE'nin, makrofaj, Th1 ve sitotoksik T hücre yanıtını artırmak ve regülatör T (Treg) hücre yanıtını azaltmak suretiyle anti-tümör ve immünomodülatör etkilere sahip olduğunu ortaya koymaktadır14,23,24. Toksoplazmoza karşı savunmada, makrofajların, diğer protozoon enfeksiyonlarına göre ayrı bir önemi vardır25. Birçok araştırıcı, AmE polisakkaritleri ve astragalosidlerinin, makrofajların fagositik aktivitesini ve aktive makrofajlardan salınan sitokin düzeylerini artırdığını rapor etmiştir23,26-28. Ayrıca AmE'nin yüksek miktarda beta-glukan içerdiği ve güçlü bir hematopoetik etkiye sahip olan beta-glukanın da granülosit, monosit, makrofaj ve dendritik hücrelerin fagositoz yeteneğini artırdığı ifade edilmektedir29. Çalışmamıza benzer olarak ülkemizde yapılan bir çalışmada, akut toksoplazmozlu fare modelinde, 7 gün uygulanan beta-glukanın, peritondaki trofozoit sayısını kontrol grubuna göre anlamlı derecede azalttığı bildirilmiştir30. Bu bulgularla uyumlu olarak, bizim çalışmamızda da, AmE ile tedavi edilen deney grubunun periton sıvısındaki trofozoit sayısı, kontrol grubuna göre anlamlı düzeyde düşük olarak belirlenmiştir (p< 0.05). Akut toksoplazmozlu fareler üzerinde etkili bulunan AmE'nin bu etkiyi, immün sistemi ve makrofajları aktive etme özelliğiyle sağladığı düşünülmüştür.
Beta-glukanın bir diğer özelliği, kombine olarak verildiğinde çeşitli antimikrobiyal ilaçların etkinliğini artırmaktır. Yapılan çalışmalarda, sefazolin, sefalotin, gentamisin ve siprofloksasin gibi antibiyotiklerin beta-glukan ile kombinasyonlarının S.aureus ve E.coli ile enfekte deney hayvanlarında sinerjik etki gösterdikleri saptanmıştır30-32. Bu etkinin, granülosit koloni stimüle edici faktör (GM-CSF) ve antibiyotiklerin bir arada olmasıyla sağlandığı anlaşılmış; in vivo ve in vitro çalışmalarda polimorfonükleer lökositlerin varlığında GM-CSF'nin antibiyotiklerle sinerjik etkileşim gösterdiği belirlenmiştir31,32. Büyükbaba Boral30 ve arkadaşlarının çalışmasında, akut toksoplazmozlu farelere oral yolla beta-glukan + spiramisin uygulaması sonunda, kombinasyon grubundaki trofozoit sayısı, tekli uygulama ve kontrol gruplarına göre anlamlı derecede düşüş göstermiştir. Bizim çalışmamızda da, benzer olarak, beta-glukan içeren AmE ile atovakuon kombinasyonu uygulanan (Ato + Astra) gruptaki trofozoit sayısı, diğer üç gruba göre anlamlı derecede düşük bulunmuştur (p< 0.05) (Şekil 1). Diğer taraftan, AmE polisakkaritlerinin hematopoez üzerindeki etkilerinin araştırıldığı bir çalışmada, AmE'nin kemik iliği stromal hücrelerinin yaşam sürelerini uzattığı, IL-6 üretimi ve kemik iliği stromal hücrelerinin mRNA sentezini etkilemesi sonucunda GM-CSF üretimini artırdığı gösterilmiştir33. Chen ve arkadaşları34 ise, in vitro olarak, periferal kan monositlerinden dendritik hücre olgunlaşması mekanizması üzerinde, AmE polisakkaritlerinin doğrudan GM-CSF gibi etki gösterdiğini saptamışlardır. Tüm bu veriler ile birlikte değerlendirildiğinde, çalışmamızda akut toksoplazmozlu fare modelinde saptanan atovakuon ve AmE arasındaki sinerjizm, AmE'nin içeriğinde bulunan beta-glukan ve/veya kendi GM-CSF etkisi ile açıklanabilir.
Hem akut, hem de kronik toksoplazmozun kontrolünde Th1 tipi yanıt en önemli rolü oynamaktadır7,8. AmE, IFN-γ ve IL-2 gibi Th1 sitokinlerinin üretimini artırarak parazitin çoğalmasını önleme etkisine sahiptir12. Yapılan çalışmalarda, astragalus beta-glukanının; IL-2 biyoaktivitesini artırdığı, IL-2 reseptörlerinin ekspresyonunda belirgin bir artışa neden olduğu, Th1 lenfosit proliferasyonunu indüklediği, Treg hücrelerini ise baskıladığı saptanmıştır14,24,29. Bu bulgulara paralel olarak, çalışmamızda da IL-2 oranları; astragalus grubunda diğer üç gruba göre anlamlı derecede yüksek olarak belirlenmiştir (p< 0.05). Ato + Astra grubu IL-2 seviyelerinin diğer üç gruba göre anlamlı derecede düşük (p< 0.05) olarak belirlenmesi ise enfeksiyon şiddetinin azalmasıyla ilişkili olarak yorumlanmıştır.
Makrofajlar, akut enfeksiyon sırasında parazit ile enfekte olduktan sonra IL-12 salgılama fonksiyonlarını gerçekleştirememektedirler7. AmE, IL-12 üretimini uyararak etki mekanizmasının devamlılığını sağlamaktadır35. Çalışmamızda da astragalus grubunun IL-12 seviyeleri, atovakuon ve Ato + Astra gruplarına göre anlamlı derecede yüksek olarak belirlenmiştir (p< 0.05). Ato + Astra grubunun IL-12 seviyesinin diğer üç gruba göre anlamlı derecede düşük olması (p< 0.05), trofozoit sayılarındaki düşüş ile uyumlu olarak enfeksiyon şiddetinin azalmasıyla ilişkili olduğunu düşündürmüştür.
Akut toksoplazmozlu fare modelinde, atovakuon ve IL-12 kombinasyon tedavisinin, hayatta kalma sürelerini belirgin bir şekilde uzattığı ve kombinasyon grubunda kontrole göre anlamlı derecede yüksek IFN-γ seviyelerine neden olduğu belirlenmiştir36. IFN-γ, T.gondii'ye karşı dirençte ana mediatör sitokin rolündedir ve IL-12'nin uyarısıyla NK ve T hücreleri tarafından üretilir12,36. Yapılan bir çalışmada, T.gondii RH suşu ile enfekte edilen farelerde, atovakuon + pirolidin ditiyokarbamat kombinasyon uygulamaları ile tam tedavi sağlanmış; enfeksiyonun kronikleştiği farelerde ise, parazitin latent formunun immünolojik kontrolünün sağlandığını gösteren oldukça yüksek IFN-γ düzeyleri tespit edilmiştir37. Çalışmamızda da Ato + Astra grubunun IFN-γ düzeyi kontrol grubuna göre anlamlı ölçüde yüksek olarak belirlenmiştir (p< 0.05). Bu durum Ato + Astra grubunda enfeksiyonun kontrol altında olduğunu, en düşük trofozoit sayısına sahip olmasıyla da desteklemektedir. Araujo ve arkadaşları36, farelere dışarıdan yapılan IFN-γ uygulamasının, primetamin ve azitromisinin antitoksoplazmoz etkisini artırdığını rapor etmişlerdir. Çalışmamızdaki yüksek IFN-γ düzeyleri, dışarıdan bir uygulamaya gerek kalmadan, doğal yoldan sentezlenmekte ve Ato + Astra kombinasyonundaki sinerjiyi desteklemektedir.
Sonuç olarak, literatür taramalarında ulaşabildiğimiz yayınlar arasında, çalışmamıza benzer bir makaleye rastlanmadığından, bu çalışma akut toksoplazmozlu fare modelinde atovakuon + AmE kombinasyonunun tedavideki etkinliğinin araştırıldığı ilk çalışma olarak nitelendirilebilir. Çalışmamızın verileri, bu iki maddenin akut toksoplazmoz tedavisinde sinerjik etkisi olduğu fikrini vermiştir. Bulgularımız, yapılacak başka araştırmalar ile desteklendiğinde, toksoplazmoz yönünden riskli olan HIV/AIDS gibi immün yetmezlikli hastalarda bu kombinasyonun; tedavi yan etkilerinin azaltılması, direnç gelişimine karşı alternatif oluşturabilme ve tedavi başarısını artırma gibi nedenlerden dolayı tedavide denenme potansiyeli olduğunu düşündürmektedir.
KAYNAKLAR
- Montoya JG, Liesenfeld O. Toxoplasmosis. Lancet 2004; 363(9425): 1965-76.
- Saygi G. The epidemiology of toxoplasmosis in Turkey--a review of the literature. Wiad Parazytol 2001; 47 (Suppl 1): 19-30.
- Inci M, Yağmur G, Aksebzeci T, Kaya E, Yazar S. The investigation of Toxoplasma gondii seropositivity in women in the Kayseri province. Turkiye Parazitol Derg 2009; 33(3): 191-4.
- Akarsu GA, Yaman K, Güngör C, Altıntaş K. Evaluation of Sabin-Feldman test results of Ankara University Medical Faculty Medical Parasitology laboratory between 1997-2007. Turkiye Parazitol Derg 2011; 35(1): 15-8.
- Akyar I. Seroprevalence and coinfections of Toxoplasma gondii in childbearing age women in Turkey. Iran J Public Health 2011; 40(1): 63-7.
- Shubar HM, Lachenmaier S, Heimesaat MH, et al. SDS-coated atovaquone nanosuspensions show improved therapeutic efficacy against experimental acquired and reactivated toxoplasmosis by improving passage of gastrointestinal and blood-brain barriers. J Drug Target 2011; 19(2): 114-24.
- Yılmaz Ö, Turgay N. Sitokin ilişkili hücre içi sinyal iletimi ve paraziter enfeksiyonlardaki önemi. Türkiye Parazitol Derg 2009; 33(4): 301-6.
- Tait ED, Hunter CA. Advances in understanding immunity to Toxoplasma gondii. Mem Ins Oswaldo Cruz 2009; 104(2): 201-15.
- Sturge CR, Yarovinsky F. Complex immune cell interplay in the gamma interferon response during Toxoplasma gondii infection. Infect Immun 2014; 82(8): 3090-7.
- Yereli K. Atovakuon, s:125-30. Akısü C, Korkmaz M (ed), Tıbbi Parazitolojide Tedavi. 2005, 1. Baskı. Türkiye Parazitoloji Derneği, Yayın No:20, İzmir.
- Haile LG, Flaherty JF. Atovaquone: a review. Ann Pharmacother 1993; 27(12): 1488-94.
- Gürüz YA, Özcel MA. Toxoplasmosis, s: 141-84. Özcel MA (ed), Tıbbi Parazit Hastalıkları. 2007, 1. Baskı. Türkiye Parazitoloji Derneği, Yayın No: 22, İzmir.
- Sinclair S. Chinese herbs: a clinical review of Astragalus, Ligusticum and Schizandrae. Altern Med Rev 1998; 3(5): 338-44.
- Cho WC, Leung KN. In vitro and in vivo immunomodulating and immunorestorative effects of Astragalus membranaceus. J Ethnopharmacol 2007; 113(1): 132-41.
- Zheng H, Chen Y, Lu F, et al. Cryopreservation of Toxoplasma gondii in infected murine tissues. Parasitol Res 2012; 111(6): 2449-53.
- Gürgün V, Halkman K. Mikroskobik Sayım Yöntemleri. 1990, 2. Baskı. Gıda Teknolojisi Derneği, Yayın No: 7, Ankara.
- Romand S, Pudney M, Derouin F. In vitro and in vivo activities of the hydroxynapthoquinone atovaquone alone or combined with pyrimethamine, sulfadiazine, clarithromycin or minocycline against Toxoplasma gondii. Antimicrob Agents Chemother 1993; 37(11): 2371-8.
- Li Y, Huang P, Wang Z, et al. Protective effect of Astragalus membrance on mice with acute toxoplasmosis. Chinese Journal of Schistosomiasis Control 2004; 16(2): 129-32.
- Spencer CM, Goa KL. Atovaquone. A review of its pharmacological properties and therapeutic efficacy in oppurtinistic infections. Drugs 1995; 50(1): 176-96.
- Gormley PD, Pavesio CE, Minnasian D, Lightman S. Effects of drug therapy on Toxoplasma cysts in an animal model of acute and chronic disease. Invest Ophthalmol Vis Sci 1998; 39(7): 1171-5.
- Grujic J, Djurkovic-Djakovic O, Nikolic A, Klun I, Bobic B. Effectiveness of spiramycin in murine models of acute and chronic toxoplasmosis. Int J Antimicrob Agents 2005; 25(3): 226-30.
- Jing Z, Jiang W, Wang Q, et al. Inhibition effects of five Chinese herbal medicines on Toxoplasma gondii proliferation in vitro. Chinese Veterinary Science 2011; 2(22): 853-7.
- Qin Q, Niu J, Wang Z, Xu W, Qiao Z, Gu Y. Astragalus embranaceus extract activates immune response in macrophages via heparanase. Molecules 2012; 17(6): 7232-40.
- Li Q, Bao JM, Li XL, Zhang T, Shen XH. Inhibiting effect of Astragalus polysaccharides on the functions of CD4+CD25 highTreg cells in the tumor microenvironment of human hepatocellular carcinoma. Chin Med J (Engl) 2012; 125(5): 786-93.
- Israelski DM, Araujo FG, Wachtel JS, Heinrichs L, Remington JS. Differences in microbicidal activities of human macrophages against Toxoplasma gondii and Trypanosoma cruzi. Infect Immun 1990; 58(1): 263-5.
- Xu HD, You CG, Zhang RL, Gao P, Wang ZR. Effects of Astragalus polysaccharides and astragalosides on the phagocytosis of Mycobacterium tuberculosis by macrophages. J Int Med Res 2007; 35(1): 84-90.
- Lee KY, Jeon YJ. Macrophage activation by polysaccharide isolated from Astragalus membranaceus. Int Immunopharmacol 2005; 5(7-8): 1225-33.
- Clement-Kruzel S, Hwang SA, Kruzel MC, Dasgupta A, Actor JK. Immune modulation of macrophage pro-inflammatory response by goldenseal and Astragalus extracts. J Med Food 2008; 11(3): 493-8
- Mao XF, Piao XS, Lai CH, Li DF,Xing JJ, Shi BL. Effects of beta-glucan obtained from the Chinese herb Astragalus membranaceus and lipopolysaccharide challenge on performance, immunological, adrenal and somatotropic responses of weanling pigs. J Anim Sci 2005; 83(12): 2775-82.
- Büyükbaba Boral Ö, Sönmez Tamer G, Keçeli Özcan S, Sönmez N, İşsever H, Tekeli F. Spiramisin ve beta-glukan kombinasyonu etkinliğinin akut toksoplazmozlu fare modelinde araştırılması ve IL-10, IL-12 ve TNF-α düzeylerinin belirlenmesi. Mikrobiyol Bul 2012; 46(3): 446-55.
- Kropec A, Lemmen SW, Grundmann HJ, Engels I, Daschner FD. Synergy of simultaneous administration of ofloxacin and granulocyte colony-stimulating factor in killing of Escherichia coli by human neutrophils. Infection 1995; 23(5): 298-300.
- Kaiser AB, Kernodle DS. Synergism between poly-(1-6)-beta-D-glucopyranosyl-(1-3)-beta-D-glucopyranose glucan and cefazolin in prophylaxis of staphylococcal wound infection in a guinea pig model. Antimicrob Agents Chemother 1998; 42(9): 2449-51.
- Zhu XL, Zhu BD. Mechanisms by which Astragalus membranaceus injection regulates hematopoiesis in myelosupressed mice. Phytother Res 2007; 21(7): 663-7.
- Chen CJ, Li ZL, Fu Q, et al. Effect of Astragalus polysaccharides on the phenotype and functions of human dendritic cells in vitro. Nan Fang Yi Ke Da Xue Xue Bao 2009; 29(6): 1192-4.
- Tan BK, Vanitha J. Immunomodulatory and antimicrobial effects of some traditional chinese medical herbs: a review. Curr Med Chem 2004;11(11): 1423-30.
- Araujo FG, Hunter CA, Remington JS. Treatment with IL-12 in combination with atovaquone or clindamycin significantly increases survival of mice with acute toxoplasmosis. Antimicrob Agents Chemother 1997; 41(1): 188-90.
- Djurkovic-Djakovic O, Nikolic A, Bobic B, Klun I, Aleksic A. Stage conversion of Toxoplasma gondii RH parasites in mice by treatment with atovaquone and pyrrolidine dithiocarbamate. Microb Infect 2005; 7(1): 49-54.
İletişim (Correspondence):
MSc. Bio. Neşe Sönmez,
İstanbul Üniversitesi İstanbul Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Çapa 34093, İstanbul, Türkiye.
Tel (Phone): +90 546 921 0908,
E-posta (E-mail): 1nesesonmez@gmail.com