Seftazidime Dirençli Pseudomonas aeruginosa İzolatlarında
Beta-Laktamazların Moleküler Epidemiyolojisi
Molecular Epidemiology of Beta-Lactamases in
Ceftazidime-Resistant Pseudomonas aeruginosa Isolates
Halil ER1, Mustafa ALTINDİŞ2, Gülşah AŞIK3, Cengiz DEMİR3
1 Muş Devlet Hastanesi, Tıbbi Mikrobiyoloji Laboratuvarı, Muş.
1 Muş State Hospital, Microbiology Laboratory, Muş, Turkey.
2 Sakarya Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Sakarya.
2 Sakarya University Faculty of Medicine, Department of Medical Microbiology, Sakarya, Turkey.
3 Afyon Kocatepe Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Afyon.
3 Afyon Kocatepe University Faculty of Medicine, Department of Medical Microbiology, Afyon, Turkey.
ÖZ
Pseudomonas aureginosa, özellikle immün sistemin baskılandığı hastalarda, yaşlılarda ve ağır yanık durumlarında hastalık oluşturan ve daha çok hastane enfeksiyonlarına neden olabilen önemli bir fırsatçı patojendir. Bakterinin birçok antibiyotiğe karşı yüksek oranda direnç geliştirme özelliği, P.aeruginosa enfeksiyonlarının mortalite ve morbiditesini artırmaktadır. Bu çalışmada, yatan hastalardan izole edilen P.aeruginosa suşlarının antibiyotik duyarlılıklarının belirlenmesi ve PER, GES, KPC, VIM, IMP ve OXA gibi direnç enzimlerinin varlığının araştırılması amaçlanmıştır. Çalışmaya, 2010-2012 yılları arasında Afyon Kocatepe Üniversitesi Tıp Fakültesi Hastanesi'nde yatan 134'ü erkek 61'i kadın hastanın çeşitli klinik örneklerinden (29 balgam, 67 yara, 53 trakeal aspirat, 23 kan, 18 idrar, 3 beyin omurilik sıvısı, 2 plevral sıvı) izole edilen, 195 P.aeruginosa suşu dahil edilmiştir. İzolatların tanımlanmasında konvansiyonel ve otomatize sistemler (VITEK 2, BioMerieux, Fransa) kullanılmış; antibiyotik duyarlılıklarının belirlenmesi için disk difüzyon ve E-test yöntemleri uygulanmıştır. İzolatların indüklenebilir beta-laktamaz (İBL), genişlemiş spektrumlu beta-laktamaz (GSBL) ve metallo-beta-laktamaz (MBL) üretimleri, fenotipik olarak, sırasıyla çift disk indüksiyon yöntemi, çift disk sinerji testi ve E-test yöntemi ile saptanmıştır. İzolatlarda direnç enzimlerini (PER, GES, KPC, VIM, IMP ve OXA) kodlayan genlerin varlığı ise gerçek zamanlı polimeraz zincir reaksiyonu ile araştırılmış; pozitif örneklere dizi analizi uygulanmıştır. Çalışmamızda, 195 P.aeruginosa suşunun tümü (%100) seftazidime, %90.8'i tazobaktam/piperasiline, %60.5'i aztroenama, %50.2'si sefepime, %48.2'si imipeneme, %47.2'si meropeneme, %47.2'si ofloksasine, %44.1'i piperasiline, %31.3'ü levofloksasine, %26.2'si siprofloksasine, %11.8'i gentamisine, %8.7'si amikasine ve %6.2'si tobramisine dirençli bulunmuştur. Fenotipik yöntemlerle, izolatların %89.2'sinde (174/195) İBL, %30.7'sinde (60/195) GSBL ve %26.7'sinde (52/195) MBL pozitifliği tespit edilmiştir. Moleküler çalışmalar sonucunda beş izolatta OXA-10, dört izolatta OXA-14, dört izolatta VIM-2, iki izolatta IMP-1, 26 izolotta GES-1 ve 87 izolatta ABC taşıyıcı permeaz (transporter permease) geni saptanmış; PER ve KPC genlerine rastlanmamıştır. Sonuç olarak, beta-laktamaz genlerini taşıyan kökenlerin saptanması ve beta-laktamaz tiplerinin tanımlanmasının; antibiyotik seçiminde, tedavinin takibinde, direnç gelişiminin önlenmesinde ve enfeksiyon kontrol programlarının geliştirilmesinde yol gösterici olacağı düşünülmüştür.
Anahtar sözcükler: Pseudomonas aeruginosa; beta-laktamazlar; moleküler epidemiyoloji.
ABSTRACT
Pseudomonas aeruginosa is an important opportunistic pathogen that cause mainly nosocomial infections especially in the immunocompromised patients, the elderly and patients with severe burns. The bacterial feature of developing high degree of resistance against several antibiotics leads to increased morbidity and mortality of P.aeruginosa infections. The aims of this study were to investigate the antibiotic susceptibilities of P.aeruginosa strains isolated from hospitalized patients and to determine the presence of resistance enzymes namely PER, GES, KPC, VIM, IMP and OXA. A total of 195 P.aeruginosa strains isolated from different clinical samples (29 sputum, 67 wound, 53 tracheal aspirate, 23 blood, 18 urine, 3 cerebrospinal fluid, 2 pleural fluid) of inpatients (134 male, 61 female) in Afyon Kocatepe University School of Medicine Hospital between 2010-2012, were included in the study. The isolates were identified by conventional methods and automated systems (VITEK 2, BioMerieux, France), and their antibiotic susceptibilities were detected by disk diffusion and E-test methods. Inducible beta-lactamase (IBL), extended-spectrum beta-lactamase (ESBL) and metallo-beta-lactamase (MBL) productions of the isolates were phenotypically investigated by double disk induction, double disk synergy and E-test methods, respectively. The presence of resistance genes encoding PER, GES, KPC, VIM, IMP and OXA enzymes were determined by real-time polymerase chain reaction, and sequence analysis was applied to positive samples. In our study, the antibiotic resistance rates of 195 P.aeruginosa strains were found as follows: ceftazidime 100%, tazobactam/piperacillin 90.8%, aztreonam 60.5%, cefepime 50.2%, imipenem 48.2%, meropenem 47.2%, ofloxacin 47.2%, piperacillin 44.1%, levofloxacin 31.3%, ciprofloxacin 26.2%, gentamicin 11.8%, amikacin 8.7% and tobramycin 6.2%. With the use of phenotypical methods, IBL, ESBL and MBL production rates in the isolates were detected as 89.2% (174/195), 30.7% (60/195) and 26.7% (52/195), respectively. Molecular studies showed that, five strains harboured OXA-10, four OXA-14, four VIM-2, two IMP-1, 26 GES-1 and 87 ABC transporter permease genes, while PER and KPC genes were not detected in any of the isolates. In conclusion, it was considered that the detection of beta-lactamase genes in bacteria and the identification of beta-lactamase types may provide facilities in selection of antibiotics, monitorization of therapy, prevention of resistance development of infection control programs.
Keywords: Pseudomonas aeruginosa; beta-lactamases; molecular epidemiology.
Geliş Tarihi (Received): 17.09.2014 - Kabul Ediliş Tarihi (Accepted): 08.11.2015
GİRİŞ
Pseudomonas aeruginosa, konağın deri savunmasının tahrip olduğu geniş yanığı olan, kistik fibrozis gibi solunum yolu hastalığı olan ve katater uygulaması yapılan hastalar ile bağışıklık sistemi baskılanmış olgularda ciddi enfeksiyonlara neden olan bir patojendir1. P.aeruginosa enfeksiyonlarının tedavisinde tikarsilin, piperasilin ve mezlosilin gibi penisilinler; seftazidim, sefoperazon ve sefepim gibi sefalosporinler; imipenem, meropenem ve doripenem gibi karbapenemler; aztreonam gibi monobaktam; amikasin, gentamisin ve tobramisin gibi aminoglikozidler; tetrasiklin, minosiklin ve doksisiklin gibi uzun etkili tetrasiklinler; siprofloksasin ve levofloksasin gibi florokinolonlar kullanılmaktadır1.
Beta-laktam antibiyotikler, gerek toplum gerekse hastane kökenli enfeksiyonların tedavisinde kullanılan antimikrobiyal ilaçların başında gelmektedir. Ancak bu yaygın kullanıma paralel olarak bakterilerin de yeni direnç mekanizmaları geliştirdiği ve beta-laktam antibiyotiklere direnç oranlarının giderek arttığı gözlenmektedir2. Beta-laktamazlar, beta-laktam grubu antibiyotiklerde bulunan beta-laktam halkasının amid bağlarına etki ederek bu bağları parçalarlar. Beta-laktamazlar, plazmid veya kromozomal kökenli bakteriyel enzimler olup, bakteride beta-laktamaz sentezi yapısal veya indüklenebilir düzeyde olabilir. Gram-negatif bakterilerde periplazmik alanda bulunan enzim, gram-pozitif bakterilerde hücre dışına salgılanmaktadır2. Bu çalışmada, Afyon Kocatepe Üniversitesi Tıp Fakültesi Hastanesi'nde yatmakta olan hastalardan izole edilen P.aeruginosa suşlarının antibiyotik duyarlılıklarının tespit edilmesi, beta-laktam antibiyotiklere direnç gelişiminden sorumlu PER, GES, KPC, VIM, IMP ve OXA gibi direnç enzimlerinin saptanması, enzim taşıdığı belirlenen izolatların dizi analizlerinin yapılması ve alt türlerinin belirlenmesi amaçlanmıştır.
GEREÇ ve YÖNTEM
Çalışmaya, 2010-2012 yılları arasında hastanemizde yatan 134'ü erkek 61'i kadın hastanın çeşitli klinik örneklerinden (29 balgam, 67 yara, 53 trakeal aspirat, 23 kan, 18 idrar, 3 BOS, 2 plevral sıvı) izole edilen 195 P.aeruginosa suşu dahil edildi. Örneklerin 50'si cerrahi birimler, 33'ü anestezi yoğun bakım, 33'ü dahiliye, 29'u göğüs hastalıkları, 16'sı ortopedi, 15'i enfeksiyon hastalıkları, 13'ü nöroloji ve 6'sı pediatri servislerinden gönderilmişti.
Suşların Tanımlanması ve Antibiyotik Duyarlılık Testleri
İzolatların tanımlanmasında konvansiyonel yöntemler ve otomatize sistem (VITEK 2, BioMerieux, Fransa) kullanıldı. Tanımlanan suşlar antibiyogram ve moleküler çalışmalar yapılıncaya kadar saklama besiyerinde (Cryo-Billes, AES Chemunex, Fransa) -80°C'de saklandı.
İzolatların antibiyotik duyarlılıklarının belirlenmesi için disk difüzyon (DD) ve E-test yöntemleri kullanıldı. DD yönteminde; seftazidim (30 µg), gentamisin (10 µg) , tobramisin (10 µg), piperasilin (100 µg), amikasin (30 µg), aztreonam (30 µg), sefepim (30 µg), siprofloksasin (5 µg), levofloksasin (5 µg), imipenem (10 µg), meropenem (10 µg), tazobaktam/piperasilin (110 µg) ve ofloksasin (5 µg) antibiyotik diskleri (Oxoid, İngiltere) kullanıldı. Ayrıca imipenem duyarlılığı E-test (Liofilchem, İtalya) ile araştırıldı. CLSI kriterleri doğrultusunda, antibiyogram diskleri ve E-test kalite kontrolleri P.aeruginosa ATCC 27853 suşu ile yapıldı; hasta örnekleri CLSI kriterlerine göre değerlendirildi3.
Çift Disk İndüksiyon Yöntemi
Bu yöntem, indüklenebilir beta-laktamaz (İBL) varlığının saptanmasında kullanıldı. Bu amaçla Mueller-Hinton agar (MHA) yüzeyine 0.5 McFarland bulanıklığında bakteri süspansiyonu inoküle edildi ve sonra plak üzerine güçlü bir beta-laktamaz indükleyicisi olarak imipenem diski ile bunun 20 mm uzağına seftazidim diski yerleştirildi. Seftazidimin indükleyici olan imipeneme bakan yüzünde, inhibisyon zonunun belirgin olarak daralması İBL pozitifliği olarak kabul edildi.
Çift Disk Sinerji Testi
Bu yöntem, genişlemiş spektrumlu beta-laktamaz (GSBL) varlığının saptanmasında kullanıldı. İzolatların 24 saatlik taze kültürlerinden 0.5 McFarland bulanıklığında olacak şekilde hazırlanan bakteri süspansiyonu MHA plağına yayıldıktan sonra petrinin ortasına amoksisilin/klavulanik asit (AMC) (20/10 μg), etrafına disk merkezinden disk merkezine uzaklığı 30 mm olacak şekilde, aztreonam (30 μg), seftazidim (30 μg), sefotaksim (30 μg) ve sefepim (30 μg) diskleri yerleştirildi. 37°C'de 16-18 saat inkübasyon sonrası, sefalosporin veya aztreonam arasındaki inhibisyon zonunun AMC diskine doğru genişlemesi veya diğer antibiyotik diskleri arasında bakterin üremediği bir sinerji alanı oluşturması GSBL pozitif olarak kabul edildi.
E-Test Yöntemi
Bu yöntem, metallo-beta-laktamaz (MBL)'ların fenotipik olarak saptanmasında kullanıldı. İzolatların taze kültürlerinden 0.5 McFarland bulanıklığında hazırlanan bakteri süspansiyonu MHA üzerine homojen olarak inoküle edildi. Besiyeri yüzeyinin kurumasının ardından E-test şeridi besiyeri üzerine yerleştirildi ve plaklar 35°C'de 24 saat inkübe edildi. İmipenem + EDTA (Etilen Diamin Tetra Asetik asit) minimum inhibisyon konsantrasyonu (MİK) değeri ile imipenem MİK değeri arasında en az 8 kat azalma saptanması, MBL enzimi açısından pozitif kabul edildi. Testin pozitif olmasının diğer bir kriteri olarak; E-test şeridinin imipenem veya EDTA içermeyen orta bölümünde hayalet bölge (ghost zone) olarak adlandırılan görünümün varlığı dikkate alındı4.
Polimeraz Zincir Reaksiyonu (PCR)
Bu yöntem, direnç enzimlerini (PER, OXA, IMP, VIM, KPC, GES) kodlayan gen bölgelerinin saptanmasında kullanıldı. Bu amaçla öncelikle, dondurularak saklanmış olan izolatlar koyun kanlı agar (KKA) besiyerine pasajlandı ve 37°C'de 24 saat inkübe edildi. Her bakteri suşu için, steril ependorf tüplere 100 μl TrisEDTA (1X) koyularak, steril öze ile her petriden 2-3 koloni alınıp lizis tamponu içerisinde iyice çözünmesi sağlandı. Kaynamış 100°C'lik saf suda 15 dakika kaynatılarak oda sıcaklığında soğuması için beklendi ve sonra tüpler 14.000 rpm'de 1 dakika santrifüj edildi. Santrifüj sonrası bakteri DNA'larının bulunduğu süpernatanın 30 μl'si alınıp PCR işlemi için ayrıldı.
Elde edilen DNA'lara iki aşamalı PCR uygulandı. Birinci aşamada, primerlerin bağlanma sıcaklıklarının tespiti için in-house PCR (Techne TC-512 Thermal Cycler, ABD) ile optimizasyon çalışmaları yapıldı; ikinci aşamada ise gerçek zamanlı PCR (Rt-PCR) (Stratagene Mx3005 Multipleks Quantitative PCR System, Almanya) uygulandı.
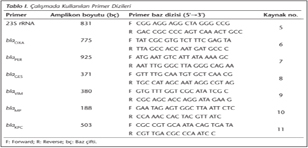
Öncelikle konvansiyonel olarak tanımlanan bakterilerin moleküler olarak doğrulanması için P.aeruginosa 23S RNA gen bölgesi çoğaltıldı. Doğrulanan izolatların DNA'ları PER, OXA, IMP, VIM, KPC ve GES gen bölgelerinin gösterilmesi için 6 ayrı primer seti kullanılarak PCR işlemine tabi tutuldu (Tablo I)5,6,7,8,9,10,11. Amplikasyon protokolü; 95°C'de 10 dakika ilk denatürasyon, 95°C'de 30 saniye, 54°C'de 30 saniye, 72°C'de 20 saniye olmak üzere 30 döngü ve 72°C'de 5 dakika son çoğaltma şeklinde uygulandı. PCR sonucunda oluşan ürünler agaroz jel elektroforez yöntemiyle incelendi.
Dizi Analizi
PCR reaksiyonları sonucu oluşan PER, OXA, IMP, VIM, KPC ve GES gen bölgelerinin dizi analizi için amplikonlar Macrogen (Hollanda) firmasına gönderildi. Diziler NCBI (National Center for Biotechnology Information) Blast programı12 kullanılarak veri bankasıyla karşılaştırıldı ve amplikonların hangi genle homolog olduğu belirlenerek çoğaltılan amplikonlar doğrulandı.
BULGULAR
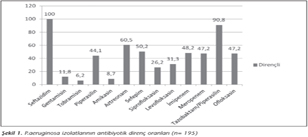
Çalışmamızda, seftazidime dirençli 195 P.aeruginosa izolatında en yüksek direnç oranı tazobaktam/piperasiline (%90.8), en düşük direnç oranı ise tobramisine (%6.2) karşı saptanmış; izolatların antibiyotik duyarlılık sonuçları Şekil 1'de gösterilmiştir. Suşların 49'unun (%25.1) çoklu ilaç direncine sahip olduğu saptanmıştır. Yapılan E-test sonuçlarına göre, imipenem MİK değeri ≥ 4 µg/ml olan 95 suş tespit edilmiştir.
Çift disk sinerji yöntemi ile taranan 195 örneğin 60'ında (%30.7) GSBL pozitifliği, çift disk indüksiyon yöntemi ile 174'ünde (%89.2) indüklenebilir beta-laktamaz saptanmış olup, E-test yöntemi ile 52 suşta (%26.7) MBL enzimi fenotipik olarak belirlenmiştir.
PCR sonuçlarına göre; 195 suşun 113'ünde (%57.9) GES, 9'unda (%4.6) OXA, 4'ünde (%2) VIM, 2'sinde (%1) IMP direnç gen bölgesinin varlığı belirlenmiş; hiçbir suşta PER ve KPC geni saptanmamıştır (Şekil 2). PCR ile VIM ve IMP geni taşıdığı tespit edilen 6 örneğin tamamının imipenem MİK değeri ≥ 8 µg/ml olarak saptanmıştır. Ayrıca bu suşların hepsinin E-test ile fenotipik olarak MBL ürettiği saptanmıştır.
Dizi analizi sonuçları değerlendirildiğinde; OXA geni saptanan 9 izolatın 5'i OXA-10, 4'ü OXA-14; VIM geni saptanan 4 izolatın hepsi VIM-2; IMP geni saptanan 2 izolatın hepsi IMP-1 olarak tanımlanmıştır. GES primerleri kullanılarak direnç genleri saptanan ve bu gen bölgelerine dizi analizi uygulanan 113 izolatın 26'sı GES-1 olarak tespit edilmiş, diğer 87 izolatta aynı primerle saptanabilen ve dizi analizi sonucu ayrımı yapılabilen ABC taşıyıcı permeaz (transporter permease) gen bölgesi tanımlanmıştır.
TARTIŞMA
P.aeruginosa özellikle immün sistemin zayıfladığı veya baskılandığı hastalarda, yaşlılarda ve ağır yanık durumlarında hastalık oluşturan ve daha çok hastane enfeksiyonlarına neden olabilen önemli bir fırsatçı patojendir1. Çeşitli antibiyotiklere yüksek oranda dirençli olması nedeniyle P.aeruginosa enfeksiyonlarının mortalite ve morbiditesi yüksektir. İran'da 2013 yılında bir yanık ünitesinde yatan 182 hastanın 86'sında üretilen P.aeruginosa izolatlarının sefazolin (CFZ), piperasilin (PIP), seftazidim (CAZ), siprofloksasin (CIP), tobramisin (TOB), amikasin (AMK), gentamisin (GEN) ve imipenem (IPM) direnç oranları sırasıyla; %83.7, %69.9, %68.8, %66.3, %58.2, %48.8, %37.2 ve %23.3 olarak bildirilmiştir13. Brezilya'da yapılan bir çalışmada ise, yatan hastalardan izole edilen P.aeruginosa suşlarında direnç oranları AMK, GEN, CIP, aztreonam (ATM), sefepim (FEP), CAZ, IPM ve meropenem (MEM) için sırasıyla; %34, %41, %41, %29, %34, %32, %32 ve %37 olarak bulunmuştur14. Özyurt ve arkadaşları15 2010 yılında İstanbul bölgesinde yaptıkları çalışmada, AMK, GEN, levofloksasin (LVX), CIP, CAZ, FEP, ATM, IPM ve MEM'e sırasıyla; %17.6, %44.9, %21.2, %20, %64.3, %45.1, %60.3, %22.9 ve %18.9 oranlarında direnç saptamışlardır. İzmir bölgesinde ise 2011-2012 yıllarında anestezi yoğun bakım hastalarından izole edilen 51 P.aeruginosa suşunun CAZ, FEP, IPM, MEM, AMK ve GEN direnci sırasıyla; %76.5, %94.2, %88.3, %82.4, %88.3 ve %94.2 olarak bildirilmiştir16. Çalışmamız yukarıdaki çalışmalar ile karşılaştırıldığında; FEP, CAZ, ATM, tazobaktam/piperasilin (TZP) ve IPM'e karşı daha yüksek oranda direnç saptanmış, AMK, GEN ve CIP'e ise düşük oranda direnç belirlenmiştir (Şekil 1). Bu farklılığın nedenlerinin, bölgesel ve toplumsal farklılıklar, çalışılan hasta grupları, hastanelerin uyguladığı enfeksiyon kontrol önlemleri, ampirik tedavi tercihleri, hasta uyumu ve ilaç kullanım politikalarına bağlı olabileceği düşünülmüştür.
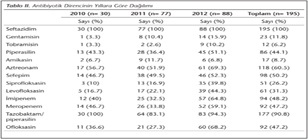
Ülkemizde Yücel ve arkadaşlarının17, 2003, 2004 ve 2005 yılları arasındaki antibiyotik direnç değişimini inceledikleri bir çalışmada; CAZ direncinde %29'dan %50'ye, FEP'de %30'dan %44'e, ATM'de %3'den %45'e, TZP'de %25'ten %39'a ve CIP'de %22'den %39'a varan artış bildirilmiştir. Tunçoğlu ve arkadaşlarının18 179 suş ile yaptığı 2005-2006 ve 2007-2008 yılları arasındaki direnç artışını incelediği çalışmalarında; FEP direncinin %29'dan %48'e, CAZ direncinin %12'den %32'ye, ATM direncinin %27'den %60'a, IPM direncinin %0'dan %15'e ve MEM direncinin %2'den %15'e çıktığı tespit edilmiştir. Çalışmamızda da benzer şekilde IPM, MEM, ATM, CIP, LVX ve ofloksasin (OFX) direnç oranlarında yıllara göre bir artışın söz konusu olduğu saptanmıştır (Tablo II).
Wolska ve arkadaşları19,20 P.aeruginosa suşlarında indüklenebilir beta-laktamaz (İBL) pozitiflik oranını 2001 yılında %72 oranında saptarken, 2008 yılında bu oranı %98.5 olarak tespit etmişlerdir. Ülkemizde yapılan çalışmalarda da; Ekşi ve arkadaşları21 2007 yılında 51 P.aeruginosa suşunun %52'sinde, Özyurt ve arkadaşları15 2010 yılında 350 izolatın %62'sinde, Berktaş ve arkadaşları22 da 2011 yılında 87 suşun %74'ünde İBL pozitifliği bildirmişlerdir. Bizim çalışmamızda saptanan İBL pozitiflik oranı (174/195; %89.2) ise ülkemizden bildirilen oranlara göre oldukça yüksektir. Bu durumun, bölgesel farklılıklar, hasta popülasyonundaki farklılıklar ve hastane florasında bulunan bakterilerin direnç paternlerinin farklılıklarından kaynaklanmış olabileceği düşünülmüştür.
Walsh ve arkadaşları4 yaptıkları bir çalışmada, daha önce metallo-beta-laktamaz (MBL) ürettiği saptanan ve IPM MİK değeri 4 µg/ml olan izolatların büyük çoğunluğunun E-test ile pozitif sonuç verdiğini rapor etmişlerdir. Bu araştırıcılar, fenotipik olarak MBL tayininde E-testin duyarlılığını %94, özgüllüğünü %95 olarak vermişlerdir4. Buna karşın Toleman ve arkadaşları23 E-test ile pozitif bulunan P.aeruginosa izolatlarından %80.6'sını (25/31), Sader ve arkadaşları24 ise sadece %46.3'ünü (25/54) PCR ile MBL açısından doğrulayabilmişlerdir. Rizek ve arkadaşları25, 1998-2012 yılları arasında hastanede yatan hastalardan izole ettikleri karbapeneme dirençli 129 P.aeruginosa izolatının 33'ünde SPM-1, dördünde VIM-2 ve üçünde GES-3 gen bölgesi tespit etmişlerdir. Bunun dışında dokuz suşta SPM-1 ve KPC-2 birlikteliği, bir suşta da SPM-1, VIM-2 ve KPC-2 gen birlikteliği saptamışlardır25. Ankara'da Çakar'ın26 2005 yılında 110 P.aeruginosa suşu ile yaptığı çalışmada, 25 suşta E-test ile MBL üretimi tespit edilmiş ve bu örneklerin 11'inde VIM direnç geni moleküler olarak gösterilmiştir. İzmir bölgesinde 2009 yılında yapılan çalışmada da, 80 P.aeruginosa suşunun 27'sinin fenotipik olarak MBL ürettiği bulunmuş, moleküler yöntemlerle bunlardan yedisinde VIM, birinde IMP gen varlığı saptanmıştır27. Çalışmamızda, VIM ve IMP gen bölgelerine ait iki adet konsensus primer seti kullanılmıştır. Çalışmaya dahil edilen 195 P.aeruginosa izolatının 52'sinde E-test ile MBL üretimi saptamış, PCR ile dört izolatta VIM geni, iki izolatta ise IMP geni gösterilmiştir. Bu izolatların dizi analizleri sonuçlarına göre bunların VIM-2 ve IMP-1 oldukları tespit edilmiştir. Bu sonuçlar ülkemizde saptanan sonuçlarla benzerlik göstermektedir.
Fransa'da 2001-2002 yılları arasında dokuz hastanenin katılımıyla gerçekleştirilen çalışmada, seftazidime dirençli 5.304 P.aeruginosa izolatından 37'sinde (%0.7) PER-1 geni varlığı tespit edilmiştir28. İstanbul'da 2007 yılında yapılan bir çalışmada, seftazidime dirençli (CAZ-R) 50 P.aeruginosa suşunun 22'sinde; Samsun'da 2008 yılında yapılan bir araştırmada da CAZ-R 50 P.aeruginosa izolatının 23'ünde PER-1 enzimi saptanmıştır29,30. Bizim çalışmamızda 56 örnekte GSBL saptanmasına rağmen PER-1 direnç geni bulunamamıştır.
İstanbul Üniversitesi Tıp Fakültesi Hastanesi'nde yapılan çalışmada, 50 CAZ-R P.aeruginosa suşunun 23'ünde (%46) OXA-10 türevi enzimler saptanmıştır29. OXA türevleri, GSBL tipi OXA enzimlerini genel olarak içerdiği için, çalışmamızda OXA gen bölgesine yönelik ortak primer kullanılmış ve dokuz izolatta OXA türevi GSBL enzimi pozitif olarak bulunmuştur. Dizi analizleri yapılan izolatların beşi OXA-10, dördü OXA-14 olarak tanımlanmıştır.
İstanbul'da 2007 yılında Çelik'in29 yaptığı çalışmada, 50 CAZ-R P.aeruginosa suşunun 43'ünde GES enzimi pozitif olarak bulunmuştur. Çalışmamızda, izolatların %57.9'unda (113/195) GES pozitifliği saptanmış; ancak dizi analizi sonucunda 113 izolatın 26'sının GES-1 GSBL geni, 87 izolatın ise aynı primer dizileri ile saptanan ABC taşıyıcı permeaz geni taşıdığı gösterilmiştir. Bu proteinin siderofor özellik gösteren pigment üretiminden sorumlu olduğu, dışa atım pompa sistemi aracılığıyla antibiyotik direncine neden olabileceği ve bakterinin virülans faktörleri ile ilişkili olduğu düşünülmektedir31. Tüm bu veriler GES enzimlerinin ülkemizde de yaygın olabileceğini düşündürmektedir. Bu nedenle bu konu ile ilgili daha detaylı ileri çalışmalar yapılması, daha net sonuçlar alınmasına olanak sağlayabilecektir. Sonuç olarak, beta-laktamaz genlerini taşıyan kökenlerin saptanması ve beta-laktamazların tiplendirilmesinin; tedavide kullanılacak antibiyotiklerin seçiminde, tedavinin takibinde, enfeksiyon hastalıklarının önlenmesinde ve enfeksiyon kontrol programlarının geliştirilmesinde yol gösterici olacağı düşünülmüştür.
KAYNAKLAR
- Vahapoğlu H, Akhan S. Pseudomonas aeruginosa ve diğer Pseudomonas türleri, s: 2175-86. Topçu AW, Söyletir G, Doğanay M (ed), Enfeksiyon Hastalıkları ve Mikrobiyolojisi. 2008, Nobel Tıp Kitapevi, İstanbul.
- Ayaz C. Beta-laktamların genel özellikleri ve penisilinler, s: 266-78. Topçu AW, Söyletir G, Doğanay M. Enfeksiyon Hastalıkları ve Mikrobiyolojisi. 2008, Nobel Tıp Kitapevi, İstanbul.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twenty-second Informational Supplement, M100-S22, 2012. CLSI, Wayne, PA.
- Walsh T, Bolmström A, Qwarmström A, Gales A. Evalution of a new E-test for detecting metallo-beta-lactamases in routine clinical testing. J Clin Microbiol 2002; 40(8): 2755-9.
- Toschka HY, Hopfl P, Ludwig W, Schleifer KH, Ulbrich N, Erdmann VA. Complete nucleotide sequence of a 23S ribosomal RNA gene from Pseudomonas aeruginosa. Nucleic Acids Res 1987; 15(17): 7182.
- Handal T, Olsen I, Walker CB, Caugant DA. Detection and characterization of beta-lactamase genes in subgingival bacteria from patients with refractory periodontitis. FEMS Microbiol Lett 2005; 242(2): 319-24.
- Weldhagen GF, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother 2003; 47(8): 2385-92.
- Bebrone C, Bogaerts P, Delbrück H, et al. GES-18, a new carbapenem-hydrolyzing GES-type-lactamase from Pseudomonas aeruginosa that contains Ile80 and Ser170 residues. Antimicrob Agents Chemother 2013; 57(1): 396-401.
- Garza-Ramos U, Morfin-Otero R, Sader HS, et al. Metallo-beta-lactamase gene bla(IMP-15) in a class 1 integron, in95, from Pseudomonas aeruginosa clinical isolates from a hospital in Mexico. Antimicrob Agents Chemother 2008; 52(8): 2943-6.
- Koh TH, Wang GC, Sng LH. Clonal spread of IMP-1-producing Pseudomonas aeruginosa in two hospitals in Singapore. J Clin Microbiol 2004; 42(11): 5378-80.
- Goldfarb D, Harvey S, Jessamine K, Jessamine P, Toye B, Desjardins M. Detection of plasmid-mediated KPC-producing Klebsiella pneumoniae in Ottawa, Canada: evidence of intrahospital transmission. J Clin Microbiol 2009; 47(6):1920-2.
- National Center for Biotechnology Information. BLAST. Available at: http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&BLAST_PROGRAMS=megaBlast&PAGE_TYPE=BlastSearch
- Nikokar I, Tishayar A, Flakiyan Z, et al. Antibiotic resistance and frequency of class 1 integrons among Pseudomonas aeruginosa, isolated from burn patients in Guilan, Iran. Iran J Microbiol 2013; 5(1):36-41.
- Araújo Jácome PRL, Alves LR, Cabral AB, Lopes ACS, Maciel MAV. Phenotypic and molecular characterization of antimicrobial resistance and virulence factors in Pseudomonas aeruginosa clinical isolates from Recife, State of Pernambuco, Brazil. Rev Soc Bras Med Trop 2012; 45(6): 707-12.
- Özyurt M, Haznedaroğlu T, Baylan O, Hoşbul T, Ardıç N, Bektöre B. Yatan hastalardan izole edilen Pseudomonas izolatlarında antibiyotik direnci. ANKEM Derg 2010; 24(3): 124-9.
- Ece G, Samlioglu P, Atalay S, Kose S. Evaluation of the in vitro colistin susceptibility of Pseudomonas aeruginosa and Acinetobacter baumannii strains at a tertiary care centre in Western Turkey. Infez Med 2014; 22(1): 36-40.
- Yücel M, Yavuz T, Kaya D, Behçet M, Öztürk C, Şahin İ. Pseudomonas aeruginosa izolatlarının antibiyotiklere direnç oranının yıllar içinde değişimlerinin izlenmesi. ANKEM Derg 2006; 20(3): 152-5.
- Tunçoğlu E, Yenişehirli G, Bulut Y. Klinik örneklerden izole edilen Pseudomonas aeruginosa suşlarında antibiyotik direnci. ANKEM Derg 2009; 23(2): 54-8.
- Wolska MK, Bukowski K, Jakubczak A. Occurrence of beta-lactamase type ESBL and IBL in Pseudomonas aeruginosa rods. Med Dosw Mikrobiol 2001; 53(1): 45-51.
- Wolska K, Jakubczak A, Soszynska A. Antibiotic susceptibility and occurrence of ESBL, IBL and MBL in Pseudomonas aeruginosa strains. Med Dosw Mikrobiol 2008; 60(2): 111-9.
- Ekşi F, Bayram A, Balcı İ, Özer G. Pseudomonas aeruginosa suşlarında indüklenebilir beta-laktamaz aktivitesinin ve antibiyotiklere direncin araştırılması. Türk Mikrobiyol Cem Derg 2007; 37(3):142-6.
- Berktaş M, Güdücüoğlu H, Çıkman A, Parlak M, Yaman G. Nozokomiyal Pseudomonas aeruginosa suşlarında indüklenebilir beta-laktamaz aktivitesi. Fırat Tıp Derg 2011; 16(3): 125-8.
- Toleman M, Biedenbach D, Bennett D, Jones R, Walsh T. Italian metallo-beta-lactamases: a national problem? Report from the SENTRY Antimicrobial Surveillance Programme. J Antimicrob Chemother 2005; 55(1): 61-70.
- Sader HS, Castanheira M, Mendes R, Toleman M, Walsh T, Jones RN. Dissemination and diversity of metallo-beta-lactamases in Latin America: report from the SENTRY Antimicrobial Surveillance Program. Int J Antimicrob Agents 2005; 25(1): 57-61.
- Rizek C, Fu L, Dos Santos LC, et al. Characterization of carbapenem-resistant Pseudomonas aeruginosa clinical isolates, carrying multiple genes coding for this antibiotic resistance. Ann Clin Microbiol Antimicrob 2014; 13: 43.
- Çakar A. Hacettepe Üniversitesi Hastanesi'nde ayrıştırılan Pseudomonas aeruginosa izolatlarında metallo-beta-laktamaz enziminin fenotipik ve genotipik yöntemler ile araştırılması. Doktora Tezi, 2005. Hacettepe Üniversitesi Sağlık Bilimleri Enstitüsü, Ankara.
- Bozçal E. Hastane enfeksiyonu etkeni Pseudomonas aeruginosa suşlarının metallo-beta-laktamaz aktivitesinin fenotipik ve genotipik yöntemler ile saptanması. Yüksek Lisans Tezi, 2009. Ege Üniversitesi Fen Bilimleri Enstitüsü, İzmir.
- De Champs C, Chanal C, Sirot D, et al. Frequency and diversity of Class A extended-spectrum beta-lactamases in hospitals of the Auvergne, France: a 2 year prospective study. J Antimicrob Chemother 2004; 54(3): 634-9.
- Çelik N. Çoğul dirençli nozokomiyal Pseudomonas aeruginosa suşlarında beta-laktamazların fenotipik ve genotipik olarak incelenmesi. Doktora Tezi, 2007. İstanbul Üniversitesi Sağlık Bilimleri Enstitüsü, İstanbul.
- Ünlü Sögüt M. Ceftazidim dirençli Pseudomonas aeruginosa izolatlarında PER-1 ve OXA-10 benzeri beta-laktamazların moleküler yöntemlerle belirlenmesi. Doktora Tezi. 2008. Ondokuz Mayıs Üniversitesi Sağlık Bilimleri Enstitüsü, Samsun.
- Hunter RC, Newman DK. A putative ABC transporter, hatABCDE, is among molecular determinants of pyomelanin production in Pseudomonas aeruginosa. J Bacteriol 2010; 192(22): 5962-71.
İletişim (Correspondence):
Uzm. Dr. Halil Er,
Muş Devlet Hastanesi
Mikrobiyoloji Laboratuvarı,
Muş, Türkiye.
Tel (Phone): +90 505 515 2050,
E-posta (E-mail): haliler004@hotmail.com