Dermatofitozların Laboratuvar Tanısında Polimeraz Zincir Reaksiyonunun Kullanılması*
The Use of Polymerase Chain Reaction in Laboratory Diagnosis of Dermatophytosis
Yasin TİRYAKİ1, Berna GÜLTEKİN KORKMAZGİL2, Mete EYİGÖR2, Neriman AYDIN2
1 Aydın Devlet Hastanesi, Mikrobiyoloji Bölümü, Aydın.
1 Aydın State Hospital, Department of Microbiology, Aydin, Turkey.
2 Adnan Menderes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Aydın.
2 Adnan Menderes University Faculty of Medicine, Department of Medical Microbiology, Aydin, Turkey.
* Bu çalışma, Adnan Menderes Üniversitesi Araştırma Fon Saymanlığı tarafından TPF-10010 sayılı proje olarak desteklenmiş ve XXXV. Türk Mikrobiyoloji Kongresi (3-7 Kasım 2011, Kuşadası)'nde sözel bildiri olarak sunulmuştur.
ÖZ
Dermatofitler toplumda sık görülen enfeksiyonlara yol açan mantarlardır. Dermatofitozların tanısında kullanılan klasik yöntemlerden direkt mikroskopik incelemenin tür ayrımını yapamaması, kültürün ise uzun süre gerektirmesi ve duyarlılığının düşük olması gibi dezavantajları bulunmaktadır. Bu çalışmada, klinik örneklerden dermatofitlerin saptanmasında ve kültürden izole edilen suşların tanımlanmasında polimeraz zincir reaksiyonu (PCR) yönteminin performansının araştırılması amaçlanmıştır. Çalışmaya, dermatofitoz ön tanısı konulan 110 hastaya (69 kadın, 41 erkek; yaş aralığı: 4-82 yıl) ait 63'ü deri ve 60'ı tırnak kazıntısı olmak üzere toplam 123 örnek alınmıştır. Örnekler, rutin direkt mikroskopi ve mantar kültürünün yanı sıra iki turlu (nested) PCR (nPCR) yöntemine dayalı iki ayrı protokol ile incelenmiştir. Birinci protokolde dermatofitlerin kitin sentaz genini (CHS-1) hedefleyen pan-dermatofit nPCR; ikinci protokolde ise Trichophyton rubrum ve T. mentagrophytes'e özgül ITS-1 genlerini hedefleyen primerlerin kullanıldığı nPCR uygulanmıştır. Kültürde üreyen suşlara da aynı şekilde PCR uygulanmıştır. Pan-dermatofit nPCR'da pozitif, T.rubrum/T.mentagrophytes'e özgül nPCR ile negatif sonuç veren örnekler ayrıca dizi analizine alınmıştır. Çalışmamızda, örneklerin 62'sinde (%50) direkt mikroskopik incelemede hif ve/veya spor yapıları görülmüş, 30'unun (%24) kültüründe dermatofit üremiştir. T.rubrum/T.mentagrophytes'e özgül nPCR ile kültürde üreyen izolatların 28'i T.rubrum, ikisi T.mentagrophytes olarak tanımlanmıştır. Direkt uygulamada klinik örneklerin 67'si (%55) pan-dermatofit nPCR ile, 65'i (%53) ise T. rubrum/T. mentagrophytes'e özgül nPCR ile pozitif bulunmuştur. Direkt mikroskopide mantar elemanı görülmeyen örneklerin kültüründe de üreme olmamış, bu örneklerin dokuzu pan-dermatofit nPCR, sekizi T. rubrum/T.mentagrophytes'e özgül nPCR ile pozitif sonuç vermiştir. Kültüründe dermatofit üremesi olan 30 örneğin ikisi, direkt olarak uygulanan pan-dermatofit nPCR ile, biri T.rubrum/T.mentagrophytes'e özgül nPCR ile negatif bulunmuştur. Pan-dermatofit nPCR ile pozitif, T.rubrum/T.mentagrophytes'e özgül nPCR ile negatif sonuç veren üç örnekteki dermatofit suşu dizi analizi ile T.rubrum olarak tanımlanmıştır. Yöntemler arasındaki uyum değerlendirildiğinde; direkt mikroskopi ve kültür arasında orta düzeyde (kappa değeri; κ=0.48), direkt mikroskopi ile pan-dermatofit nPCR ve T.rubrum/T.mentagrophytes'e özgül nPCR arasında iyi düzeyde (κ=0.78), pan-dermatofit nPCR ile T.rubrum/T.mentagrophytes'e özgül nPCR arasında mükemmel düzeyde uyum bulunmuştur (κ=0.93). Çalışmamızda dermatofitozların laboratuvar tanısında kullanılmış olan iki farklı nPCR yöntemi, kültüre göre daha kısa sürede ve yüksek oranda pozitif sonuç vermiştir. Sonuç olarak, dermatofitlerin gerek direkt klinik örneklerden gerekse kültürde üreme sonrası tanımlanmasında nPCR'nin yararlı olduğu düşünülmüştür.
Anahtar sözcükler: Dermatofit; Trichophyton; direkt mikroskopi; kültür; iki turlu PCR.
ABSTRACT
Dermatophytes are among the common causes of fungal infections in the community. Classical diagnostic tests for dermatophytosis have some disadvantages such as failure of direct microscopy in species differentiation and culture methods being time consuming and having low sensitivity. The aim of this study was to investigate the performance of polymerase chain reaction (PCR) in the identification of dermatophytes directly from the clinical samples and the cultures. A total of 123 samples that comprise 63 skin and 60 nail scrapings obtained from 110 patients (69 female, 41 male; age range: 4-82 years) who were prediagnosed as dermatophytosis, were included in the study. Samples were examined with routine direct microscopy, culture and two different nested PCR (nPCR) protocols. The first was a pan-dermatophyte nPCR protocol targeting chitin synthase gene (CHS-1) of dermatophytes and the second was a nPCR protocol which targets specific ITS-1 genes of Trichophyton rubrum and T.mentagrophytes. Similar PCR methods were also applied to cultivated strains. Sequence analysis was performed for the samples that yielded positive results in pan-dermatophyte nPCR and negative results in T.rubrum/T.mentagrophytes - specific nPCR. Hyphae and/or spore structures were observed in 62 (50%) samples with direct microscopic examination and dermatophytes were isolated in 30 (24%) samples. Twenty-eight of the isolates grown in culture were identified as T.rubrum, and two as T.mentagrophytes with T.rubrum/T.mentagrophytes-specific nPCR protocol. In direct application, 67 (55%) of the clinical samples were found positive with pan-dermatophyte nPCR and 65 (53%) were positive with T.rubrum/T.mentagrophytes-specific nPCR. Samples which were negative in direct microscopic examination were also negative in culture. Nine of them were found positive with pan-dermatophyte nPCR and eight were positive with T.rubrum/T.mentagrophytes-specific nPCR. Two of the 30 samples which were positive in culture were negative in direct pan-dermatophyte nPCR, and one of them was negative in T.rubrum/T. mentagrophytes-specific nPCR. Three samples which were positive by pan-dermatophyte nPCR, gave negative result with T.rubrum/T.mentagrophytes-specific nPCR. Sequence analysis was performed for these three samples and all were identified as T.rubrum. In evaluation of concordance between the methods, the agreement of direct microscopy and culture was moderate (kappa value; κ= 0.48), the agreement of direct microscopy and both protocols of nPCR was high (κ= 0.78) and the agreement of both nPCR protocols with each other was excellent (κ= 0.93). Our data indicated that two different nPCR methods used for the laboratory diagnosis of dermatophytosis yielded higher positivity in less time than the culture method. In conclusion, nPCR was considered to be useful in identification of dermatophytosis from either direct clinical samples or culture-isolated strains.
Keywords: Dermatophyte; Trichophyton; direct microscopy; culture; nested PCR.
Geliş Tarihi (Received): 05.11.2014 - Kabul Ediliş Tarihi (Accepted): 02.12.2014
GİRİŞ
Dermatofitler, saç, deri ve tırnak gibi keratin içeren dokularda enfeksiyon oluşturma yeteneğine sahip küf mantarlarıdır1. Bu mantarların etken olduğu enfeksiyonlar (dermatofitoz) tüm dünyada yaygın ve sık olarak görülmektedir2. Dermatofitozların laboratuvar tanısı için sıklıkla kullanılan yöntemler direkt mikroskopik inceleme (DMİ) ve mantar kültürüdür. DMİ'nin duyarlılığı mantar kültürüne göre daha yüksektir; ancak bu yöntemin yalancı negatif sonuçların alınabilmesi ve tür tayininin yapılamaması gibi olumsuzlukları bulunmaktadır3. Dermatofitlerin üreme zamanının uzun olması (1-4 hafta), besiyerlerinin saprofit mantarlar ile kontamine olabilmesi ve örnekte mantar elemanlarının az sayıda bulunması nedeniyle yalancı negatif sonuçlar alınabilmesi de mantar kültürünün olumsuz özelikleridir. Bunun yanında kültürde üreyen mantarların tanımlanması için zaman alıcı, zahmetli ve bazen kesin tanı sağlayamayan testlere ihtiyaç duyulmaktadır4.
Son yıllarda dermatofitozların tanısında moleküler yöntemlerin kullanıldığı çalışmaların sayısı giderek artmaktadır. Yapılan çalışmalarda sıklıkla polimeraz zincir reaksiyonu (PCR) tek başına ya da RFLP (Restriction Fragment Length Polymorphism) ve dizi analizi gibi yöntemlerle beraber kullanılmıştır5,6. Moleküler yöntemlerin, dermatofitlerin klinik örneklerden direkt olarak saptanmasında ve kültürde üreyen suşların tanısında klasik yöntemlere göre daha kısa sürede ve doğru sonuç verdiği belirtilmektedir3. Bu çalışmada, dermatofitlerin saptanmasında ve tanımlanmasında moleküler yöntemlerin kullanılabilirliğinin araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
olgular
Çalışmaya, 01.03.2010-30.06.2010 tarihleri arasında Aydın Devlet Hastanesi Dermatoloji Polikliniklerinde dermatofitoz ön tanısı ile, üniversite hastanemizin mikrobiyoloji laboratuvarına gönderilen 110 olgu alındı. Lezyonun özelliği nedeniyle yeterli miktarda örneğin alınamadığı ve lokal ya da sistemik antifungal ilaç kullandığı öğrenilen olgular çalışma dışı bırakıldı. Çalışma için yerel etik kurul onayı ve İl Sağlık Müdürlüğünden gerekli izinler alındı.
Direkt Mikroskopik İnceleme
Olgulardan alınan deri ve tırnak kazıntı örnekleri, lam üzerinde %20'lik potasyum hidroksit solüsyonu ile karıştırıldı ve üzerlerine lamel kapatıldı. Oda sıcaklığında 15-20 dakika bekletildikten sonra mikroskopta 40x objektif ile incelenerek hif ve spor yapıları araştırıldı7.
Mantar Kültürü
Örneklerden Sabouraud dekstroz agar (SDA) ve patates dekstroz agar (PDA) besiyerlerine batırma ekimi yapıldı ve besiyerleri 28°C'de iki aya kadar inkübasyona bırakıldı. SDA ve PDA besiyerlerinde suşların üreme hızı, koloni morfolojisi, koloni yüzeyinin ve tabanının rengi incelendi. Kültürde üreyen suşlardan petrideki besiyerlerine pasaj yapıldı. Pasajlardaki kolonilerden laktofenol pamuk mavisi (Merck, Almanya)-selofan bant yöntemi ile mikroskopik inceleme yapıldı4,7.
DNA Ekstraksiyonu ve Nested-PCR (nPCR)
Klinik örneklerden DNA ekstraksiyonu, Brillowska-Dabrowska ve arkadaşlarının8 bildirdiği yöntemle yapıldı. Buna göre 60 mM sodyum bikarbonat (NaHCO3), 250 mM potasyum klorür (KCl) ve 50 mM Tris karışımından oluşan ekstraksiyon tamponu hazırlandı (pH: 9.5). Steril mikrosantrifüj tüpüne 100 μl ekstraksiyon tamponu ve yaklaşık 10 mg örnek eklendikten sonra 95°C'de 10 dakika bekletildi. Ardından üzerine %2'lik sığır serum albumininden (BD Difco, ABD) 100 μl eklendi ve 5 saniye karıştırıldı. Bu şekilde hazırlanan DNA ekstraksiyon ürünü çalışılana dek -20°C'de saklandı.
Kültürde üreyen dermatofit kolonilerinden ise DNA ekstraksiyonu, PureLink Genomic DNA Mini Kit (İnvitrogen, ABD) kullanılarak kit protokolüne uygun olarak yapıldı.
Klinik örneklere ve kültürde üreyen dermatofit özelliğindeki suşlara iki ayrı protokol ile, iki turlu (nested)-PCR (nPCR) uygulandı (Tablo I). Kontrol amacıyla tüm klinik örneklere, gliseraldehit-3-fosfat dehidrogenaz (GA3PD) enzimini kodlayan gen bölgesini (300 bç) hedefleyen PCR uygulandı11.
Tüm çalışmalarda kontrol suşları olarak; Epidermophyton floccosum RSKK (Refik Saydam Hıfzıssıhha Merkezi Başkanlığı Ulusal Tip Kültür Koleksiyonu) 03018, Trichophyton verrucosum RSKK 296, Trichophyton tonsurans RSKK 299, Trichophyton rubrum RSKK 486 ve dizi analizi ile doğrulanmış T. mentagrophytes laboratuvar suşu kullanıldı.
Dizi Analizi
Pan-dermatofit PCR'da pozitif, ancak T.rubrum/T.mentagrophytes'e özgül nPCR ile negatif sonuç veren 3 örneğe ticari firma (Macrogen, Kore) tarafından dizi analizi uygulandı. Sonuçlar National Center of Biotechnology Informationın web sayfasında yer alan BLAST programı (http://www.ncbi.nlm.nih.gov/BLAST/) kullanılarak karşılaştırıldı.
İstatistiksel Analiz
Yöntemler arasındaki uyumun belirlenmesinde SPSS 14.0 paket programında bulunan kappa testi kullanıldı.
BULGULAR
Çalışmamızda, 110 olgudan alınan 63'ü deri kazıntısı, 60'ı tırnak kazıntısı olmak üzere toplam 123 örnek (11'inden ikişer, birinden üç örnek) değerlendirilmiştir. Olguların 69'u kadın, 41'i erkek olup, yaş ortalamaları 44.85 ± 16.39 (yaş aralığı: 4-82) yıldır.
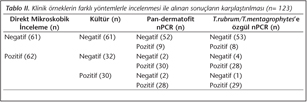
Klinik örneklerin 62'sinde (%50) DMİ ile hif ve/veya artrospor yapıları görülmüş, 30'unda (%24) mantar kültüründe dermatofit üremesi olmuştur. DMİ sonucu negatif bulunan örneklerin kültüründe üreme saptanmamıştır. Kültürde üreyen 30 suş pan-dermatofit n-PCR ve T.rubrum/T.mentagrophytes'e özgül nPCR ile pozitif sonuç vermiştir (28 suş T.rubrum, 2 suş T.mentagrophytes için özgül bant oluşturmuştur). Örneklerin ikisinin kültüründe T.rubrum üremesine rağmen, direkt yapılan pan-dermatofit nPCR sonucu negatif bulunmuştur. Bunlardan biri aynı zamanda örnekten direkt olarak yapılan T.rubrum/T.mentagrophytes'e özgül nPCR ile negatif sonuç vermiştir. Bu iki örnekte DMİ ile mantar elemanları görülmüştür. Örneklerin DMİ, kültür ve PCR sonuçları Tablo II'de sunulmuştur.
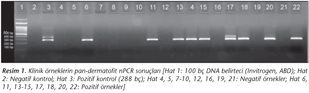
Çalışmaya alınan 123 örneğin 67'sinde (%55) pan-dermatofit nPCR pozitif bulunmuş (Resim 1); 65'inde (%53) ise T.rubrum/T.mentagrophytes'e özgül nPCR pozitif sonuç (60'ı T.rubrum, 5'i T.mentagrophytes) vermiştir (Resim 2). Klinik örneklerin tümünde kontrol amacıyla yapılan GA3PD-PCR pozitif bulunmuştur.
T.rubrum/T.mentagrophytes'e özgül nPCR'da T.rubrum olarak tanımlanan bir örnek, pan-dermatofit nPCR'da negatif sonuç vermiştir. Pan-dermatofit nPCR'da pozitif bulunan üç örnek, T.rubrum/T.mentagrophytes'e özgül nPCR'da negatif bulunmuştur. Bu üç örnekten pan-dermatofit nPCR ile çoğaltılmış ürünlere dizi analizi uygulanmış ve üçü de T.rubrum olarak tanımlanmıştır.
Yöntemler arasındaki uyum değerlendirildiğinde; DMİ ve mantar kültürü arasında orta düzeyde (kappa value: κ= 0.48), DMİ ile pan-dermatofit nPCR ve T.rubrum/T.mentagrophytes'e özgül nPCR arasında iyi düzeyde (κ= 0.78), pan-dermatofit nPCR ile T.rubrum/T.mentagrophytes'e özgül nPCR arasında mükemmel düzeyde uyum bulunmuştur (κ= 0.93).
TARTIŞMA
Çalışmamızda, dermatofitoz ön tanılı hastalardan alınan örneklerin %50'sinde DMİ'de mantar elemanları görülmüş, %24'ünde mantar kültüründe dermatofit üremiştir. Meriç ve arkadaşları12, dermatofitoz ön tanısı ile incelenen örneklerde DMİ ve mantar kültürünün pozitiflik oranlarını sırasıyla %13.1 ve %13.6; Özekinci ve arkadaşları13 %19.7 ve %13.9; Arca ve arkadaşları14 %77 ve %23; Garg ve arkadaşları15 ise %63.4 ve %25 olarak bildirmişlerdir. Meriç ve arkadaşlarının12 çalışması dışındaki çalışmalarda14,15,16, bizim çalışmamızda olduğu gibi mantarların DMİ'de saptanma oranları, kültürde üreme oranlarına göre daha yüksektir. Bu durum, örnekte mantar yapılarının az sayıda bulunması veya hiflerin canlılığını yitirmiş olması ile açıklanabilmektedir9,17.
Dermatofitlerin laboratuvar tanısında rutinde kullanılan yöntemler olan DMİ ve mantar kültürünün olumsuz yanlarının bulunması nedeniyle yeni testlere ihtiyaç duyulmaktadır. Mikrobiyolojide birçok alanda kullanılan moleküler yöntemlerin bu amaçla kullanılıp kullanılamayacağı ile ilgili çalışmalar yapılmaktadır. Dermatofitoz tanısında en sık kullanılan moleküler yöntemler arasında PCR, PCR-RFLP ve PCR-dizi analizi yer almaktadır6,14,18,19. Çalışmamızda her iki nPCR protokolü ile alınan sonuçlarda, direkt klinik örneklerde saptanan pozitiflik oranları oldukça yüksek ve sonuç alma zamanları kültüre göre kısa bulunmuştur. Aynı zamanda kültürde üreyen suşların tümü pan-dermatofit nPCR ile dermatofit olarak, T.rubrum/T.mentagrophytes'e özgül nPCR ile tür düzeyinde, aynı gün içinde ve ek teste gerek kalmadan tanımlanmıştır. Yapılan bazı çalışmalarda, benzer şekilde kültürde üremiş ancak tanımlanamamış suşların PCR ile kısa sürede ve doğru olarak tanımlandığı bildirilmiştir5,10.
Turin ve arkadaşları6 kültürde üretilen dermatofitlerden ve kazıntı örneklerinden yapılan 18S rDNA'yı hedefleyen PCR ile dermatofit türlerinin ayrılamadığını, ITS bölgesini hedefleyen PCR ile bu ayrımın yapılabildiğini; 20 örneğin 12'sinde kültürde üreme saptandığını, 10'unda PCR ile pozitif sonuç alındığını bildirmiştir. Arca ve arkadaşları14, onikomikoz şüphesi olan 52 hastadan alınan örneklerin %77.7'sini DMİ ile, %23'ünü kültür ile, %38'ini mantarların ITS bölgesini hedefleyen (ITS1-ITS4 primerleri) PCR ile pozitif bulmuşlardır. Bu çalışmalarda görüldüğü gibi, 18S rDNA ya da ITS bölgesini çoğaltan genel primerlerin seçildiği PCR ile örneklerde dermatofitlerin saptanma oranları klasik yöntemlere göre daha düşük bulunmuştur6,14. Buna karşın nPCR ile yapılan çalışmalarda, dermatofitlerin saptanma oranlarının yüksek olduğu görülmektedir9,10,15. Garg ve arkadaşları15 onikomikoz şüpheli 152 tırnak örneğinin %63.4'ünü DMİ ile, %79.6'sını pan-dermatofit nPCR ile, %25'ini kültür ile pozitif bulmuşlardır. Araştırmacılar aynı yöntemi kullandıkları diğer çalışmalarında dermatofitoz şüpheli 105 deri örneğinde DMİ, pan-dermatofit nPCR ve kültür ile pozitiflik oranlarını sırasıyla %63.8, %82.8 ve %23.8 olarak saptamışlar ve dermatofitozların laboratuvar tanısında pan-dermatofit nPCR'nin altın standart olarak kullanılabilebileceğini belirtmişlerdir9. Uchida ve arkadaşları10, DMİ'de mantar elemanları görülen 206 örnekte (126 deri, 80 tırnak örneği) kültür temelli morfolojik yöntemler ile deri ve tırnak örneklerinde sırasıyla %67 ve %33, PCR ile %95 ve %99 oranında pozitiflik saptamışlardır. Berk ve arkadaşları20 onikomikoz şüpheli 90 örneği inceledikleri çalışmalarında, örneklerin 72'sini DMİ ile, 20'sini kültür ile, 75'ini T.rubrum'a özgül primerlerin kullanıldığı gerçek zamanlı PCR ile pozitif bulmuşlar ve moleküler yöntemlerin geleneksel yöntemlerin tamamlayıcısı olduğunu vurgulamışlardır. Çalışmamızda iki farklı nPCR ile hızlı ve kültüre göre oldukça yüksek oranda pozitif sonuç elde edilmiştir. Pan-dermatofit nPCR ile dermatofit türü belirlenememekte, bu amaçla dizi analizi gibi ek bir yönteme ihtiyaç duyulmaktadır. T.rubrum/T.mentagrophytes'e özgül nPCR ile en sık görülen bu iki dermatofit ek teste gerek kalmadan saptanmakta, ancak bu iki tür dışındakiler saptanamamaktadır. Çalışmamızda bu iki yöntem arasındaki uyumun yüksek olduğu görülmüştür. Bu yöntemlerin, bizim kullandığımız şekilde kombine edilerek ya da sık karşılaşılan etkenlerden biri, laboratuvar alt yapısına göre seçilerek kullanabileceği düşünülmüştür.
DMİ sonucu pozitif bulunan örneklerin dördünde pan-dermatofit nPCR, beşinde T.rubrum/T.mentagrophytes'e özgül nPCR negatif sonuç vermiştir. Bu durumda DMİ yapılmadığında bu örneklere ait pozitiflik gözden kaçabilmektedir. Mantar kültüründe T.rubrum üreyen iki örnekten direkt olarak yapılan pan-dermatofit PCR sonucu negatif bulunmuştur. Bunlardan biri aynı zamanda direkt T.rubrum/T.mentagrophytes'e özgül nPCR ile de negatif sonuç vermiştir. Bu iki örnekte DMİ'de mantar elemanları görülmüştür. Mümkün olan en yüksek pozitiflik oranlarının elde edilebilmesi için DMİ, kültür ve PCR'nin bir arada kullanılması gerekli görülmektedir. Sonuç olarak çalışmamızda, dermatofitozların laboratuvar tanısında iki farklı nPCR yöntemi, kültüre göre daha kısa sürede ve yüksek oranda pozitif sonuç vermiştir. Dermatofitlerin direkt klinik örneklerden ya da kültürde üreme sonrası tanımlanmasında nPCR'nin yararlı olduğu düşünülmüştür.
TEŞEKKÜR
Örnek toplama aşamasındaki yardımlarından dolayı Aydın Devlet Hastanesi Dermatoloji ve Mikrobiyoloji Bölümlerine teşekkür ederiz.
KAYNAKLAR
- Hainer BL. Dermatophyte infections. Am Fam Physician 2003; 67(1): 101-8.
- Kanbe T. Molecular approaches in the diagnosis of dermatophytosis. Mycopathologia 2008; 166(5-6):307-17.
- Panasiti V, Borroni RG, Devirgiliis V, et al. Comparison of diagnostic methods in the diagnosis of dermatomycoses and onychomycoses. Mycoses 2006; 49(1): 26-9.
- Robert R, Pihet M. Conventional methods for the diagnosis of dermatophytosis. Mycopathologia 2008; 166(5-6): 295-306.
- Makimura K, Tamura Y, Mochizuki T, et al. Phylogenetic classification and species identification of dermatophyte strains based on DNA sequences of nuclear ribosomal internal transcribed spacer 1 regions. J Clin Microbiol 1999; 37(4): 920-4.
- Turin L, Riva F, Galbiati G, Cainelli T. Fast, simple and highly sensitive double-rounded polymerase chain reaction assay to detect medically relevant fungi in dermatological specimens. Eur J Clin Invest 2000; 30(6): 511-8.
- Saniç A. Dermatofitler, s: 1031-44. Ustaçelebi Ş (Ed), Temel ve Klinik Mikrobiyoloji. 1999, Güneş Kitabevi, Ankara.
- Brillowska-Dabrowska A, Saunte DM, Arendrup MC. Five-hour diagnosis of dermatophyte nail infections with specific detection of Trichophyton rubrum. J Clin Microbiol 2007; 45(4): 1200-4.
- Garg J, Tilak R, Garg A, Prakash P, Gulati AK, Nath G. Rapid detection of dermatophytes from skin and hair. BMC Res Notes 2009; 2: 60.
- Uchida T, Makimura K, Ishihara K, et al. Comparative study of direct polymerase chain reaction, microscopic examination and culture-based morphological methods for detection and identification of dermatophytes in nail and skin samples. J Dermatol 2009; 36(4): 202-8.
- Johnson BJ, McMurray DN. Cytokine gene expression by cultures of human lymphocytes with autologous Mycobacterium tuberculosis-infected monocytes. Infect Immun 1994; 62(4): 1444-50.
- Meriç M, Yuluğkural Z, Keçeli S, Willke A. Onikomikoz ön tanılı olgulardan izole edilen dermatofit türleri ve mantar kültürünün tanısal değeri. Mikrobiyol Bul 2004; 38(4): 435-9.
- Özekinci T, Özbek E, Gedik M, Topçu M, Tekay F, Mete M. Dicle Üniversitesi Tıp Fakültesi Mikrobiyoji Laboratuvarına başvuran hastalarda dermatofitoz etkenleri. Dicle Tıp Derg 2006; 33(1): 19-22.
- Arca E, Saracli MA, Akar A, Yildiran ST, Kurumlu Z, Gur AR. Polymerase chain reaction in the diagnosis of onychomycosis. Eur J Dermatol 2004; 14(1): 52-5.
- Garg J, Tilak R, Singh S, et al. Evaluation of pan-dermatophyte nested PCR in diagnosis of onychomycosis. J Clin Microbiol 2007; 45(10): 3443-5.
- Kardjeva V, Summerbell R, Kantardjiev T, Devliotou-Panagiotidou D, Sotiriou E, Gräser Y. Forty-eight-hour diagnosis of onychomycosis with subtyping of Trichophyton rubrum strains. J Clin Microbiol 2006; 44(4): 1419-27.
- Gürcan Ş, Tikveşli M, Eskiocak M, Kılıç H, Otkun M. Dermatofitozlarda etkenlerin ve risk faktörlerinin araştırılması: Hastane bazlı bir çalışma. Mikrobiyol Bul 2008; 42(1): 95-102.
- Beak SC, Chae HJ, Houh D, Byun DG, Cho BK. Detection and differentiation of causative fungi of onychomycosis using PCR amplification and restriction enzyme analysis. Int J Dermatol 1998; 37(9): 682-6.
- Kano R, Hirai A, Muramatsu M, Watari T, Hasegawa A. Direct detection of dermatophytes in skin samples based on sequences of the chitin synthase 1 (CHS1) gene. J Vet Med Sci 2003; 65(2): 267-70.
- Berk E, Kuştimur S, Kalkancı A, Öztaş OM. Onikomikozlu olguların direkt tırnak kazıntı örneklerinden DNA izolasyonu ve gerçek zamanlı polimeraz zincir reaksiyonu ile Trichophyton rubrum tanımlanması. Mikrobiyol Bul 2011; 45(1): 150-8.
İletişim (Correspondence):
Doç. Dr. Berna Gültekin Korkmazgil,
Adnan Menderes Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Aydın Türkiye
Tel (Phone): +90 256 444 1256/2723,
E-posta (E-mail): gultekinberna@hotmail.com