Mikrobiyoloji Laboratuvarlarında Maya Türlerinin Tanımlanmasında Sık Kullanılan
Ticari Sistemlerin Değerlendirilmesi: Çok Merkezli Bir Çalışma
Evaluation of Common Commercial Systems for the Identification of Yeast Isolates in
Microbiology Laboratories: A Multicenter Study
Nilgün KARABIÇAK1, Hatice ULUDAĞ ALTUN2,3, Onur KARATUNA4, Gülşen HAZIROLAN5, Neriman AKSU5,
Ali ADİLOĞLU2, Işın AKYAR4
1 Türkiye Halk Sağlığı Kurumu, Mikoloji Referans Laboratuvarı, Ankara.
1 Public Health Institution of Turkey, Mycology Reference Laboratory, Ankara, Turkey.
2 Ankara Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Laboratuvarı, Ankara.
2 Ankara Training and Research Hospital, Microbiology Laboratory, Ankara, Turkey.
3 Turgut Özal Üniversitesi Tıp Fakültesi Hastanesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
3 Turgut Ozal University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
4 Acıbadem Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
4 Acibadem University Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
5 Ankara Numune Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Laboratuvarı, Ankara.
5 Ankara Numune Training and Research Hospital, Microbiology Laboratory, Ankara, Turkey.
ÖZ
Son yıllarda türe özgü klinik direnç sınır değerlerinin belirlenmesi nedeniyle ve uygun antifungal tedaviye erken başlanması için maya türlerinin doğru ve hızlı tanımlanması önemlidir. Klinik laboratuvarlarda tanımlama, sıklıkla biyokimyasal özellikleri temel alan çeşitli ticari sistemlerle ve nadiren de fizyolojik ve morfolojik özelliklere göre yapılmaktadır. Bu çalışmanın amacı, rutin laboratuvarlarda sık kullanılan Vitek 2 sistemi YST maya tanımlama kartı (Vitek; bioMérieux, Fransa) ve API 20C AUX (API; bioMérieux, Fransa) sisteminin konvansiyonel mikolojik tanı yöntemleriyle karşılaştırılmasıdır. Çalışmamızda, çeşitli üniversite ve eğitim/araştırma hastanelerinde klinik örneklerden izole edilen ve Vitek ile tanımlanan toplam 473 maya izolatı, Türkiye Halk Sağlığı Kurumu, Mikoloji Referans Laboratuvarı'nda, API sistemi ve morfolojik tanımlamayı da içeren konvansiyonel mikolojik yöntemler ile birlikte değerlendirilerek tür düzeyinde tanımlanmıştır. Çalışmada kalite kontrol suşları olarak Candida dubliniensis MYA 583, Candida krusei ATCC 6258, Candida parapsilosis ATCC 22019, Candida albicans ATCC 10231 ve Cryptococcus neoformans ATCC 32268 kullanılmış; standart suşlar her iki sistemle de ardarda 10 gün çalışılmıştır. Konvansiyonel yöntemler ile tanımlanan 473 klinik maya izolatının [6 cins (Candida, Cryptococcus, Blastoshizomyces, Rhodotorula, Saccharomyces, Trichosporon), 17 tür (5'i sık, 12'si nadir görülen)] Vitek ve API sonuçları karşılaştırıldığında; sistemlerin performansı, sık görülen türlerin (C.albicans, C.parapsilosis, C.glabrata, C.tropicalis ve C.krusei) tanımlanmasında (Vitek: %95; API: %96), nadir görülen türlerden (Vitek: %78.4; API: %71.6) daha iyi bulunmuştur (p= 0.155). Yanlış tanımlama veya tanımlayamama, her iki sistemle de, sık görülen türlerden en sık C.parapsilosis (Vitek: 6/87; API: 7/87) ve C.glabrata (Vitek: 9/104; API: 3/104) izolatlarında görülürken, nadir görülen türlerden C.pelliculosa (Vitek: 3/11; API: 6/11) ve C.dubliniensis (Vitek ve API: 2/5) izolatlarında saptanmıştır. API ile C.guilliermondii (API: 2/5) izolatlarının tanısı diğer türlere göre daha problemlidir. Blastoschizomyces capitatus ve Saccharomyces cerevisiae türleri, Vitek ve API ile tanımlanamamıştır. Sonuç olarak, Vitek ve API testlerinin doğru tanı koyma açısından tutarlılıkları benzer bulunmuş (%86.3); sık karşılaşılan türlerde tanımlama oranları daha yüksekken (en az %95) nadir görülen türlerde azaldığı dikkati çekmiştir. Ticari sistemlere morfolojik tanımlamanın da eklenmesi, tanıyı kolaylaştırmasının yanı sıra birden fazla etkenle meydana gelen enfeksiyonların doğru tanımlanması ve tedavisinde de yararlı olacaktır.
Anahtar sözcükler: Maya; tanımlama; API® 20 C AUX; VITEK® 2 YST ID kart.
ABSTRACT
Accurate and rapid identification of yeast isolates have become important in recent years for not only antifungal susceptibility testing due to the species-specific clinical resistance breakpoints but also early initiation of appropriate antifungal therapy. In clinical microbiology laboratories species identification of yeasts is often performed with several commercial systems based on biochemical properties and rarely according to the physiological and morphological characteristics. The aim of this study was to compare the two common commercial systems, VITEK 2 YST ID Card (Vitek; bioMérieux, France) and API 20C AUX (API; bioMérieux, France) with conventional mycological methods. A total of 473 clinical yeast strains isolated from clinical specimens in different university and training/research hospitals and identified by Vitek system were included in the study. The isolates were re-identified with API and conventional methods including morphological identification in the Mycology Reference Laboratory of the Public Health Institute of Turkey. Candida dubliniensis MYA 583, Candida krusei ATCC 6258, Candida parapsilosis ATCC 22019, Candida albicans ATCC 10231 and Cryptococcus neoformans ATCC 32268 were used as quality control strains and those standard strains were studied consecutively 10 days with both of the methods. The results of identification by Vitek and API were compared with the results of conventional methods for those 473 yeast isolates [6 genus (Candida, Cryptococcus, Blastoshizomyces, Rhodotorula, Saccharomyces, Trichosporon), 17 species (5 common and 12 rarely isolated)]. The performances of the systems were better (Vitek: 95%; API: 96%) for the commonly detected species (C.albicans, C.parapsilosis, C.glabrata, C.tropicalis and C.krusei) than those for rarely detected species (Vitek: 78.4%; API: 71.6%) (p= 0.155). Misidentification or unidentification were mostly detected for C.parapsilosis (Vitek: 6/87; API: 7/87) and C.glabrata (Vitek: 9/104; API: 3/104) by both of the systems. For rarely detected yeast isolates, misidentification or unidentification were most frequently observed in species of C.pelliculosa (Vitek: 3/11; API: 6/11) and C.dubliniensis (API and Vitek: 2/5) isolates. Candida guilliermondii (API: 2/5) isolates had lower rate of identification with API compared to other species. Blastoschizomyces capitatus and Saccharomyces cerevisiae isolates could not be identified by both of the systems. As a result, the accurate diagnosis of Vitek and API systems were similar in terms of consistency (86.3%). Two systems performed well in correct identiÞcation of common clinical yeast species (at least 95%), while the identiÞcation of rare species was more challenging indicating that they require further morphological and physiological testing. The addition of morphological identification to commercial systems will be useful for accurate diagnosis and treatment of mixed infections.
Keywords: Yeast; identification; API® 20C AUX; VITEK® 2 YST ID card.
Geliş Tarihi (Received): 10.12.2014 - Kabul Ediliş Tarihi (Accepted): 21.03.2015
GİRİŞ
Candida spp. ve diğer maya mantarlarının neden olduğu invazif mantar enfeksiyonları, son yıllarda giderek artan sıklıkta karşımıza çıkmaktadır. Bu enfeksiyonlar altta yatan ciddi hastalığı olan hastalar için mortalite ve morbiditenin önemli nedenleri arasında yer almaktadır1,2,3,4,5,6. Amerika'da hastane kökenli kan dolaşımı enfeksiyonlarında Candida türleri dördüncü sırada saptanmakta ve nötropenik olmayan hasta grubunda da tüm sepsis ataklarının yarısından fazlasına neden olmaktadır3. Hastane kökenli mantar enfeksiyonlarında Candida albicans hala en sık karşılaşılan etken olmakla birlikte, C.glabrata, C.parapsilosis, C.tropicalis, C.lusitaniae ve C.krusei gibi diğer Candida türlerine ve Cryptococcus, Trichosporon, Geotrichum, Rhodotorula, Saccharomyces gibi diğer maya türlerine giderek artan sıklıkta rastlanmaktadır1,2,3,4,5.
Maya türlerinin doğru ve hızlı tanımlanması, uygun antifungal tedavinin seçimi, duyarlı hastalara yayılma riskinin izlenmesi ve epidemiyolojik yönden önemlidir3. Antifungal duyarlılık ve direncin gösterilmesinde kullanılan direnç sınır değerleri, son yıllarda Clinical Laboratory Standards Institute (CLSI) tarafından güncellenmiş ve yeni türe özgü klinik direnç sınır değerleri ve epidemiyolojik eşik değerleri belirlenmiştir7. Bu nedenle klinik laboratuvarlarda sık karşılaşılan başta Candida spp. olmak üzere maya mantarlarının tür düzeyinde tanımlanması daha da önemli bir hale gelmiştir. Günümüzde klinik laboratuvarlarda maya tanımlaması biyokimyasal özellikleri temel alan çeşitli ticari sistemlerle ve nadiren de fizyolojik ve morfolojik özellikleriyle yapılmaktadır5,8,9. Bu sistemlerin performansı, tanısı güç veya değişik patojen mayaların ortaya çıkması, taksonomideki gelişmeler ve olası coğrafi tür varyasyonları nedeniyle sürekli izlenmelidir2,10. Bu çalışmada, mayaların tür düzeyinde tanımlanmasında kullanılan Vitek 2 otomotize sistemi YST maya tanımlama kartı ve API 20C AUX sisteminin konvansiyonel mikolojik yöntemlerle karşılaştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Klinik İzolatlar
Bu çalışmada, Acıbadem Üniversitesi'nin afiliye laboratuvarları olan Acıbadem Labmed Klinik Laboratuvarları (n= 229), Numune Eğitim ve Araştırma Hastanesi Mikrobiyoloji Laboratuvarları (n= 149) ve Ankara Eğitim ve Araştırma Hastanesi Mikrobiyoloji Laboratuvarında (n= 95), çeşitli klinik örneklerden izole edilen toplam 473 maya suşu, YST maya tanımlama kartı ile Vitek 2 sisteminde tanımlandı. Klinik izolatlar, Sabouraud dekstroz agar (SDA; Oxoid, İngiltere) besiyerinde Türkiye Halk Sağlığı Kurumu, Mikoloji Referans Laboratuvarına gönderildi.
Tanımlama Prosedürü ve Sonuçların Yorumlanması
Türkiye Halk Sağlığı Kurumu, Mikoloji Referans Laboratuvarına (THSK-MRL) kabul edilen klinik izolatların saf kültür olduklarını doğrulamak için tüm izolatlar (n= 473) laboratuvarımızın maya izolatları standart tanımlama prosedürüne göre, siklohekzimid içeren ve içermeyen kloramfenikollü SDA (Oxoid, İngiltere) ve kromojenik besiyerine (CHROMagar Candida, Becton Dickinson, ABD) ekildi. Kromojenik besiyerinde farklı renk ve morfolojide maya kolonileri görüldüğünde birden fazla maya türünün varlığı düşünüldü ve saf kültür elde edebilmek için, kromojenik besiyerindeki farklı renklerdeki kolonilerin herbirinden tekrar kromojenik besiyerine tek koloni pasajları yapıldı. Ardından mayaların morfolojik özelliklerinin belirlenmesi ve tür tanımlamasına katkı sağlamak amacıyla mısır unu/Tween-80 besiyerine Dalmau yöntemiyle ekildi11. İzolatların kromojenik besiyerinde oluşturduğu renk, koloni morfolojisi ve mısır unu/Tween-80 besiyerindeki hif, yalancı hif, klamidospor, blastokonidyum veya artrokonidyum gibi mikroskobik morfolojileri değerlendirildi. Ayrıca bu izolatlara, çimlenme borusu (germ tüp) testi ve API 20C AUX testi (bioMérieux, Fransa) uygulandı.
Testlerin sonucunda saptanan fizyolojik ve morfolojik özelliklerin birlikte değerlendirilmesi ile izolat tür düzeyinde tanımlandı. Bu prosedüre göre tanımlanamayan, nadir görülen maya türlerinin tanımlanması için, karbonhidrat fermentasyonu (glukoz, maltoz, sükroz, laktoz, galaktoz ve trehaloz), API ID32C sistemi (bioMérieux, Fransa), pigment üretimi, nitrat asimilasyonu, üre hidrolizi ve çeşitli ısılarda üremeyi (25°C, 37°C ve 42°C) içeren diğer mikolojik tanımlama yöntemleri standart tanımlama prosedürüne ilave edildi5,11,12.
Vitek 2 Sistemi YST Maya Tanımlama Kartı (Vitek, bioMérieux, Fransa)
YST maya tanımlama kartı, 46 biyokimyasal test içeren, 64 kuyucuklu tek kullanımlık plastik bir karttan oluşur ve 53 maya türü tanımlanabilir. Değerlendirme Vitek 2 sistemi ile yapılır. Çalışmaya katılan hastanelerin mikrobiyoloji laboratuvarlarında, kalite kontrol suşları ve klinik izolatlardan elde edilen saf kültürlerin süspansiyonları, NaCl içerisinde McFarland 2 standardında türbidimetre ile hazırlandı. Bu kültür süspansiyonları ile hazırlanan test kartları, Vitek 2 sisteminde 35.5°C'de 18 saat süre ile her 15 dakikada bir otomatik olarak okunarak inkübe edildi. Okuma sonuçları, veritabanı ile karşılaştırılarak mayalar değerlendirildi ve son tanımlamalar, tanımlandı, tanımlanamadı ve yanlış tanımlandı şeklinde sınıflandırıldı.
API 20C AUX (bioMérieux, Fransa)
API 20C AUX, 20 kuyucuklu tek kullanımlık plastik bir şeritten oluşur. Birinci kuyucuk, negatif kontrol; ikinci kuyucuk, içerdiği glukoz nedeniyle pozitif kontrol olarak değerlendirilir; diğer 18 kuyucuk ise farklı dehidrate karbonhidratları içerir ve 43 maya türü tanımlanabilir. Çalışmamızda, kuyucuklara, mikroorganizmanın McFarland 2 standardında hazırlanan süspansiyonlarının 1:70 dilüsyonu ekildi ve üreticinin önerileri doğrultusunda 30°C'de 48-72 saat inkübe edildi. İnkübasyon sonrasında karbonhidrat asimilasyonunun göstergesi olan bulanıklık, araştırmacılar tarafından gözle değerlendirildi. İlaveten mikroorganizma süspansiyonundan 100 µl mısır unu (Oxoid, İngiltere)/Tween-80 (Sigma-Aldrich, ABD) besiyerine Dalmau yöntemiyle11 ekildi ve 25°C'de 48-72 saat inkübasyon sonrası plaklar, hif veya yalancı hif varlığı açısından mikroskobik olarak incelendi. Bulanıklık ve hif oluşturma özellikleriyle elde edilen profil numaraları, API web sistemine girildi ve APILAB V4.0 programı ile değerlendirildi. Tanımlama sonuçları, tanımlandı, tanımlanamadı ve yanlış tanımlandı şeklinde sınıflandırıldı.
Tüm maya izolatlarının, ilave konvansiyonel yöntemler uygulanmadan, sadece API profil numaralarına göre tanımlama sonuçları ayrıca kaydedildi. İzolatların Vitek ve API tanımlama profilleri, THSK-MRL'nda morfolojik ve fizyolojik özelliklerini içeren konvansiyonel yöntemlerle tanımlama sonuçları ile karşılaştırıldı ve aşağıdaki gibi sınıflandırıldı:
(i) Doğru tanımlanan: Tür tanımlaması konvansiyonel yöntemlerle aynı ise veya Vitek/API birden fazla tür sonucu vermesi durumunda ilk verdiği sonucun konvansiyonel yöntem sonucu ile uyumlu olması,
(ii) Yanlış tanımlanan: Konvansiyonel yöntemlere göre farklı bir tür tanımlanması veya Vitek/API birden fazla tür sonucu vermesi durumunda aralarında doğru tür tanısını içermemesi,
(iii) Tanımlanamayan: Vitek/API sistemlerinin izolatı tanımlamada yetersiz kalması; bilinmeyen profil, vb.
Konvansiyonel tanımlama yöntemleri bu çalışma için referans yöntem olarak kabul edildi. Vitek ve API arasındaki uyumsuz sonuçlarda konvansiyonel tanımlama sonucu esas alındı.
Standart Suşlar
Çalışmada standart suşlar olarak; Candida albicans ATCC 10231, Candida dubliniensis MYA 583, Candida krusei ATCC 6258, Candida parapsilosis ATCC 22019 ve Cryptococcus neoformans ATCC 32268 kullanıldı. Bu suşlar, tekrarlanabilirlik ve kalite kontrol testleri için her iki sistemle de ardarda 10 gün çalışıldı.
İstatistiksel Analiz
İstatistiksel değerlendirmede, Ki-kare (X2) ve Fisher'in kesin ki-kare testi kullanıldı; p< 0.05 değeri anlamlı kabul edildi. Tüm analizler SPSS version 15.0.A. kullanılarak, THSK Bulaşıcı Hastalıklar Daire Başkanlığı'nda yapıldı.
BULGULAR
Çalışmamızda, konvansiyonel yöntemlerle 473 klinik maya izolatının, 6 cins içinde yer alan 17 türden oluştuğu saptanmıştır. Klinik izolatlara ilaveten beş standart ATCC suşunun tür düzeyinde tanımlama sonuçları, Vitek ve API ile karşılaştırılmıştır. Standart suşlar ile ardarda 10 gün boyunca yapılan testlerde, her iki sistemle de tüm suşlar için ilk tercih olarak tanımlama sağlanabilmiştir.
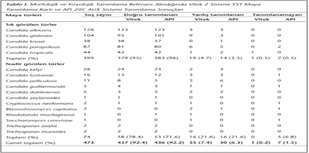
Sık görülen türlerde (C. albicans, C. parapsilosis, C. glabrata, C. tropicalis ve C. krusei), Vitek ile izolatların %95'i doğru tanımlanırken, %4.7'si yanlış tanımlanmış, %0.3'ü ise tanımlanamamıştır. API ile doğru tanımlama oranı %96, yanlış tanımlama oranı %3.5 olarak bulunmuş ve izolatların %0.5'i tanımlanamamıştır. Nadir görülen türlerde, Vitek ile izolatların %78.4'ü API ile %71.6'sı doğru tanımlanırken, her iki sistemle de izolatların %21.6'sı yanlış tanımlanmış ve API ile %6.8'i tanımlanamamıştır (Tablo I). Vitek ve API testleri, sık veya nadir görülen türleri tanımlama yönünden karşılaştırıldığında, aralarında istatistiksel olarak anlamlı bir fark bulunmamıştır (p= 0.155).
Konvansiyonel yöntemlerle tanımlamaya göre Vitek ve API ile farklı tanımlanan 47 suşun ticari sistemlere göre dağılımı sırasıyla %7.6 (36/473) ve %7.8 (37/473) olarak saptanmıştır (Tablo I ve II). Yanlış tanımlama veya tanımlayamama, her iki sistemle de, sık görülen türlerden en sık C.parapsilosis (Vitek: 6/87; API: 7/87) ve C.glabrata (Vitek: 9/104; API: 3/104) için, nadir görülen türlerden ise C.pelliculosa (Vitek: 3/11; API: 6/11) ve C.dubliniensis (Vitek ve API: 2/5) için tespit edilmiştir (Tablo II). API ile C. guilliermondii (API: 2/5) izolatlarının tanısı diğer türlere göre daha problemlidir. B. capitatus ve S. cerevisiae her iki sistemle de tanımlanamamıştır (Tablo I ve II).
Sık ve nadir görülen tüm türler birlikte değerlendirildiğinde, Vitek ve API ile doğru tanımlama oranı sırasıyla %92.4 (437/473) ve %92.2 (436/473) bulunmuştur. Vitek ile tüm suşların %7.4 (35/473)'ü yanlış tanımlanmış ve %0.2 (1/473)'si tanımlanamamıştır; API ile bu oranlar sırasıyla %6.3 (30/473) ve %1.5 (7/473) olarak saptanmıştır (Tablo I).
Vitek ve API sonuçları %86.3 oranında birbiriyle tutarlı bulunmuş ve her iki testin tanı koyma kapasitelerinin istatistiksel olarak benzer olduğu görülmüştür.
TARTIŞMA
Maya türlerinin tanımlamasında kullanılan başlıca özellikler, mayaların karbon ve nitrojen kaynaklarındaki farklılıklar olmakla beraber, hücre morfolojileri ve eşeyli üreme yapılarının değerlendirilmesi de ayırıcı tanıda çok önemlidir5,11,12. Günümüzde klinik mikrobiyoloji laboratuvarlarında mayaların konvansiyonel yöntemlerle tanımlanması zaman alıcı ve emek yoğun olduğu için, Candida spp. ve diğer maya mantarlarının tanımlanmasında hızlı tanımlama sağlayan ticari sistemler yaygın olarak kullanılmaktadır9,13. Bunlardan biri, ince plastik kartlarda bulunan mikro-kuyucuklardaki üreme ve metabolik değişiklikleri kolorimetrik bir yöntem ile saptayan Vitek 2 otomotize sistemi YST maya tanımlama kartı13,14,15,16,17, diğeri de API 20C AUX sistemidir9,13,17. Çalışmadaki amacımız; türe özgü direnç sınır değerlerinin belirlenmesi sonucu doğru tanımlamanın daha da önemli bir hale gelmesi ile birlikte klinik laboratuvarlarda yaygın olarak kullanılan Vitek ve API sistemlerinin sık görülen Candida spp. ve nadir görülen tanımlanması güç olan diğer mayaların, tür düzeyinde tanımlama performansının izlenmesidir.
Sık görülen türlerin (C.albicans, C.parapsilosis, C.glabrata, C.tropicalis ve C.krusei) tanımlanmasında her iki sistemin performansı yüksek ve tanımlama oranları birbirine yakın (Vitek: %95; API: %96) bulunmuştur. Nadir görülen türlerin tanımlanmasında Vitek'in performansı (%78.4) API'den (%71.6) daha yüksek olarak saptanmıştır. Her iki sistemle de izolatların %21.6'sı yanlış tanımlanmış ve API ile %6.8'i tanımlanamamıştır (Tablo I). Meletiadis ve arkadaşları18 üç ticari maya tanımlama sistemini karşılaştırdıkları çalışmada; bulgularımıza benzer şekilde, Vitek ve diğer ticari sistemlerin performansını sık görülen türlerde daha yüksek (Vitek %92, Api ID32C %94, Auxacolor %95), nadir türlerde daha düşük ve üç sistem arasında Vitek'in performansının daha iyi olduğunu saptamışlardır (Vitek %64, Api ID 32C %56, Auxacolor %43).
Vitek ve API ile yapılan karşılaştırmalı çalışmalarda farklı oranlar bildirilmektedir. Çok merkezli bir çalışmada, 660 maya izolatı Vitek ve API ID 32C ile tanımlanmış ve duyarlılık oranları sırasıyla %92.6 ve %98.3 olarak bulunmuştur19. Yine bu çalışmada, sadece bir metod ile tüm maya türlerinin doğru tanımlanamayacağı en az iki metodun kullanılmasının uygun olacağı belirtilmiştir19. Vitek, API ID 32C, API 20C AUX, Yeast Star, Auxacolor, Rapid Yeast Plus, API Candida sistemlerinin karşılaştırıldığı bir çalışmada; sistemlerin doğru tanımlama oranları %59.6 ile %80.8 arasında raporlanmıştır20. Yine aynı çalışmada API ID 32C ve Vitek ile mayaların doğru tanımlanma oranları sırasıyla %63.5 ve %59.6 olarak bulunmuş ve germ tüp negatif olan 29 izolatın doğru tanımlanma oranları sırasıyla %72.4 ve %62.1 olarak belirtilmiştir20. Çalışmamızda nadir türlerin tanımlanmasındaki sorunlar (Vitek: %78.4; API: %71.6) morfolojik değerlendirme de içeren testlerin ilave edilmesi ile çözümlenmiştir.
Candida famata (Vitek n= 4, API n= 7), C.sake (Vitek n= 2) ve C.utilis (API n= 1) gibi epidemiyolojik olarak nadir görülen türlerin, konvansiyonel yöntemlerle karşılaştırıldığında yanlış tanımlandığı tespit edilmiştir (Tablo II). Bu nedenle sadece ticari sistemlerle maya tanımlaması yapılan laboratuvarlarda; hastaneler, ülkeler ve dünyadaki en sık etken olan maya tür dağılımlarını bilerek tanımlama sonuçlarının yorumlanması önemlidir. Ticari sistemlerle yanlış tanımlanan türlerin çoğunluğu THSK-MRL'ında, mısır unu/Tween-80 besiyeri plaklarının 48-72 saatlik inkübasyon sonrasında mikroskobik olarak değerlendirilmesi ile yalancı hif, gerçek hif, artrospor, klamidospor veya kapsül varlığının gösterilmesi sonucu kolayca tanımlanabilmiştir. Yapılan diğer çalışmalarda da morfolojik tanımlamanın önemi vurgulanmaktadır9,20,21,22.
Tür tanımlamasının doğru yapılabilmesi için, klinik örneklerde üreyen izolatların öncelikle saf kültürlerinin elde edilmesi önemlidir. Bu nedenle kromojenik besiyerlerinin kullanımının karışık kültürlerin ayrımında kullanılmasının yararlı olduğu çeşitli çalışmalarla da desteklenmektedir8,9,23. Benzer şekilde, ticari sistemlerle yanlış tanımlanan [Vitek: 35/473 (%7.4); API: 30/473 (%6.3)] veya tanımlanamayan [Vitek: 1/473 (%0.2); API: 7/473 (%1.5)] türler, antifungal duyarlılık test sonuçlarının yanlış yorumlanmasına ve olasılıkla hasta tedavisinin yanlış yönlendirilmesine neden olması yönünden önemlidir.
Maya tanımlamasında Vitek ID-YST ve API 20C AUX sistemlerinin karşılaştırıldığı bir çalışmada; suşların %92.1'i (222/241) kesin olarak tanımlanırken, %4.6 (11/241)'sı düşük oranda tanımlanmıştır15. İnci ve arkadaşları24 tarafından ülkemizde yapılan bir çalışmada, 41 C.albicans dışı maya izolatı Vitek 2 YST kart ve API 20C AUX ile tanımlanmış olup, her iki sistemle izolatların 34 (%82.9)'ü aynı tür olarak tanımlanırken, yedisinde (%17.1) farklı sonuçlar elde edilmiştir. Tüm klinik izolatlar birlikte değerlendirildiğinde, çalışmamızdaki doğru tanımlanma oranları (Vitek: %92.4; API: %92.2) Graf ve arkadaşlarının15 çalışmalarıyla uyumlu bulunurken, İnci ve arkadaşlarının24 çalışmalarından daha yüksek olarak saptanmıştır. Ticari sistemlerle izolatların tür tanımlamalarında özellikle C.glabrata başta olmak üzere C.tropicalis ve C.parapsilosis türlerinin tanımlanmasında dikkatli olunması gerektiği belirtilmiştir22,23,24. Bu çalışmada da, her iki sistemle de türlerin yanlış tanımlanması/tanımlanamaması, sık rastlanan türlerden C.parapsilosis (Vitek: 6/87; API: 7/87) ve C.glabrata (Vitek: 9/104; API: 3/104) için, nadir rastlanan türlerden ise C.lusitanae (Vitek: 3/16; API: 4/16), C.pelliculosa (Vitek: 3/11; API: 6/11) ve C.guilliermondii (Vitek: 1/5; API: 2/5) için saptanmıştır (Tablo II). Blastoschizomyces capitatus ve S.cerevisiae her iki sistemle de tanımlanamamıştır. Çeşitli çalışmalarda da benzer türlerde tanımlama sorunlarından bahsedilmektedir15,18.
Vitek ile aynı gün içinde (18 saat) hızlı sonuç alınabilmesi, kullanımının basit olması ve mikolojiye özgü deneyim gerektirmemesi sistemin avantajlı yönleridir. Bu sistemler arasında referans yöntem olarak kabul edilen API ile sonuçların alınması uzun (48-72 saat) sürmektedir13. API profil numaralarında, bulanıklığa ilaveten hif oluşturma özelliklerinin de değerlendirmeye dahil edilmesi, C.glabrata suşları başta olmak üzere, tür tanımlamasında Vitek'e göre daha başarılı bulunmuştur. Diğer çalışmalar da bu bulguyu desteklemektedir9,13.
Sonuç olarak, Vitek ve API sistemlerinin performansı birbirine yakındır (p= 0.155). İki sistemde de sık karşılaşılan türlerde tanımlama oranları daha yüksek olup, nadir görülen türlerde oranlar düşmektedir. Biyokimyasal özellikleri esas alan bu ticari sistemlerle nadir görülen türler tanımlandığında, tanımlama sonuçları, hastane, ülke ve dünyadaki mayaların tür dağılımı epidemiyolojik verileri doğrultusunda yorumlanmalı ve morfolojik tanımlama ile birlikte değerlendirilmelidir. İlaveten rutin laboratuvarlarda mayaların tür düzeyinde tanımlanmasında ticari sistemlerin beraberinde morfolojik bulguların ve kromojenik besiyerlerinin kullanımının, birden fazla mayanın etken olduğu karışık enfeksiyonların doğru tanımlanması ve tedavisinde de önemli olduğu sonucuna varılmıştır.
TEŞEKKÜR
Laboratuvardaki titiz çalışmaları için Türkiye Halk Sağlığı Kurumu, Mikoloji Referans Laboratuvarı çalışanları Orhan Danışmaz, Nihal Alem'e ve verilerin istatistiksel olarak değerlendirmesindeki destekleri için Türkiye Halk Sağlığı Kurumu, Bulaşıcı Hastalıklar Daire Başkanı Dr. Selmur Topal ve Erken Uyarı Cevap ve Saha Epidemiyolojisi Daire Başkanlığı'ndan Uzm. Dr. Fehminaz Temel'e çok teşekkür ederiz.
KAYNAKLAR
- Bitar D, Lortholary O, Le Strat Y, et al. Population-based analysis of invasive fungal infections, France, 2001-2010. Emerg Infect Dis 2014; 20(7): 1163-9.
- Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem. Clin Microbiol Rev 2007; 20(1): 133-63.
- Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 48(5): 503-35.
- Berdal JE, Haagensen R, Ranheim T, Bjørnholt JV. Nosocomial candidemia; risk factors and prognosis revisited; 11 years experience from a norwegian secondary hospital. PLoS One 2014; 9(7): e103916.
- Brandt ME, Johnson EM. Mycology, pp: 1744-992. In: Versalovic J, Carroll KC, Funke G, Jorgensen JH, Landry ML, Warnock DW (eds), Manual of Clinical Microbiology. 2011, 10th ed. ASM Press, Washington, D.C.
- Yenigün Koçak B, Kuloğlu F, Doğan Çelik A, Akata F. Evaluation of epidemiological characteristics and risk factors of candidemia in adult patients in a tertiary-care hospital. Mikrobiyol Bul 2011; 45(3): 489-503.
- Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts. 4th Informational Supplement. CLSI Document M27-S4, 2012. CLSI, Wayne, PA.
- Freydiere AM, Guinet R, Boiron P. Yeast identiÞcation in the clinical microbiology laboratory: phenotypical methods. Med Mycol 2001; 39(1): 9-33.
- Borman AM, Szekely A, Palmer MD, et al. Assessment of accuracy of identification of pathogenic yeasts in microbiology laboratories in the United Kingdom. J Clin Microbiol 2012; 50(8): 2639-44.
- Groll AH, Walsh TJ. Uncommon opportunistic fungi: new nosocomial threats. Clin Microbiol Infect 2001; 7(Suppl 2): 8-24.
- Larone DH (ed). Medically Important Fungi: A Guide To Identification. 2002, 4th ed. ASM Press, Washington, D.C.
- Hazen KC, Howell SA. Full identification of yeasts, pp: 8.8. In: Garcia LS, Isenberg HD, Jorgensen JH, Pfaller M, Landry ML (eds), Clinical Microbiology Procedures Handbook. 2007, 3rd ed. ASM Press, Washington, D.C.
- Hata DJ, Hall L, Fothergill AW, Larone DH, Wengenack NL. Multicenter evaluation of the new VITEK 2 advanced colorimetric yeast identification card. J Clin Microbiol 2007; 45(4): 1087-92.
- Freydiere AM, Guinet R, Boiron P. Yeast identification in the clinical microbiology laboratory: phenotypical methods. Med Mycol 2001; 39(1): 9-33.
- Graf B, Adam T, Zill E, Göbel UB. Evaluation of the VITEK 2 system for rapid identification of yeasts and yeast-like organisms. J Clin Microbiol 2000; 38(5): 1782-5.
- Ochiuzzi ME, Cataldi S, Guelfand L, Maldonado I, Arechavala A. Evaluation of Vitek 2 for the identification of Candida yeasts. Rev Argent Microbiol 2014; 46(2): 107-10.
- Aubertine CL, Rivera M, Rohan SM, Larone DH. Comparative study of the new colorimetric VITEK 2 yeast identification card versus the older fluorometric card and of CHROMagar Candida as a source medium with the new card. J Clin Microbiol 2006; 44(1): 227-8.
- Meletiadis J, Arabatzis M, Bompola M, et al. Comparative evaluation of three commercial identification systems using common and rare bloodstream yeast isolates. J Clin Microbiol 2011; 49(7): 2722-7.
- Lo HJ, Ho YA, Ho M. Factors accounting for misidentification of Candida species. J Microbiol Immunol Infect 2001; 34(3): 171-7.
- Verweij PE, Breuker IM, Rijs AJ, Meis JF. Comparative study of seven commercial yeast identification systems. J Clin Pathol 1999; 52(4): 271-3.
- Fenn JP, Segal H, Barland B, et al. Comparison of updated Vitek yeast biochemical card and API 20C yeast identificarion systems. J Clin Microbiol 1994; 32(5): 1184-7.
- Massonet C, Van Eldere J, Vaneechoutte M. Comparison of VITEK 2 with ITS2-fragment length polymorphism analysis for identiÞcation of yeast species. J Clin Microbiol 2004; 42(5): 2209-11.
- Coignard C, Hurst SF, Benjamin LE, Brandt ME, Warnock DW, Morrison CJ. Resolution of discrepant results for Candida species identiÞcation by using DNA probes. J Clin Microbiol 2004; 42(2): 858-61.
- İnci M, Atalay MA, Koç AN, Özer B, Kılınç Ç, Durmaz S. Comparison of VITEK 2 YST Card and API 20C AUX system in identification of nonalbicans Candida species. Dicle Med J 2012; 39(1): 80-2.
İletişim (Correspondence):
Uzm. Dr. Nilgün Karabıçak,
Türkiye Halk Sağlığı Kurumu,
Mikoloji Referans Laboratuvarı,
Sıhhiye 06100, Ankara, Türkiye.
Tel (Phone): +90 312 565 5504,
E-posta (E-mail): nilgunkarabicak@yahoo.com