Metisiline Dirençli Staphylococcus aureus İzolatlarının Antibiyotik Direnci ve
Azalmış Vankomisin Duyarlılığının Araştırılması: Çok Merkezli Bir Çalışma*
Investigation of Antibiotic Resistance Patterns and Reduced Vancomycin Susceptibilities of
Methicillin-Resistant Staphylococcus aureus Isolates: A Multi-Center Study
Aytekin ÇIKMAN1, Merve AYDIN1, Barış GÜLHAN1, Mehmet PARLAK2, Bilge GÜLTEPE3, Yıldız KALAYCI4, Fulya BAYINDIR BİLMEN5, Sinem SOLMAZ6, Tuncer ÖZEKİNCİ7
1 Erzincan Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Erzincan.
1 Erzincan University Faculty of Medicine, Department of Medical Microbiology, Erzincan, Turkey.
2 Yüzüncü Yıl Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Van.
2 Yuzuncu Yil University Faculty of Medicine, Department of Medical Microbiology, Van, Turkey.
3 Bezmialem Vakıf Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
3 Bezmi-Alem University Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
4 Çukurova Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Adana.
4 Çukurova University Faculty of Medicine, Department of Medical Microbiology, Adana, Turkey.
5 İzmir Menemen Devlet Hastanesi, Tıbbi Mikrobiyoloji Laboratuvarı, İzmir.
5 Izmir Menemen State Hospital, Medical Microbiology Laboratory, Izmir, Turkey.
6 Gazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
6 Gazi University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
7 Dicle Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Diyarbakır.
7 Dicle University Faculty of Medicine, Department of Medical Microbiology, Diyarbakır, Turkey.
* Bu çalışma, XXXVI. Türk Mikrobiyoloji Kongresi (12-16 Kasım 2014, Antalya)'nde poster olarak sunulmuştur.
ÖZ
Bu çalışmanın amacı, ülkemizin farklı coğrafi bölgelerindeki hastanelerde izole edilen metisiline dirençli Staphylococcus aureus (MRSA) suşlarında vankomisin, teikoplanin, daptomisin, kinupristin/dalfopristin, linezolid, tigesiklin, kloramfenikol, rifampisin, ofloksasin ve tetrasiklin için minimum inhibitör konsantrasyonu (MİK) değerlerinin saptanması ile azalmış vankomisin duyarlılığının araştırılmasıdır. Çalışmaya, Ağustos 2013-Ağustos 2014 tarihleri arasında; İstanbul (n= 15), Ankara (n= 15), İzmir (n= 15), Adana (n= 15), Diyarbakır (n= 15), Erzincan (n= 15) ve Van (n= 10) olmak üzere Türkiye'deki yedi merkezde yatan hastalardan (%50'si yoğun bakımda yatan) izole edilen toplam 100 MRSA suşu dahil edilmiştir. Suşların 43'ü kan, 21'i alt solunum yolu örneği, 17'si yara, sekizi kateter, altısı idrar, dördü burun sürüntüsü, biri ise beyin omurilik sıvısından izole edilmiştir. İzolatların metisilin direnci, sefoksitin (30 μg) diski kullanılarak standart disk difüzyon yöntemiyle, diğer antibiyotiklerin MİK değerleri ise E-test yöntemi ile CLSI (Clinical and Laboratory Standards Institute) önerileri doğrultusunda belirlenmiştir. MİK sonuçlarının değerlendirmesinde; kinupristin/dalfopristin (K/D) için CLSI'ın metisiline duyarlı S.aureus için önerdiği kriterler; tigesiklin için ise FDA (Food and Drug Administration)'nın MRSA için önerdiği kriterler dikkate alınmıştır. Vankomisine orta düzeyde duyarlı S.aureus (VISA) ve heterojen VISA (hVISA) suşlarının belirlenmesinde öncelikle agar tarama yöntemi (ATY) kullanılmıştır. ATY'nde 6 μg/ml vankomisin içeren beyin kalp infüzyon agar kullanılmış; bu yöntemle şüpheli VISA/hVISA olarak belirlenen izolatlara standart E-test ve makro E-test yöntemleri uygulanmıştır. Tüm MRSA suşları E-test yöntemiyle vankomisin, teikoplanin, daptomisin, K/D ve linezolide duyarlı bulunmuş; tigesiklin, kloramfenikol, rifampisin, ofloksasin ve tetrasikline duyarlılık oranları ise sırasıyla; %89, %97, %40, %39 ve %32 olarak belirlenmiştir. MİK50/MİK90 değerleri sırasıyla; vankomisin için 1.5/2 μg/ml, teikoplanin için 2/4 μg/ml, daptomisin için 0.19/0.38 μg/ml, K/D için 0.19/0.38 μg/ml, linezolid için 0.75/1 μg/ml, tigesiklin için 0.19/0.75 μg/ml, kloramfenikol için 3/6 μg/ml, rifampisin için 32/32 μg/ml, ofloksasin için 32/32 μg/ml ve tetrasiklin için 32/64 μg/ml olarak saptanmıştır. Azalmış vankomisin duyarlılığı araştırıldığında, ATY ile MRSA suşlarının %2 (2/100)'si VISA, %5 (5/100)'i ise hVISA olarak tanımlanmıştır. ATY ile VISA/hVISA olarak saptanan bu yedi suştan birisi hem standart E-test hem de makro E-test yöntemiyle şüpheli hVISA olarak değerlendirilmiştir. Sonuç olarak çalışmamızda, MRSA suşlarında vankomisin, teikoplanin, daptomisin, K/D ve linezolide dirençli suş saptanmamış, tigesiklin direnci (%11) ise beklenenden yüksek bulunmuştur. Dünyada artan glikopeptid direnci ve ülkemizde bu grup ilaçların yoğun kullanımı nedeniyle, MRSA suşlarında vankomisin direnç oranlarının periyodik olarak araştırılması gerektiği düşünülmüştür.
Anahtar sözcükler: Metisiline dirençli Staphylococcus aureus; antibiyotik direnci; VISA; hVISA.
ABSTRACT
The aims of this study were to determine the minimum inhibitory concentration (MIC) values of vancomycin, teicoplanin, daptomycin, quinupristin/dalfopristin, linezolid, tigecycline, chloramphenicol, rifampicin, ofloxacin and tetracycline and to investigate the reduced vancomycin susceptibility among methicillin-resistant Staphylococcus aureus (MRSA) strains isolated in hospitals located in different geographical regions of Turkey. A total of 100 MRSA strains isolated from patients (of which 50% were from intensive care units) hospitalized in seven centers in Turkey [Istanbul (n= 15), Ankara (n= 15), Izmir (n= 15), Adana (n= 15), Diyarbakir (n=15), Erzincan (n= 15), Van (n= 10)], between August 2013 - August 2014, were included in the study. Fourty-three strains were isolated from blood, whereas 21 were from lower respiratory tract, 17 from wounds, eight from catheters, six from urine, four from nasal swab and one from cerebrospinal fluid samples. Methicillin resistance of the isolates was determined by using cefoxitin (30 μg) disk with standard disk diffusion method, while the MIC values of other antibiotics were determined with E-test in accordance with the recommendations of Clinical and Laboratory Standards Institute (CLSI). MIC results obtained for quinupristin-dalfopristin (Q/D) were evaluated according to the CLSI criteria used for methicillin-susceptible S.aureus and for tigecycline according to the criteria recommended by the Food and Drug Administration for MRSA. Primarily, agar screening method (ASM) was used for determination of vancomycin-intermediate S.aureus (VISA) and heterogeneous VISA (hVISA) strains. Brain heart infusion agar containing 6 μg/ml vancomycin was used in ASM, and the strains with suspicion of VISA/hVISA were screened by standard E-test and macro E-test methods. All MRSA strains were susceptible to vancomycin, teicoplanin, daptomycin, Q/D and linezolid by E-test method; and their rates of susceptibility for tigecycline, chloramphenicol, rifampicin, ofloxacin and tetracycline were detected as 89%, 97%, 40%, 39% and 32%, respectively. MIC50/MIC90 values were 1.5/2 μg/ml for vancomycin, 2/4 μg/ml for teicoplanin, 0.19/0.38 μg/ml for daptomycin, 0.19/0.38 μg/ml for Q/D, 0.75/1 μg/ml for linezolid, 0.19/0.75 μg/ml for tigecycline, 3/6 μg/ml for chloramphenicol, 32/32 μg/ml for rifampicin, 32/32 μg/ml for ofloxacin and 32/64 μg/ml for tetracycline, respectively. For the evaluation of reduced vancomycin susceptibility, 2% (2/100) of MRSA strains were defined as VISA and 5% (5/100) as hVISA with ASM. One of those seven isolates identified as VISA/hVISA with ASM was evaluated as suspected hVISA by using both standard E-test and macro E-test methods. In conclusion, no MRSA resistant strain to vancomycin, teicoplanin, daptomycin, Q/D and linezolid was determined in our study. However tigecycline resistance (11%) was found higher than expected. As the glycopeptide resistance is increasing in the world and because of the intense use of these drugs in Turkey, the rates of vancomycin resistance among MRSA strains should be investigated periodically.
Keywords: Methicillin-resistant Staphylococcus aureus; antibiotic resistance; VISA; hVISA.
Geliş Tarihi (Received): 15.10.2014 - Kabul Ediliş Tarihi (Accepted): 09.03.2015
GİRİŞ
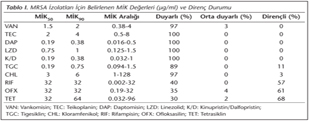
Staphylococus aureus, yaygın metisilin direnci nedeniyle tüm dünyada önemli bir sağlık problemi olmaya devam etmektedir. Metisiline dirençli S.aureus (MRSA), tüm beta-laktamlara dirençli olmasının yanı sıra makrolidler, kinolonlar, tetrasiklinler, linkozamidler ve aminoglikozidlere de direnç gösterebilmektedir1. MRSA'a bağlı invazif enfeksiyonu olan hastaların tedavisinde glikopeptid grubu antibiyotiklerin, özellikle vankomisinin sık kullanımı sonucunda; vankomisine orta düzeyde duyarlı (VISA), heterojen orta düzeyde duyarlı (hVISA) ve dirençli (VRSA) S.aureus suşlarının ortaya çıktığı bildirilmektedir2. Günümüzde VISA ve hVISA suşlarının ortaya çıkması, glikopeptid grubu antibiyotiklere alternatif olabilecek başka antimikrobiyallere ihtiyaç doğurmuştur. Son yıllarda, oksazolidinon grubunda yer alan linezolid; glisilsiklin grubunda yer alan tigesiklin; streptogramin grubunda yer alan kinupristin/dalfopristin (K/D) ve siklik lipopeptid grubunda yer alan daptomisin yeni tedavi seçeneği olarak kullanılmaktadır3,4,5. Bu çalışmada, ülkemizin farklı coğrafi bölgelerindeki hastanelerin çeşitli servislerinde yatan hastalardan izole edilen MRSA suşlarında vankomisin (VAN), teikoplanin (TEC), daptomisin (DAP), K/D, tigesiklin (TGC), linezolid (LZD), kloramfenikol (CHL), rifampisin (RIF), tetrasiklin (TET) ve ofloksasin (OFX) için MİK değerlerinin saptanması ve azalmış vankomisin duyarlılığının araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Bakteriyel İzolatlar
Çalışmaya, Ağustos 2013-Ağustos 2014 tarihleri arasında, altı üniversite hastanesi ile bir devlet hastanesi olmak üzere Türkiye'deki yedi merkezde [İstanbul (n= 15), Ankara (n= 15), İzmir (n= 15), Adana (n= 15), Diyarbakır (n= 15), Erzincan (n= 15), Van (n= 10)], yatan hastalardan (%50'si yoğun bakımda yatan) izole edilen toplam 100 MRSA suşu alındı. Suşların 43'ü kan, 21'i alt solunum yolu örneği, 17'si yara, 8'i kateter, 6'sı idrar, 4'ü burun sürüntüsü ve biri beyin omurilik sıvısından izole edildi.
Antibiyotik Duyarlılık Testleri
İzolatların metisilin direnci, sefoksitin (30 μg) diski kullanılarak Mueller-Hinton agar (MHA) besiyerinde standart disk difüzyon yöntemiyle saptandı. Diğer antibiyotiklerin MİK değerleri ise standart E-test (Liofilchem, İtalya) yöntemiyle belirlendi. Bu amaçla tüm suşların koyun kanlı agardaki pasajlarından 0.5 McFarland bulanıklığında bakteri süspansiyonları hazırlandı ve MHA'a ekilerek üzerine E-test şeritleri yerleştirildi. 35°C'de 24 saat inkübasyondan sonra, inhibisyon zonunun E-test şeridini kestiği noktadaki MİK değerleri kaydedildi ve sonuçlar CLSI (Clinical and Laboratory Standards Institute) önerilerine göre değerlendirildi6. TGC için bulunan MİK sonuçları ise, FDA (Food and Drug Administration)'nın MRSA için önerdiği (> 0.5 mg/L dirençli) kriterlere göre değerlendirildi7. K/D için CLSI'ın metisiline duyarlı S.aureus (MSSA) için önerdiği değerler (≤ 1 mg/L duyarlı) temel alındı6.
Agar Tarama Yöntemi
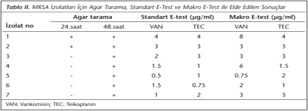
VISA, hVISA ve VRSA suşlarının belirlenmesinde öncelikle agar tarama yöntemi kullanıldı. Agar tarama yönteminde; 6 μg/ml vankomisin içeren beyin kalp infüzyon agar (BHI-V6) (Oxoid) besiyerine 0.5 McFarland bulanıklığına ayarlanan bakteri süspansiyonlarından 10'ar μl ekildi ve plaklar 35°C'de normal atmosfer koşullarında 48 saat inkübe edildi. Tarama besiyerlerinde 24. saatte üreyebilen bakteriler şüpheli VISA, 48. saatte üreyen bakteriler ise şüpheli hVISA olarak kabul edildi. Üreme göstermeyen izolatlar ise vankomisine duyarlı olarak değerlendirildi8. Bu yöntemle şüpheli VISA/hVISA olarak belirlenen izolatlara standart E-test ve makro E-test yöntemleri uygulandı.
Makro E-test Yöntemi
Standart E-test yöntemi ile VAN MİK değeri 4 μg/ml olarak bulunan suşlar ile agar tarama yöntemi ile şüpheli VISA/hVISA olarak belirlenen 7 MRSA suşuna standart E-test ve makro E-test yöntemleri uygulandı. Makro E-Test yönteminde 2 McFarland bulanıklığına ayarlanan bakteri süspansiyonlarından 200 μl alınarak BHI agar besiyerlerinin yüzeyine yayıldı. Kuruma için 10 dakika beklendikten sonra VAN ve TEC E-test şeritleri yerleştirildi ve 35°C'de 48 saat inkübe edildi. Sonuçlar yorumlanırken, VAN ve TEC MİK değerleri ≥8μg/ml ya da sadece TEC MİK değeri ≥ 12 μg/ml olan izolatlar VISA/hVISA olarak yorumlandı9.
BULGULAR
Çalışmaya alınan tüm MRSA suşları E-test yöntemi ile VAN, TEC, DAP, K/D ve LZD'e duyarlı bulunmuş; CHL, RIF, OFX ve TET duyarlılık oranları ise sırasıyla; %97, %40, %39 ve %32 olarak belirlenmiştir. FDA'nın MRSA için önerdiği kriterlere göre suşların %11'i (11/100) TGC'e dirençli bulunmuştur. RIF, OFX ve TET MİK50/MİK90 değerlerinin, direnç oranlarına benzer şekilde yüksek olduğu gözlenmiştir. Ayrıca VAN, TEC ve LZD MİK90 değerlerinin CLSI'ın duyarlılık için önerdiği sınır değerlere yakın olduğu bulunurken; TGC MİK90 değeri, FDA'nın MRSA için önerdiği dirençli değerinin (> 0.5mg/L) üzerinde bulunmuştur. Tüm MRSA suşlarının MİK aralıkları, MİK50/MİK90 değerleri ve antibiyotik direnç durumları Tablo I'de, MİK dağılımları ise Şekil 1'de sunulmuştur.
Azalmış vankomisin duyarlılığı araştırıldığında; agar tarama yöntemi ile MRSA suşlarının %2 (2/100)'si VISA, %5 (5/100)'i ise hVISA olarak tanımlanmıştır. Agar tarama yöntemi ile VISA/hVISA olarak saptanan 7 S.aureus izolatının birisi (1 no.lu suş) hem standart E-test hem de makro E-test yöntemiyle şüpheli hVISA olarak değerlendirilmiştir (Tablo II).
TARTIŞMA
Son on yılda kullanıma giren LZD, DAP, K/D ve TGC, MRSA enfeksiyonlarına karşı etkili bir tedavi sağlamıştır. Bu yeni ilaçlara karşı direnç geliştiğini gösteren çalışmalar bulunmakla birlikte, LZD ve DAP'in düşük direnç oranlarına sahip olduğu vurgulanmaktadır10. Ülkemizde yapılan çalışmalarda da, test edilen tüm MRSA suşlarının bu iki antibiyotiğe karşı duyarlı saptamıştır11,12,13. Bizim çalışmamızda da benzer şekilde tüm suşların LZD ve DAP'e duyarlı oldukları bulunmuştur. Ülkemizde henüz kullanıma girmeyen fakat dirençli suşların bildirildiği yeni antibiyotiklerden biri de K/D'dir. Yapılan çalışmalarda Öksüz ve arkadaşları14 K/D için MİK50/MİK90 değerini; 0.5/0.75, Cesur ve arkadaşları12 ise; 0.5/1.0 olarak saptamış ve bu çalışmalarda direnç bildirilmemiştir. Çalışmamızda K/D için MİK50/MİK90 değeri 0.19/0.38 bulunurken tüm suşlar duyarlı olarak tespit edilmiştir.
Başta MRSA olmak üzere çoklu ilaç direnci gösteren bakterilerin tedavisinde kullanılan yeni antimikrobiyallerden bir diğeri tigesiklindir. Son zamanlarda yapılan bazı çalışmalarda TGC'e karşı direnç bildirilmeye başlanmıştır. Öksüz ve arkadaşları14 49 MRSA suşu ile yaptıkları çalışmada; %2 oranında direnç saptamış, MİK50/MİK90 değerlerini 0.19/0.38 olarak bildirmiştir. Cesur ve arkadaşları12 ise direnç oranını %3 ve MİK50/MİK90 değerlerini 0.19/0.38 olarak saptamıştır. Ülkemizin farklı bölgelerinden izole edilen suşlarla yaptığımız bu çalışmada ise, TGC'e karşı direnç oranı (%11) ve MİK90 değeri (0.75), diğer çalışmalara12,14 göre beklenenden yüksek bulunmuştur. Bu durum, birçok gram-negatif ve gram-pozitif bakteri enfeksiyonlarında tigesiklinin daha yaygın kullanılması ile ilişkili olabilir. Ayrıca bazı çalışmalarda MHA'da bulunan manganez miktarının yüksek olması durumunda tigesiklin MİK değerlerinin arttığı gösterilmiştir15. Dolayısıyla çalışmamızda kullanılan biyolojik bir besiyeri olan MHA'daki manganez miktarı, saptadığımız tigesiklin direnç oranını etkilemiş olabilir. Çalışmamızda değerlendirilen VAN, TEC, K/D ve DAP'in MİK değerleri incelendiğinde, diğer çalışmalarla11,12 benzerlik gösterdiği saptanmıştır. Ancak LZD için saptadığımız MİK50/MİK90 değerleri (0.75/1), Çelikbilek ve arkadaşları11 (0.19/0.75) ile Cesur ve arkadaşlarının12 (0.38/0.50) çalışmalarına göre daha yüksek bulunmuştur.
Kullanıma giren yeni antibiyotiklere rağmen MRSA enfeksiyonla¬rında temel tedavi seçeneği glikopeptidlerdir. Glikopeptid direnci ilk kez 2002 yılında ortaya çıkmış olup, son yıllarda dünyanın değişik bölgelerinde giderek artan oranlarda VISA/hVISA izolatları rapor edilmektedir16,17. VISA izolatlarının rutin antimikrobiyal duyarlılık testleri ile belirlenememesi ve vankomisinin oldukça yaygın olarak kullanılıyor olması, ülkemizde belirli aralıklarla azalmış vankomisin duyarlılığı araştırılmasını gerekli kılmaktadır. Bu suşları saptamak için bir dizi tarama deneyi geliştirilmiş, ancak uygun ve güvenilir olan standart bir yaklaşım saptanamamıştır. Bu suşların saptanmasında kolay, hızlı ve ucuz olması nedeniyle rutin laboratuvarlarda 3-4-6 mg/L vankomisin içeren BHI tarama yöntemi kullanılmaktadır18,19.
European Committee of Antimicrobial Susceptibility Testing (EUCAST), European Antimicrobial Resistance Surveillance System (EARSS) ve CLSI gibi bazı kuruluşlar sıvı mikrodilüsyon ve makro E-test gibi metodlarla doğrulama yapılabileceğini bildirse de, popülasyon analizi profili yöntemi en güvenilir doğrulama yöntemidir20. Bu yöntemin, pahalı ve rutin mikrobiyoloji laboratuvarlarında uygulanması oldukça zor olması nedeniyle referans laboratuvarlarda çalışılması önerilmektedir21. Bu nedenle çalışmamızda öncelikle tarama yöntemi olarak 6 mg/L vankomisin içeren BHI agar tarama yöntemi kullanılmıştır. Çalışmalarda kullanılan yöntemlerin farklılığı, VISA/hVISA suşlarının prevalanslarının karşılaştırılmasında zorluklar yaşanmasına neden olmaktadır. Cesur ve arkadaşları12, vankomisin agar tarama testi ve E-test yöntemi kullanılarak azalmış vankomisin duyarlılığını araştırdıkları bir çalışmada, MRSA suşlarında VISA veya VRSA saptamamışlardır. Benzer şekilde Aktaş ve arkadaşları22, 4 ve 6 μg/ml vankomisinli agar tarama yöntemi ve agar dilüsyon yöntemi ile stafilokok suşlarında VISA/hVISA tespit etmemişlerdir. Buna karşın Sancak ve arkadaşları23 makro E-test yöntemi ve 4 μg/ml vankomisinli agar tarama yöntemi ile %17.9 oranında hVISA saptamışlardır. Başka bir çalışmada ise Kuşçu ve arkadaşları24 S.aureus suşlarında VISA ve hVISA oranını sırasıyla %0.9 ve %0.9 olarak bulmuşlardır. Bizim çalışmamızda, MRSA suşlarında agar tarama yöntemi ile %2 oranında VISA, %5 oranında hVISA saptanmıştır. Agar tarama yöntemi ile VISA olarak saptanan suşlarından biri hem standart E-test hem de makro E-test yöntemiyle şüpheli hVISA olarak değerlendirilmiştir.
Sonuç olarak çalışmamızda, MRSA suşlarında VAN, TEC, DAP, K/D ve LZD'e dirençli suş saptanmamış, TGC direnci (%11) ise beklenenden yüksek bulunmuştur. MRSA kaynaklı enfeksiyonların tedavisinde bu antibiyotiklerin birbirlerine alternatif olarak kullanılabileceği görülmektedir. Dünyada artan glikopeptid direnci ve ülkemizde yoğun kullanımı nedeniyle, belirli dönemlerde MRSA suşlarında vankomisin direnç oranlarının araştırılması gerektiği düşünülmektedir.
KAYNAKLAR
- Oksuz L, Dupieux C, Tristan A, Bes M, Etienne J, Gurler N. The high diversity of MRSA clones detected in a university hospital in Istanbul. Int J Med Sci 2013; 10(12): 1740-5.
- Tarai B, Das P, Kumar D. Recurrent challenges for clinicians: emergence of methicillin-resistant Staphylococcus aureus, vancomycin resistance, and current treatment options. J Lab Physicians 2013; 5(2): 71-8.
- Baudoux P, Lemaire S, Denis O, Tulkens PM, Van Bambeke F, Glupczynski Y. Activity of quinupristin/dalfopristin against extracellular and intracellular Staphylococcus aureus with various resistance phenotypes. J Antimicrob Chemother 2010; 65(6): 1228-36.
- Pelitli TS, Cesur S, Kinikli S, Irmak H, Demiröz AP, Karakoç E. Evaluation of vancomycin, teicoplanin, linezolide and tigecycline susceptibilities of nosocomial methicillin-resistant Staphylococcus strains by E-test. Mikrobiyol Bul 2011; 45(4): 758-61.
- Aktaş G, Derbentli S. In vitro activity of daptomycin against VRE and MRSA strains. Mikrobiyol Bul 2014; 48(1): 123-8.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Twenty-Second Informational Supplement. CLSI Document M100 S22, 2012. CLSI, Wayne, PA.
- United States Food and Drug Administration. Highlights of prescribing information tygacil. Available at: http://www.fda.gov/Safety/MedWatch/SafetyInformation/Safety-RelatedDrugLabelingChanges/ucm132714.htm
- Hiramatsu K, Aritaka N, Hanaki H, et al. Dissemination in Japanese hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin. Lancet 1997; 350(9092): 1670-3.
- Walsh TR, Bolmström A, Qwärnström A, et al. Evaluation of current methods for detection of staphylococci with reduced susceptibility to glycopeptides. J Clin Microbiol 2001; 39(7): 2439-44.
- Holmes NE, Tong SY, Davis JS, Hal SJ. Treatment of methicillin-resistant Staphylococcus aureus: vancomycin and beyond. Semin Respir Crit Care Med 2015; 36(1): 17-30.
- Celikbilek N, Ozdem B, Gürelik FC, Güvenman S, Güner HR, Açıkgöz ZC. Invitro susceptibility of methicillin-resistant Staphylococcus aureus isolates to vancomycin, teicoplanin, linezolide and daptomycin. Mikrobiyol Bul 2011; 45(3): 512-8.
- Cesur S, Irmak H, Simşek H, et al. Evaluation of antibiotic susceptibilities and VISA-VRSA rates among MRSA strains isolated from hospitalized patients in intensive care units of hospitals in seven provinces of Turkey. Mikrobiyol Bul 2012; 46(3): 352-8.
- Hancı H, Uyanık MH, Bilici D, Albayrak A, Ayyıldız A. Klinik örneklerden izole edilen metisiline dirençli stafilokok suşlarında daptomisin etkinliğinin araştırılması. ANKEM Derg 2013; 27(2): 64-9.
- Oksuz L, Gurler N. Susceptibility of clinical methicillin-resistant Staphylococci isolates to new antibiotics. J Infect Dev Ctries 2013; 7(11): 825-31.
- Thamlikitkul V, Tiengrim S. Effect of different Mueller-Hinton agars on tigecycline disc diffusion susceptibility for Acinetobacter spp. J Antimicrob Chemother 2008; 62(4): 847-8.
- Dilworth TJ, Sliwinski J, Ryan K, Dodd M, Mercier RC. Evaluation of vancomycin in combination with piperacillin-tazobactam or oxacillin against clinical methicillin-resistant Staphylococcus aureus isolates and vancomycin-intermediate S.aureus isolates in vitro. Antimicrob Agents Chemother 2014; 58(2): 1028-33.
- Gardete S, Tomasz A. Mechanisms of vancomycin resistance in Staphylococcus aureus. J Clin Invest 2014; 124(7): 2836-40.
- Burnham CA, Weber CJ, Dunne WM Jr. Novel screening agar for detection of vancomycin-nonsusceptible Staphylococcus aureus. J Clin Microbiol 2010; 48(3): 949-51.
- Van Hal SJ, Wehrhahn MC, Barbagiannakos T, et al. Performance of various testing methodologies for detection of heteroresistant vancomycin-intermediate Staphylococcus aureus in blood stream isolates. J Clin Microbiol 2011; 49(4): 1489-94.
- Taş T, Mengeloğlu FZ. Stafilokoklarda glikopeptid duyarlılığının hatalı bildirimi. ANKEM Derg 2013; 27(1): 46-7.
- Sancak B. Staphylococcus aureus and antibiotic resistance. Mikrobiyol Bul 2011; 45(3): 565-76.
- Aktaş E, Mengeloğlu FZ, Külah C, Cömert FB. Evaluation of reduced susceptibility to vancomycin among MRSA strains isolated from clinical specimens. Mikrobiyol Bul 2010; 44(2): 339-41.
- Sancak B, Ercis S, Menemenlioglu D, Colakoglu S, Hasçelik G. Methicillin-resistant Staphylococcus aureus heterogeneously resistant to vancomycin in a Turkish university hospital. J Antimicrob Chemother 2005; 56(3): 519-23.
- Kuşcu F, Oztürk DB, Gürbüz Y, Tütüncü EE, Sencan I, Gül S. Investigation of reduced vancomycin susceptibility in methicillin-resistant staphylococci. Mikrobiyol Bul 2011; 45(2): 248-57.
İletişim (Correspondence):
Yrd. Doç. Merve Aydın,
Erzincan Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
24030 Erzincan, Türkiye.
Tel (Phone): +90 446 226 1818,
E-posta (E-mail): maydin@erzincan.edu.tr