Genişlemiş Spektrumlu Beta-Laktamazların Akım Sitometrisi Yöntemiyle Hızlı Tespiti
Rapid Detection of Extended-Spectrum Beta-Lactamases by Flow Cytometry Method
Serhat DUYAN1, Abdullah KILIÇ1, Soner YILMAZ2, Nurittin ARDIÇ1
1 Gülhane Askeri Tıp Akademisi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gulhane Military Academy of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 Gülhane Askeri Tıp Akademisi, Bölge Kan Merkezi, Ankara.
2 Gulhane Military Academy of Medicine, Regional Blood Center, Ankara, Turkey.
ÖZ
Enterobacteriaceae üyelerinde görülen genişlemiş spektrumlu beta-laktamaz (GSBL), özellikle klinikte yaygın olarak kullanılan sefalosporin grubu antibiyotiklere direnç gelişmesine neden olan bir enzimdir. GSBL üretiminin erken ve doğru olarak tespit edilmesi, antimikrobiyal tedavi ve enfeksiyon kontrolü için önemlidir; ancak bu amaç için kullanılan yöntemler zaman alıcıdır (24-48 saat). Bu çalışmanın amacı, GSBL üreten bakterilerin kısa sürede tespit edilmesine imkan veren, akım sitometrisi temelli bir test yönteminin belirlenmesidir. Çalışmaya, 2012-2013 yılları arasında izole edilmiş olan, GSBL üreten 38 (29 Escherichia coli, 9 Klebsiella pneumoniae) ve GSBL üretmeyen 10 (5 E.coli, 5 K.pneumoniae) Enterobacteriaceae suşu dahil edilmiştir. İzolatların tanımlanması ve antibiyotik duyarlılık testleri, PhoenixTM 100 otomatize sistemi (Becton Dickinson, ABD) ile yapılmıştır. GSBL pozitif izolatlar polimeraz zincir reaksiyonu yöntemiyle blaTEM, blaSHV, blaCTX-M1, blaCTX-M2 ve blaCTX-M9 beta-laktamaz genlerinin varlığı açısından araştırılmıştır. Toplam 38 izolatın 36'sında en az bir GSBL geni tespit edilirken, iki E.coli izolatında gen tespit edilmemiştir. Akım sitometrisi yöntemi kullanılarak, sefalosporin [seftazidim (CAZ) veya sefotaksim (CTX)] ve klavulanik asit (CLA) kombinasyonuyla muamele edildiğinde ölen hücre yüzdeleri, sadece sefalosporin (CAZ veya CTX) ile muamele sonrası ölen hücre yüzdelerine oranlanmıştır. CAZ ve CTX için CLA indeks değerleri (CAZ-CLA ve CTX-CLA indeksi) elde edilmiştir. İndeks değerin en az bir sefalosporin için 1.5'ten daha büyük olması GSBL pozitif olarak değerlendirilmiştir. Çalışmamızda, GSBL pozitif olan izolatların genotipik özelliklerine göre CTX-CLA indeksi ortalamaları 1.14 ile 7.22; CAZ-CLA indeks ortalamaları ise 0.85 ile 5.6 arasında bulunmuştur. GSBL pozitif 38 ve GSBL negatif 10 izolattan oluşan iki grup değerlendirildiğinde; hem CAZ-CLA hem de CTX-CLA indeksi için iki grup arasında istatistiksel olarak anlamlı fark olduğu saptanmıştır (p< 0.005). CTX-CLA ve CAZ-CLA indeksleri istatistiksel olarak karşılaştırıldığında ise, CTX-CLA indeksinin GSBL pozitifleri saptayabilme özelliğinin daha iyi olduğu belirlenmiştir (p= 0.001). Sonuç olarak, diğer yöntemlerle kıyaslandığında, akım sitometrisi yönteminin klinik mikrobiyoloji laboratuvarlarında GSBL tespiti için hızlı ve güvenilir bir yöntem olabileceği düşünülmüştür.
Anahtar sözcükler: Akım sitometrisi; genişlemiş spektrumlu beta-laktamaz; Enterobacteriaceae.
ABSTRACT
Extended-spectrum beta-lactamases (ESBL), produced by Enterobacteriaceae members are enzymes that especially cause a resistance to cephalosporin group antibiotics commonly used in clinics. Early and rapid detection of ESBL production is crucial for antimicrobial treatment and infection control; however the methods used for this purpose are time consuming (24 to 48 hours). The aim of this study was to determine a flow cytometry based-test which provides to detect ESBL producing bacteria in a short time. A total of 38 ESBL-producing (29 Escherichia coli, 9 Klebsiella pneumoniae) and 10 non-producing (5 E.coli, 5 K.pneumoniae) Enterobacteriaceae strains isolated between 2012 and 2013 were included in this study. The identification and antibiotic susceptibility tests of the isolates were performed by using PhoenixTM 100 automated system (Becton Dickinson, USA). The presence of blaTEM , blaSHV , blaCTX-M1, blaCTX-M2 and blaCTX-M9 genes were investigated in ESBL positive isolates via polymerase chain reaction method. At least one of the ESBL genes were detected in 36 out of 38 isolates and no genes were detected in two E.coli isolates. In flow cytometric method, the percentages of death cells exposed to cephalosporin [(ceftazidime (CAZ) or cefotaxime (CTX)] and clavulanic acid (CLA) combination, were compared with death cells exposed only to cephalosporin (CAZ or CTX). CLA index values (CAZ-CLA and CTX-CLA indices) were obtained for CTX and CAZ. Index values which was higher than 1.5 just for one cephalosporin were accepted as GSBL positive. The mean index values for CTX-CLA in ESBL positive strains according to their genotypic characteristics were between 1.14 and 7.22, while those values for CAZ-CLA were between 0.85 and 5.6. When the two groups of 38 ESBL positive and 10 ESBL negative strains were evaluated, statistically significant difference was detected for both CAZ-CLA and CTX-CLA indices (p< 0.005). CTX-CLA indices (p= 0.001) shown a better determination of ESBL when CAZ-CLA and CTX-CLA indices were compared statistically. In conclusion, flow cytometry is a rapid and reliable method for the detection of ESBL in clinical microbiology laboratories when compared with the other methods.
Keywords: Flow cytometry; extended-spectrum beta-lactamase; Enterobacteriaceae.
Geliş Tarihi (Received): 05.03.2015 • Kabul Ediliş Tarihi (Accepted): 28.08.2015
GİRİŞ
Genişlemiş spektrumlu beta-laktamaz (GSBL) enzimleri, özellikle üçüncü kuşak sefalosporin grubu antibiyotiklere karşı hidrolitik aktive göstermeleri nedeniyle önem taşımakta ve tedavi seçeneklerinin kısıtlanmasına sebep olmaktadırlar. GSBL aktivitesi gösteren enzimler, beta-laktamaz aktivitesi gösteren blaTEM-1, blaTEM-2 ve blaSHV-1 genlerinde meydana gelen nokta mutasyonları ile ortaya çıkmıştır. blaTEM ve blaSHV genlerinden köken alan GSBL enzimleri, 1980'li yıllarda yaygın iken, 2000'li yıllarda yerlerini CTX-M tipi enzimlere bırakmışlardır. CTX-M tipi enzimler, TEM ve SHV'nin aksine, bakteride önceden bulunan bir genin mutasyonuna bağlı olarak oluşmamıştır1,2.
GSBL üreten bakterilerin endemik olduğu bölgelerde, ampirik antibiyotik tedavi uygulaması da değişmektedir. Ampirik tedavi, karbapenem, kinolon ya da beta-laktam/beta-laktamaz inhibitörüne kaymaktadır. Ampirik tedavideki bu değişimin bir sonucu olarak da, karşımıza, GSBL üreten bakterilerle birlikte, dirençli Pseudomonas aeruginosa ve Acinetobacter baumannii gibi nonfermentatif bakteriler çıkmaktadır3,4. GSBL üreten bakterilerin, hastane ortamından veya enfeksiyon etkeni olarak izolasyonu, en kısa sürede tanımlanmaları ve antibiyotik duyarlılıklarının belirlenmesi gereğini ortaya çıkarmaktadır. Hızlı tanımlama, hastanın uygun tedaviyi en kısa sürede almasını sağlayacak ve ayrıca hastaların izolasyonu ile hastanede oluşabilecek muhtemel salgınları da önleyecektir1,2.
Akım sitometrisi; hücre topluluklarının, tek hücre bazında hızlı bir şekilde optik analizinin yapılabilmesine imkan veren bir yöntemdir5. Akım sitometrisi ilk defa 1940'lı yılların sonunda II. Dünya Savaşı döneminde aerosoller içerisindeki bakterileri tespit etmek amacıyla kullanılmıştır. 1970'lerin ortasından itibaren mikrobiyoloji alanında akım sitometrisinin kullanımı başlamıştır6. Bu çalışmanın amacı, GSBL üreten bakterilerin daha kısa sürede tespit edilmesini sağlayan akım sitometrisi temelli test yönteminin değerlendirilmesidir.
GEREÇ ve YÖNTEM
Bu çalışma, hastanemiz Etik Kurulu'nun onayı ile (7 Kasım 2012 tarih ve 1491-191-12/1648.4-5202 sayılı karar) gerçekleştirildi.
Bakteri İzolatları
Çalışmaya, Gülhane Askeri Tıp Akademisi, Tıbbi Mikrobiyoloji Laboratuvarlarında 2012-2013 yılları arasında PhoenixTM 100 otomatize sistemi (Becton Dickinson, ABD) ile tanımlanan 48 Enterobacteriaceae izolatı [38 GSBL pozitif kan izolatı (29 Escherichia coli, 9 Klebsiella pneumoniae) ve 10 GSBL negatif (5 E.coli, 5 K.pneumoniae) izolat] dahil edildi. Bakterilerdeki GSBL pozitifliği, çift disk sinerji testi ve gradiyent strip test ile tespit edildi7. Pozitif kontrol olarak; E.coli ATCC BAA-201 (blaTEM geni pozitif), K.pneumoniae subsp. pneumoniae ATCC 700603 (blaSHV geni pozitif) ve E.coli ATCC BAA-2326 (blaCTX-M1 geni pozitif izolat) suşları; negatif kontrol olarak ise E.coli ATCC 25922 ve E.coli ATCC 35218 suşları kullanıldı.
GSBL Direnç Genlerinin Polimeraz Zincir Reaksiyonu (PCR) ile Tespit Edilmesi
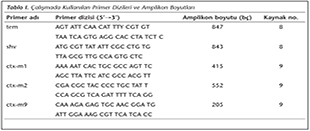
Bakteri DNA'ları fenol-kloroform-izoamilalkol yöntemi ile elde edildi. PCR reaksiyonu için örnekler, son hacmi 50 µl olacak şekilde hazırlandı. blaTEM ve blaSHV geninin varlığını tespit etmek için PCR amplifikasyonu; 95°C'de 10 dk denatürasyon sonrasında 95°C'de 45 sn, 56°C'de 45 sn ve 72°C'de bir dk olacak şekilde 35 döngü sonrasında, 72°C'de 10 dakika uzamadan oluşan program ile yapıldı. Bu protokolle ilişkili kaynak çalışmada8, döngü içinde her iki gen için 56°C ve 55°C gibi farklı sıcaklıklar kullanılmış olmasına rağmen, çalışmamızda her iki gen için 56°C'de 45 saniyede iyi sonuçlar elde edildi. blaCTX-M1, blaCTX-M2 ve blaCTX-M9 için PCR amplifikasyonu; 95°C'de 10 dk denatürasyon sonrasında 95°C'de 25 sn, 52°C'de 40 sn ve 72°C'de 50 sn olmak üzere 30 döngü uygulandı. Primer için kaynak olan makaledeki8 döngü süresi ve sayısı uygulandığında sonuç elde edilemediğinden PCR döngülerinin sayı ve süreleri yeniden düzenlendi. Son aşamada 72ºC'de 6 dk uzamadan oluşan program uygulandı8,9. Çalışmada kullanılan primer dizileri ve amplikon boyutları Tablo I'de gösterildi.
Akım Sitometrisi Yöntemi ile GSBL Varlığının Saptanması
Sefotaksim (CTX) (Sigma, ABD) için 0.1 mg/ml, seftazidim (CAZ) (Sigma, ABD) için 0.4 mg/ml, klavulanik asit (CLA) (Sigma, ABD) için 0.1 mg/ml ve Bis (1,3-dibutilbarbütirik asit) trimetin oksonol [DiBAC4(3)] (Sigma, ABD) için 0.1 mg/ml yoğunluğunda çalışma solüsyonu hazırlandı. -80°C'de saklanan ve %5'lik koyun kanlı besiyerinde canlandırılan E.coli izolatlarından bir koloni, K.pneumoniae izolatlarından iki koloni alınıp 4 ml'lik triptik soy buyyon içeren şişelere inoküle edildi. Şişeler 37ºC'de, 60-75 dakika süre ile inkübe edildi. 0.5 McFarland yoğunluğa ulaşan bakteriden 2 ml'lik steril triptik soy buyyonda dört adet 1/100'lük dilüsyonda bakteri süspansiyonu hazırlandı. Birinci tüpe 80 µl CTX, ikinci tüpe 80 µl CTX ve 80 µl CLA, üçüncü tüpe 80 µl CAZ ve dördüncü tüpe 80 µl CAZ ve 80 µl CLA eklendi ve tüpler 37°C'lik etüvde bir saat bekletildi. İnkübasyon sonunda DiBAC4(3), çalışma solüsyonundan tüplere 20 µl eklendi ve örnekler karanlık ortamda oda sıcaklığında bekletildi. Boyama işlemi sonunda her bir tüp MoFlo® AstriosTM Akım Sitometrisi cihazında (Beckman Coulter, ABD) 488 nm dalga boyundaki lazer ve 513 nm dalga boyundaki optik filtre kullanılarak değerlendirildi10.
Akım sitometrisi yönteminde bir örnek cihazda iki dakikalık bir sürede değerlendirildi. Duvar bütünlüğünü kaybedip boyayı hücre içine alarak floresan veren ölü hücrelerin, toplam hücrelerdeki yüzdesi belirlendi (Şekil 1). İnceleme sonucunda sefalosporin + CLA kombinasyonu (CAZ + CLA veya CTX + CLA) ile muamele edildiğinde ölen hücre yüzdeleri, sadece sefalosporin (CAZ veya CTX) ile muamele sonrası ölen hücre yüzdelerine oranlandı ve CAZ ve CTX için CLA indeks değer (CAZ-CLA ve CTX-CLA endeks) elde edildi. İndeks değerin en az bir sefalosporin için 1.5'ten büyük olması GSBL pozitif olarak değerlendirildi10.
İstatistiksel Analiz
Verilerin analizi için SPSS 15.0 paket programı kullanıldı. Verilerin tanımlamasında ortalama, medyan, en düşük ve en yüksek değerler kullanıldı. Sürekli değişkenlerin gruplar arası karşılaştırılmasında Mann Whitney U testi, kesikli değişkenlerin gruplar arası karşılaştırılmasında McNemar testi, değişkenler arası uyumun değerlendirilmesinde Kappa analizi kullanıldı. p< 0.05 değeri istatistiksel olarak anlamlı kabul edildi.
BULGULAR
Çalışılan 38 izolatın 36'sında PCR ile en az bir GSBL geni tespit edilirken, 2 E.coli izolatında tespit edilmemiştir (Tablo II). GSBL pozitif izolatlarda blaTEM geni %78.94, blaSHV geni %26.31, blaCTX-M1 geni %84.21, blaCTX-M2 geni %23.68 ve blaCTX-M9 geni %5.26 oranında bulunmuştur. Fenotipik olarak GSBL negatif izolatlarda GSBL genleri tespit edilmemiştir.
Çalışmamızda GSBL pozitif olan izolatların genotipik karakteristiklere göre CTX-CLA indeksi ortalamaları 1.14-7.22, CAZ-CLA indeks ortalamaları ise 0.85-5.6 arasında bulunmuştur (Tablo II). GSBL pozitif 38 ve negatif 10 izolattan oluşan iki grup değerlendirildiğinde; hem CAZ-CLA hem de CTX-CLA indeksi için iki grup arasında istatistiksel olarak anlamlı fark saptanmıştır (p< 0.05). CTX-CLA ve CAZ-CLA indeksleri istatistiksel olarak karşılaştırıldığında ise, CTX-CLA indeksinin GSBL pozitifleri saptayabilme özelliğinin daha iyi olduğu görülmüştür (p= 0.001). İstatistiksel analiz sonucunda, iki indeks arasında anlamlı bir uyum saptanmazken (p= 0.413), her iki indeksin beraber kullanılmasıyla GSBL pozitiflerin saptama oranının %100 olduğu belirlenmiştir (Tablo II).
TARTIŞMA
Özellikle sefalosporin grubu antibiyotiklerin yoğun şekilde kullanımı, hem hastane hem de toplum florası üzerine olumsuz etkide bulunmaktadır11. Enterobacteriaceae ailesi üyeleri arasında GSBL'ye bağlı üçüncü kuşak sefalosporin direnç oranlarının, tüm dünyada %6-38.5 arasında değiştiği bildirilmektedir12. Ülkemizde yapılan çalışmalarda; E.coli ve K.pneumoniae izolatlarında GSBL pozitiflik oranı; Gür ve arkadaşları13 tarafından sırasıyla %26 ve %32; Eraksoy ve arkadaşları14 tarafından sırasıyla %15.3 ve %40.5; Zarakolu ve arkadaşları15 tarafından ise sırasıyla %33 ve %31.4 olarak rapor edilmiştir.
Gram-negatif bakterilerin etken olduğu, özellikle kan dolaşımı enfeksiyonlarında yüksek mortalite oranı nedeniyle uygun şekilde değerlendirme yapılıp tedavinin planlanması önemlidir16. Gram-negatif sepsis olgularında, kültür pozitifliği sonrasında, antibiyotik duyarlılık testlerinin sonuçları alınıncaya kadar uygulanan ampirik antibiyotik tedavisinin %30'unun uygunsuz olduğu; ampirik olarak, uygun olan ve olmayan antibiyotik verilen hastalarda mortalite oranının sırasıyla %36.4 ve %51.7'ye ulaştığı bildirilmektedir17. Kritik hastaların bulunduğu bölümlerde ampirik tedavi seçeneği olarak karbapenemlerin kullanılması, hastane florası üzerine olumsuz etkiler oluşturmaktadır. Özellikle bu enzimi üretmeyen ve sefalosporinlere duyarlı olduğu gösterilen mikroorganizmaların erken saptanması karbapenem kullanımını sınırlandıracak önemli etkenlerden biridir. Böylece karbapenem kullanımına bağlı olarak karbapenemaz üreten Enterobacteriaceae'ler gibi mikroorganizmaların hastane florasında yoğunlaşması, kolonize olması ve sonrasında nozokomiyal salgınlara neden olması önlenmiş olacaktır18.
Rutin laboratuvarlarda GSBL saptamak için en sık olarak çift disk sinerji (ÇDS), gradiyent strip testi (GST) ve otomatize yöntemler kullanılmaktadır. Bu testlerin hepsinde üremiş olan mikroorganizma, GSBL tespiti için bir gece inkübe edilmektedir. Bu da uygun antibiyotik seçiminde gecikmelere neden olmaktadır19. GSBL ve AmpC beta-laktamazlarının bir arada bulunması, GSBL testlerinde yalancı negatif sonuçların elde edilmesine neden olabilmektedir. Bu durum, AmpC'nin CLA gibi beta-laktamaz inhibitörlerinin etkisine dirençli olması ve böylece GSBL varlığının AmpC aktivitesi ile baskılanmasıyla açıklanmaktadır. Bu da fenotipik testlerde GSBL saptanmasında problem oluşturmaktadır20. Örneğin ÇDS yöntemi ile yapılacak GSBL tespitinde, beraberinde bulunan AmpC, GSBL'ye bağlı oluşan anahtar deliği görüntüsünün kaybolmasına neden olacaktır21. Akım sitometrisinden elde edilen sonuçlar, direkt olarak apoptoza uğramış bakterilerin yüzdelik değerlerini ifade ettiğinden, bu yöntemin AmpC varlığında GSBL tespit edilebilmesinde diğer klasik yöntemlerden daha üstün olabileceği öngörülmektedir. Çalışmamızdaki izolatlar AmpC geninin varlığı yönünden araştırılmamış olup, bu iki genin beraber varlığındaki performansının ortaya konabilmesi için bu türden izolatlarla yeni çalışmaların yapılması gerekmektedir. Son zamanlarda gerçek zamanlı PCR ve microarray teknikleri de GSBL hızlı tespitinde kullanılmaktadır22.
Akım sitometrisi yöntemi, bakteriyolojide hem bakterilerin hızlı tanımlaması hem de antibiyotik duyarlılıklarının saptanmasında kullanılmaya başlanmıştır23. İşaretli antikorların kullanması ile balgam örneklerinden direkt olarak mikobakteriler üç saatten kısa sürede tespit edilebilmektedir5. Akım sitometrisi ile aynı örnekte birden fazla mikroorganizma tanımlanması yapılabilmektedir24. Akım sitometrisi, özellikle standart duyarlılık test yöntemleri ile sonuç alınmasının uzun sürdüğü mikobakteri ve mantar gibi mikroorganizmaların antibiyotik duyarlılık sonuçlarının kısa sürede alınmasında da kullanılmaktadır23. Bu yöntem ayrıca, antimikrobiyal ajanların bakteriyostatik ve bakterisidal etkilerini göstermekte de yararlıdır ve minimal bakterisidal konsantrasyon değerlerini de tespit edebilmektedir6. Faria-Ramos ve arkadaşları10, 41 GSBL pozitif ve 20 GSBL negatif olmak üzere toplam 61 örnekte akım sitometri yöntemini değerlendirmişler ve yöntemin GSBL tespitinde hızlı ve doğru sonuçlar verdiğini bildirmişlerdir. Çalışmamızda, GST, disk difüzyon ve otomatik yöntemlerle tanımlanmış 38 GSBL pozitif ve 10 GSBL negatif Enterobacteriaceae izolatı kullanılmış; GSBL pozitif izolatlarda CTX-CLA ve CAZ-CLA indeksinin GSBL negatif izolatlara göre anlamlı oranda yüksek olduğu saptanmıştır. Her iki indeks kıyaslandığında ise, CTX-CLA indeksinin tanımlama özelliğinin daha yüksek olduğu görülmüştür. GST, disk difüzyon ve otomatik yöntemlerin en az bir gecelik inkübasyon süresi ile kıyasladığımızda, akım sitometri yöntemi, iki saat gibi kısa bir süre içinde hızlı ve güvenilir GSBL tanımlaması yapabilmektedir. Bu yöntemde, bakteri başına sarfedilen DiBAC4(3) ve antibiyotiğin maliyeti ise yaklaşık 2.00 TL'dir. Sonuç olarak, akım sitometrisi yönteminin klinik mikrobiyoloji laboratuvarlarında GSBL tespiti için hızlı ve güvenilir bir yöntem olabileceği düşünülmektedir.
KAYNAKLAR
- Rossolini GM, D'Andrea MM, Mugnaioli C. The spread of CTX-M-type extended-spectrum beta-lactamases. Clin Microbiol Infect 2008; 14 Suppl 1:33-41.
- Nasseer U, Sundsfjord A. The CTX-M conundrum: dissemination of plasmids and Escherichia coli clones. Microb Drug Resist 2011; 17(1): 83-97.
- Meyer KS, Urban C, Eagen JA, et al. Nosocomial outbreak of Klebsiella infection resistant to late-generation cephalosporins. Ann Inten Med 1993; 119(5): 353-8.
- Rahal JJ, Urban C, Horn D, et al. Class restriction of cephalosporin use to control total cephalosporin resistance in nosocomial Klebsiella. JAMA 1998; 280(14): 1233-7.
- Brehm-Stecher BF, Johnson EA. Single-cell microbiology: tools, technologies, and applications. Microbiol Mol Biol Rev 2004; 68(3): 538-59.
- Givan AL. Flow cytometry: an Introduction. Methods Mol Biol 2011; 699:1-29.
- Clinical and Laboratory Standards Institute. Performance Standards for antimicrobial susceptibility testing. 21th Informational Supplement. CLSI Document M100-S21, 2011. CLSI, Wayne, PA.
- Copur Cicek A, Saral A, Duzgun OA et al. Nationwide study of Escherichia coli producing extended-spectrum -lactamases TEM, SHV and CTX-M in Turkey. J Antibiot (Tokyo) 2013; 66(11): 647-50.
- Khan E, Schneiders T, Zafra A, et al. Emergence of CTX-M Group 1-ESBL producing Klebsiella pneumonia from a tertiary care centre in Karachi, Pakistan. J Infect Dev Ctrles 2010; 4(8): 472-76.
- Faria-Ramos I, Espinar MJ, Rocha. A Novel flow cytometric assay for rapid detection of extended-spectrum beta-lactamase. Clin Microbiol Infect 2013; 19(1): E8-E15.
- Livermore DM, Hope R, Reynolds R, et al. Declining cephalosporin and fluroquinolone non-susceptibility among blood stream Enterobacteriaceae from the UK: links to prescribing change? J Antimicrob Chemother 2013; 68(11): 2667-74.
- Zowawi HM, Balkhy HH, Walsh TR, et al. -Lactamase production in key gram-negative pathogen isolates from the Arabian Peninsula. Clin Microbiol Rev 2013; 26(3): 361-80.
- Gür D, Gülay Z, Akan OA, et al. Resistance to newer beta-lactams and related ESBL types in gram-negative nosocomial isolates in Turkish hospitals: results of the multicentre HITIT study. Mikrobiyol Bul 2008; 42(4): 537-44.
- Eraksoy H, Basustaoglu A, Korten V, et al. Susceptibility of bacterial isolates from Turkey-a report from the Meropenem Yearly Susceptibility Test Information Collection (MYSTIC) Program. J Chemother 2007; 19(6): 650-7.
- Zarakolu P, Metan G, Hasçelik G, Akova M. Prevalence of extended-spectrum beta-lactamases in nosocomial Escherichia coli and Klebsiella spp. strains isolated from blood cultures. Mikrobiyol Bul 2007; 41(4): 579-84.
- Rossotti R. Orani A. Clinical management of ESBL-producing Enterobacteriaceae: the insidious role of fluoroquinolones. Eur J Clin Microbiol Infect Dis 2012; 31(7): 1517-22.
- Micek ST, Welch EC, Khan J, et al. Empiric combination antibiotic therapy is associated with improved outcome against sepsis due to gram-negative bacteria: a retrospective analysis. Antimicrob Agents Chemother 2010; 54(5): 1742-8.
- Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis 2011; 17(10): 1791-8.
- Nordmann P, Dortet L, Poirel L. Rapid detection of extended-spectrum--lactamase-producing Enterobacteriaceae. J Clin Microbiol 2012; 50(9): 3016-22.
- Coudron PE. Inhibitor-based methods for detection of plasmid-mediated AmpC beta-lactamases in Klebsiella spp., Escherichia coli, and Proteus mirabilis. J Clin Microbiol 2005; 43(8): 4163-7.
- Jones-Dias D, Manageiro V, Ferreira E. Diversity of extended-spectrum and plasmid-mediated AmpC beta-lactamases in Enterobacteriaceae isolates from Portuguese health care facilities. J Microbiol 2014; 52(6): 496-503.
- Cuzon G, Naas T, Bogaerts P, et al. Evaluation of a DNA microarray for the rapid detection of extended-spectrum -lactamases (TEM, SHV and CTX-M), plasmid-mediated cephalosporinases (CMY-2-like, DHA, FOX, ACC-1, ACT/MIR and CMY-1-like/MOX) and carbapenemases (KPC, OXA-48, VIM, IMP and NDM). J Antimicrob Chemother 2012; 67(8): 1865-9.
- Pieretti B, Masucci A, Moretti M. Applications of Flow Cytometry to Clinical Microbiology, pp: 17-42. In: Schmid I (ed), Clinical Flow Cytometry, Emerging Applications. 2012, InTech, Croatia.
- Kim JS, Anderson GP, Erickson JS, et al. Multiplexed detection of bacteria and toxins using a microflow cytometer. Anal Chem 2009; 81(13): 5426-32.
İletişim (Correspondence):
Uzm. Dr. Soner Yılmaz,
Gülhane Askeri Tıp Akademisi,
Bölge Kan Merkezi, Keçiören, Ankara, Türkiye.
Tel (Phone): +90 533 384 4746,
E-posta (E-mail): soyilmaz@gata.edu.tr