B�brek
Nakil Hastalarında Sitomegalovirusa �zg�l CD4+ ve CD8+
T H�cre Yanıtının
Sitokin Akım Sitometri Y�ntemiyle İzlemi*
Monitoring
of Cytomegalovirus-Specific CD4+ and CD8+ T Cell
Responses by Cytokine
Flow Cytometry in Renal Transplant Recipients
Hafize KILIN�KAYA DOĞAN1, Esvet MUTLU2, Sadi K�KSOY2, Vural T. YILMAZ3, H�seyin KO�AK3, Dilek �OLAK4, Derya MUTLU4, Filiz G�NSEREN5, Ayhan DİN�KAN3, İbrahim ALİOSMANOĞLU3, G�ltekin S�LEYMANLAR3, Meral G�LTEKİN2
1 Akdeniz �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Antalya.
1 Akdeniz University Faculty of Medicine, Department of Medical Microbiology, Antalya, Turkey.
2 Akdeniz �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Temel İmm�noloji Bilim Dalı, Antalya.
2 Akdeniz University Faculty of Medicine, Department of Immunology, Antalya, Turkey.
3 Akdeniz �niversitesi Prof. Dr. Tuncer Karpuzoğlu Organ Nakli Merkezi, Antalya.
3 Akdeniz University Prof. Dr. Tuncer Karpuzoğlu Transplantation Center, Antalya, Turkey.
4 Akdeniz �niversitesi Tıp Fak�ltesi,Tıbbi Mikrobiyoloji Anabilim Dalı, Viroloji Bilim Dalı, Antalya.
4 Akdeniz University Faculty of Medicine, Department of Virology, Antalya, Turkey.
5 Akdeniz �niversitesi Tıp Fak�ltesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Antalya.
5 Akdeniz University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Antalya, Turkey.
* Bu �alışma, Akdeniz �niversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi (No: 2011.04.0103.039) tarafından desteklenmiş ve 2. Ulusal Klinik Mikrobiyoloji Kongresi (10-13 Kasım 2013, Antalya) ve 18th� Symposium on Infections in the Immunocompromised Host (15-17 Haziran 2014, Berlin, Almanya) Sempozyumunda poster olarak sunulmuştur.
�Z
Solid organ transplant (SOT) alıcılarında, imm�n s�presyon ve geniş �aplı profilaksinin sağladığı klinik iyileşmeye rağmen, insan sitomegalovirus enfeksiyonu (CMV) morbidite ve mortalitenin en �nemli nedenlerinden biri olmaya devam etmektedir. CMV replikasyonunun kontrol�nde h�cresel imm�n yanıt �nemli bir rol oynamaktadır. CMV'ye �zg�l T h�cre yanıtının izlemi, CMV hastalığı gelişme riski y�ksek olan bireyleri �nceden belirlemede kullanılabilir. Bu �alışmada, b�brek transplant alıcılarında, nakil �ncesi ve sonrası, CMV'ye �zg�l interferon (IFN)-γ �reten CD4+ ve CD8+ T lenfosit d�zeylerinin sitokin akım sitometri y�ntemiyle araştırılması ama�lanmıştır. �alışmada, CMV seropozitif 21 b�brek transplant alıcısı (14 erkek, 7 kadın; yaş aralığı: 18-66 yıl, ortalama yaş: 34.5 � 9.9) değerlendirilmiş; nakilden �nce ve nakilden sonraki 1., 3. ve 6. aylarda olgulardan kan �rnekleri alınmıştır. CMV seropozitif sağlıklı b�brek vericileri (n= 20) ise kontrol grubunu oluşturmuştur. Uygulanan prosed�r�n ana basamakları; tam kandan periferik kan monon�kleer h�crelerinin izolasyonu, �rneklerin dondurulması ve saklanması, daha sonra �rneklerin ��zd�r�lmesi, CMV peptid havuzu kullanarak lenfositlerin ex vivo uyarımı, son olarak da y�zey ve h�cre i�i boyamalardan sonra CMV'ye �zg�l IFN-γ �reten CD4+ ve CD8+ T h�crelerinin akım sitometri y�ntemiyle sayılmasıdır. Hastalarda viral y�k (CMV-DNA) izlemi, ilk 3 ayda 10 g�nl�k aralarla, takiben 6. aya dek 3 haftada bir COBAS AmpliPrep/COBAS TaqMan CMV test sistemi (Roche Diagnostics, ABD) kullanılarak yapılmıştır. Hastaların transplantasyon �ncesi CMV'ye �zg�l IFN-γ �reten CD8+ T h�cre sayısı (3.53 � 4.35/�l) kontrol grubundakinden (4.52 � 5.17/�l) farklı bulunmamıştır (p= 0.266). Hasta ve kontrol grubunun CMV'ye �zg�l CD4+ T h�cre sayıları ise sırasıyla; 8.84 � 9.56/�l ve 8.23 � 11.98/�l olarak bulunmuş, aradaki fark anlamlılık d�zeyinde sınırda sonu� vermiştir (p= 0.057). Hastaların yaşı, cinsiyeti ve uygulanan antiviral profilaksi protokollerinin [valgansiklovir (n= 4); valasiklovir (n= 17)], CMV'ye �zg�l h�cresel imm�nite (CMV-Hİ) �zerinde anlamlı bir etkisi bulunmamıştır (p> 0.05). D�rt hastaya uygulanan ind�ksiyon tedavisinin CMV-Hİ'yi etkilemediği belirlenmiştir (p> 0.05). Farklı imm�n s�presyon protokolleri uygulanan [takrolimus + mikofenolat mofetil (MMF) + steroid (n= 17); siklosporin + MMF + steroid (n= 2); mTOR inhibit�r + MMF + steroid (n= 2)] hastaların CMV'ye �zg�l imm�n yanıtları arasında da farklılık g�zlenmemiştir (p> 0.05). T�m hastalarda, CMV'ye �zg�l CD4+ T h�cre sayısının, nakil sonrası 3. ayda, 1. aya g�re anlamlı d�zeyde d�ş�k olduğu belirlenmiş (p= 0.003), bu durumun imm�n s�presif tedavinin s�resiyle ilişkili olduğu d�ş�n�lm�şt�r. Hastalardan birinde, nakil �ncesinde virusa �zg�l sitotoksik T h�crelerinin (CD8+ T = %0.6) varlığına rağmen, �zg�l CD4+ T h�cre yanıtının olmadığı saptanmış; bu hastada izlem sırasında CD4+ T h�cre yanıtının geliştiği (1., 3. ve 6. aylarda sırasıyla; %1.4, %1.5 ve %0.5) ve reaktivasyonun olmadığı g�r�lm�şt�r.� İki hastada ise nakil sonrası 3. ayda CMV'ye �zg�l CD4+� ve CD8+ T h�creleri saptanmamış; bunların birinde 6. ayda d�ş�k d�zeyde viremi (150 kopya/ml) ortaya �ıkmıştır. Bu hastada, nakil sonrası 6. aydaki CMV-Hİ d�zeyinin (CD4+T + CD8+ T= %0.9), nakil �ncesinden (CD4+ T + CD8+ T= %0.5) daha y�ksek d�zeye ulaştığı izlenmiş; hastada viremi kendiliğinden temizlenmiş ve antiviral tedavi gerekmemiştir. Sonu� olarak, SOT hastalarında transplantasyon �ncesi ve sonrası s�re�te, viral y�k izleminin yanı sıra, CMV'ye �zg�l T h�cre yanıtı izleminin, CMV hastalığının kontrol�nde yararlı olacağı d�ş�n�lm�şt�r.��
Anahtar s�zc�kler: Sitomegalovirus enfeksiyonu; CMV; h�cresel imm�n yanıt; b�brek transplantasyonu; imm�nolojik izlem; akım sitometrisi.
ABSTRACT
In spite of the improvements in the clinical management of solid organ transplant (SOT) recipients provided by immunosuppresion and universal prophylaxis, human cytomegalovirus (CMV) infections continue to be one of the most leading causes of morbidity and mortality. Cell-mediated immunity specific to CMV (CMV-CMI) plays an important role in the control of CMV replication. Therefore, monitoring of CMV-specific T-cell response can be used to predict individuals at increased risk of CMV disease. The aim of this study was to investigate the levels of CMV-specific interferon (IFN)-γ producing CD4+ and CD8+ T cells in kidney transplant recipients before and after the transplantation, by cytokine flow cytometry. A total of 21 kidney transplant recipients (14 male, 7 female; age range: 18-66 years, mean age: 34.5 � 9.9) who were all CMV seropositive have been evaluated in the study. Blood samples from the patients were obtained before and at the 1st, 3rd and 6th months after transplantation. CMV seropositive healthy kidney donors (n= 20) constituted the control group. The main stages of our procedure were as follows; isolation of peripheral blood mononuclear cells from whole blood, freezing and storing of the samples, later on thawing the samples, ex vivo stimulation of lymphocytes with pooled CMV peptides and counting CMV-specific IFN-γ producing CD4+ and CD8+ T cells by flow cytometry following surface and intracellular cytokine staining. Monitoring of the viral load (CMV-DNA) was performed in 10 days intervals in the first 3 months followed by 3 week intervals until 6 months using COBAS AmpliPrep/COBAS TaqMan CMV test system (Roche Diagnostics, USA). The frequencies of pretransplant CMV-specific IFN-γ producing CD8+ T cells in patient (3.53 � 4.35/�l) and control (4.52 � 5.17/�l) groups were not statistically different (p= 0.266). The difference between the number of virus-specific CD4+ T cells in patients (8.84 � 9.56/�l) and those in the control group (8.23 � 11.98/�l) was at the borderline of significance (p= 0.057). The age and gender of the patients and type of antiviral prophylaxis protocols [valgancyclovir (n= 4); valacyclovir (n= 17)] did not have any significant effect on CMV-CMI (p> 0.05). Similarly, induction therapy administered to four patients did not show any effect on CMV-CMI (p> 0.05). CMV-specific immune responses of patients who received different immunosuppression protocols [tacrolimus + mycophenolate mofetil (MMF) + steroid (n= 17); cyclosporine + MMF + steroid (n= 2); mTOR inhibitor + MMF + steroid (n= 2)] were not different (p> 0.05). The number of CMV-specific CD4+ T cells in all patients were significantly decreased in the 3rd month compared to the 1st month after the transplantation (p=0.003), indicating a relationship with the period of immunosuppressive therapy. In one of the patients who did not have CMV-specific CD4+ T-cell response but had cytotoxic T-cells (CD8+ T= 0.6%) before transplantation, CD4+ T-cell response have developed during monitorization (1.4%, 1.5% and 0.5% in 1st, 3rd and 6th months, respectively), and no viral reactivation was detected. Out of the two patients who had no CD4+� and CD8+ T cell response in the 3rd month, one of them developed low level viremia (150 copies/ml) in the 6th month. In this patient the level of CMV-CMI in the 6th month (CD4+T + CD8+T= 0.9%), have reached higher values than the values obtained before the transplantation (CD4+ T + CD8+ T= 0.5%). The viremia was cleared spontaneously in this patient and no antiviral therapy was required. In conclusion, our results suggested that pretransplant and posttransplant monitoring of CMV-specific T-cell responses might be helpful as well as viral load in the clinical management of CMV infection in SOT patients.
Keywords: Cytomegalovirus infection; CMV; cell-mediated immunity; renal transplantation; immunologic monitoring; flow cytometry.
Geliş Tarihi (Received): 29.12.2015 • Kabul Ediliş Tarihi (Accepted): 22.02.2016
GİRİŞ
Solid organ transplantasyon (SOT) hastalarında, sitomegalovirus (CMV) enfeksiyonu ve hastalığı insidansında� son yıllarda� azalma kaydedilmesine karşın, g�n�m�zde hala transplantasyon alanında enfeksiyon ile ilişkili morbidite ve �nlenebilir mortalitenin �nemli etkenlerinden biri olmaya devam etmektedir. Antiviral proflaksi ve preemptif tedavi yaklaşımları ile sağlanan başarı; y�ksek mortalite, organ kaybına neden olabilen ge� d�nem CMV hastalığı ve gansiklovir direnci sorunlarını da beraberinde getirmiştir1. Kendisi de imm�nojen olan CMV�nin konak tarafından kontrol�, doğal ve edinsel bağışık sistemin yanıt verdiği kompleks bir s�re�tir. Toll-benzeri resept�r 2 ve 4 polimorfizmi; mannoz bağlayıcı lektin ve fikolin 2 genlerinde tek n�kleotid polimorfizmi ile CMV hastalığı gelişimi arasında ilişki olduğu g�sterilmiştir2,3. Doğal �ld�r�c� (NK) h�creler de b�brek nakil hastalarında primer veya tekrarlayan CMV enfeksiyonlarının kontrol�nde rol oynarlar4. H�moral imm�n yanıt, primer olarak glikoprotein B, glikoprotein H ve pentamerik glikoprotein H/gL/UL128/UL130/UL131 kompleksini hedef alan antikor sentezi sonucunda, h�cre dışı virus n�tralizasyonu ile virusun kontrol�ne katkı sağlasa da, transplantasyon laboratuvarında CMV serolojisi, esas itibarıyla alıcı ve vericide nakil �ncesi CMV IgG taraması ile risk grubunun belirlenmesi amacıyla kullanılmaktadır1,5. Diğer herpesviruslar ile benzer bir şekilde CMV, primer enfeksiyonun ardından makrofaj, n�trofil, fibroblast, endotel ve epitelyal h�creler gibi �eşitli h�crelerde yaşamaya devam eder. CMV, �eşitli stratejilerle imm�n sistemden ka�tığı i�in konak tarafından yok edilemez, ancak sağlıklı bireylerin bağışık sistemi virusu hastalık ve komplikasyonlar oluşmaksızın �latent'� tutmayı başarır. CMV seropozitif SOT hastalarında, nakledilen yabancının (doku, organ) konak tarafından reddini �nlemek amacıyla uygulanan imm�n s�presyon tedavisi, latent virusun reaktivasyonuna ve viremiden yaşamı tehdit eden invazif enfeksiyonlara uzanan bir yelpazede CMV hastalığı gelişimine neden olabilir. CMV enfeksiyonunda konak-virus etkileşiminin konak aleyhine bozulmamasında anahtar mekanizma virusa �zg�l h�cresel bağışık yanıttır1,6.
Viral enfeksiyonlara karşı erken ve ge� d�nem imm�n yanıtta, bellek T h�crelerinin �nemi uzun yıllardır bilinmektedir7. İmm�n s�presyon ile baskılanmış olan CMV'ye �zg�l T h�cre yanıtının yeniden yapılanması, enfeksiyonun kontrol�nde �ok �nemli olup, bu durum k�k h�cre alıcılarına CMV'ye �zg�l CD8+ sitotoksik T h�cre klonlarının transfer edildiği klinik araştırmalarda g�sterilmiştir8. Son 20 yılda gerek SOT, gerekse k�k h�cre alıcılarında akım sitometrisi, ELISPOT ve Quantiferon y�ntemleriyle hem virolojik hem de imm�nolojik izlem yapılarak, CMV enfeksiyonunun �nlenmesi, kontrol� ve tedavisinde daha etkin yaklaşımlar hedeflenmektedir6,9,10. Kaynak taramamıza g�re, ulaşılabildiği kadarıyla, yurdumuzda klinik �rneklerde CMV h�cresel imm�nite araştırması daha �nce yapılmamıştır. Bu �alışmada, b�brek nakli planlanan hastalarda nakil �ncesi ve sonrası 1, 3 ve 6. aylarda sitokin akım sitometri y�ntemiyle, CMV'ye �zg�l interferon (IFN)-γ �reten CD4+ ve CD8+ T lenfosit d�zeylerinin araştırılması ve h�cresel imm�n yanıtların değerlendirilmesi ama�lanmıştır.
HASTALAR ve Y�NTEM
Olgular
Akdeniz �niversitesi Prof. Dr. Tuncer Karpuzoğlu Organ Nakli Merkezi tarafından canlı vericiden b�brek nakli planlanan 21 hastadan (Tablo I) Aralık 2012- Ağustos 2013 tarihleri arasında nakil �ncesi (0. ay) ve sonrası (1, 3, 6. aylar), sodyum heparinli t�plere 5 ml ven�z kan �rnekleri alındı. Hastalar ve vericiler CMV seropozitif idi (R+/D+). Kontrol grubu olarak sağlıklı 20 vericiden �rnek toplandı. Virolojik izlem protokol� uyarınca, hastalarımızda nakil sonrası ilk 3 ay 10 g�nde bir, 6. aya kadar 3 haftada bir CMV-DNA PCR �alışıldı.
Araştırma, Akdeniz �niversitesi Tıp Fak�ltesi Etik Kurul Başkanlığı'nın 03.01.2012/10 tarih/sayılı etik kurul onayı ile ger�ekleştirildi ve hastaların yazılı onamları alındı.
CMV-DNA d�zeyinin kantitasyonu
Plazma �rneklerinden CMV-DNA kantitasyonu i�in COBAS AmpliPrep/COBAS TaqMan CMV test sistemi, �retici firmanın (Roche Diagnostics, ABD) �nerileri doğrultusunda uygulandı. Ekstraksiyon i�in, manyetik partik�ller kullanan silika tabanlı bir y�ntem; amplifikasyon ve saptama i�in, CMV DNA polimeraz genini (UL54) hedef alan primer �ifti ve �ift işaretli Taqman hidroliz probları kullanıldı. Aynı zamanda PCR inhibit�rlerinin varlığını saptamak amacıyla, ekstraksiyon karışımı i�erisine eklenen internal kontrol DNA'sı, hedef amplifikasyonunda kullanılan primer �ifti kullanılarak �oğaltıldı ve internal kontrol DNA'sına �zg�, farklı bir hidroliz probu kullanılarak saptandı.
CMV'ye �zg�l IFN-γ �reten CD4+ ve CD8+ �T lenfositlerinin kantitasyonu
Y�ntem standardize olmadığından ve laboratuvarımızda ilk kez �alışacağımızdan, �ncelikle optimizasyon �alışmaları, ardından g�n i�i ve g�nler arası kesinlik değerleri ile laboratuvar validasyonu yapıldıktan sonra kontrol ve hasta �rneklerinin �alışılmasına başlandı. Y�ntemin ana basamakları; tam kandan periferik kan monon�kleer h�cre (PKMNH) izolasyonunun ardından, lenfositlerin CMV peptidleri ile ex vivo olarak uyarılması ve CMV'ye �zg�l IFN-γ �reten T lenfositlerinin y�zey antijenleri ve h�cre i�i sitokin boyama sonucunda akım sitometride fonksiyonel ayırım yaparak sayılmasıdır6,9,10.
PKMNH izolasyonu, ven�z kan �rneği alınmasını takip eden 4 saat i�erisinde ger�ekleştirildi ve h�creler, stok besiyeri ile s�spanse edilerek kriyoviyallere aktarıldı. �nce -80�C'de, ertesi g�n sıvı azot tankına alınarak saklandı. Dondurulmuş �rnekler, �alışılacağı zaman 1 ml ��zd�rme sol�syonu [%88:%1 L-Glutaminli RPMI 1640, %1 steril -ısı ile inaktive edilmiş- fetal dana serumu (FBS), %1 Na-piruvat, %1 penisilin-streptomisin) ile ��zd�r�ld�kten sonra, 1 ml �alışma besiyeri (%90: %1 L-Glutaminli RPMI 1640, %10 steril -ısı ile inaktive edilmiş- FBS) ile s�spanse edilen pellette %0.4'l�k tripan mavisi ile (Sigma Trypan blue solution %0.4, St. Louis, USA) Neubauer lamında h�cre sayımı yapılarak 50 μl'de 3x105 h�cre olacak şekilde ihtiya� duyulan �alışma besiyeri miktarı hesaplandı ve nihai h�cre izolasyonu tamamlandı11.
CMV'ye �zg�l CD4+ ve CD8+ T lenfosit sayımları i�in negatif kontrol, pozitif kontrol ve CMV peptid etiketlemesi yapılarak her bir �rnek i�in altı ayrı falkon t�p� hazırlandı. T�m t�plere 50 μl h�cre i�eren sol�syon konarak; negatif kontrol t�plerine 100 μl �alışma besiyeri, pozitif kontrol t�plerine 100 μl pokeweed (GenID Gmbh, Almanya), CMV peptid t�plerine ise 100'er μl CMV peptid (GenID Gmbh, Almanya), 1'er μl CD28/CD49d (BD FastImmune, ABD) ilave edildi. CMV peptid ve pozitif kontrol t�plerine ink�basyonun 2. saati dolduğunda 1.5 μl golgi stopper (BD Golgi Plug, ABD) konuldu. Sekiz saatlik ink�basyonun ardından IFN-γ/CD69/CD4/CD3 (BD FastImmune, ABD; Cat. No: 337184) veya IFN-γ/CD69/CD8/CD3 (BD FastImmune, ABD; Cat. No: 346048) antikorları kullanılarak boyama aşamalarına ge�ildi. Akım sitometri (BD FACSCanto II, ABD) cihazında, toplam lenfositler i�indeki aktive olmuş CD3+CD69+ T lenfositlere ve onların i�indeki CD4+/CD8+IFN-γ T lenfositlere kapı alındı. % parent (%p) ve % grandparent (%gp) değerleri bulundu. %gp değerleri kullanılarak eş zamanlı �alışılmış olan lenfosit sayıları ile oranlayarak CMV'ye �zg�l CD4+ ve CD8+ T lenfositlerinin sayısal değerlerine ulaşıldı9,12,13,14.
İstatistiksel Değerlendirme
Elde edilen veriler PASW 18 (SPSS/IBM, Chicago, ABD) kullanılarak analiz edildi. Parametrik test varsayımlarının sağlandığı durumlarda Student t testi, iki eş arası fark testi, varyans analizi, parametrik test varsayımlarının sağlanmadığı durumlarda ise Mann-Whitney U, Wilcoxon işaretli sıra ve Kruskall-Wallis testleri kullanıldı. S�rekli değişkenler arasındaki ilişki durumu Spearman korelasyon katsayısı, kategorik veriler ise ki-kare anlamlılık testi ile incelendi.
BULGULAR
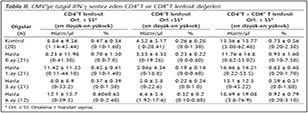
Hasta ve kontrol grubunun CMV'ye �zg�l h�cresel imm�n yanıt değerleri Tablo II'de verilmiştir. Kontrol grubunda bir �rnekte CMV'ye �zg�l CD8+ T h�cre yanıtı saptanamamıştır, ancak CMV peptidleri ile CD4+ T lenfosit uyarımı mevcuttur (%0.6) (Tablo III). Hastalardan birinde ise nakil �ncesi CMV'ye �zg�l sitotoksik T h�cre varlığına rağmen (CD8+ T= %0.4), CD4+ T h�cresi saptanamamıştır (Tablo III). Bu hastada nakil sonrası 1, 3 ve 6. aylarda CMV'ye �zg�l CD4+ T ve CD8+ T h�cre y�zdeleri sırasıyla; %1.4 ve %0.3,� %1.5 ve %0.3, %0.5 ve %0.1 değerlerinde saptanmıştır.
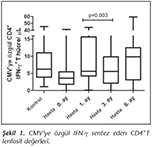
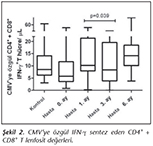
Kontrol ve hasta grubu arasında nakil �ncesi, CMV'ye �zg�l CD8+ IFN-γ T lenfosit ve CD4+ + CD8+ IFN-γ T lenfosit sayıları arasında anlamlı fark saptanmamıştır (Mann-Whitney U testi, p= 0.266, p= 0.088). CD4+ IFN-γ T lenfosit d�zeyleri a�ısından ise kontrol ve hastaların nakil �ncesi değerleri arasındaki fark istatistiksel olarak sınırda bulunmuştur (p= 0.057). Nakil sonrası 3. aydaki CD4+IFN-γ T lenfosit sayısının, 1. ay CD4+IFN-γ T lenfosit sayısından anlamlı d�zeyde daha d�ş�k olduğu belirlenmiştir (Wilcoxon Signed testi, p= 0.003) (Tablo II). CD8+T h�cre değerleri farklı olmamasına karşın, CD4+ T lenfositlerdeki bu farklılık, toplam T lenfosit sayısını -CMV'de �zg�l imm�niteyi- etkileyerek 3. ayda 1. aya g�re daha d�ş�k bulunmuştur (Wilcoxon Signed testi, p= 0.039) (Şekil 1,2).
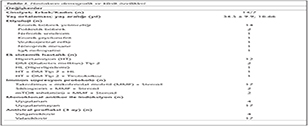
Tablo I�de belirtilen değişkenler ayrı ayrı değerlendirildiğinde, kontrol grubu ve hastaların nakil �ncesi CMV'ye �zg�l h�cresel imm�nite değerlerinin yaş ve cinsiyete g�re fark g�stermediği belirlenmiştir (Korelasyon ve Mann-Whitney U testi, p> 0.05). Farklı imm�n s�presyon protokollerinin CMV'ye �zg�l h�cresel imm�nite �zerine farklı etkileri olmadığı (Kruskal-Wallis, p> 0.05); ind�ksiyon tedavisi uygulanma ya da uygulanmamasının CMV'ye �zg�l CD4+ T ve CD8+ T lenfositlerinin yeniden yapılanması �zerine etkisi olmadığı saptanmıştır.
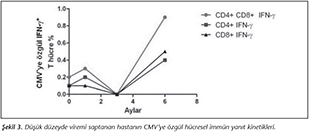
İmm�n s�presif tedavinin 3. ayında, iki hastamızda CMV'ye �zg�l her iki T lenfosit alt grubu da saptanamamıştır. Bazal değerlerine baktığımızda, nakil �ncesi CMV'ye �zg�l� CD4+ T ve CD8+ T lenfosit değerlerinin kontrol grubuna g�re daha d�ş�k olduğu g�r�lm�şt�r. CMV'ye �zg�l h�cresel imm�niteleri baskılanmış olan bu hastaların birinde nakil sonrası 6. ayda d�ş�k d�zeyde viremi (150 kopya/ml) saptanmış olup CMV hastalığı gelişmemiştir. Hastamızın 6. aydaki CMV'ye �zg�l h�cresel imm�nite değerleri ise; CD4+� T h�cre %0.4 �ve� CD8+T h�cre % 0.5� olarak belirlenmiştir (Şekil 3).
TARTIŞMA
H�cresel imm�n yanıtın izleminde kullanılan y�ntemlerin temeli; virusa �zg�l T lenfositleri ve fonksiyonlarının tanımlanması, belirlenmesi ve h�cresel bağışıklığın en �nemli sitokinlerinden olan IFN-γ yanıtının �l��m�ne dayanmaktadır. CMV'ye �zg�l imm�nite �l��m�nde kullanılan test/y�ntemler ELISPOT, QuantiFERON ve akım sitometrisi olup, altın standart� "sitokin akım sitometri (Cytocine flow cytometry; CFC) - h�cre i�i sitokin boyama (Intracellular cytokine staining; ICS)" y�ntemidir. ICS y�nteminde; viral� peptidler� ile ex vivo olarak uyarılan lenfositler, y�zey antijenleri ve h�cre i�i sitokin boyama sonucunda fonksiyonlarının sitokin sentez aşamasında g�sterilirler. Bu y�ntem, viral peptid-MHC-tetramer� kompleksine direkt olarak bağlanan epitopa �zg�l T lenfosit fenotiplerinin� belirlendiği tetramer bazlı akış sitometrisine g�re daha duyarlı ve fonksiyonel olma avantajına sahiptir10,11,12,13,14. Bizim �alışmamızda da, SOT hastalarında CMV'ye �zg�l h�cresel imm�nitenin izleminde, CMV peptidleri ile ex vivo uyarımın ardından viral aktivasyonun en duyarlı, �zg�l belirte�lerinden olan� IFN-γ sentezleyen CD4+ ve CD8+ T lenfositlerinin kantitasyonu amacıyla sitokin akım sitometri y�ntemi kullanılmıştır. Kaynak taramamıza g�re, ulaşılabildiği kadarıyla, araştırmamız bu alanda yurdumuzda yapılan ilk �alışmadır.
ICS y�ntemi standardize olmadığından, araştırmamızda �ncelikle, her bir aşama i�in optimizasyon �alışmaları ve ardından test validasyonu ger�ekleştirilmiştir15,16. �alışmamızın ex vivo uyarım aşamasında, tam kanın direkt olarak ya da PKMNH izole edilerek yapılan �alışmanın; �rneklerin dondurulup, saklanıp, ��zd�r�lerek yapılan �alışmaya �st�nl�ğ� olmadığı belirlenmiştir16. Ancak, test rutin uygulamaya girdiğinde ve �rnek sayısı �ok olduğunda, Motta ve arkadaşlarının17 vurguladıkları gibi, direkt olarak tam kan uyarımının testin uygulanmasında daha pratik olduğu yorumuna katılıyoruz. Lenfositlerin ex vivo uyarımında, tek peptid, saflaştırılmış polipeptid, peptid kokteyli ya da virus ile enfekte h�cre lizatı kullanılmaktadır. Tek peptid kullanımı durumunda, lenfosit aktivasyonu sağlanamayabilir. Viral lizat kullanımında, �ok sayıda CMV protein ekspresyonu nedeniyle testin duyarlılığı artmaktadır, ancak enfekte fibroblastlardan hazırlanan lizat standardize değildir6,10,14,18,19. İmm�nite araştırmalarında, ex vivo koşulların olabildiğince in vivo ortama yakın olması arzu edilir. Lozza ve arkadaşları20, endotelyotropik ve dendrotropik CMV VR1814 suşu ile dendritik h�creleri enfekte ederek oluşturdukları lenfosit k�lt�r� ile, T lenfositlerinin uyarılma aşamasının in vivo koşullara daha yakın olarak ger�ekleştirilmesini ama�lamışlardır. Bu �eşitliliklerden dolayı, h�cresel imm�nite araştırmaları karşılaştırılırken, lenfositlerin uyarılması aşamasında ne kullanıldığı g�z �n�nde tutulmalıdır. Bizim �alışmamızda, lenfosit aktivasyonu i�in CMV peptid kokteyli; aktive olan T lenfositlerinden sentez edilen sitokinleri h�cre i�i saptayabilmek i�in de, sekresyon yolağını inhibe etmek amacıyla brefeldin A21 i�eren Golgi plug kullanılmıştır. T lenfosit aktivasyonu �alışmalarında kullanılan mitojen �eşidi konusunda da standardizasyon yoktur. Quantiferon y�ntemi ile �alışılan seride �rneklerin %29.6'sında mitojene yanıt alınamamıştır22. Bunun nedeni, y�ntemde kullanılan peptid kombinasyonu ile yaygın olmayan HLA tipinde olan hastalardan yanıt alınamaması ve ICS y�nteminin duyarlılığı olabilir6,10,17. Bizim serimizde, pokeweed mitojenine yanıt alamadığımız �rnek olmaması, y�ntemin duyarlılığı ile a�ıklanabilir.
Araştırma grubumuzun CMV seropozitif (R+/D+) olması nedeniyle, olgularımızın bellek B h�creleri mevcuttur. Buna karşın, imm�n s�presif tedavide baskılanan yanıt, h�cresel yanıt olduğundan, nakil hastaları seropozitif olsa dahi, CMV reaktivasyonu/hastalığının �nlenmesinde CMV'ye �zg�l T h�crelerinin yeniden yapılanması kritik bir �neme sahiptir. Nakil �ncesi CMV'ye �zg�l T h�crelerinin varlığı, nakil sonrası h�cresel imm�nitenin erken d�nemde yapılanmasının belirleyicisidir10,23,24. Bu nedenlerle, hastaların nakil �ncesi risk durumlarını belirlemede sadece CMV IgG bakılmasının yeterli olmadığı, h�cresel imm�nite testleri ile alınan pozitif sonu�la birlikte ger�ek pozitiflikten s�z edilebileceği belirtilmiştir25. Nakil �ncesi CMV'ye �zg�l IFN-γ yanıtı saptanmayan SOT hastalarında, IFN-γ d�zeyi > 0.2 IU/ml olan hastalara g�re nakil sonrası s�re�te CMV replikasyon riski 10 kat daha fazla bulunmuştur23. Hastalarımızın nakil �ncesi CMV'ye �zg�l h�cresel imm�nitelerini değerlendirdiğimizde, CMV'ye �zg�l IFN-γ sentez eden sitotoksik T lenfosit d�zeyleri kontrol grubumuzdan farklı bulunmamış ve t�m hastalarda yanıtın mevcut olduğu saptanmıştır. CMV'ye �zg�l CD4+ T lenfosit değerleri ise kontrol grubu ile karşılaştırıldığında %95 anlamlılık d�zeyinde p= 0.057 şeklinde sınır değerdedir ve bir hastamızda nakil �ncesi CMV'ye �zg�l CD4+ T lenfosit yanıtı mevcut değildir (Tablo I ve II). Hastamızın nakil �ncesi CD8+ T lenfosit d�zeyi %0.4 olup, nakil sonrası CD4+ ve CD8+ T lenfosit d�zeyleri 1, 3 ve 6. aylar i�in sırasıyla; %1.4 ve % 0.3, %1.5 ve %0.3, %0.5 ve %0.1 olarak belirlenmiştir. İzlem s�recinde bu hastada CMV reaktivasyonu saptanmamıştır. CMV'ye �zg�l sitotoksik T h�creleri, CMV replikasyonu olan konak h�creleri hedef alarak enfeksiyon kontrol�n�n ilk aşamasında g�rev yaparlar. Dolayısıyla, primer enfeksiyondan korunmada ve nakil sonrası erken d�nemde sitotoksik T lenfositlerin etkin rol� �nemlidir. CD4+ T h�creleri ise, nakil sonrası daha uzun s�re�te antiviral kontrol�n sağlanmasında rol oynarlar6,10. Sester ve arkadaşları9, 76 b�brek nakil hastasının CMV'ye �zg�l CD4+ T h�crelerinin yoğun imm�n s�presyon d�neminde progresif olarak azaldığını ve ilk bir ayda CD4+ T d�zeyleri ile enfeksiy�z komplikasyon gelişmesi arasında ters y�nde korelasyon olduğunu belirtmişlerdir. Lenfosit aktivasyonunda endotelyotropik CMV suşu ile enfekte dendritik h�cre k�lt�r�n�n kullanıldığı bir �alışmada, CD4+ T ve CD8+ T lenfositleri i�in 0.4 T h�cre/�l d�zeyinin, CMV enfeksiyonunu �ng�ren bir eşik değer olduğu belirtilmiştir26. Bu �alışmada, nakil sonrası h�cresel imm�nitenin ilk bir ayda yapılandığı hastalarda viremi kendiliğinden kaybolurken, imm�nitenin ge� yapılandığı grupta ise CMV hastalığı gelişmiştir26.�
Seropozitif SOT hastalarında latent viral reaktivasyon a�ısından en �nemli risk fakt�r�, imm�n s�presyonun yoğunluğudur12. "İmm�n s�presyon protokollerinin farklılıkları h�cresel imm�nite �zerine etkili midir?" sorusuna yanıt aradığımızda, farklı protokollerin CMV imm�nitesi �zerindeki etkisi 1, 3 ve 6. aylarda ayrı ayrı değerlendirilmiş ve farklılık saptanmamıştır. İnd�ksiyon tedavisi alan (n= 4) ve almayan (n= 17) hastalarımızın CMV h�cresel imm�nite değerlerinde de bir fark tespit edilmemiştir. İmm�n s�presyonun yoğun olduğu ilk �� ay sonunda ise, hastalarımızın CMV'ye �zg�l h�cresel imm�n yanıtları CD4+ T lenfosit d�zeyinde azalma ile sonu�lanmıştır. CD8+ T lenfositlerde ise birinci aya g�re bir farklılık g�zlenmemiştir. Bu değerlendirme toplam T lenfositleri i�in yapıldığında da, nakil sonrası ���nc� ayda CMV'ye �zg�l T h�cre yanıtının baskılandığı belirlenmiştir (Şekil 1, 2).
SOT hastalarında CMV hastalığı insidansının son yıllarda azalmasının en �nemli nedenlerinden birisi, CMV reaktivasyonunun başarılı antiviral profilaksi uygulamaları ile kontrol altına alınmasıdır27. Antiviral profilaksinin h�cresel imm�nite �zerine olumsuz etkisi belirlenmemiştir28. Araştırmamızda, valasiklovir ya da valgansiklovir profilaksisi alan hasta grupları karşılaştırıldığında, CMV'ye �zg�l h�cresel imm�nite �zerine farklı etkilerinin olmadığını saptanmıştır. Yoğun imm�n s�presyonun azalmasıyla eş zamanlı profilaksi de tamamlanmaktadır. Bu d�nemde h�cresel imm�n yapılanmanın derecesi, ge� CMV hastalığı i�in belirleyici bir değerdir. Kumar ve arkadaşları22, Quantiferon y�ntemiyle izledikleri 108 SOT hastasının %64.8'inde, profilaksi bitiminde CMV'ye �zg�l imm�n yapılanmanın sağlanamadığını bildirmişler; bu grupta CMV hastalığı gelişme oranının (%22.9),� CMV'ye �zg�l h�cresel imm�nite saptanan hastalara (%5.3) g�re daha y�ksek olduğunu rapor etmişlerdir.
Transplantasyon sonrası altıncı ayda d�ş�k viremi saptanan hastamızın, ���nc� ayda CMV'ye �zg�l T h�cre yanıtının olmadığı, buna karşın altıncı ayda s�z konusu değerlerin �nceki aylardan da daha y�ksek olduğu dikkati �ekmiştir (Şekil 3). Bu hastada, h�cresel imm�n yanıtın d�ş�k olduğu d�nemde reaktivasyonun olduğu ve bellek h�crelerinin yanıtı sonucunda CMV replikasyonunun sınırlı kaldığı d�ş�n�lm�şt�r. Chierrgin ve arkadaşları29, asemptomatik CMV viremisi olan hastaların CD4+ T lenfosit yanıtının, semptomatik hastalara g�re daha iyi olduğunu vurgulamışlardır. Radha ve arkadaşları13 da, seropozitif b�brek transplantasyon hastalarında CMV enfeksiyonu geliştiğinde, CD8+ T lenfosit yanıtının sağlıklı kontrollerden daha iyi olduğunu saptamışlar ve seropozitif hastaların viral replikasyonu �nlemeye �alıştıkları yorumunu yapmışlardır.�
Bizim d�ş�k viremi saptanan olgumuzun ���nc� ayda h�cresel yanıtının olmaması, reaktivasyon riskinin belirteci olabilir. Diğer taraftan, nakil sonrası altıncı ayda T h�cre yanıtının iyi olması da hastalığın gelişimini �nleyen bir fakt�rd�r. Bunde ve arkadaşları18, SOT hastalarında CMV IE-1'e �zg�l CD8+ T h�cre sayısının, nakil sonrası herhangi bir zamanda %0.4 �zerinde olmasının, CMV enfeksiyonundan korunmada eşik değer olduğunu bildirmişlerdir. Viral bağışıklığın tekrar yapılanmasında, enfeksiyon/hastalığı �n g�recek �eşik değerler' k�k h�cre ve SOT alıcılarında farklılık g�stermektedir30. Sonu� olarak, b�brek nakli yapılan hastaların CMV enfeksiyonu a�ısından izleminde, sadece virus y�k� değil, konağın h�cresel imm�n yanıtı da değerlendirilmelidir. Bu alandaki verilerin artması sonucunda, profilaksi ve antiviral tedavi yaklaşımlarında, viral y�k�n yanı sıra CMV'ye �zg�l T h�cre yanıtının da dikkate alındığı protokoller belirlenecektir.
KAYNAKLAR
- Razonable RR, Humar A; AST Infectious Diseases Community of Practice. Cytomegalovirus in solid organ transplantation. Am J Transplant 2013; 13(Suppl 4): 93-106.
- Cervera C, Lozano F, Saval N, et al. The influence of innate immunity gene receptors polymorphisms in renal transplant infections. Transplantation 2007; 83(11): 1493-500.
- Manuel O, Pascual M, Trendelenburg M, et al. Association between mannose-binding lectin deficiency and cytomegalovirus infection after kidney transplantation. Transplantation 2007; 83(3): 359-62.
- Venema H,� van den Berg AP, van Zanten C, van Son WJ, van der Giessen M,� The TH. Natural killer cell responses in renal transplant patients with cytomegalovirus infection. J Med Virol 1994; 42(2): 188-92.
- Lilleri D, Kabanova A, Lanzavecchia A, et al. Antibodies against neutralization epitopes of human cytomegalovirus gH/gL/pUL128-130-131 complex and virus spreading may correlate with virus control in vivo. J Clin Immunol 2012; 32(6): 1324-31.
- Fernandez-Ruiz M, Kumar D, Humar A. Clinical immune-monitoring strategies for predicting infection risk in solid organ transplantation. Clin Transl Immunology 2014; 3(2): e12.
- Quinnan GV Jr, Kirmani N, Rook AH, Manischewitz JF, Jackson L, Moreschi G. Cytotoxic T cells in cytomegalovirus infection: HLA-restricted T-lymphocyte and non-T-lymphocyte cytotoxic responses correlate with recovery from cytomegalovirus infection in bone-marrow-transplant recipients. N Engl J Med 1982; 307(1): 7-13.
- Walter EA, Greenberg PD, Gilbert MJ, et al. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N Engl J Med 1995; 333(16): 1038-44.
- Sester M, Sester U, G�rtner B, et al. Levels of virus-specific CD4 T cells correlate with cytomegalovirus control and predict virus-induced disease after renal transplantation. Transplantation 2001; 71(9): 1287-94.
- Egli A, Humar A, Kumar D.� State-of-the-art monitoring of cytomegalovirus-specific cell-mediated immunity after organ transplant: a primer for the clinician. Clin Infect Dis 2012; 5(12): 1678-89.
- Maecker HT, Rinfret A, D'Souza P, et al. Standardization of cytokine flow cytometry assays. BMC Immunol 2005; 6: 13. Access
- Sester U, Gartner BC, Wilkens H, et al. Differences in CMV-specific T-cell levels and long-term susceptibility to CMV infection after kidney, heart and lung transplantation. Am J Transplant 2005; 5(6): 1483-9.
- Radha R, Jordan S, Puliyanda D, et al. Cellular immune responses to cytomegalovirus in renal transplant recipients. Am J Transplant 2005; 5(1): 110-7.
- Egli A, Binet I, Binggelli S, et al. Cytomegalovirus-specific T-cell responses and viral replication in kidney transplant recipients. J Transl Med 2008; 6: 29.
- Maecker HT, Hassler J, Payne JK, et al. Precision and linearity targets for validation of an IFNgamma ELISPOT, cytokine flow cytometry and tetramer assay using CMV peptides. BMC Immunol 2008; 9: 9.
- Doğan HK, Mutlu E, K�ksoy S, G�ltekin M. Sitokin akış sitometri y�ntemi ile CMV spesifik imm�n yanıt �l��m�n�n optimizasyon ve validasyon �alışmaları. 3. Ulusal KLİMUD Kongresi, 10-13 Kasım 2013, Antalya. Kongre Kitabı, s: 390, PS451.
- Motta VN, Martins SL. Impairment of cytomegalovirus-specific cellular immune response as a risk factor for cytomegalovirus disease in transplant recipients. Braz J Med Biol Res 2008; 41(1): 5-11.
- Bunde T, Kirchner A, Hoffmeister B, et al. Protection from cytomegalovirus after transplantation is correlated with immediate early 1-specific CD8 T cells. J Exp Med 2005; 201(7): 1031-6.
- Maecker HT, Dunn HS, Suni MA, et al. Use of overlapping peptide mixtures as antigens for cytokine flow cytometry. J Immunol Methods 2001; 255(1-2): 27-40.
- Lozza L, Lilleri D, Percivalle E, et al. Simultaneous quantification of human cytomegalovirus (HCMV)- specific CD4+ ve CD8+ T cells by a novel method using monocyte-derived HCMV-infected immature dendritic cells. Eur J Immunol 2005; 35(6): 1795-804.
- Nylander S, Kalies I. Brefeldin A, but not monensin, completely blocks CD69 expression on mouse lymphocytes: efficacy of inhibitors of protein secretion in protocols for intracellular cytokine staining by flow cytometry. J Immunol Methods 1999; 224(1-2): 69-76.
- Kumar D, Chernenko S, Moussa G, et al. Cell-mediated immunity to predict cytomegalovirus disease in high-risk solid organ transplant recipients. Am J Transplant 2009; 9(5): 1214-22.
- Cantisan S, Lara R, Montejo M, et al. Pretransplant interferon-γ secretion by CMV-specific CD8+ T cells informs the risk of CMV replication after transplantation. Am J Transplant 2013; 13(3): 738-45.
- Abate D, Saldan A, Fiscon M, et al. Evaluation of cytomegalovirus (CMV)-specific T cell immune reconstitution revealed that baseline antiviral immunity, prophylaxis, or preemptive therapy but not antithymocyte globulin treatment contribute to CMV-specific T cell reconstitution in kidney transplant recipients. J Infect Dis 2010; 202(4): 585-94.
- Kotton CN, Kumar D, Calliendo AM, et al. Updated international guidelines on the management� of cytomegalovirus in solid-organ transplantation. Transplantation 2013; 96(4): 333-60.
- Gerna G, Lilleri D, Fornara C, et al. Monitoring of human cytomegalovirus-specific CD4 and CD8 T-cell immunity in patients receiving solid organ transplantation. Am J Transplant 2006; 6(10): 2356-64.
- Eid AJ, Brown RA, Arthurs SK, et al. A prospective longitudinal analysis of cytomegalovirus (CMV)-specific CD4+ and CD8+ T cells in kidney allograft recipients at risk of CMV infection. Transpl Int 2010; 23(5): 506-13.
- Snyder LD, Medinas R, Chan C, Sparks S, Davis WA, Palmer SM. Polyfunctional cytomegalovirus-specific immunity in lung transplant recipients receiving valganciclovir prophylaxis. Am J Transplant 2011; 11(3): 553-60.
- Chiereghin A, Gabrielli L, Zanfi C, et al. Monitoring cytomegalovirus T-cell immunity in small bowel/multivisceral transplant recipients. Transplant Proc 2010; 42(1): 69-73.
- Gerna G, Lilleri D, Furione M, Baldanti F. Management of human cytomegalovirus infection in transplantation: validation of virologic cut-offs for preemptive therapy and immunological cut-offs for protection. New Microbiol 2011; 34(3): 229-54.
İletişim (Correspondence):
Prof. Dr. Meral G�ltekin,
Akdeniz �niversitesi Tıp Fak�ltesi,
Tıbbi
Mikrobiyoloji Anabilim Dalı,
Temel İmm�noloji Bilim Dalı,
Antalya, T�rkiye.
Tel (Phone): +90 242 249 6909,
E-posta (E-mail): mgultekin@akdeniz.edu.tr