Viral S�perantijenler*
Viral Superantigens
A. D�rdal US
Hacettepe �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı (E), Ankara.
Hacettepe University Faculty of Medicine, Department of Medical Microbiology (Ret), Ankara, Turkey.
* 1. Ulusal Viroloji G�nleri ve Kursu (25-28 Şubat 2016, Ankara) kongresinde konferans olarak sunulmuştur.
�Z
S�perantijenler, �eşitli mikroorganizmalar tarafından �retilen ve T h�crelerini olağandışı yolla, poliklonal olarak, g��l� ve hızlı bir şekilde aktive eden mikrobiyal proteinlerdir. Bir s�perantijen (SAg)'in T h�crelerini uyarması, T h�cre resept�r� (TCR)'n�n belirli bir değişken-beta (Vβ) b�lgesi ile antijen sunan h�crelerin y�zeyindeki MHC sınıf II molek�l�ne, işlenmeye gerek duymaksızın, dışarıdan k�pr� oluşturarak, �zg�l olmayan şekilde bağlanmasıyla olur. SAg'ler; 1) ekzojen (mikroorganizmalar tarafından salgılanan ��z�n�r protein ve ekzotoksinler), 2) endojen (h�cre genomuna entegre olmuş viruslar tarafından kodlanan transmembran proteinler) ve 3) B h�cre SAg'leri (predominant olarak B h�crelerini uyaran proteinler) olmak �zere �� grupta sınıflandırılır. En iyi tanımlanan ve �zerinde en �ok �alışılan SAg'ler, stafilokokal ve streptokokal ekzotoksinlerdir; ancak diğer bir�ok mikroorganizmanın da SAg aktivitesine sahip olduğu bilinmektedir. İnsanda ciddi enfeksiyonlara yol a�an �eşitli virusların varlığına rağmen, patogenezinde, SAg �zelliği g�steren proteinlerin tanımlandığı virus sayısı ise g�rece olarak azdır. Bug�ne dek SAg kodladığı belirlenen viruslar; fare meme t�m�r� virusu (MMTV) (Marrack ve ark., 1991), kuduz virusu (Lafon ve ark., 1992), Epstein-Barr virusu (EBV) (Sutkowski ve ark., 1996), insan endojen retrovirusu (human endogenous retrovirus; HERV) (Conrad ve ark., 1997), insan imm�n yetmezlik virusu (HIV) (Posnett ve ark., 1995; Torres ve ark., 1996; Townsley-Fuchs ve ark., 1997) ve Ebola virus (Leroy ve ark., 2011) olarak sıralanabilir. SAg aktivitesine sahip olduğu ilk tanımlanan virus MMTV'dir. B tipi polimorfik bir retrovirus olan MMTV'nin, ekzojen (s�t ile bulaşan replikatif form) ve endojen (kalıtsal ge�iş g�steren proviral form) olmak �zere iki formu vardır ve her ikisi de SAg kodlamaktadır. Ekzojen MMTV'nin SAg'si, T h�crelerinin masif aktivasyonuna yol a�arak, virusun bağırsaklardan meme dokusuna ge�işini, dolayısıyla da yayılımını sağlar. Diğer taraftan endojen� SAg'lerin ekspresyonu, f�tal d�nemde timusta �z-toleransı ind�kleyerek, reaktif T h�crelerinin (Vβ6-9 TCR taşıyan) delesyonuna yol a�ar ve b�ylece konağı, ilerideki ekzojen MMTV enfeksiyonundan korur. Kuduz virusunun kodladığı SAg, n�kleokapsid yapısında bulunan N proteinidir ve TCR Vβ8 taşıyan T h�crelerini uyarmaktadır. Sonu�ta oluşan poliklonal T h�cre aktivasyonu, �zg�l imm�n yanıtın kapatılmasına, virusun ilk enfeksiyon b�lgesinden (kas dokusu) sinir u�larına ge�işinin kolaylaşmasına ve imm�nopatogenezin artışına yol a�ar. TCR Vβ13 taşıyan T h�crelerini aktive eden EBV ile ilişkili SAg'nin ise, virusun kendisi tarafından değil, EBV latent membran proteinleri tarafından transaktive edilen, HERV-K18'in env geni tarafından kodlandığı g�sterilmiştir (Sutkowski ve ark., 2001). EBV'nin ind�klediği SAg �retiminin, virusun bellek B h�crelerinde latent olarak kalmasında ve ayrıca otoimm�n hastalıklar ve onkogenez mekanizmalarında rol oynadığı ifade edilmektedir. HIV'in SAg'leri olarak tanımlanan proteinler ise Nef ve gp120'dir. Enfeksiyonun erken d�neminde, dinlenme halindeki CD4+T h�crelerindeki (se�ici olarak Vβ12+, Vβ5.3+, Vβ18+ TCR taşıyanlar) masif aktivasyonunun; ileri d�nemlerde de, klonal delesyon, anerji ve enfekte olmayan T h�crelerindeki apoptozun, diğer mekanizmaların yanı sıra, Nef'in SAg �zelliğinden kaynaklanabileceği d�ş�n�lmektedir. Buna karşın Nef'in SAg gibi davranmadığını ileri s�ren �alışmalar da vardır (Lapatschek ve ark., 2001). HIV'in gp120 proteini ise bir B h�cre SAg olup, VH3 eksprese eden B h�cre resept�rlerine bağlanarak poliklonal B h�cre aktivasyonuna yol a�ar. Ayrıca gp120, y�zeyinde IgE taşıyan bazofil ve mast h�crelerini de aktive ederek y�ksek d�zeyde proinflamatuar mediyat�r salınımına, dolayısıyla da alerjik reaksiyonlar ve doku hasarının artmasına neden olur. Son yıllarda yapılan bir �alışmada da, Zaire Ebola virusu ile enfekte kişilerde, klinik sonu� ne olursa olsun (�l�m ya da iyileşme), Vβ12, Vβ13 ve Vβ17 TCR taşıyan T h�cre pop�lasyonlarının yok olduğu (anerji veya delesyon) g�sterilmiş, bu bulguların da bir SAg varlığını işaret ettiği belirtilmiştir. Bu derleme yazıda, SAg'lerin genel �zelliklerinden kısaca bahsedilerek, viruslar tarafından kodlanan SAg'ler ve hastalıklardaki rolleri tartışılmaktadır.
Anahtar s�zc�kler: Virus; s�perantijen; T h�cre aktivasyonu; TCR V-beta; endojen retroviruslar.
ABSTRACT
Superantigens (SAgs) are microbial proteins produced by various microorganisms that elicit excessive and strong stimulation of T cells via an unconventional mechanism. They cause polyclonal activation of T cells in a non-specific manner, by binding to a particular variable-beta (Vβ) chain of T-cell receptor (TCR) and MHC class II molecule, in unprocessed form and outside of peptide-binding cleft, forming a bridge between the antigen presenting cell and the T cell. SAgs are classified into three groups, namely 1) exogenous (soluble proteins and exotoxins secreted by microorganisms), 2) endogenous (transmembrane proteins encoded by viruses which are integrated into the genome) and 3) B-cell SAgs (proteins which stimulate predominantly B cells). The best characterized and mostly studied SAgs are staphylococcal and streptococcal exotoxins, however it is well-known that many other microorganisms also possess SAg activities. Despite the presence of several viruses that cause severe infections in humans, the number of viruses that have proteins identified with SAg property in their pathogenesis, is relatively low. To date, the defined viruses that encoded SAgs are as follows; mouse mammary tumor virus (MMTV) (Marrack, et al. 1991), rabies virus (Lafon, et al. 1992), Epstein-Barr virus (EBV) (Sutkowski, et al. 1996), human endogenous retrovirus (HERV) (Conrad, et al. 1997), human immunodeficiency virus (HIV) (Posnett, et al. 1995; Torres, et al. 1996; Townsley-Fuchs, et al. 1997) and Ebola virus (Leroy, et al. 2011). SAgs were first described in the MMTV, a polymorphic B-type retrovirus that is either contained in the genome as an endogenous provirus (germline transmission) or exogenous infectious virus that transmits vertically via breast milk. Both MMTV forms encode SAgs. The SAg-mediated massive T cell activation is required for the spread of exogenous MMTV from intestines to mammary glands, facilitating the transmission of infectious virus. On the other hand, expression of endogenous SAgs leads to thymic deletion of responding T cells (bearing Vβ6-9+ TCR) due to self-tolerance induction during the fetal life, and protects the host against future exogenous MMTV infections. The SAg of rabies virus is the N protein found in nucleocapsid structure and stimulates Vβ8+TCR-bearing T cells. The SAg-induced polyclonal activation of T cells leads to turn-off the specific immune response, to enhance the immunopathogenesis and facilitates viral transmission from the initial site of infection (the muscle tissue) to the nerve endings. In case of EBV-associated SAg that activates Vβ13+TCR-bearing T cells, it was detected that the SAg activity was not encoded by EBV itself, but instead was due to the transactivation of HERV-K18 by EBV latent membrane proteins, whose env gene encodes the SAg (Sutkowski, et al. 2001). It has been denoted that EBV-induced SAg expression plays a role in the long-term persistence and latency of virus in memory B cells, in the development of autoimmune diseases and in the oncogenesis mechanisms. The proteins which are identified as SAgs of HIV are Nef and gp120. It is believed that, the massive activation of CD4+ T cells (selectively with Vβ-12+, Vβ-5.3+ and Vβ-18+ TCRs) in early stages of infection and clonal deletion, anergy and apoptosis of bystander T cells in the late stages may be due to SAg property of Nef protein, as well as the other mechanisms. However there are some studies indicating that Nef does not act as a SAg (Lapatschek, et al. 2001). HIV gp120 glycoprotein is a B-cell SAg that binds to VH3-expressing B cell receptors and causes polyclonal B cell activation. In addition, binding of gp120 to IgE on the surface of basophiles and mast cells causes activation of those cells, secretion of high level proinflammatory mediators leading to allergic reactions and tissue damage. In a recent study, the depletion (anergy or deletion) of T cell populations bearing Vβ12+, Vβ13+ and Vβ17+ TCR have been shown, in patients infected with Zaire Ebola virus, whatever the clinical outcome (death or recovery), these results also suggest the presence of SAg activity. In this review article, following a brief description of the general characteristics of SAgs, virus-encoded SAgs and their roles in the diseases have been discussed.
Keywords: Virus; superantigen; T cell activation; TCR V-beta; endogenous retroviruses.
Geliş Tarihi (Received): 24.02.2016 • Kabul Ediliş Tarihi (Accepted): 08.03.2016
GİRİŞ
S�perantijenler, �eşitli mikroorganizmalar tarafından �retilen ve T h�crelerini olağandışı yolla poliklonal olarak aktive eden mikrobiyal proteinlerdir. S�perantijen (SAg) terimi, ilk kez 1989 yılında, T h�crelerini �ok g��l� şekilde uyaran bakteriyel toksinler i�in kullanılmıştır1. SAg �retimi, bir mikroorganizmanın vir�lansını artıran �nemli bir fakt�r olarak kabul edilmektedir2. Bu derleme yazıda, SAg'lerin genel �zelliklerinden kısaca bahsedilerek, viruslar tarafından kodlanan SAg'ler ve hastalıklardaki rolleri tartışılmıştır.
S�PERANTİJENLERİN GENEL �ZELLİKLERİ
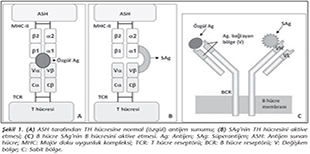
Bir antijenin, SAg �zelliği g�stermesi; T h�cre resept�r� (T-cell receptor; TCR) beta zincirinin değişken kısımları (Vβ) ile antijen sunan h�cre (ASH)'lerin y�zeyindeki maj�r doku uygunluk kompleksi sınıf II (MHC-II) molek�l�ne dışarıdan, k�pr� oluşturarak bağlanması ve naif T h�crelerini g��l� ve hızlı şekilde aktive etmesine bağlıdır. S�perantijenlerin biyoaktivitesi, hem MHC-II molek�l�ne hem de TCR'nin belirli bir ya da birka� Vβ alt tipine bağlanma yeteneği ile belirlenir. Dolayısıyla, her bir SAg'nin karakteristik bir "Vβ imzası" vardır; yani bir SAg, belirli bir veya birka� TCR Vβ tipine sahip T h�crelerini aktive etmektedir.
Klasik T h�cre uyarımı ve aktivasyonu, bilindiği gibi, ASH'ler tarafından alınan ve işlenen (oligopeptidlerine par�alanan) antijenlerin, MHC-II molek�l�n�n kovuğuna yerleştirilerek CD4+ yardımcı T (TH) h�crelerine sunulması ve TCR'nin alfa ve beta zincirlerinin değişken (Vα ve Vβ) b�lgeleri tarafından �zg�l olarak tanınması sonucu ger�ekleşir (Şekil 1A). Buna karşın SAg'lerin TH h�crelerini uyarması ve aktive etmesi �ok farklı bir şekilde olmaktadır2. SAg'ler, ASH'ler tarafından işlenmeye ve sunulmaya gerek duymaksızın, MHC-II molek�l�n�n genellikle α1 kangalı ile (α1 + β1'e �apraz yolla da olabilir) TCR'nin Vβ kısmına dışarıdan, yani �zg�l olmadan bağlanırlar (Şekil 1B). Dolayısıyla normal bir antijen T h�cre pop�lasyonunun az bir kısmını (%0.01-0.001) aktive ederken, SAg'ler �ok sayıda T h�cre pop�lasyonunu (%20-30) �zg�l olmayan yolla aktive eder ve y�ksek d�zeylerde sitokin salgılanmasına yol a�arlar2,3,4.
Yapısal olarak SAg'ler, 22-29 kD b�y�kl�ğ�nde glob�ler proteinler olup iki kangaldan oluşurlar. Amino ucunun olduğu kangal, MHC-II molek�l�ne; karboksi ucunun olduğu kangal ise TCR'nin Vβ b�lgesine bağlanmadan sorumludur. SAg'lerin �oğu 1-2 adet �inko (Zn) bağlayan b�lge i�erir; bu b�lgeler, SAg'lerin MHC-II molek�lleri tarafından tanınmasında etkilidir. SAg'lerin en iyi etkileştiği MHC-II molek�lleri, HLA-DR ve HLA-DQ antijenleridir. SAg'ler, proteazlara ve ısı ile denat�rasyona diren�lidirler ve �ok d�ş�k konsantrasyonlarda (10 mol/L) etki g�sterirler2,3,4.
S�perantijenler; ekzojen, endojen ve B h�cre SAg'leri olarak �� grupta sınıflandırılabilir3,4. Ekzojen SAg'ler, mikroorganizmalar tarafından salgılanan ��z�n�r proteinler ve ekzotoksinlerdir (Tablo I). Endojen SAg'ler ise, h�cre genomuna entegre olmuş viruslar tarafından kodlanan ve h�cre membranında bulunan proteinlerdir (Tablo I). Bazı SAg'ler de predominant olarak B h�crelerini uyarırlar (Tablo I). B h�cre SAg'leri olarak adlandırılan bu grup, B h�cre resept�r�n�n (y�zeyel IgM; BCR) ağır veya hafif zincirlerinin değişken b�lgelerine (sırasıyla; VH ve VL) bağlanır; ancak bu bağlanma da dışarıdan doğru olur ve �zg�l değildir (Şekil 1C).� B�ylece B h�crelerinin %30-60'ının poliklonal aktivasyonu ger�ekleşir. Ayrıca, B h�cre SAg'lerinin serumdaki ��z�n�r antikorlara (IgM veya IgG) bağlanması sonunda da, b�y�k miktarlarda imm�n kompleks (İK) oluşumu ger�ekleşir; bu İK'ler komplemanı aktive ederek doku hasarına yol a�arlar4,5. B h�cre SAg'lerinin, mast h�cre ve bazofil y�zeyindeki IgE antikorlarına bağlanması da, proinflamatuar mediyat�rlerin y�ksek d�zeyde salınımına yol a�arak doku hasarı ve alerjik reaksiyonların artışına neden olmaktadır. Bu tip SAg'ler "s�perallerjen" olarak da anılmaktadır.
S�perantijen uyarımı sonucu ortaya �ıkan ilk etki; TH h�crelerinin y�ksek d�zeyde ve kuvvetle prolifere olması, T h�cre pop�lasyonlarının genişlemesi ve b�y�k miktarlarda proinflamatuvar sitokin [t�m�r nekrozis fakt�r (TNF)-α, interl�kin (IL)-1β, IL-2, IL-6, interferon (INF)-γ, makrofaj inflamatuar protein (MIP)-1α, MIP-1β, monosit kemoatraktan protein (MCP)-1] salgılamasıdır4. "Sitokin fırtınası" olarak bilinen bu olay, kapiller sızıntının artışı, inflamasyonun artışı, ateş, �oklu organ hasarı ve sistemik şok gelişimine neden olur. Takiben, masif aktivasyonun sonucu olarak T h�crelerinin �l�m� (apoptoz) ve delesyonu ger�ekleşir, imm�n s�presyon ortaya �ıkar2. Ayrıca, T h�cre anerjisi sonucu imm�n tolerans ve oto-reaktif T ve B h�crelerinin aktivasyonu sonucu da otoimm�nite gelişebilir. G�n�m�zde, stafilokokal ve streptokokal toksik şok sendromları, stafilokokal besin zehirlenmesi, stafilokokal haşlanmış deri sendromu, kızıl, Kawasaki hastalığı, ekzema, guttat ps�riazis, romatoid artrit, diabetes mellitus ve nazal polipler gibi �eşitli hastalıkların SAg �retimi ile ilişkisi bilinmekte; daha bir�ok enfeksiyon ve hastalıkta da y�ksek olası rolleri olduğu ifade edilmektedir2,3,4,6,7. En iyi bilinen ve �zerinde en �ok �alışılan SAg'ler, Staphylococcus aureus ve Streptococcus pyogenes tarafından �retilen ekzotoksinlerdir; ancak diğer bazı mikroorganizmaların da SAg aktivitesi mevcuttur (Tablo I)3,4.
VİRAL S�PERANTİJENLER
İnsanda ciddi enfeksiyonlara yol a�an �eşitli virusların varlığına rağmen, patogenezinde, SAg �zelliği g�steren proteinlerin tanımlandığı virus sayısı g�rece olarak azdır. Bug�ne dek SAg kodladığı belirlenen viruslar; MMTV (1991), kuduz virusu (1992), EBV (1996), insan endojen retrovirusu (1997), HIV (1997) ve Ebola virus (2011) olarak sıralanabilir8,9,10,11,12,13,14.
Fare Meme T�m�r� Virusu (MMTV) ile İlişkili S�perantijen
Marrack ve arkadaşları8 1991 yılında, fare genomunda endojen olarak bulunan MMTV'nin bir SAg kodladığını g�stermişlerdir. Daha sonra bu antijenlerin, 1973 yılında Festenstein15 tarafından, farelerin timus stromal h�crelerinde keşfedilen "min�r lenfosit stim�le edici (Mls) ekzotoksinler" ile aynı olduğu anlaşılmıştır16. MMTV tarafından kodlanan SAg, ilk keşfedilen viral SAg olması ve endojen retrovirus SAg'lerinin tanımlanmasında model teşkil etmesi a�ısından �nem taşımaktadır17. Bunun yanı sıra, MMTV'nin insan meme kanseriyle ilişkisi olduğuna dair verilerin elde edilmesi, virusun �nemini daha da artırmıştır18,19. Wang ve arkadaşları18 1995 yılında, meme kanseri olan kadınların %39'unun t�m�r dokusunda MMTV dizilerine %95 homoloji g�steren dizilerin varlığını saptamışlar; daha sonra yapılan� �alışmalarda da benzer sonu�lar ortaya konmuştur20,21,22. T�m bu veriler, MMTV'nin insan meme kanserlerindeki rol�n�n aydınlatılması i�in ileri �alışmaların yapılması gereğini vurgulamaktadır23,24.�
B tipi bir retrovirus olan MMTV, farelerin meme dokusunda bulunur, s�t ile bulaşır ve farelerde meme kanserine yol a�ar. MMTV, ekzojen ve endojen olmak �zere iki formda bulunmaktadır24. Ekzojen MMTV replikatif bir virustur ve vertikal ge�iş (s�t ile) g�sterir. Endojen MMTV ise bir provirustur ve kalıtsal yolla Mendel kurallarına g�re yavrulara aktarılır. MMTV'nin her iki formu da SAg �retmektedir17.
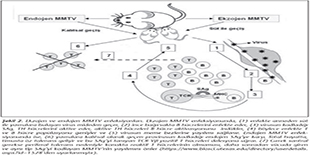
Ekzojen MMTV, s�t ile alındıktan sonra bağırsak B h�crelerini enfekte eder ve tipik bir retrovirus gibi replike olur. MMTV'nin kodladığı SAg, 3' LTR (long terminal repeat) b�lgesi i�inde yer almaktadır17. Bu gen �r�n� 45 kD b�y�kl�ğ�nde tip II transmembran proteinidir ve karboksi ucunda, TCR Vβ �zg�ll�ğ�nden sorumlu, 10-14 aminoasitlik polimorfik bir b�lge i�ermektedir. Transkripsiyon ve translasyon sonrasında sentezlenen SAg, B h�cre y�zeyindeki MHC-II'ye bağlanarak uygun TCR Vβ taşıyan TH h�crelerini uyarır (Şekil 2)17. TH h�crelerinin masif aktivasyonu, B h�cre proliferasyonunun artmasına, dolayısıyla da virusun etkin olarak bağırsak B h�crelerinde �oğalmasına yardımcı olmaktadır. T ve B h�creleri arasındaki bu kuvvetli etkileşim, se�ici olarak enfekte B h�crelerinin klonal artışına yol a�ar. Enfekte B h�crelerinin bir kısmı uzun �m�rl� bellek h�crelerine farklılaşır; b�ylece MMTV enfeksiyonu stabil hale gelir, meme dokusuna yerleşir ve virus, s�t ile salgılanmaya başlar17� (Şekil 2). MMTV'nin, bağırsaklardan meme dokusuna yayılımı sırasında, SAg ile uyarılmış T ve B h�crelerinin gerekli olduğu g�sterilmiştir25. Dolayısıyla MMTV SAg, virusun konakta yayılımı (meme dokusuna ulaşması) i�in gerekli lenfosit havuzunu artırmaktadır.
Endojen MMTV proviruslarının varlığı ise 1970'li yıllardan beri bilinmekte ve evrimsel s�re�te ekzojen virusların fare genomuna rastgele entegrasyonu sonucu ortaya �ıktığı d�ş�n�lmektedir15,17. Bu provirusların �oğu, replike olmak ve enfeksiy�z partik�l oluşturabilmek i�in gerekli temel genlerini kaybetmiş "fosil viruslar"dır; ancak ilgin� olarak t�m�nde SAg genleri (kısmi env ve 3'LTR) bozulmamıştır. Bu genlerin korunmuş olmasının nedeni, konağa se�ici avantaj sağlamalarıdır; zira provirus tarafından kodlanan endojen SAg'ler, konağın, enfeksiy�z (ekzojen) MMTV enfeksiyonundan korunmasında �nemli rol oynarlar26. Ş�yle ki; anneden yavruya ge�en endojen SAg genleri tarafından kodlanan antijenler, f�tal d�nemde timusta �z (self)-toleransı ind�klerler ve bu SAg'yi tanıyan (Vβ-14 TCR taşıyan) T h�crelerinin delesyonuna neden olurlar17,26. B�ylece, aynı tip SAg'yi kodlayan enfeksiy�z bir virusun konaktaki yayılımı (meme dokusuna ulaşımı), reaktif T h�crelerinin olmaması nedeniyle m�mk�n olmayacak ve konak, ekzojen MMTV enfeksiyonundan korunmuş olacaktır17 (Şekil 2). Dolayısıyla, diğer �oğu mikroorganizmanın konak imm�n sistemini bozmak amacıyla kullandığı SAg'lerin aksine, MMTV, yaşamı i�in SAg tarafından ind�klenmiş kuvvetli bir konak imm�n yanıtına gereksinim duymaktadır.
Kuduz Virusu ile İlişkili S�perantijen
Zarflı, negatif tek iplikli bir RNA virusu olan kuduz virusu, n�kleoprotein (N), fosfoprotein (NS), RNA polimeraz (L), matriks proteini (M) ve y�zey proteini (G) olmak �zere beş adet protein kodlamaktadır. N, NS ve L proteinleri virusun n�kleokapsidini oluşturur. N�kleokapsid yapısında bulunan N proteininin, ekzojen bir SAg olduğu g�sterilmiştir9. Fosforillenmiş bir protein olan N proteini, 450 aminoasitten oluşur ve h�crenin enfeksiyonu sırasında bol miktarda sentezlenir. N proteini, olgun virionda heliksel n�kleokapsidin maj�r bileşeni olup, replikasyon, transkripsiyon ve� morfogenez sırasında rol oynamaktadır. Kuduz virusunun SAg'si, MHC-II α1 zinciri ve TCR Vβ8'e bağlanarak T h�crelerini uyarmaktadır9,17. Bunun sonucunda oluşan poliklonal T h�cre aktivasyonu, �zg�l imm�n yanıtın kapatılmasına, virusun ilk enfeksiyon b�lgesinden (kas dokusu) sinir u�larına ge�işinin kolaylaşmasına ve imm�nopatogenezin artışına neden olmaktadır. Sinir sistemine ge�işin kolaylaştırılması ile ilgili mekanizma tam olarak aydınlatılamamış olmakla birlikte, SAg ile y�ksek d�zeyde uyarılan T h�crelerinin salgıladığı sitokinlerle ilişkili olduğu d�ş�n�lmektedir. Nitekim, TNF-α ve IL-1β gibi proinflamatuvar sitokinlerin, virusun resept�rlerinden olan n�ronal nikotinik asetilkolin resept�r� (nAchR) ekspresyonunu artırdığı g�sterilmiştir27. Farelerde yapılan �alışmalarda, SAg ile uyarılmış T h�creleri ortadan kaldırıldığında, virusun sinirlere ge�işinin azaldığı g�sterilmiş; ayrıca N proteini ile yapılan imm�nizasyonun y�ksek d�zeyde koruyucu olduğu saptanmıştır28.
Epstein-Barr virus (EBV) ile İlişkili S�perantijen
Herpesviridae ailesinin bir �yesi olan EBV, t�m d�nyada yaygın olarak bulunmaktadır. Yetişkinlerin %90'ından fazlası EBV ile latent olarak enfektedir. �ocukluk d�neminde kazanılan enfeksiyonlar b�y�k oranda asemptomatik seyretmekle birlikte, ad�lesan ve gen� erişkin d�nemde kazanılan enfeksiyonlar enfeksiy�z monon�kleoz (EM) tablosuyla seyretmektedir. EM, yoğun B ve T h�cre aktivasyonu ile karakterize, kendini sınırlayan lenfoproliferatif bir hastalıktır. Buna karşın, imm�n sistemi baskılanmış hastalarda EBV'nin reaktivasyonu �eşitli kanserler ile ilişkilidir. Bu bilgiler ışığında, EBV'nin bir SAg aktivitesine sahip olup olmadığını araştıran Sutkowski ve arkadaşları10, 1996 yılında yayınlanan �alışmalarında, EBV ile transforme B h�cre dizilerinin, Vβ13 TCR taşıyan T h�crelerini se�ici olarak uyardığını ve B h�crelerinde SAg ekspresyonunun, EBV'nin litik d�ng�ye ge�işinin ind�ksiyonu ile ilişkili olduğunu g�stermişlerdir. Ancak aynı araştırıcıların yaptığı ileri �alışmalarda, bu SAg aktivitesinin EBV'nin kendisi tarafından değil, transaktive ettiği, HERV-K18 olarak adlandırılan endojen bir retrovirus tarafından kodlandığı ortaya konmuştur29. Bu noktada, insan endojen retroviruslarından kısaca bahsetmek gereği doğmaktadır.
İnsan Endojen Retrovirusları (Human Endogenous Retrovirus; HERV)
İnsan Genom Projesi �alışmaları sırasında, insan genomuna entegre olarak bulunan provirusların varlığı tespit edilmiş ve bunların insan endojen retrovirus (HERV) dizileri olduğu tanımlanmıştır30. HERV dizileri, insan genomunun yaklaşık %8'ini oluşturmaktadır. HERV dizilerinin, evrimsel olarak, milyonlarca yıl �nce, atasal (germline) h�crelere entegre olan enfeksiy�z retroviruslardan k�ken aldığı ve Mendel kurallarına g�re aktarılarak insan pop�lasyonlarında kalıcı hale geldiği d�ş�n�lmektedir30,31.
�� b�y�k sınıfta (I, II ve III) gruplandırılan HERV'ler �ok sayıda aileye (K, L, W, H, T, vb) ayrılmışlardır. Bunlar i�inde en gen� ve en aktif olan grup HERV-K ailesidir32. Bu grupta yer alan HERV-K18'in SAg aktivitesine sahip olduğu, ilk kez 1997 yılında, ins�line bağımlı diyabeti olan hastalarda tanımlanmış ve bu virus, IDDMK1,222 (Insulin Dependent Diabetes Mellitus-associated K virus) olarak adlandırılmıştır11. Conrad ve arkadaşları11, diyabetli hastaların pankreas adacıklarında yoğun Vβ-7 TCR taşıyan T h�cre infiltrasyonu olduğunu ve SAg ile aktive olan bu h�crelerin pankreas h�crelerini hasara uğrattığını g�stermişlerdir. IDDMK1,222 virusunun, daha sonra, HERV-K18'in alelik bir varyantı olduğunu belirlenmiş ve �oğunlukla Vβ13, daha az olarak da Vβ7 TCR taşıyan T h�creleri �zerinde mitojenik aktivite g�sterdiği bildirilmiştir33.
HERV'ler, ekzojen retroviruslar gibi gag, pol ve env genlerini i�erirler, ancak bu genlerin bazıları delesyonlar ve insersiyonlar nedeniyle defektif hale gelmiş olabilir. Buna karşın LTR b�lgeleri bozulmamıştır31,33. HERV genleri, histon metilasyonu gibi konak fakt�rleri tarafından baskılanmış durumdadır. Ancak �eşitli fakt�rlere bağlı olarak bu baskının kalkması, genin aktif hale gelmesine ve fonksiyonel proteinleri kodlamasına yol a�maktadır. Bug�n i�in nedeni bilinmeyen bir�ok hastalıktan, HERV genlerinin aktivasyonu sorumlu tutulmaktadır34. Bunlar arasında; �zellikle HERW-W grubunun, başta multiple skleroz ve şizofreni olmak �zere �eşitli n�rolojik ve otoimm�n hastalıklarla; HERV-K grubunun ise �eşitli kanserlerle ilişkili olabileceği ifade edilmektedir32,35,36,37,38.
HERV-K18'in� EBV Tarafından Transaktivasyonu
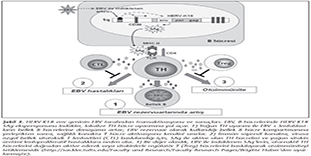
HERV-K18 dizisi, insanda 1. kromozomda, CD48 geninin ilk intronunda yer alır ve başlangı� kısmında EBV'nin ind�klediği bir artırıcı (enhancer) b�lgeye sahiptir33 (Şekil 3). Bu b�lge, EBV'nin latent membran proteinleri (�zellikle LMP-2A ve LMP-1) tarafından aktive edilmektedir33,39. B�ylece, normalde sessiz olarak bulunan HERV-K18 provirusunun env geni, EBV LMP'lerin neden olduğu� transkripsiyonel aktivasyon sonucunda SAg sentezlemeye başlar (Şekil 3). EBV'nin ind�klediği SAg �retiminin, virusun latent olarak kalmasında ve ayrıca otoimm�n hastalıklar ve onkogenez mekanizmalarında rol oynadığı d�ş�n�lmektedir33.
Bilindiği gibi EBV, imm�n sistemden ka�arak yaşamını s�rd�rmek ve konakta kalıcı olabilmek i�in bellek B h�crelerinde latent d�neme girmektedir. EBV ile aktive olan B h�crelerinin ise bellek B h�crelerine farklılaşması i�in, TH h�cre yardımı gereklidir. İşte bu noktada, EBV'nin transaktive ettiği SAg �retimi, TH h�crelerini y�ksek d�zeyde uyararak, EBV+ lenfoblastların bellek h�crelerine d�n�şmesini sağlar; b�ylece EBV'nin bellek B h�crelerindeki latentliği kolaylaşır ve artırılır (Şekil 3). EBV ile ilişkili kanserlerde ise, EBV+ t�m�r h�crelerinde LMP-1 ve LMP-2A ekspresyonunun arttığı bilinmektedir. Bu proteinlerin d�zeyindeki artış, HERV-K18 env geni yani SAg'nin sentezini de artıracaktır. �retilen SAg'ler tarafından ind�klenen T h�crelerinin, EBV ile ilişkili kanserlerde metastazın artışında rol oynadığı; salgılanan sitokin ve kemokinlerle mikro�evreyi değiştirerek t�m�r h�crelerinin sitotoksik T h�crelerinden ka�ışını kolaylaştırdığı ifade edilmektedir17,33(Şekil 3).
Herpesviridae ailesinin bir diğer �yesi olan sitomegalovirus (CMV) da, EBV'ye benzer �zellikler g�stermektedir. Toplumlarda �ok yaygın olarak bulunan CMV, EBV gibi, erken �ocukluk d�neminde kazanılır, sıklıkla asemptomatik seyreder ve primer enfeksiyonun ad�lesan d�nemde ge�irilmesi, masif T h�cre proliferasyonu ile karakterize EM benzeri semptomlara yol a�ar. EBV'nin bir ASH olan B h�crelerini enfekte etmesine karşın, CMV başka bir ASH grubunu, monositleri enfekte etmektedir. Dolayısıyla bu iki herpesvirus, konakta benzer imm�nolojik reaksiyonlar oluşturmaktadır. Bu noktadan hareketle, CMV'nin SAg aktivitesi ile ilgili �alışmalar yapılmış; konu ile ilgili veriler, AIDS'li hastalarda yapılan �alışmalardan elde edilmiştir. Dubrescu ve arkadaşları40,41, CMV seropozitif, HIV ile enfekte hastalarda, HIV-1 replikasyonunun Vβ12 TCR taşıyan T h�crelerinde daha fazla olduğunu, CMV seronegatif yenidoğanlarda ise olmadığını g�zlemlemişler ve bu durumu in vitro deneylerle de g�stermişlerdir. Araştırıcılar, HIV enfeksiyonu sırasında reaktive olan CMV'nin bir SAg kodlayarak Vβ12+ T h�crelerini uyardığını ve b�ylece aktive olan T h�crelerinin, enfekte kişilerde yıllar boyunca HIV-1 i�in rezervuar g�revi g�rd�ğ�n� ifade etmişlerdir41. Ancak bug�n i�in, CMV'de SAg kodlayan bir gen b�lgesi tanımlanmamıştır.
HIV ile İlişkili S�perantijenler
İnsan imm�n yetmezlik virusu (HIV), bilindiği gibi, konağın imm�n yanıtından başarıyla ka�manın yanı sıra, imm�n sisteme karşı koyan ve onu ��kerten sofistike mekanizmalara sahiptir. T�m bu mekanizmaların arasında, SAg �zelliği g�steren HIV proteinlerinin varlığı da beklenen bir durumdur. Nitekim, HIV'in aksesuvar proteini olan Nef ve zarf glikoproteini olan gp120'nin SAg �zelliğine sahip olduğu bildirilmiştir42.
HIV'in Nef proteini, viral replikasyonun artışı, enfektivitenin artışı, T h�cre aktivasyonu, CD4 ve MHC-I molek�llerinin inhibisyonu ve sitotoksik T h�crelerinin apoptozu gibi bir�ok etkiye sahip �nemli bir vir�lans fakt�r�d�r43. Nef'in sebep olduğu T h�cre aktivasyonunun, SAg �zelliğine bağlı olabileceği d�ş�n�lmektedir. Nef, enfeksiyonun erken d�neminde, M-tropik HIV ile enfekte makrofajlardan salınmakta ve se�ici olarak Vβ5, 8, 12-18 TCR� taşıyan CD4+ T h�crelerini aktive etmektedir12,44. B�ylece dinlenme halindeki CD4+ T h�crelerinin masif aktivasyonu ve proliferasyonu ger�ekleşmekte; yani virus, replike olabilmek i�in kendisine bol miktarda aktive T h�cre havuzu oluşmaktadır45. Enfeksiyonun ileri d�nemlerinde ise, T h�crelerinde klonal delesyon, anerji ve enfekte olmayan (bystander) T h�crelerinin apoptozu ortaya �ıkar. AIDS'de ortaya �ıkan klinik semptomların bireysel farklılıklar g�stermesinin, TCR Vβ gen polimorfizmlerine ve MHC-II alellerinin SAg'e karşı afinitesindeki farklılıklara bağlı olduğu d�ş�n�lmektedir42. Buna karşın Lapatschek ve arkadaşları46, Nef'in fonksiyonel olarak SAg gibi davranmadığını ileri s�rmektedir.�
HIV'in gp120 proteini ise bir B h�cre SAg olup, B h�cre resept�rlerine (BCR) ve serum imm�noglobulinlerine olağandışı şekilde bağlanmaktadır47. Fonksiyonel olarak gp120, �zellikle VH3 eksprese eden B h�crelerini uyarır. BCR'ye bağlanma poliklonal B h�cre aktivasyonuna neden olurken, serbest antikorlara bağlanma b�y�k miktarda imm�n kompleks oluşumuna ve kompleman aktivasyonuna yol a�arak doku hasarı oluşturur. Yapılan �alışmalar, bağlanmanın, gp120'nin V4 b�lgesi ile VH3 imm�noglobulin gen ailesinin �ok değişken kısmı (CDR-2) arasında olduğunu g�stermiştir48. HIV enfeksiyonu sırasında VH3 B h�crelerinde y�ksek d�zeyde bir aktivasyon s�z konusu iken, tipik bir SAg etkisi olarak, AIDS'e ilerleyen hastalarda bu h�creler delesyona uğramakta ve yok olmaktadır13,47.
HIV-1 enfeksiyonu sırasında, hastalarda serum IgE d�zeyleri y�kselmekte ve bu durum k�t� prognozu işaret etmektedir. Marone ve arkadaşları49, gp120'nin bir SAg gibi davranarak, y�zeyinde FcRI resept�r�ne bağlı IgE taşıyan bazofil ve mast h�crelerini aktive ettiğini ve histamin ve sitokin (IL-4 ve IL-13) salınımını artırdığını g�stermişlerdir. Bu sitokinler, ya doğrudan B h�crelerini aktive ederek ya da TH h�crelerini TH2 y�n�ne �evirmek suretiyle B h�crelerinin aktivasyonuna yol a�arak y�ksek d�zeyde IgE sentezine neden olmaktadır49. Sonu�ta, gerek proinflamatuar mediyat�rlerin gerekse IgE d�zeylerinin artışı, alerjik reaksiyonlara ve doku hasarına yol a�maktadır.
Ebola Virus S�perantijeni
Ebola virusu, �zellikle de Zaire suşu (ZEBOV), %90'a varan mortalite ile seyreden hemorajik ateşe neden olmaktadır. Bu enfeksiyonlar, hastalarda zayıf imm�n yanıt ve şiddetli inflamatuar reaksiyon� ile karakterizedir50. İmm�n yanıt yetersizliğine yol a�an fakt�rlerden birisi, masif CD4+ ve CD8+ T h�cre apoptozunun virus tarafından ind�klenmesidir; oysa ZEBOV lenfositleri enfekte etmemektedir. Sitokin fırtınası ile karakterize anormal imm�n yanıt ve fatal enfeksiyonlarda toksik şok sendromu benzeri tablonun ortaya �ıkması, diğer bir�ok mekanizmanın yanı sıra ZEBOV'un bir SAg aktivitesine sahip olabileceğini d�ş�nd�rmektedir. SAg varlığının araştırmasına y�nelik olarak, Leroy ve arkadaşlarının14 yaptığı �alışmada, ZEBOV'un neden olduğu 1996 Gabon salgınında, virustan etkilenen kişilerde (hastalıktan �lenler, hastalıktan iyileşenler ve asemptomatik temaslılar), TCR Vβ repertuvarı, ters transkripsiyon-polimeraz zincir reaksiyonu (RT-PCR) ile araştırılmıştır. �alışmanın sonucunda, t�m olgu gruplarında, kontrollerle karşılaştırıldığında, TCR Vβ12, Vβ13 ve Vβ17 taşıyan T h�cre pop�lasyonlarında ciddi azalmanın olduğu tespit edilmiştir. Bu araştırıcılar, klinik sonu� ne olursa olsun, ZEBOV ile enfekte kişilerde belirli TCR Vβ tiplerini taşıyan T lenfositlerinde anerji veya delesyonun olduğunu, bu bulguların da bir SAg varlığını işaret ettiğini belirtmişlerdir16. SAg aktivitesinin, virusun ��z�n�r zarf glikoproteinlerine bağlı olma olasılığına rağmen, bu konu hen�z a�ık değildir. Yapılan literat�r taramasında, ulaşılabildiği kadarıyla, Ebola virus SAg'i konusunda başka bir �alışmaya rastlanmamıştır.
SONU�
S�perantijenler, sentezlendikleri mikroorganizmanın patojenitesini artırmanın yanı sıra, konağa karşı patojenin imm�nolojik bir �st�nl�k kazanmasını sağlamaktadırlar. G�n�m�zde, SAg'lerin, �nceden beri iyi bilinen klasik hastalıkların (�rn. toksik şok sendromu, haşlanmış deri sendromu) dışında, alerjik, n�rolojik ve otoimm�n hastalıklar, inflamatuar deri hastalıkları, imm�n yetmezlikler ve hatta bazı kanserler de dahil olmak �zere bir�ok patolojiden sorumlu olduğu anlaşılmıştır. Viral SAg'ler ile ilgili �alışmalar ise, �zellikle insan genomunda bulunan endojen retrovirusların tanımlanması ve bunların env genleri ve LTR b�lgelerinin SAg sentezinden sorumlu olduğunun g�sterilmesiyle hız kazanmıştır. V�cudumuzda normalde sessiz olarak bulunan HERV dizilerinin, başka bir patojen (�rn. EBV) ya da diğer mekanizmalarla transaktive olma olasılığının, otoimm�nite ve onkogenez a�ısından potansiyel bir risk oluşturduğu d�ş�n�lmektedir. Dolayısıyla, ileriki yıllarda yapılacak olan �alışmalarda, gerek enfeksiy�z virusların gerekse endojen retrovirusların kodladığı SAg �zelliğine sahip proteinlerin tanımlanması, hastalıkların patofizyolojisinin aydınlatılmasında yol g�sterici olacaktır.
KAYNAKLAR
- Choi YW, Kotzin B, Herron L, Callahan J, Marrack P, Kappler J. Interaction of Staphylococcus aureus toxin "superantigens" with human T cells. Proc Natl Acad Sci U S A 1989; 86(22): 8941-5.
- Vaishnani J. Superantigen. Indian J Dermatol Venereol Leprol 2009; 75(5): 540-4.
- Hemalatha V, Srikanth P, Mallika M. Superantigens - concepts, clinical disease and therapy. Indian J Med Microbiol 2004; 22(4): 204-11.
- Solanki LS, Srivastava N, Singh S. Superantigens: a brief review with special emphasis on dermatologic diseases. Dermatol Online J 2008; 14(2): 3.
- Zouali M. B cell superantigens subvert innate functions of B cells. Chem Immunol Allergy 2007; 93:92-105.
- Torres BA, Kominsky S, Perrin GQ, Hobeika AC, Johnson HM. Superantigens: the good, the bad, and the ugly. Exp Biol Med (Maywood) 2001; 226(3): 164-76.
- Sur G, Sporis D, Kudor-Szabadi L, Samasca G. Super-antigens and human pathology: always an interesting topic. J Bioequiv Availab 2013; 5(3): 125-8.
- Marrack P, Kushnir E, Kappler J. A maternally inherited superantigen encoded by a mammary tumour virus. Nature 1991; 349(6309): 524-6.
- Lafon M, Lafage M, Martinez-Arends A, et al. Evidence for a viral superantigen in humans. Nature 1992; 358(6386): 507-10.
- Sutkowski N, Palkama T, Ciurli C, et al. An Epstein-Barr virus-associated superantigen. J Exp Med 1996; 184(3): 971-80.
- Conrad B, Weissmahr RN, B�ni J, et al. A human endogenous retroviral superantigen as candidate autoimmune gene in type I diabetes. Cell 1997; 90(2): 303-13.
- Posnett DN, Kabak S, Dobrescu D, Hodtsev AS. The HIV-1 reservoir in distinct V beta subsets of CD4 T cells: evidence for a putative superantigen. J Clin Immunol 1995; 15(6 Suppl): 18S-21S.
- Townsley-Fuchs J, Neshat MS, Margolin DH, Braun J, Goodglick L. HIV-1 gp120: a novel viral B cell superantigen. Int Rev Immunol 1997; 14(4): 325-38.
- Leroy EM, Becquart P, Wauquier N, Baize S. Evidence for Ebola virus superantigen activity. J Virol 2011; 85(8): 4041-2.
- Festenstein H. Immunogenetic and biological aspects of in vitro lymphocyte allotransformation (MLR) in the mouse. Transplant Rev 1973; 15: 62-88.
- Beutner U, Rudy C, Huber BT. Molecular characterization of Mls-1. Int Rev Immunol 1992; 8(4): 279-88.
- Huber BT, Hsu PN, Sutkowski N. Virus-encoded superantigens. Microbiol Rev 1996; 60(3): 473-82.
- Wang Y, Holland JF, Bleiweiss IJ, Melana S, et al. Detection of mammary tumor virus env gene-like sequences in human breast cancer. Cancer Res 1995; 55(22): 5173-9.
- Pogo BG, Holland JF. Possibilities of a viral etiology for human breast cancer. A review. Biol Trace Elem Res 1997; 56(1): 131-42.
- Etkind P, Du J, Khan A, Pillitteri J, Wiernik PH. Mouse mammary tumor virus-like ENV gene sequences in human breast tumors and in a lymphoma of a breast cancer patient. Clin Cancer Res 2000; 6(4): 1273-8.
- Wang Y, Pelisson I, Melana SM, Go V, Holland JF, Pogo BG. MMTV-like env gene sequences in human breast c ncer. Arch Virol 2001; 146(1): 171-80.
- Holland JF, Pogo BG. Mouse mammary tumor virus-like viral infection and human breast cancer. Clin Cancer Res 2004; 10(17): 5647-9.
- Salmons B, Gunzburg WH. Revisiting a role for a mammary tumor retrovirus in human breast cancer. Int J Cancer 2013; 133(7): 1530-5.
- Holt MP, Shevach EM, Punkosdy GA. Endogenous mouse mammary tumor viruses (mtv): new roles for an old virus in cancer, infection, and immunity. Front Oncol 2013; 3:287.
- Golovkina TV, Dudley JP, Ross SR. B and T cells are required for mouse mammary tumor virus spread within the mammary gland. J Immunol 1998; 161(5): 2375-82.
- Golovkina TV, Chervonsky A, Dudley JP, Ross SR. Transgenic mouse mammary tumor virus superantigen expression prevents viral infection. Cell 1992; 69(4): 637-45.
- Gahring LC, Days EL, Kaasch T, et al. Pro-inflammatory cytokines modify neuronal nicotinic acetylcholine receptor assembly. J Neuroimmunol 2005; 166(1-2): 88-101.
- Lafon M. Viral superantigens. Rev Med Interne 2000; 21(8): 713-6.
- Sutkowski N, Conrad B, Thorley-Lawson DA, Huber BT. Epstein-Barr virus transactivates the human endogenous retrovirus HERV-K18 that encodes a superantigen. Immunity 2001; 15(4): 579-89.
- Griffiths DJ. Endogenous retroviruses in the human genome sequence. Genome Biol 2001; 2(6): REVIEWS1017.
- Kim HS. Genomic impact, chromosomal distribution and transcriptional regulation of HERV elements. Mol Cells 2012; 33(6): 539-44.
- Hohn O, Hanke K, Bannert N. HERV-K(HML-2), the best preserved family of HERVs: endogenization, expression, and implications in health and disease. Front Oncol 2013; 3:246.
- Sutkowski N, Huber BT. EBV induces an endogenous superantigen: Implications for pathogenesis, pp: 233-62. In: Robertson ES (ed), Epstein-Barr Virus. 2005, Caister Academic Press, England.
- Suntsova M, Garazha A, Ivanova A, et al. Molecular functions of human endogenous retroviruses in health and disease. Cell Mol Life Sci 2015; 72(19): 3653-75.
- Brodziak A, Ziolko E, Muc-Wierzgon M, et al. The role of human endogenous retroviruses in the pathogenesis of autoimmune diseases. Med Sci Monit 2012; 18(6): RA80-8.
- Emmer A, Staege MS, Kornhuber ME. The retrovirus/superantigen hypothesis of multiple sclerosis. Cell Mol Neurobiol 2014; 34(8): 1087-96.
- Downey RF, Sullivan FJ, Wang-Johanning F, Ambs S, Giles FJ, Glynn SA. Human endogenous retrovirus K and cancer: Innocent bystander or tumorigenic accomplice? Int J Cancer 2015; 137(6): 1249-57.
- Christensen T. Human endogenous retroviruses in neurologic disease. APMIS 2016; 124(1-2): 116-26.
- Sutkowski N, Chen G, Calderon G, Huber BT. Epstein-Barr virus latent membrane protein LMP-2A is sufficient for transactivation of the human endogenous retrovirus HERV-K18 superantigen.J Virol 2004; 78(14): 7852-60.
- Dobrescu D, Kabak S, Mehta K, et al. Human immunodeficiency virus 1 reservoir in CD4+ T cells is restricted to certain V beta subsets. Proc Natl Acad Sci U S A 1995; 92(12): 5563-7.
- Dobrescu D, Ursea B, Pope M, Asch AS, Posnett DN. Enhanced HIV-1 replication in V beta 12 T cells due to human cytomegalovirus in monocytes: evidence for a putative herpesvirus superantigen. Cell 1995; 82(5): 753-63.
- Torres BA, Tanabe T, Subramaniam PS, Yamamoto JK, Johnson HM. Mechanism of HIV pathogenesis: role of superantigens in disease. Alcohol Clin Exp Res 1998; 22(5 Suppl): 188S-192S.
- Basmaciogullari S, Pizzato M. The activity of Nef on HIV-1 infectivity. Front Microbiol 2014; 5:232.
- Tanabe T, Torres BA, Subramaniam PS, Johnson HM. V beta activation by HIV Nef protein: detection by a simple amplification procedure. Biochem Biophys Res Commun 1997; 230(3): 509-13.
- Torres BA, Tanabe T, Yamamoto JK, Johnson HM. HIV encodes for its own CD4 T-cell superantigen mitogen. Biochem Biophys Res Commun 1996; 225(2): 672-8.
- Lapatschek MS, D�rr S, Sutter G, Wagner H, Miethke T. Functional evaluation of HIV/SIV Nef as superantigen. Virology 2001; 282(2): 329-37.
- M�ller S, K�hler H. B cell superantigens in HIV-1 infection. Int Rev Immunol 1997; 14(4): 339-49.
- Neshat MN, Goodglick L, Lim K, Braun J. Mapping the B cell superantigen binding site for HIV-1 gp120 on a V(H)3 Ig. Int Immunol 2000; 12(3): 305-12.
- Marone G, Florio G, Petraroli A, de Paulis A. Dysregulation of the IgE/Fc epsilon RI network in HIV-1 infection. J Allergy Clin Immunol 2001; 107(1): 22-30.
- Wauquier N, Becquart P, Padilla C, Baize S, Leroy EM. Human fatal zaire ebola virus infection is associated with an aberrant innate immunity and with massive lymphocyte apoptosis. PLoS Negl Trop Dis 2010; 4(10). pii: e837.
İletişim (Correspondence):
Prof. Dr. D�rdal Us (Em.),
Ahmet Mithat Efendi Cad. No: 11/2,
06550 �ankaya, Ankara, T�rkiye.
Tel (Phone): +90 312 438 5640,
E-posta (E-mail): durdalus@hacettepe.edu.tr