HIV ile Enfekte Hastalarda İnsan L�kosit Antijeni (HLA)-B*57:01 Prevalansı
Prevalence of Human Leukocyte Antigen (HLA)-B*57:01 in HIV-Infected Patients
Aydın DEVECİ1, Ahmet Yılmaz �OBAN2, Belma DURUPINAR2
1 Ondokuz Mayıs �niversitesi Tıp Fak�ltesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı, Samsun.
1 Ondokuz Mayis University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology,
Samsun, Turkey.
2 Ondokuz Mayıs �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Samsun.
2 Ondokuz Mayis University Faculty of Medicine, Department of Medical Microbiology, Samsun, Turkey.
�Z
İnsan imm�n yetmezlik virus (HIV) enfeksiyonu ile ilişkili �l�mler, kombine anti-retroviral tedavinin (ART) kullanıma girmesiyle azalmaya başlamıştır. Kombine ART; genellikle omurga tedavi olarak adlandırılan iki n�kleozid/n�kleotid analoğu ters transkriptaz inhibit�r� (NRTI) ile n�kleozid/n�kleotid analoğu olmayan ters transkriptaz inhibit�rleri (NNRTI),� proteaz inhibit�rleri (PI), integraz zincir transfer inhibit�rleri (INSTI) veya giriş inhibit�rleri sınıfına ait bir ilacın kombinasyonundan oluşturulur. Bir NRTI ila� olan abakavir tedavisi sırasında, hastaların yaklaşık %4-9'unda ilaca karşı aşırıduyarlılık reaksiyonu gelişmekte ve bu durum HIV tedavisini g��leştirmektedir. Abakavire karşı gelişen aşırıduyarlılık ile HLA-B*57:01 alel varlığı arasında g��l� bir ilişki olduğu bilinmekte; bu nedenle abakavir kullanımından �nce HLA-B*57:01 gen varlığının araştırılması gerekmektedir. T�rkiye'de HLA-B*57:01 sıklığı ile ilgili herhangi bir veri yoktur. Bu �alışma, HIV ile enfekte hastalarda HLA-B*57:01 genotipinin prevalansını belirleyen �lkemizdeki ilk �alışmadır. �alışmaya, Ondokuz Mayıs �niversitesi Tıp Fak�ltesi, Enfeksiyon Hastalıkları Kliniğine başvuran HIV-1 ile enfekte 100 hasta (81 erkek, 19 kadın; yaş ortalaması: 42.31 � 11.97 yıl) dahil edilmiştir. Hastaların kan �rneklerinden genomik DNA izolasyonu, ticari bir spin kolon y�ntemiyle yapılmış (QIAamp� DNA Blood Mini Kit; QIAGEN GmbH, Almanya); HLA-B*57:01 genotiplendirmesi i�in ticari Olerup SSP� HLA-B*57:01 y�ksek ��z�n�rl�kl� test kiti (Olerup SSP AB, İsve�) kullanılmıştır. Diziye �zg�l primer (Sequence-specific primer; SSP) tabanlı amplifikasyon temeline dayanan bu y�ntem, �retici firmanın protokol�ne g�re uygulanmıştır. Bu y�ntemle elde edilen polimeraz zincir reaksiyonu �r�nleri, Olerup SSP GelRed boyası (Olerup SSP AB, İsve�) eklenmiş %2'lik agaroz jelde elektroforeze tabi tutulmuş ve oluşan bantlar UV altında değerlendirilmiştir. �alışmamızda, HIV ile enfekte 100 hastadan ���nde (2 erkek, 1 kadın) HLA-B*57:01 pozitifliği saptanmış; HIV pozitif hastalarda HLA-B*57:01 prevalansı %3 olarak, orta d�zeyde tespit edilmiştir. Abakavir kullanımından �nce HLA-B*57:01 taramasının tıbbi yararının vurgulanmasına rağmen, bu uygulamanın, HLA-B*57:01 prevalansının y�ksek olduğu toplumların aksine, prevalansın d�ş�k olduğu toplumlar i�in maliyet-etkin olmadığı belirtilmektedir. �lkemizdeki HIV/AIDS insidansının 0.12 olduğu dikkate alındığında,abakavir tedavisi verilecek olan HIV pozitif hastalarda HLA-B*57:01 taramasının değeri ve maliyet-etkinlik analizinin, daha ileri �alışmalarla belirlenmesinin yararlı olacağı d�ş�n�lm�şt�r.
Anahtar s�zc�kler: HIV; HLA-B*57:01; prevalans; abakavir.
ABSTRACT
Deaths related with human immunodeficiency virus (HIV) infections have been decreased by the introduction of combined anti-retroviral therapy (ART) into the clinical practice. Combined ART usually consists of two nucleoside/nucleotide analogs reverse transcriptase inhibitors (NRTI) that is called backbone and a third drug that belongs to either non-nucleoside/nucleotide reverse transcriptase inhibitors (NNRTI), protease inhibitors (PI), integrase strand transfer inhibitors (INSTI) or entry inhibitors. During abacavir therapy which is a member of NRTI, hypersensitivity reactions can occur approximately 4-9% of the patients that lead difficulties for the management of HIV infections. It is known that, the development of hypersensitivity reactions to abacavir is strongly associated with the presence of HLA-B*57:01 allel, therefore, HLA-B*57:01 screening should be performed prior to abacavir use. Since there is no data on HLA-B*57:01 prevalence in HIV-1-infected cases in Turkey, this is the first study that screened HLA-B*57:01 allels among HIV-1 infected adults in Turkey. A total of 100 HIV-1-infected patients (81 male, 19 female; mean age: 42.31�11.97 years) who have admitted to the Department of Infectious Diseases and Clinical Microbiology of Ondokuz Mayıs University School of Medicine, Samsun, Turkey, were included in the study. Genomic DNAs were isolated from the blood samples of patients by using a commercial spin column procedure (QIAamp� DNA Blood Mini Kit; QIAGEN GmbH, Germany). HLA-B*57:01 genotyping was performed by the method of sequence-specific primer (SSP)�based amplification using a commercial OlerupSSP� HLA-B*57:01 high-resolution test kit (Olerup SSP AB, Sweden) according to the manufacturer's protocol. The products of polymerase chain reaction were electrophoresed on a 2% agarose gel stained with Olerup SSP GelRed dye (Olerup SSP AB, Sweden), and the bands were evaluated under UV light. In our study, three (2 male, 1 female) out of 100 patients were found positive for HLA-B*57:01 gene with a prevalence of 3%, which is a moderate level. Although the medical usefulness of HLA-B*57:01 screening before the abacavir therapy is emphasized, it was also noted that this application is not cost-effective for the populations with low HLA-B*57:01 prevalence, in contrast to populations with high prevalence. Considering of the incidence of HIV/AIDS in Turkey which is 0.12, the value and cost-effectiveness of HLA-B*57:01 screening in HIV-1 positive cases before abacavir therapy should be analysed by further studies.
Keywords: HIV; HLA-B*57:01; prevalence; abacavir.
Geliş Tarihi (Received): 13.05.2016 - Kabul Ediliş Tarihi (Accepted): 27.09.2016
GİRİŞ
İnsan imm�n yetmezlik virusu (HIV) enfeksiyonu tanımlandığı g�nden beri yaklaşık 36 milyon kişinin �l�m�ne neden olan global bir halk sağlığı sorunudur1. Kazanılmış imm�n yetmezlik sendromu (AIDS) ve ilişkili �l�mler, kombine anti-retroviral tedavinin (cART) kullanıma girmesiyle azalmaya başlamıştır2,3. Bu tedavi, genellikle omurga tedavi olarak adlandırılan iki n�kleozid/n�kleotid analoğu ters transkriptaz inhibit�r� (NRTI) ile non-n�kleozid/n�kleotid analoğu ters transkriptaz inhibit�rleri (NNRTI),� proteaz inhibit�rleri (PI), integraz zincir transfer inhibit�rleri (INSTI) veya giriş inhibit�rleri sınıfına ait bir ilacın kombinasyonundan oluşturulur4. NRTI bir ila� olan abakavir, HIV tedavisinde cART tedavisinin bir par�ası olarak kullanılmaktadır. Omurga tedavide kullanılan diğer NRTI'lar �zellikle de tenofovir ile karşılaştırıldığında renal fonksiyonlar ve kemik mineral metabolizması �zerinde daha az yan etkiye sahiptir. Dolayısıyla osteoporoz ve kronik b�brek hastalığı olan HIV ile enfekte hastaların tedavisinde tercih edilmektedir4.
Abakavirin en �nemli istenmeyen etkisi; ateş, d�k�nt�, konstit�syonel, gastrointestinal (bulantı, kusma, ishal karın ağrısı) ve solunum semptomları (�ks�r�k ve nefes darlığı) ile kendini g�steren aşırıduyarlılık reaksiyonudur [HSR (Hypersensitivity reaction)].5 Bu reaksiyon, insan l�kosit antijeni (HLA)-B*57:01 aktivasyonuna neden olan maj�r doku uygunluk kompleks (MHC)-I antijen sunumuyla tetiklenir ve CD8+ T h�creleriyle sınırlı gecikmiş tip bir aşırıduyarlılık reaksiyonudur.6,7 Abakavire karşı HSR ile HLA�B*57:01 arasındaki ilişki ilk olarak 2002 yılında belirlenmiştir8. Daha sonraki �alışmalarda da, abakavir HSR riskinin belirlenmesinde, HLA-B*57:01 genotiplendirmesinin y�ksek pozitif ve negatif prediktif değerle ilişkili olduğu g�sterilmiştir9. Dolayısıyla, HIV enfeksiyonu tedavisi i�in abakavir i�eren cART rejimi başlamadan �nce, hastaların HLA-B*57:01 a�ısından taranarak risk altındaki hastaların belirlenmesi, HSR insidansında azalmaya neden olur. Bunun yanında bazı HLA alellerinin (HLA-B*57/58:01/81:01) HIV'in viral replikasyon kapasitesi d�ş�k mutantlarının se�imine neden olduğu ve enfeksiyon hızını azalttığına dair �alışmalar mevcuttur10,11. T�rkiye'de HLA-B*57:01 sıklığı ile ilgili herhangi bir veri yoktur; dolayısıyla bu �alışma, �lkemizde HIV ile enfekte hastalarda HLA-B*57:01 genotipinin prevalansının belirlenmesi i�in planlanmıştır.
Gere� ve Y�ntem
Hasta grubu ve kan �rneklerinin toplanması
Ondokuz Mayıs �niversitesi Tıp Fak�ltesi, Enfeksiyon Hastalıkları Kliniğine başvuran, HIV-1 ile enfekte hastalar, tedavi alıp almadıkları dikkate alınmaksızın �alışmaya dahil edildi. T�m hastalardan bilgilendirilmiş onam alındı. Ondokuz Mayıs �niversitesi Klinik Araştırmalar Etik Kurulu tarafından onaylanan bu �alışma, Helsinki deklarasyonu �er�evesinde ger�ekleştirildi.
�alışmaya dahil edilen her hastadan 2-3 ml EDTA'lı t�pe alınan kan �rnekleri DNA izolasyonu i�in kullanıldı.
DNA izolasyonu
Genomik DNA, ticari QIAamp� DNA Blood Mini Kit (QIAGEN GmbH, Almanya) kullanılarak QIAamp spin kolon y�ntemiyle elde edildi12. Kısaca 20 μl proteaz, 200 μl taze tam kan �rneği ve 200 μl tampon ��zelti mikrosantrif�j t�p�ne konularak 15 saniye vorteksle karıştırıldı. Hazırlanan bu karışım ısı bloğunda 56�C'de 10 dakika ink�be edildi. İnk�basyondan sonra karışıma 200 μl etanol (%98) eklenerek 15 saniye vorteksle karıştırıldı. Elde edilen bu karışım QIAamp spin kolon t�plerine aktarılarak 6000xg'de 1 dakika santrif�j edildi. Daha sonra QIAamp spin kolon tampon sol�syonlarıyla iki kere yıkandı. Son aşamada; 200 μl Buffer AL (Qiagen) sol�syonu QIAamp spin kolona eklendi ve oda sıcaklığında 2-3 dakika ink�be edildikten sonra 6000xg'de 1 dakika santrif�j edildi. Elde edilen DNA �rneği �alışılıncaya kadar -20�C'de saklandı.
HLA-B*57:01 genotiplendirmesi
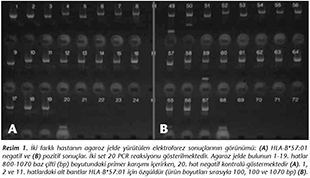
Bu ama�la, ticari olarak kullanıma sunulmuş olan Olerup SSP� HLA-B*57:01 y�ksek ��z�n�rl�kl� test kiti (Olerup SSP AB, İsve�) ile, diziye �zg�l primer [SSP (Sequence-specific primer)] tabanlı amplifikasyon y�ntemi �retici firmanın protokol�ne g�re uygulandı. Bu y�ntemle elde edilen polimeraz zincir reaksiyonu (PCR) �r�nleri, Olerup SSP GelRed boyası (Olerup SSP AB, İsve�) eklenmiş %2'lik agaroz jelde (SeaKem LE Agarose, ABD) elektroforez yapıldıktan sonra UV (Transilluminator TFX-20M; Vilber Lourmat, Fransa) altında bantlar değerlendirilerek sonu�lar raporlandı (Resim 1).
bulgular
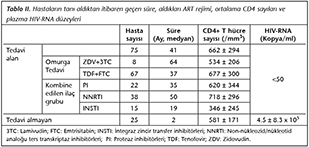
�alışmada, HIV ile enfekte 81 erkek ve 19 kadın olmak �zere toplam 100 hasta HLA-B*57:01 varlığı y�n�nden taranmıştır (Tablo I). Bunların 75'i tedavi alan, 25'i ise hen�z tedavi başlanmamış yeni tanı alan hastalardır. Hastaların tanı aldıktan itibaren ge�en s�re, aldıkları ART tedavi rejimi, ortalama CD4 sayıları ve plazma HIV-RNA d�zeyleri Tablo II'de g�sterilmiştir. Tedavi edilen hastaların plazma HIV-RNA d�zeyleri < 50 kopya/ml'dir. Agaroz jelde y�r�t�len PCR �r�nlerinin 1., 2. ve 11. primer karışım �r�nlerinde bant oluşumu HLA-B*57:01 alelleri i�in �zg�ld�r. �alışmada, 100 hastadan 2'si erkek, 1'i kadın olmak �zere 3 hastada (%3) HLA-B*57:01 pozitifliği saptanmış ve bu hastaların ���n�n de tedavi aldığı tespit edilmiştir (Tablo I). HLA-B*57:01 pozitif bulunan hastaların ortalama CD4+ T lenfosit sayıları 693 � 213/mm3, tedavi alan diğer hastaların ortalama CD4+ T lenfosit sayıları ise 660 � 298/mm3 olarak saptanmış ve aralarında istatistiksel a�ıdan anlamlı bir fark bulunmamıştır.
tartışma
Bu �alışma, T�rkiye'de HIV ile enfekte hastalarda HLA-B*57:01 prevalansını belirleyen ilk �alışma olup, �alışma grubumuzda HLA-B*57:01 prevalansı %3 olarak bulunmuştur. HLA-B*57:01 prevalansı ırk ve coğrafi b�lgelere g�re farklılık g�stermektedir. Orkin ve arkadaşları13, 10 Avrupa �lkesini kapsayan b�y�k bir epidemiyolojik �alışmada, HIV ile enfekte hastalarda HLA-B*57:01 prevalansını %4.98 olarak belirlemişlerdir. En y�ksek seroprevalans %7.75 ile İsvi�re'de saptanırken, %1.53 ile en d�ş�k Finlandiya'da saptanmıştır13. Bu �alışmada ayrıca, beyaz ırkta (%6.49) siyah ırka (%0.39) g�re prevalansın daha y�ksek olduğu izlenmiştir13. Parczewski ve arkadaşları14, HIV ile enfekte Polonyalı hastalarda HLA-B*57:01 prevalansını %4.7 olarak bildirmiş; Kuzey Amerika'da yapılan bir �alışmada15 ise 725 kişinin (%16'sı kadın) 41'inde (%5.7) HLA-B*57:01 pozitifliği saptanmıştır. Young ve arkadaşları15, HLA-B*57:01 pozitifliğinin ırklara g�re farklılık g�sterdiğini; bu oranı beyazlarda %7.2, siyahlarda %2.8 ve diğer ırklarda %5.6 olarak saptadıklarını vurgulamıştır. Abakavir tedavisi alan HIV-1 ile enfekte 489 hastadan oluşan Kanada kohortunda ise HLA-B*57:01 alel pozitifliği %4.1 olarak bildirilmiştir16. G�ney Amerika �lkelerinden Şili ve Brezilya'dan HLA-B*57:01 sıklığı ile ilgili iki �alışma rapor edilmiştir. Poggi ve arkadaşları17 HIV ile enfekte Şilili hastalarda HLA-B*57:01 sıklığını %2.2 olarak belirlerken; bu oran Kuzey Brezilya'da HIV ile enfekte hastalar ve sağlıklı kişilerde sırasıyla %3.1 ve %3.4 olarak saptanmıştır18. �oğunluğu Han ırkından oluşan (%81.7) 3000 �inli'nin katıldığı �ok merkezli prospektif bir �alışmada, HLA-B*57:01 prevalansı %0.86 olarak bulunmuştur19. �in'deki bu d�ş�k prevalansın aksine, Taylandlı HIV ile enfekte �ocuklarda HLA-B*57:01 prevalansı %4 ve Kambo�yalı �ocuklarda %3.4 olarak rapor edilmektedir20.�
HLA-B*57:01 alelini kapsayan bazı genlerin HIV enfeksiyonunun ilerlemesine negatif y�nde bir etkisi olduğu g�sterilmiştir10,11. Polonya'da yapılan bir �alışmada, HLA-C -35C ve HLA-B*5701 alellerine sahip HIV ile enfekte hastaların tedavi �ncesinde daha y�ksek CD4+ T lenfosit sayısına ve daha d�ş�k viral y�ke sahip olduğu belirtilmiştir21. Bununla birlikte, HIV ve hepatit C virusu ile enfekte ve cART alan HLA-B*57 pozitif hastalarda mortalitenin daha y�ksek olduğu bildirilmektedir22. �alışmamızda, HLA-B*57:01 pozitifliği saptanan hastalarda, ilerleyen enfeksiyonun �nemli bir belirteci olan CD4+ T lenfosit sayısı ile tedavi alan HLA-B*57:01 negatif hastaların CD4+ T lenfosit sayısı arasında anlamlı bir fark tespit edilmemiştir.�
Son yıllara kadar HLA-B*57:01'i tespit etmek i�in mevcut bir kit bulunmazken, �zellikle HIV ile enfekte hastalarda abakavir kullanımına başlamadan �nce HLA-B*57:01 varlığının belirlenmesindeki �nemin g�ndeme gelmesi, kullanıma hazır ticari kitlere karşı ilginin artmasına neden olmuştur. Bu ama�la, HLA-B*57:01'i tespit etmek i�in; diziye �zg�l oligon�kleotid prob hibridizasyon (SSOP), DNA dizi tabanlı tiplendirme (SBT), SSP-PCR, akım sitometrisi, alele �zg�l PCR (AS-PCR), kantitatif PCR (Q-PCR) ve kapiller elektroforezde floresan belirlemesiyle birlikte SSP gibi farklı molek�ler y�ntemler geliştirilmiştir23. SSOP, SBT ve akım sitometri y�ntemleri, HLA-B*57:01 alelini tespit etmek i�in y�ksek ��z�n�rl�kl� ikinci basamağa ihtiya� duymakta ve diğer y�ntemlerle karşılaştırıldığında iş g�c�, zaman ve maliyet a�ısından bazı dezavantajlar i�ermektedirler. Kapiller elektroforezde floresan belirlemesiyle birlikte SSP y�ntemi, enfeksiy�z olmayan t�k�r�k ve bukkal mukozadan alınan �rneklerden elde edilen az miktarda genomik DNA'da HLA-B*57:01 alelini tespit edebilmekle birlikte maliyeti y�ksektir24. Kantitatif PCR ve SSP-PCR maliyet ve zaman a�ısından avantajlı y�ntemlerdir25. SSP-PCR y�nteminin duyarlılık ve �zg�ll�ğ� y�ksek olup, yapılan �ok merkezli bir �alışmada, bu değerlerin sırasıyla, %99.3 ve %100 olduğu g�sterilmiştir23. Dolayısıyla, �alışmamızda HLA-B*57:01 genotiplendirmesi i�in kullanılan SSP-PCR y�nteminin g�venilir bir y�ntem olduğu kabul edilmektedir.
Abakavire bağlı HSR, hastaların %4-9'unda gelişmekte ve HIV tedavisini g��leştirmektedir5. Bu t�r komplikasyonların oluşması, hem hastanın tedavisini zorlaştırmakta hem de tedavi maliyetini artırmaktadır. Abakavire bağlı HSR'nin �nlenmesini irdeleyen beş yıllık retrospektif bir �alışmada; HLA-B*57:01 prevalansı %5.4 olarak saptanmış; genotip taraması yapılan hastalarda HSR gelişme oranının 23 kat daha az olduğu ve taramanın maliyet-etkin bir uygulama olduğu bildirilmiştir26. Abakavir kullanımından �nce HLA-B*57:01 taramasının maliyeti ile abakavir aşırıduyarlılığına bağlı maliyeti, karşılaştırmalı olarak değerlendiren farklı coğrafyalarda yapılan �alışmalar mevcuttur27-29. Bu �alışmalar, HLA-B*57:01 prevalansının %3.23-6.59 arasında olduğu g�zlenen Amerika Birleşik Devletleri, Birleşik Krallık ve Almanya'da yapılmış olup, tedavi �ncesi tarama yapılmasının maliyet- etkin olduğu vurgulanmaktadır. Bunun aksine, Singapur'da yapılan bir �alışmada, prevalansın d�ş�k olduğu �inliler, Malaylar ve diğer ırklardan oluşan hastalar i�in, tedavi �ncesi yapılan taramanın maliyet-etkin olmadığı bildirilmiştir30. �alışmaların t�m�nde, ekonomik g�stergelerden bağımsız olarak, abakavir kullanımından �nce HLA-B*57:01 taramasının tıbbi yararının olduğu a�ık�a ifade edilmektedir.
T�rkiye d�ş�k HIV/AIDS prevalansına sahip bir �lke olarak kabul edilmektedir. Sağlık Bakanlığı verilerine g�re ilk HIV/AIDS olgusunun bildirildiği 1985 yılından 31 Aralık 2014 tarihine kadar ge�en s�rede toplam 9.191 olgu rapor edilmiştir31. Bu verilere g�re, T�rkiye'de HIV/AIDS insidansı 0.12 olarak saptanmıştır31. Bizim �alışmamızda ise, HIV ile enfekte hastalarda HLA-B*57:01 prevalansı %3 olarak, orta d�zeyde tespit edilmiştir. Sonu� olarak, abakavir tedavisi verilecek olan HIV pozitif hastalarda HLA-B*57:01 taramasının değeri ve maliyet-etkinlik analizi, daha ileri �alışmalarla belirlenebilir.
Teşekk�r
�alışma i�in kullanılacak kitin temin edilmesini sağlayan GlaxoSmithKline'a teşekk�r ederiz.
Kaynaklar
- UNAIDS. Global Report. UNAIDS report on the global AIDS epidemic 2013. Available at: http://www.unaids.org/en/resources/campaigns/globalreport2013/factsheet
- HIV Trialists' Collaborative Group. Zidovudine, didanosine, and zalcitabine in the treatment of HIV infection: meta-analyses of the randomised evidence. Lancet 1999; 353 (9169): 2014-25.
- Zolopa A, Andersen J, Powderly W, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy trial. PLoS One 2009; 4(5): e5575.
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Available at: http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf
- Hetherington S, McGuirk S, Powell G, et al. Hypersensitivity reactions during therapy with the nucleoside reverse transcriptase inhibitor abacavir. Clin Ther 2001; 23(10): 1603-14.
- Chung WH, Hung SI, Chen YT. Human leukocyte antigens and drug hypersensitivity. Curr Opin Allergy Clin Immunol 2007; 7(4): 317-23.
- Aceti A, Gianserra L, Lambiase L, Pennica A, Teti E. Pharmacogenetics as a tool to tailor antiretroviral therapy: A review. World J Virol 2015; 4(3): 198-208.
- Mallal S, Nolan D, Witt C, et al. Association between presence of HLA-B*5701, HLA-DR7, and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir. Lancet 2002; 359 (9307): 727-32.
- Ma JD, Lee KC, Kuo GM. HLA-B*5701 testing to predict abacavir hypersensitivity. PLoS Currents 2010; 2: RRN1203.
- Adland E, Paioni P, Thobakgale C, et al. Discordant impact of HLA on viral replicative capacity and disease progression in pediatric and adult HIV infection. PLoS Pathog 2015; 11(6): e1004954.
- Kl�verpris HN, Harndahl M, Leslie AJ, et al. HIV control through a single nucleotide on the HLA-B locus. J Virol 2012; 86(21):11493-500.
- Qiagen. QIAprep Spin Miniprep Kit. Available at: https://www.qiagen.com/tr/resources/resourcedetail?id=331740ca-077f-4ddd-9e5a-2083f98eebd5&lang=en
- Orkin C, Wang J, Bergin C, et al. An epidemiologic study to determine the prevalence of the HLA-B*5701 allele among HIV-positive patients in Europe. Pharmacogenet Genomics 2010; 20(5): 307-14.
- Parczewski M, Leszczyszyn-Pynka M, Wnuk A, et al. Introduction of pharmacogenetic screening for the human leucocyte antigen (HLA) B*5701 variant in Polish HIV-infected patients. HIV Medicine 2010; 11(5): 345-8.
- Young B, Squires K, Patel P, et al. First large, multicenter, open-label study utilizing HLA-B*5701 screening for abacavir hypersensitivity in North America. AIDS 2008; 22(13): 1673-81.
- Berka N, Gill JM, Liacini A, O'Bryan T,� Kha FM. Human leukocyte antigen (HLA) and pharmacogenetics: screening for HLA-B*57:01 among human immunodeficiency virus�positive patients from southern Alberta. Human Immunol 2012; 73(2): 164-7.
- Poggi H, Vera A, Lagos M, Solari S, Rodr�guez PL, P�rez CM. HLAB*5701 frequency in Chilean HIV-infected patients and in general population. Braz J Infect Dis 2010; 14(5): 510-2.
- Crovella S, Biller VL, Santos S, et al. Frequency of HLA B*5701 allele carriers in abacavir treated HIV infected patients and controls from northeastern Brazil. CLINICS 2011; 66(8): 1485-7.
- Zhang H, Zhang T, Zhao H, et al. Low prevalence of human leukocyte antigen-B*5701 in HIV-1-infected Chinese subjects: a prospective epidemiological investigation. AIDS Res Ther 2015; 12: 28.
- Puthanakit T, Bunupuradah T, Kosalaraksa P, et al; PREDICT Study Group. Prevalence of human leukocyte antigen-B*5701 among HIV-infected children in Thailand and Cambodia: implications for abacavir use. Pediatr Infect Dis J 2013; 32(3): 252-3.
- Leszczyszyn-Pynka M, Aksak-Wąs B, Urbańska A, Parczewski M. Protective effect of HLA-B*5701 and HLA-C -35 genetic variants in HIV-positive caucasians from Northern Poland. PLoS One 2015; 10(6): e0127867.
- Dold L, Ahlenstiel G, Althausen E, et al. Survival and HLA-B*57 in HIV/HCV co-infected patients on highly active antiretroviral therapy (HAART). PLoS One 2015; 10(8): e0134158.
- Stocchi L, Cascella R, Zampatti S, Pirazzoli A, Novelli G, Giardina E. The pharmacogenomic HLA biomarker associated to adverse abacavir reactions: comparative analysis of different genotyping methods. Curr Genomics 2012; 13(4): 314-20.
- Meini G, Dello Russo C, Allice T, et al. First external quality assurance program of the Italian HLA-B*57:01 Network assessing the performance of clinical virology laboratories in HLA-B*57:01 testing. J Clin Virol 2016; 78: 1-3.
- Hammond E, Almeida CA, Mamotte C, et al. External quality assessment of HLA-B*57:01 reporting: an international multicentre survey. Antivir Ther 2007; 12(7): 1027-32.
- Ruiz-Iruela C, Padull�s-Zamora N, Podzamczer-Palter D, et al. HLA-B*57: 01 genotyping in the prevention of hypersensitivity to abacavir: 5 years of experience. Pharmacogenet Genomics 2016; 26(8): 390-6.
- Wolf E, Blankenburg M, Bogner J, et al. Cost impact of prospective HLA-B*5701-screening prior to abacavir/lamivudine fixed dose combination use in Germany. Eur J Med Res 2010; 15(4): 145-51.
- Hughes DA, Vilar FJ, Ward CC, Alfirevic A, Park BK, Pirmohamed M.� Cost-effectiveness analysis of HLA-B*5701 genotyping in preventing abacavir hypersensitivity. Pharmacogenetics 2004; 14(6): 335-42.
- Schackman BR, Scott Ca, Walensky RP, Losina E, Freedberg KA, Sax PE. The cost-effectiveness of HLa-B*5701 genetic screening to guide initial antiretroviral therapy for HIV. AIDS 2008; 22(15): 2025-33.
- Kapoor R, Martinez-Vega R, Dong D, et al. Reducing hypersensitivity reactions with HLA-B*5701 genotyping before abacavir prescription: clinically useful but is it cost-effective in Singapore? Pharmacogenet Genomics 2015; 25(2): 60-72.
- T�rkiye Halk Sağlığı Kurumu 2014 Faaliyet Raporu. Erişim: http://www.thsk.gov.tr/dosya/birimler/strateji_db/dokumanlar/faaliyet_raporu/2014_faaliyet_raporu.pdf
İletişim (Correspondence):
Prof. Dr. Ahmet Yılmaz �oban,
Ondokuz Mayıs �niversitesi Tıp Fak�ltesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
55139, Samsun, T�rkiye.
Tel (Phone): +90 362 3121919/3526,
E-posta (E-mail): cobanay2003@gmail.com