Toksin
Pozitif Clostridium difficile İzolatlarının
Antimikrobiyal Duyarlılıkları ve
Molek�ler Karakterizasyonu: T�rkiye'den Hipervir�lan Suşların
Varlığı ile İlişkili İlk Bildirim*
Antimicrobial
Susceptibilities and Molecular Characterization of Toxin-Positive
Clostridium difficile Isolates: The First Report on the Presence of
Hypervirulent Strains from Turkey
Emrah SALMAN1,2, Belkıs LEVENT3, Zeynep Ceren KARAHAN1
1 Ankara �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Ankara University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 �ukurova �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Tıbbi İmm�noloji Bilim Dalı, Adana.
2 Cukurova University Faculty of Medicine, Department of Medical Microbiology, Discipline of Medical Immunology, Adana, Turkey.
3 T�rkiye Halk Sağlığı Kurumu, Mikrobiyoloji Referans Laboratuvarları Daire Başkanlığı, Ankara.
3 Turkish Public Health Institution, National Microbiology Reference Laboratory, Ankara, Turkey.
* Bu �alışma, Ankara �niversitesi Bilimsel Araştırma Projeleri Koordinat�rl�ğ� tarafından 13L3330010 proje numarasıyla desteklenmiş ve 3. Klinik Mikrobiyoloji Kongresi (18-22 Kasım 2015, Belek, Antalya)'nde s�zl� bildiri olarak sunulmuştur.
�Z
Clostridium difficile g�n�m�zde en �nemli hastane k�kenli enfeksiyonlardan birisidir. Hipervir�lan C.difficile suşları ile oluşan enfeksiyonlar daha y�ksek morbidite ve mortalite, komplikasyonlar ve relaps oranları ile seyretmektedir. Y�ksek d�zeyde toksin �reten hipervir�lan C.difficile suşları daha y�ksek sporlanma oranı ve florokinolonlara artmış diren� �zelliği taşımaktadır. Oluşabilecek y�ksek oranda morbidite, mortalite ve sağlık maliyetlerindeki artışı �nlemek i�in ciddi salgınlara yol a�madan �nce, patojenitesi y�ksek C.difficile izolatlarının tanımlanması gerekmektedir. Bu �alışmada, Eyl�l 2012-Kasım 2014 tarihleri arasında Ankara'daki �� farklı laboratuvara başvuran hastaların toksin pozitifliği tespit edilen dışkı �rneklerinden anaerobik k�lt�r ile izole edilen 61 adet C.difficile izolatının antimikrobiyal duyarlılıklarının belirlenmesi ve molek�ler �zelliklerinin araştırılması ama�lanmıştır. Suşların antibiyotik duyarlılıkları gradiyent test şeritleri kullanılarak saptanmış ve sonu�lar g�ncel "Clinical and Laboratory Standards Institute (CLSI)" ve "The European Committee on Antibiotic Susceptibility Testing" �nerilerine g�re yorumlanmıştır. Toksin genlerinin varlığı polimeraz zincir reaksiyonu (PCR) ile, tcdC geni mutasyonları PCR amplifikasyonunu takiben dizi analizi ile araştırılmıştır. Tespit edilen bir hipervir�lan suşun genetik karakterizasyonu T�rkiye Halk Sağlığı Kurumu tarafından GenoType CDiff (Hain Lifescience, Almanya) testi kullanılarak ger�ekleştirilmiştir. Suşların t�m�n�n vankomisin ve metronidazole duyarlı olduğu bulunmuştur. �� (%4.9) suşun moksifloksasin i�in minimum inhibit�r konsantrasyonu (MİK) > 8 �g/ml olup diren�lidir. Eritromisin i�in saptanan MİK50 ve MİK90 değerleri sırasıyla 1.5 �g/ml ve 3 �g/ml iken klindamisin i�in saptanan MİK50 değeri 2 �g/ml, MİK90 değeri 4 �g/ml'dir. Suşların t�m�n�n tcdA ve tcdB geni taşıdığı tespit edilmiştir. Bir (%1.6) suşun binary-toksin genlerini (cdtA ve cdtB) taşıdığı tespit edilmiştir. Binary-toksin pozitif bulunan izolatın tcdC geninde 54 bp'lik delesyonla birlikte tek n�kleotit değişimi tespit edilirken, 12 (%19.6) suşun tcdC geninde �eşitli tek n�kleotit değişimleri taşıdığı tespit edilmiştir. �alışmanın sonu�ları �lkemizde hipervir�lan suşların bulunduğunu fakat;� hen�z ribotip 027 varlığı a�ısından kanıta ulaşılamadığını g�stermektedir. Bununla birlikte bu izolatların t�m d�nya genelinde artan sıklıkta bildirilmesi nedeniyle, t�m d�nyada olduğu gibi �lkemizde de s�rveyans �alışmalarının yapılması ve izolatların karakterizasyonu �nemli g�r�lmektedir.
Anahtar s�zc�kler: Clostridium difficile;� antimikrobiyal diren�;� toksin genleri;� hipervir�lan suş.
ABSTRACT
Clostridium difficile infection is one of the most important hospital-acquired infections. Infections caused by hypervirulent C.difficile strains which produce toxins at high levels, have higher morbidity and mortality rates, more complications and relapses. They are characterized by higher sporulation ratios and resistance rates for fluoroquinolones. In order to prevent serious morbidities, mortalities and remarkable increase in health costs, highly pathogenic C.difficile strains must be identified before causing severe outbreaks. The aim of this study was to determine the antimicrobial susceptibilities and molecular characteristics of 61 C.difficile strains isolated by culture from toxin-positive fecal samples of patients who were admitted to three different laboratories in Ankara, between September 2012 and November 2014. Antimicrobial susceptibilities were determined by using gradient test strips and results were interpreted according to the current CLSI and EUCAST criteria. The presence of toxin genes was investigated by polymerase chain reaction (PCR), and mutations in the tcdC gene were determined by sequence analysis following PCR amplification. Genetic characterization of one hypervirulent strain was� performed by Public Health Institution of Turkey using the GenoType CDiff (Hain Lifescience, Germany) test. All strains were susceptible to vancomycin and metronidazole. Three (4.9%) isolates were resistant to moxifloxacin with a minimum inhibitory concentration (MIC) of > 8 �g/ml. The MIC50 and MIC90 values for erythromycin and clindamycin were 1.5-3 �g/ml, and 2-4 �g/ml, respectively. All strains carried the tcdA and tcdB genes, and 1 (1.6%) was positive for the binary-toxin (cdtA and cdtB) genes. The binary-toxin positive strain carried a 54 bp deletion as well as a single nucleotide change in the tcdC gene. Various single nucleotide changes were found in the tcdC gene of 12 strains (19.6%). Our results� have shown that, hypervirulent strains exist in our country, but we have no evidence for the presence of ribotype 027 yet. On the other hand, when the increasing incidence of these strains through out the world is taken into consideration, it would be of great importance to perform surveillance studies and characterize the isolated strains.
Keywords: Clostridium difficile;� antimicrobial resistance;� toxin genes;� hypervirulent strain.
Geliş Tarihi (Received): 26.12.2016 - Kabul Ediliş Tarihi (Accepted): 06.07.2017
GİRİŞ
Clostridium difficile anaerobik, gram-pozitif, sporlu bir basildir. Komplikasyonsuz hafif ishalden �l�mc�l toksik megakolon ve kolon perforasyonuna değişen hastalıkla ilişkilidir. C.difficile enfeksiyonu (CDE) gelişiminde antibiyotik kullanımı en �nemli risk fakt�r�d�r1. C.difficile, hastane kaynaklı ishalin de başlıca nedenidir ve artmış morbidite-mortaliteyle seyreden salgınlardan sorumludur2.
C.difficile'nin maj�r toksinleri tcdA ve tcdB genlerince kodlanan toksin A (enterotoksin) ve toksin B (sitotoksin)'dir. tcdC, toksin A ve toksin B'nin negatif d�zenleyicisidir. Bazı C.difficile suşlarınca aktin spesifik ADP-ribozilleyici binary-toksin �retilmektedir. Y�ksek d�zeyde toksin �reten hipervir�lan C.difficile suşları florokinolonlara diren�le karakterizedir ayrıca daha y�ksek morbidite-mortalite, komplikasyonlar ve relapslarla ilişkilendirilmektedir. Patojenik C.difficile suşlarının varlığı, ağır bir C.difficile salgınına yol a�madan �nce ortaya konmalıdır. Aksi takdirde kolektomi, �l�mler ve sağlık hizmetlerinde ciddi maliyet artışlarına neden olabilmektedir. CDE riskini azaltıcı uygun �nlemlerin alınabilmesi, etkin s�rveyans �alışmalarıyla m�mk�nd�r3.
CDE tedavisinde sıklıkla metronidazol ve vankomisin kullanılmaktadır. C.difficile her iki antibiyotiğe duyarlı kabul edilse de C.difficile'nin metronidazol ve vankomisine karşı artmış minimum inhibit�r konsantrasyonu (MİK) ile ilişkili yayınlar bulunmaktadır4.
Bu �alışmada, amacımız 2012 Eyl�l-2014 Kasım ayları arasında Ankara'daki �� farklı laboratuvardan alınan toksin-pozitif dışkı �rneklerinden izole edilen C.difficile suşlarının antibiyotik duyarlılıkları ve molek�ler �zelliklerinin saptanmasıdır.
GERE� ve Y�NTEM
Bakterilerin İzolatlar
�alışmada Ankara �niversitesi Tıp Fak�ltesi (A�TF) Merkez Laboratuvarı, Hacettepe �niversitesi Tıp Fak�ltesi (H�TF) Merkez Laboratuvarı ve D�zen Laboratuvarlar Grubu (DLG)'ndan Eyl�l 2012-Kasım 2014 tarihleri arasında randomize olarak toplanan 61 dışkı �rneği değerlendirildi. Hastaların demografik bilgileri hastane kayıtlarından sağlandı ve son altı haftada antibiyotik kullanımı kaydedildi. Araştırma, A�TF Etik Kurulu tarafından onaylandı (Onay no.03-104-13).
CDE ş�phesiyle laboratuvarlara g�nderilen ve kurumun rutin analizde kullandığı y�ntemle [A�TF'de "Xpect toxin A/B test" (Remel, ABD), H�TF'de in-house PCR ve DLG'de "VIDAS C.difficile toxin A&B test (BioM�rieux SA, Marcy l'Etoile, Fransa)"] toksin pozitifliği tespit edilen dışkı �rneklerinden suşların izolasyonu i�in �rnekler A�TF Tıbbi Mikrobiyoloji Anabilim Dalı Anaerob Laboratuvarında alkolle muamele edildikten sonra %7 at kanlı ve %0.1 taurokolik asitli, indirgenmiş sikloserin-sefoksitin-fruktoz agarda �retildi. Plaklar 37oC'de anaerobik şartlarda 48 saat ink�be edildi. �reyen koloniler konvansiyonel y�ntemler (tipik koloni morfolojisi, koku, Gram boya morfolojisi) ve Crystal Anaerop kit (BBL, ABD) kullanılarak tanımlandı. Toksin-pozitif ve toksin-negatif kontrol olarak sırasıyla BAA-1870 ve ATCC 700057 suşları kullanıldı.
Antibiyotik Duyarlılık Testleri
Vankomisin, metronidazol, moksifloksasin, eritromisin ve klindamisin i�in MİK değerleri gradiyent test (Gtest) şeritleri (Liofilchem, İtalya) kullanılarak saptanmıştır. Hemin, vitamin K1 ve %5 defibrine koyun kanlı indirgenmiş Brucella kanlı agar plaklarına 1 McFarland standardında inokul�m ekildikten sonra Gtest şeritleri yerleştirildi. Anaerobik koşullarda 24-48 saat ink�basyondan sonra �reticinin talimatları doğrultusunda MİK değerleri kaydedildi. Kontrol suşu olarak C.difficile ATCC 700057 kullanıldı.
Vankomisin ve metronidazol i�in MİK değerleri, "The European Committee Antimicrobial Susceptibility Testing (EUCAST)"5 tarafından �nerilen epidemiyolojik eşik (Epidemiological cut-off, Ecoff) değerleriyle değerlendirildi;� her iki antibiyotik i�in de MİK ≤ 2 mg/L değerleri sokak izolatlarının dağılımına uygun olarak "duyarlı" kabul edildi. Moksifloksasin i�in duyarlılık kategorileri "Clinical and Laboratory Standards Institute (CLSI)"6 �nerileri doğrultusunda MİK ≤ 2 �g/ml i�in "duyarlı", ≥ 8 �g/ml i�in "diren�li" olarak belirlendi. Klindamisin ve eritromisin i�in tespit edilen MİK değerleri kaydedildi ve izolatların MİK50 ve MİK90 değerleri belirlendi. İstatistiksel analiz SPSS programında Fisher kesin ki-kare testi kullanılarak yapıldı.
Molek�ler Analiz
Brucella kanlı agar plaklarında �reyen C.difficile kolonilerinden ticari kit (DNeasy virus mini kit v2.0, Qiagen, ABD)� kullanılarak �reticinin �nerileri doğrultusunda DNA ekstraksiyonu ger�ekleştirildi.
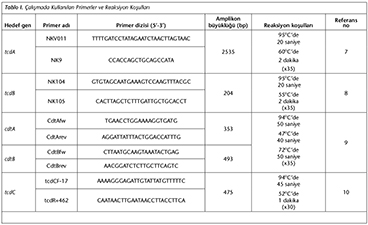
C.difficile toksin genleri literat�rde tanımlandığı şekilde PCR ile saptandı7-9. Kullanılan primerler ve reaksiyon koşulları Tablo I'de g�sterilmiştir. tcdC geni mutasyonlarının belirlenmesi i�in literat�rde tanımlandığı şekilde PCR ile amplifikasyonu takiben aynı primerlerle tek y�nl� dizi analizi (Applied Biosystems 3130xl Genetic analyzer, AbiPrism, ABD) yapıldı, yeterli okuma sağlanamayan izolatlara karşı y�n sekansı uygulandı10. Elde edilen diziler, GenBank'ta kayıtlı VPI10463 suşunun tcdC dizisiyle karşılaştırıldı.
Hipervir�lan Suşun Genetik Karakterizasyonu
İzolatlar i�erisinde binary-toksin genlerini taşıyan ve tcdC geninde delesyon saptanan tek hipervir�lan suş T�rkiye Halk Sağlığı Kurumuna g�nderildi. Suşun genetik karakterizasyonu, toksin A, B ve binary-toksin genlerinin varlığını, tcdC genindeki delesyonları ve gyrA genindeki mutasyonları tanımlayan ve hibridizasyon prensibiyle �alışan GenoType CDiff (Hain Lifescience, Almanya) kiti kullanılarak ger�ekleştirildi (Şekil 1).
BULGULAR
Hastaların 26 (%42)'sı erkek ve 35 (%58)'i kadın olup ortalama yaş 52.01'dir. Hastaların 38 (%62.2)'inde hastanede yatış, tamamında antibiyotik kullanma �yk�s� vardır. Hastaların 18 (%29.5)'i sefalosporin, 15 (%24.5)'i karbapenem, 14 (%22.9)'� penisilin, 10 (%16.3)'u florokinolon, 9 (%14.7)'u aminoglikozit ve 8 (%13.1)'i glikopeptit sınıfı antibiyotikleri daha �nceden kullanmıştır. Alınan antibiyotiklerle tespit edilen diren� profilleri arasında ilişki saptanmamıştır. Hastaların 42 (%68.9)'sinde monoterapi, 19 (%31.1)'unda kombine antibiyotik kullanımı olduğu belirlenmiştir. Hastaların 13 (%34)'�nde malignite ve 17 (%44)'sinde kronik hastalık �yk�s� (kronik obstr�ktif akciğer hastalığı, b�brek yetmezliği, diyabet, �lseratif kolit) saptanmıştır.
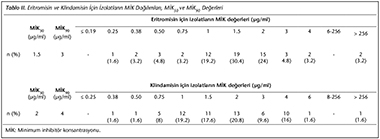
Suşların tamamı vankomisin ve metronidazole, 58 (%95.1)'i moksifloksasine duyarlı olarak saptanmıştır. Eritromisin ve klindamisin i�in tespit edilen MİK aralıklarıyla MİK50 ve MİK90 değerleri Tablo II'de verilmiştir. �oklu antibiyotik direncine rastlanılmamıştır. Merkezler arasında diren� dağılımları arasında fark bulunmamıştır (p> 0.05).
Hastanede yatış �yk�s� olan 38 (%62.2) hasta hastane kaynaklı, diğerleri toplum kaynaklı olarak değerlendirildiğinde, iki grup arasında izolatların antibiyotik diren� oranları a�ısından anlamlı fark bulunmamıştır (p> 0.05).
Suşların t�m� tcdA ve tcdB genleri taşımaktadır. Bir (%1.6) C.difficile suşunun binary-toksin genlerini (cdtA ve cdtB) taşıdığı saptanmıştır.
Bir C.difficile suşunda tcdC geninde 54 bp'lik delesyon ve 378. pozisyonda guanin→Adenin değişimi (G378A) saptanmıştır (GenBank erişim numarası: 1843798). On (%16.4) izolatta 50. Aminoasitte Ala→Ser değişimine neden olan G148T değişimi, 1 (%1.6) izolatta T150C sessiz mutasyonu ve 1 (%1.6) izolatta 138. aminoasitte Asp→Glu değişimine neden olan C414A değişimi tespit edilmiştir (GenBank erişim numaraları sırasıyla 1843207, 1843786, 1843801).
tcdC geninde 54 bp'lik delesyon saptanan suşta florokinolonlara diren�le karakterize gyrA geninde mutasyon g�zlenmemiş;� ribotip 027 dışı hipervir�lan suş olarak tanımlanmıştır (Şekil 1).
TARTIŞMA
C.difficile antibiyotikle ilişkili ishalin başlıca sebebi olup nozokomiyal enfeksiyonların �nde gelen nedenidir. Beta-laktamlar, beta-laktam/beta-laktamaz inhibit�r kombinasyonları, florokinolonlar ve linkozamidler, CDE ile en sık ilişkili antimikrobiyal ila�lardır11. �alışmamız kapsamındaki hasta grubunda en fazla kullanılan antibiyotikler beta-laktamlar (n= 47, %77) olup, bu grubu florokinolonlar, aminoglikozitler ve glikopeptitler izlemektedir.
Tedavi a�ısından daha ucuz olması, kullanım kolaylığı ve vankomisine diren�li enterokokların se�imine neden olmaması dolayısıyla, metronidazol daha �ok tercih edilmektedir12. Yapılan �alışmalarda metronidazol direnci %2-6.3 olarak bildirilmiştir13,14. Vankomisine diren�li ilk C.difficile suşu 1991'de Polonya'da bildirilmiş15, ardından vankomisine diren�li suşların sıklığında artış (2000'de %2.7-3.1, 2005'te %21.6) g�zlenmiştir14,16,17. �alışmamızda değerlendirilen suşların t�m� CDE tedavisinde ilk se�enek olan metronidazol ve vankomisine duyarlı olarak saptanmıştır.
Moksifloksasin direnci C.difficile hipervir�lan suşlarının �nceden belirlenmesinde �nemlidir ve �eşitli �alışmalarda %12-61.8 arasında moksifloksasin direnci bildirilmiştir18-21. �alışmamızda moksifloksasin direnci %4.9 olarak tespit edilmiştir. G�receli d�ş�k diren� oranının, hipervir�lan suşların veya hastaneler tarafından bildirilen salgınların az olmasından kaynaklanmaktadır.
Ge�miş yıllarda, d�nya genelinde hipervir�lan (ribotip 027/NAP1/B1 gibi) veya varyant (tcdA-/tcdB+) suşlarla artan sıklıkta salgınlar bildirilmiştir22. Hipervir�lan suşlar binary-toksin �retimi, tcdC geninde delesyonlar ve moksifloksasin direnciyle karakterizedir23. G�n�m�ze kadar �lkemizden bu suşlarla ilgili bildirim yapılmamıştır24,25. T�rkiye'yi de kapsayan 14 Avrupa �lkesinin yer aldığı �ok merkezli �alışmada 354 toksijenik suşun %24.3'�nde varyant genler tespit edilmekle birlikte, varyant genler T�rkiye'den g�nderilen �rneklerde saptanmamıştır. S�z konusu varyant izolatların %17.2'sinde binary-toksin eksprese edilmektedir22. Farklı �alışmalarda binary-toksin �reten C.difficile suşlarının prevalansı %6-23 arasında bildirilmiştir6,7,20. �alışmamızda sadece bir (%1.6) izolat binary-toksin pozitif bulunmuştur. Bu suş, bug�ne kadar �lkemizde karakterize edilen ilk hipervir�lan suştur. Bu suş, Haziran 2013'te Tokat'ta �zel bir klinikte prostat operasyonunu takiben kronik ishal yakınmasıyla başvuran 85 yaşında erkek hastadan izole edilmiştir. Siprofloksasin ve metronidazol başlanan hastaya, ishalin k�t�leşmesi ve dışkıda kan varlığı nedeniyle kolonoskopi uygulanmış ve dışkı �rneği C.difficile toksin değerlendirimi a�ısından DLG'ye g�nderilmiştir. Kolonoskopide, kolonda �lserasyonlar g�zlenmesiyle hastanın tedavisine vankomisin eklenmiştir. Hasta herhangi bir komplikasyon g�zlenmeksizin iyileşerek taburcu edilmiştir. Bu suşun metronidazol i�in MİK değeri 0.25 mg/l olup, metronidazole duyarlı bir izolattır ancak tedavi sırasında klinik tablonun ağırlaşması, kombine antibiyotik kullanımının etkisiyle ve/veya in vivo ortamdaki farmakokinetik etkileşimlerle a�ıklanabilir.
tcdC genindeki �eşitli mutasyonlar genin inaktivasyonuna bağlı olarak artan toksin ekspresyonuna yol a�maktadır. Bu suşlarla olan enfeksiyonlar ağır seyreder ve salgın yapma potansiyeli vardır. Bildirilen mutasyonlar;� tek n�kleotit polimorfizmleri, 18-, 39- veya 54-baz �iftlik delesyonlar, premat�r stop kodonu oluşumu, trunkasyon veya �er�eve kayması mutasyonlardır7,26. İzolatlarımızdan birinde 54-baz �iftlik delesyon saptanmış olup 105-122. aminoasitleri kodlayan 313-366. n�kleotitlerin trunkasyonuyla sonu�lanmıştır. Bu izolat ayrıca 378. pozisyonda sessiz bir mutasyona sahiptir (Guanin→Adenin değişikliği). Benzer şekilde, 54-baz �iftlik bir delesyon daha y�ksek sıklıkta (57 toksijenik izolatın %10.5'inde) g�r�lerek daha �nceki bir �alışmada bildirilmiştir26. İzolatlarımızda en sık tespit edilen mutasyon, �nceki �alışmalarda da bildirilen G148T değişikliği olup, bu durum Alanin→Serin değişikliğine neden olmaktadır (n= 10, %16.4)27. Saptanan diğer iki n�kleotit değişiminden T150C (n= 1, %1.6), kodlanan aminoasitte değişikliğe neden olmazken C414A (n= 1, %1.6), Asparajin→Glutamin değişimine neden olmaktadır.
Farklı �lkelerde C.difficile izolatları arasında hipervir�lan suşların sıklığı değişkenlik g�stermektedir ve ribotip 027 i�in sıklık %6-100 arasında değişmektedir22,28,29. Hipervir�lan suşların oluşturduğu nozokomiyal CDE'de mortalite oranları daha y�ksektir. �rneğin;� 30 g�nl�k mortalite binary-toksin negatif suşlarda %17 iken, binary-toksin pozitif suşlarda %28 olarak g�r�lmektedir. Yaş, cinsiyet ve coğrafi dağılım ele alındığında tahmini r�latif mortalite riski binary-toksin eksprese eden hipervir�lan suşlar i�in %60 d�zeyinde olmaktadır30. Binary-toksin pozitif olan izolatımız tcdC geninde 54 baz �iftlik delesyona sahip ribotip 027 dışı hipervir�lan bir suş olup moksifloksasine duyarlı olarak saptanmıştır.
Bu �alışmanın kısıtlılıkları, değerlendirilen suş sayısının nispeten az olması ve suşların genetik karakterizasyonu i�in ribotipleme yapılamamış olmasıdır. Suşların genetik yakınlıklarının ve ribotiplerinin tanımlanması epidemiyolojik olarak verileri daha ayrıntılı değerlendirmemizi sağlayabilirdi.
�alışmamız kapsamındaki izolatlar antibiyotikler i�in hen�z d�ş�k diren� oranlarıyla karakterize olup t�m� metronidazol ve vankomisine duyarlı olarak bulunmuştur. İzolatlar arasında hipervir�lan bir suşun tespiti �alışmanın �nemli bir bulgusudur. �lkemizdeki hipervir�lan suşların ger�ek prevalansı ve �zelliklerini ortaya �ıkarmak i�in k�lt�r ve molek�ler analizler ger�ekleştirilmeli ve suşların ribotipleri saptanmalıdır. Hipervir�lan suşlara �lkemizde nadir olarak rastlanması, hen�z bu genotipteki bakterilerin �lkemizde salgın oluşturmaması, olası salgınların rapor edilememesiyle a�ıklanabileceği gibi, CDE tanısının sıklıkla dışkıda toksin varlığının g�sterilmesiyle konması ve k�lt�rle suşların izolasyonunu takiben fenotipik ve genotipik karakterizasyonlarının yapılmamasıyla da a�ıklanabilir.
TEŞEKK�R
A�TF İbn-i Sina Hastanesi Merkez Laboratuvarı, H�TF Hastanesi Merkez Laboratuvarı ve Ankara DLG personeline dışkı �rneklerinin temininde g�sterdikleri yardımlardan dolayı teşekk�r ederiz.
KAYNAKLAR
- Abt MC, McKenney PT, Pamer EG. Clostridium difficile colitis: pathogenesis and host defence. Nat Rev Microbiol 2016; 14(10): 609-20.
- Kazanowski M, Smolarek S, Kinnarney F, Grzebieniak Z. Clostridium difficile: epidemiology, diagnostic and therapeutic possibilities-a systematic review. Tech Coloproctol 2014; 18(3): 223-32.
- van Dorp SM, Kinross P, Gastmeier P, et al. Standardised surveillance of Clostridium difficile infection in European acute care hospitals: a pilot study, 2013. Euro Surveill 2016; 21(29).
- Simon DB, Mark HW. Antimicrobial resistance and reduced susceptibility in Clostridium difficile: potential consequences for induction, treatment, and recurrence of C.difficile infection. Antibiotics (Basel) 2015; 4(3): 267-98.
- European committee on antimicrobial susceptibility testing (Eucast). Breakpoint tables for interpretation of MICs and zone diameters. Version5.0. 2015. Available at: [http://www.eucast.org]. Accessed: 10.11.2015.
- Clinical and Laboratory Standards Institute (CLSI). Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria M11-A7. 2007, 7th ed. Clinical and Laboratory Standards Institute, Wayne, PA.
- Pinto LJ, Alcides AP, Ferreira EO, et al. Incidence and importance of Clostridium difficile in paediatric diarrhoea in Brazil. J Med Microbiol 2003; 52(Pt 12): 1095-9.
- van den Berg RJ, Claas EC, Oyib DH, et al. Characterization of toxin A-negative,toxin B-positive Clostridium difficile isolates from outbreaks in different countries by amplified fragment length polymorphism and PCR ribotyping. J Clin Microbiol 2004; 42(3): 1035-41.
- Gon�alves C, Decr� D, Barbut F, Burghoffer B, Petit JC. Prevalence and characterization of a binary toxin (actin-specific ADP-ribosyltransferase) from Clostridium difficile. J Clin Microbiol 2004; 42(5): 1933-9.
- Persson S, Torpdahl M, Olsen KE. New multiplex PCR method for the detection of Clostridium difficile toxin A (tcdA) and toxin B (tcdB) and the binary toxin (cdtA/cdtB) genes applied to a Danish strain collection. Clin Microbiol Infect 2008; 14(11): 1057-64.
- Brown KA, Khanafer N, Daneman N, Fisman DN. Meta-analysis of antibiotics and the risk of community-associated Clostridium difficile infection. Antimicrob Agents Chemother 2013; 57(5): 2326-32.
- Huang H, Weintraub A, Fang H, Nord CE. Antimicrobial resistance in Clostridium difficile. Int J Antimicrob Agents 2009; 34(6): 516-22.
- Bishara J, Bloch Y, Garty M, Behor J, Samra Z. Antimicrobial resistance of Clostridium difficile isolates in a tertiary medical center, Israel. Diagn Microbiol Infect Dis 2006; 54(2): 141-4.
- Pel�ez T, Alcal� L, Alonso Ret alRodr�guez-Cr�ixems M, Garc�a-Lechuz JM, Bouza E. Reassessment of Clostridium difficile susceptibility to metronidazole and vancomycin. Antimicrob Agents Chemother 2002; 46(6): 1647-50.
- Dworczynski A, Sokol B, Meisel-Mikolajczyk F. Antibiotic resistance of Clostridium difficile isolates. Cytobios 1991; 65(262-263): 149-53.
- Wong SS, Woo PC, Luk WK, Yuen KY. Susceptibility testing of Clostridium difficile against metronidazole and vancomycin by disk diffusion and Etest. Diagn Microbiol Infect Dis 1999; 34(1): 1-6.
- Mutlu E, Wroe AJ, Sanchez-Hurtado K, Brazier JS, Poxton IR. Molecular characterization and antimicrobial susceptibility patterns of Clostridium difficile strains isolated from hospitals in south-east Scotland. J Med Microbiol 2007; 56(Pt 7): 921-9.
- Ackermann G, Degner A, Cohen SH, Silva J Jr, Rodloff AC. Prevalence and association of macrolide�lincosamide� streptogramin B (MLSB) resistance with resistance to moxifloxacin in Clostridium difficile. J Antimicrob Chemother 2003; 51(3): 599-603.
- Spigaglia P, Barbanti F, Mastrantonio P; European Study Group on Clostridium difficile (ESGCD). Multidrug resistance in European Clostridium difficile clinical isolates. J Antimicrob Chemother 2011; 66(10): 2227-34.
- Kim H, Jeong SH, Roh KH, et al. Investigation of toxin gene diversity. molecular epidemiology and antimicrobial resistance of Clostridium difficile isolated from 12 hospitals in South Korea. Korean J Lab Med 2010; 30(5): 491-7.
- Huang H, Weintraub A, Fang H, Wu S, Zhang Y, Nord CE. Antimicrobial susceptibility and heteroresistance in Chinese Clostridium difficile strains. Anaerobe 2010; 16(6): 633-5.
- Barbut F, Mastrantonio P, Delm�e M, Brazier J, Kuijper E, Poxton I ; European Study Group on Clostridium difficile (ESGCD). Prospective study of Clostridium difficile infections in Europe with phenotypic and genotypic characterisation of the isolates. Clin Microbiol Infect 2007; 13(11): 1048-57.
- Harvala H, Alm E, Akerlund T, Rizzardi K. Emergence and spread of moxifloxacin-resistant Clostridium difficile ribotype 231 in Sweden between 2006 and 2015. New Microbe and New Infect 2016; 14: 58-66.
- Ergen EK, Akalin H, Yilmaz E, et al. Nosocomial diarrhea and Clostridium difficile associated diarrhea in a turkish university hospital. Med Mal Infect 2009; 39(6): 382-7.
- Deniz U, Ulger N, Aksu B, Karavuş M, S�yletir G. Investigation of toxin genes of Clostridium difficile strains isolated from hospitalized patients with diarrhoea at Marmara University Hospital. Mikrobiyol Bul 2011; 45(1): 1-10.
- Bouvet PJ, Popoff MR. Genetic relatedness of Clostridium difficile isolates from various origins determined by triple-locus sequence analysis based on toxin regulatory genes tcdC, tcdR, and cdtR. J Clin Microbiol 2008; 46(11): 3703-13.
- Curry SR, Marsh JW, Muto CA, O'Leary MM, Pasculle W, Harrison LH. tcdC genotypes associated with severe tcdC truncation in an epidemic clone and other strains of Clostridium difficile. J Clin Microbiol 2007; 45(1): 215-21.
- Kuijper EJ, Coignard B, Brazier JS, et al. Update of Clostridium difficile associated disease due to PCR ribotype 027 in Europe. Euro Surveill 2007; 12(6): E1-2.
- MacCannell DR, Louie TJ, Gregson DB, et al. Molecular analysis of Clostridium difficile PCR ribotype 027 isolates from eastern and western Canada. J Clin Microbiol 2006; 44(6): 2147-52.
- Bacci S, Molbak K, Kjeldsen MK, Olsen KE. Binary toxin and death after Clostridium difficile infection. Emerg Infect Dis 2011; 17(6): 976-82.
İletişim (Correspondence):
Uzm. Dr. Emrah Salman,
�ukurova �niversitesi Tıp Fak�ltesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Tıbbi İmm�noloji Bilim Dalı,
Adana, T�rkiye.
Tel (Phone): +90 322 338 3480,
E-posta (E-mail): esalman@cu.edu.tr