Anti-dense Fine Speckled 70/lens Epithelium Derived Growth Factor p75 Otoantikorunun
Otoimm�n Hastalıklarda Klinik Tanıya Katkısının Araştırılması
Investigation of the Diagnostic Value of Anti-dense Fine Speckled 70/lens Epithelium
Derived Growth Factor p75 Autoantibody for Autoimmune Diseases
Gamze T�RKOĞLU1, Rukiye BERKEM2, Ayşe Esra KARAKO�2
1 Malatya Eğitim ve Araştırma Hastanesi, Tıbbi Mikrobiyoloji Kliniği, Malatya.
1 Malatya Training and Research Hospital, Clinic of Medical Microbiology, Malatya, Turkey.
2 Ankara Eğitim ve Araştırma Hastanesi, Tıbbi Mikrobiyoloji Kliniği, Ankara.
2 Ankara Training and Research Hospital, Clinic of Medical Microbiology, Ankara, Turkey.
�Z
Antin�kleer antikor (ANA), h�cre n�kleusu ve/veya sitoplazmasındaki n�kleer antijenlere karşı gelişen otoantikorlar olup sistemik otoimm�n romatizmal hastalıklar (SORH) i�in �nemli tanı kriterleri arasında yer alır. G�n�m�zde, ANA'ların saptanması amacıyla geliştirilmiş bir�ok y�ntem bulunmaktadır. Ancak, en eski y�ntem olarak bilinen indirekt imm�nofloresan (IIF) tekniği, halen en yaygın kullanılan y�ntemdir. Anti-dense fine speckled 70/lens epithelium derived growth factor p75 (anti-DFS70/LEDGF p75) otoantikoru genellikle HEp-2 (insan larenks karsinoma) h�crelerinin kullanıldığı IIF y�ntemiyle saptanabilmektedir. Dense fine speckled (DFS) paterni diğer ANA'lar ile birlikte bulunduğunda IIF y�nteminde maskelenebilmekte ve g�zden ka�abilmektedir. Anti-DFS70 otoantikoru SORH olanlarda sağlıklı bireylere g�re daha d�ş�k sıklıkta g�r�lmektedir. Ayrıca, bu antikorlar farklı kronik enflamatuvar durumlarda da (interstisyel sistit, kronik yorgunluk sendromu, atopik dermatit, Vogt-Koyanagi-Harada sendromu) ortaya �ıkabilmektedir. Bu �alışmada, IIF y�nteminde DFS boyanma paterni g�steren ve g�stermeyen hasta serumlarında imm�nblot (IB) y�ntemi ile anti-DFS70 antikorunun sıklığını saptamak ve bu antikorun SORH tanısının konulmasında ANA test istemi algoritmalarında yer almasının klinik tanıya katkısının araştırılması ama�lanmıştır. �alışmada IIF y�ntemi ile DFS paterni g�r�len 60 ve DFS dışı ANA paternleri g�r�len 67 hasta serumunda IB y�ntemi ile anti-DFS70 otoantikoru araştırılmıştır. IIF-DFS paterni pozitif bulunan 60 hasta serumunun 55 (%91.6)'inde IB y�ntemi ile anti-DFS70 pozitif bulunurken, IIF'de DFS dışı paternlerin g�r�ld�ğ� 67 hasta serumunun 3 (%4.5)'�nde anti-DFS70 pozitif bulunmuştur. IIF-DFS paterni/anti-DFS70 birlikte pozitif bulunan 55 hastanın 6 (%11)'sının SORH tanısı olup IB ile DFS dışı diğer ANA'lar negatif bulunmuştur. DFS dışı diğer ANA paternlerinin g�r�ld�ğ� grupta ise SORH tanısı almış olan 22 hastanın hi�birinde IB y�ntemi ile anti-DFS70 pozitifliği bulunmamıştır. IIF-DFS paterni pozitif olan gruptaki 16 (%26.6) �rnek romatoloji ve fizik tedavi ve rehabilitasyon (FTR) kliniklerinden gelirken, DFS dışı diğer paternlerin g�r�ld�ğ� grupta bu sayı 32 (%47.7) olarak bulunmuştur. DFS paterni ise diğer kliniklerden gelen �rneklerde, romatoloji ve FTR kliniklerinden gelen �rneklere g�re anlamlı olarak daha sık saptanmıştır (p= 0.018). Bu �alışmada, IIF y�ntemi ile DFS paterninin uzmanlar tarafından tanımlanabileceği, d�ş�k titrelerdeki homojen benzeri ve miks paternlerle karışabildiğinden anti-DFS70 otoantikorunu saptayabilecek iyi valide edilmiş imm�nolojik ikinci bir teste ihtiya� olduğu kanısına varılmıştır.
Anahtar s�zc�kler: Anti-DFS70; DFS paterni; ANA; otoimm�n hastalık.
ABSTRACT
Antinuclear antibodies (ANA) are the autoantibodies that are produced against nuclear antigens in the cell nucleus and/or cytoplasm, and are one of the important diagnostic criteria in systemic autoimmune rheumatic diseases (SARD). Until today, several methods have been developed for detecting ANA's. However, indirect immunofluorescence (IIF) technique, that is also known as one of the oldest methods, is still the most commonly used one. Typically, anti-dense fine speckled 70/Lens epithelium derived growth factor p75 (anti-DFS70/LEDGF p75) autoantibody can be detected via IIF method where in HEp-2 (human larynx carcinoma) cells are used. The dense fine speckled (DFS) pattern method can be masked and remain unnoticed by the IIF method when it exists with the other ANA. Anti-DFS70 autoantibodies seldomly appear in SARD patients compared to healthy individuals. Moreover, these antibodies may appear in different chronic inflammatory conditions like interstitial cystitis, chronic fatigue syndrome, atopic dermatitis and Vogt-Koyanagi-Harada syndrome. The aim of this study was to determine the frequency of anti-DFS70 autoantibodies by immunblot (IB) method in patients sera with and without DFS70 staining pattern by IIF and to determine if the presence of anti-DFS70 has a clinical impact when included in ANA testing algorithm. In our study, a total of 60 patients' sera in which DFS pattern was defined by IIF method and 67 patients' sera in which other patterns observed were included in the study and anti-DFS70 autoantibody was investigated by IB method in these sera. In 67 patient samples which have shown the other patterns three (4.5%) samples were determined to be anti-DFS70 positive by IB. In 55 patients who were determined to have IIF-DFS pattern (+)/IB anti-DFS70 (+), 6 (11%) were diagnosed as SARD and the other antinuclear antibodies (ANA) were found as negative by IB. In the other group with the other ANA patterns detected, none of the SARD-diagnosed 22 patients had shown anti-DFS70 by IB method. Sixteen (26.6%) samples in the group that was positive for the IIF-DFS pattern were obtained from rheumatology and physical therapy and rehabilitation clinics, 32 (47.7%) samples were from the group in which other patterns� observed� and were also obtained from those clinics. DFS pattern was detected significantly more frequent in the samples from other clinics in comparison to the samples from rheumatology and physical therapy and rehabilitation clinics (p= 0.018). In our study, it was� concluded that DFS pattern can be defined by IIF method by only specialists, however, since homogeneous-like and mixed patterns can be confused especially in low titers, there is a need for a second well-validated immunological test that could detect anti-DFS70 auto-antibody.
Keywords: Anti-DFS70; DFS pattern; ANA; autoimmune disease.
Geliş Tarihi (Received): 17.05.2018 - Kabul Ediliş Tarihi (Accepted): 14.09.2018
GİRİŞ
Antin�kleer antikor (ANA), h�cre �ekirdeğindeki n�kleer bileşenleri hedef alan heterojen antikorların en yaygın g�r�lenleri arasında yer almaktadır. Sistemik otoimm�n romatizmal hastalıkların (SORH) tanısında ve sınıflandırmasında �nemli bir yardımcı kriter olduğu kanıtlanmıştır1,2. Bu antikorlar enfeksiyon hastalıkları, kanser, tiroid, romatizmal olmayan hastalıklar ile �zellikle 40 yaş �st� kadınlar olmak �zere sağlıklı bireyler ve yaşlılarda serumda saptanabilmektedir3.
ANA saptanmasında altın standart olarak �nerilen y�ntem HEp-2 h�crelerinin substrat olarak kullanıldığı imm�nofloresan (IIF) y�ntemidir4. Pozitif ANA test sonu�ları, 150 farklı n�kleer antijene karşı oluşmuş serum antikorlarının etkileşimini g�sterebilmektedir. Bu antikorlardan sadece bazıları �ok iyi tanımlanmış ve hastalıklarla ilişkilendirilmiş olup, diğer antijen antikor reaksiyonları klinik olarak anlam ifade etmeyebilmektedir5. T�m toplumlarda yaygın g�zlenen bir ANA boyanma modeli, interfazdaki h�cre n�kleoplazmasının yoğun ince benekli şekilde boyanıp n�kleolusların boyanmaması ve b�l�nen h�crelerin kromozomlarının da aynı şekilde daha parlak olarak boyanması şeklinde olmaktadır6. Bu boyanmaya neden olan oton�kleer antijenler imm�nblot (IB) testinde yaklaşık 70 kDa'luk b�y�kl�kte bir reaksiyon vermekte olup, bu bant Ochs ve arkadaşları tarafından DFS70 olarak adlandırılmıştır. Protein sekans veri taban analizi aynı zamanda DFS70 n�kleer antijeninin, transkripsiyon koaktivat�r p75 ve lens kaynaklı epitel b�y�me fakt�r� (LEDGFp75) adı verilen bir protein olduğunu ortaya koymuştur7,8.
Anti-DFS70 otoantikorunun, diğer otoantikorlara g�re daha sık ve y�ksek titrelerde saptanması, herhangi bir hastalığa �zg�l olmaması, sistemik otoimm�n romatizmal hastalıklar dışındaki bazı enflamatuvar durumlarda ve sağlıklı bireylerde de bulunabilmesinden dolayı klinik ve biyolojik �nemi tam olarak anlaşılamamıştır. Bu otoantikor SORH tanısı olanlarda �ok d�ş�k sıklıkta bulunmakta olup, sağlıklı g�r�nen bireylerde bunlara g�re daha sık g�r�lmektedir9. DFS70 antijenine karşı oluşan otoantikorlar birka� farklı kronik enflamatuvar hastalıkta interstisyel sistit, kronik yorgunluk sendromu, atopik dermatit� gibi durumlarda da ortaya �ıkabilmektedir10.
IIF y�nteminde HEp-2 h�crelerinin mikroskobik değerlendirilmesi yorumlayan kişinin bilgi ve deneyimine bağlıdır, bu nedenle laboratuvar i�i ve laboratuvarlar arası sonu�lar farklı olabilmektedir. Bu konuda uzman olmayan bir kişi tarafından yorumlandığında anti-DFS70/LEDGF p75 otoantikorunu diğer n�kleer otoantikorlardan ayırt etmek zor olabilmekte ve DFS paterni, diğer ANA paternleriyle karışabilmektedir. DFS paterninin ve diğer ANA paternlerinden ayırt edilememesi, antikor pozitif bireylerde tekrarlayan negatif sonu�ların alınmasına ve doğru olmayan SORH tanılarına yol a�abilmektedir. Bu nedenle, araştırmacılarda anti-DFS70/LEDGF p75 otoantikorunun saptanması i�in tek bir ANA test y�nteminin yeterli olmadığı konusunda artan fikir birliği bulunmaktadır9.
Bu �alışmada, IIF y�ntemi ile DFS paterninin g�r�ld�ğ� hasta serumlarında anti-DFS70 otoantikorunun İB y�ntemi ile doğrulanması ve bu otoantikorun SORH tanısında klinik tanıya katkısının olup olmadığının g�sterilmesi ama�lanmıştır.
GERE� ve Y�NTEM
Klinik Olarak Tanımlanmış �rnekler
Kasım 2015-Şubat 2016 tarihleri arasında laboratuvarımıza farklı kliniklerden gelen, Hep-20-10 h�crelerinde IIF y�ntemiyle tanımlanan, 1/100 ve daha y�ksek titrede DFS paternine sahip 60 hasta serumu ve diğer ANA paternlerine sahip 67 hasta serumu �alışmaya dahil edildi. IIF ile değerlendirilen 127 hasta serumunda IB y�ntemiyle anti-DFS70 antikoru ve diğer n�kleer antikorlar araştırıldı. Hastaların SORH tanıları ve klinik verileri hasta kayıtları incelenerek tespit edildi.
İndirekt İmm�nofloresan (IIF) Y�ntemi
IIF y�nteminde, IIFT Mosaic: Hep-20-10/Liver (Monkey) Kiti ve FITC işaretli anti-insan IgG (Euroimmun, Almanya) kullanıldı. �retici firmanın �nerdiği 1/100 başlangı� dil�syonu ile tarama yapıldı. Tarama dil�syonunda g�r�nt�n�n parlaklığına g�re sonu�lar zayıf pozitif (1/100) ve +4 (> 1/3200) arasında kalitatif olarak EUROStar III plus marka floresan mikroskobu ile x40 b�y�tmede değerlendirildi. Değerlendirme, bu konuda uzman iki ayrı kişi tarafından birbirinden bağımsız olarak aynı g�n, farklı zamanlarda yapıldı. Uyumsuz sonu�lar tekrar değerlendirilerek ortak karar alındı.
İmm�nblot Y�ntemi
�alışmaya dahil edilen 127 hasta serumuna, nitrosel�loz membran �zerinde paralel �izgiler halinde sıralanmış ve kontrol bandı ile birlikte rekombinant ve y�ksek oranda saflaştırılmış nRNP/Sm, Sm, SSA, Ro-52, SSB, Scl-70, PM-Scl, Jo-1, CENP-B, PCNA, dsDNA, nucleosomes, histones, ribosomal protein-P, AMA-M2 ve DFS70 (eksprese insan cDNA) antijenleri ile kaplanmış; ANA Profile 3plus DFS70 DL 1590-1601-30 G kiti (Euroimm�n/Almanya) kullanılarak n�kleer antijen tip tayini yapıldı. IIF y�ntemi ile uyumsuz bulunan sonu�larda, hasta �rnekleri eş zamanlı olarak her iki y�ntem ile tekrar �alışıldı ve değerlendirildi.�
İstatistiksel Analiz
Verilerin değerlendirilmesinde; tanımlayıcı istatistiklerden sayısal �l��mler i�in ortalama � standart sapma, ortanca değerleri ile niteliksel �l��mler i�in sayı ve y�zdeler kullanıldı. IIF paterni gruplarında yaş dağılımının normal dağılım g�sterip g�stermediği Shapiro Wilk testi ile test edildi. Test sonucunda yaşların normal dağılım g�stermediği g�r�ld�. Dolayısıyla iki grupta yaş karşılaştırmaları Mann-Whitney U testi ile yapıldı. IIF paterni gruplarında cinsiyet, poliklinik/klinik, tanı, IB y�nteminde anti-DFS70 pozitifliği gibi niteliksel �l��mlerin karşılaştırılmasında �apraz tablo analizlerinden ve ki-kare analizinden yararlanıldı. IIF y�ntemindeki floresan şiddeti ile IB y�ntemi ile saptanan anti-DFS70 sinyal eşik değeri arasındaki korelasyona ise parametrik olmayan Spearman korelasyon katsayısı ile bakıldı. İstatistiksel �nemlilik i�in p< 0.05 ise anlamlı kabul edildi ve istatistiksel analizlerin t�m�nde IBM-SPSS 21.0 for Windows paket programı kullanıldı.
BULGULAR
IIF y�ntemi ile DFS paterni g�r�len grupta yer alan 60 hastanın 45 (%75)'i kadın, 15 (%25)'i erkek olarak tespit edilmiştir (p= 0.01) (Tablo I). Hastaların yaş aralığı 5-77 arasında olup, yaş ortalaması 34.2 � 18.4 yıl olarak saptanmıştır. DFS paterni g�r�len gruptaki hastaların yaşlarının daha �ok ikinci ve ���nc� dekatlar arasında olduğu saptanmıştır (p= 0.04) (Tablo II).
Serum �rnekleri romatoloji, fizik tedavi ve rehabilitasyon (FTR), dermatoloji, �ocuk sağlığı ve hastalıkları, genel dahiliye, g�z hastalıkları, gastroenteroloji, ortopedi, n�roloji, hematoloji, nefroloji, endokrinoloji, aile hekimliği ve diğer klinikler (plastik cerrahi, enfeksiyon hastalıkları,� �ocuk allerji ve imm�noloji, acil servis) olmak �zere farklı klinik ve polikliniklerden toplanmıştır (Tablo III). DFS paterni g�r�len gruptaki hasta serumlarının 16 (%26.6)'sı romatoloji (n= 14) ve FTR (n= 2) kliniklerinden gelmiştir. DFS dışı diğer paternlerin g�r�ld�ğ� grupta bu sayı 32 (%47.7) olarak belirlenmiştir. DFS paterni diğer kliniklerden gelen �rneklerde, romatoloji ve FTR kliniklerinden gelen �rneklere g�re daha sık saptanmıştır (p= 0.018). DFS paterni g�r�len hasta serumlarının en sık dermatoloji polikliniğinden (n= 16, %26.7) geldiği g�zlenmiştir.
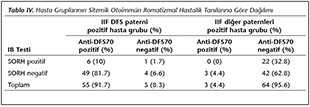
SORH g�r�lme sıklığı, DFS paterni g�r�len hasta grubunda %11.7, diğer paternlerin g�r�ld�ğ� hasta grubunda ise %32.8 olarak bulunmuştur (p= 0.006). DFS paterni g�r�len grupta, SORH tanısı alan hastaların altısında [romatoid artrit (RA) (n= 3); sistemik skleroderma (SSc) (n= 2); Sj�gren sendromu (SS) (n= 1)] anti-DFS70 antikoru pozitif, diğer ANA'lar negatif bulunmuştur. Bir hastada [RA (n= 1)] ise hem anti-DFS70 antikoru hem de diğer ANA'lar negatif bulunmuştur. Diğer paternlerin g�r�ld�ğ� grupta ise SORH tanısı alan 22 hastanın [RA (n= 8); SS (n= 10); SSc (n= 2); ilaca bağlı sistemik lupus eritematozus (SLE) (n= 1); primer biliyer siroz (n= 1)] hi�birinde anti-DFS70 antikoru pozitif bulunmamıştır (Tablo IV).
IIF y�nteminde DFS paterni g�r�len hasta grubunda 60 hastanın 55 (%91.7)'inde IB y�ntemi ile anti-DFS70 antikoru pozitif saptanırken, diğer ANA paternlerinin g�r�ld�ğ� (gran�ler, n= 25; gran�ler ve homojen, n= 37; homojen, n= 2; n�kleoler ve homojen, n= 1; sentromer, n= 2) 67 hastanın 3 (%4.5)'�nde anti-DFS70 antikoru pozitif saptanmıştır (p= 0.0001). IIF y�nteminde DFS paterni (+)/Anti-DFS70 (-) olan beş hastadan d�rd�n�n floresan şiddeti zayıf pozitif, bir hastanın ise bir pozitif şiddetinde saptanırken, IIF DFS dışı paternler/anti-DFS70 pozitif olan �� hastada ise bir pozitif gran�ler ve n�kleer homojen boyanma paterni bulunmuştur (Tablo V, VI).
DFS paterninin g�r�ld�ğ� grupta anti-DFS70 pozitifliği saptanan 55 hastada herhangi bir başka antikor pozitifliği saptanmamıştır.
�alışmamızda DFS paterni; IIF y�ntemi ile saptanmaya ve anti-DFS70 antikoruna �zg�l olarak hazırlanmış IB y�ntemi ile doğrulanmaya �alışıldığında; DFS paterninin saptanmasında IIF y�nteminin duyarlılığı %95, �zg�ll�ğ� %93, pozitif prediktif değeri %92, negatif prediktif değeri %95 olarak tespit edilmiştir (Tablo VII).
IIF DFS paterni/anti-DFS70 birlikte pozitif olan hasta serumlarının IIF y�nteminde saptanan floresan şiddeti ve IB y�ntemindeki anti-DFS70 sinyal eşik değeri arasında Spearman rho testiyle yapılan analizde, iki parametre arasında orta d�zeyde uyum saptanmıştır (p= 0.001, rho= 0.49) (Şekil 1).
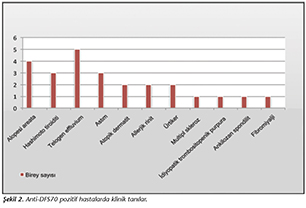
Anti-DFS70 pozitif 58 hastanın klinik tanıları incelediğinde; 5 (%8.6)'inde telogen effluvium, 4 (%6.9)'�nde alopesi areata, 3 (%5.2)'er hastada Hashimoto tiroiditi ve astım, 2 (%3.4)'şer hastada atopik dermatit, allerjik rinit ve �rtiker, 1 (%1.7)'er hastada multipl skleroz, idiyopatik trombositopenik purpura, ankilozan spondilit ve fibromiyalji saptanmıştır (Şekil 2).
TARTIŞMA
Anti-DFS70 otoantikoru, SORH tanısı olan hastalarda saptandığında genellikle diğer SORH'lere spesifik otoantikorlar ile birlikte bulunmaktadır. Ancak, bu boyanma paterni tek başına saptanması durumunda SORH tanısını ekarte edebileceği bildirilmektedir. Bu da anti-DFS70 otoantikorunun SORH tanısını ekarte etmede yararlı bir biyobelirte� olarak kullanılabileceğini ve geliştirilen algoritmalarda yer almasının klinik yararının olabileceğini d�ş�nd�rmektedir9.
Miyara ve arkadaşlarının11 yaptıkları bir �alışmada IIF y�nteminde DFS paternine sahip 100 hastanın 12'si SORH tanısı alırken, diğer paternlerin g�r�ld�ğ� grupta 100 hastanın 58'i bu tanıyı almıştır. Lee ve arkadaşları12 IIF y�nteminde DFS paterni g�steren 181 hasta ve kontrol grup olarak da diğer paternlerin g�r�ld�ğ� 50 hasta olmak �zere toplamda 231 hastanın klinik verilerini inceleyerek 60 hastada ANA ilişkili romatizmal hastalık saptamışlar ve bu hastaların sadece 4 (%6.7)'�nde ELISA y�ntemi ile anti-DFS70 antikorunu pozitif, diğer ANA'ları negatif bulmuşlardır. Bizzaro ve arkadaşları13 da otoimm�n hastalığa sahip 50 hastada [SLE (n= 10), skleroderma (n= 10), SS (n= 10), polimiyozit (n= 10) ve ANA negatif Hashimoto tiroiditi (n= 10)] anti-DFS70 antikorunu g�stermek amacıyla CIA y�ntemini kullanmışlar ve pozitif sonu� tespit etmemişlerdir. SLE tanısı konmuş 251 hasta ile yapılan bir �alışmada anti-DFS70 antikor sıklığı %2.8, 124 bireyden oluşan sağlıklı grupta ise %8.9 olarak bildirilmiştir14. Mariz ve arkadaşları15 DFS paternini IIF y�ntemi ile araştırmışlar ve 918 sağlıklı bireyin 39 (%4.2)'unda pozitif sonu� bulurken, 153 SORH tanısı olan hastanın ise hi�birinde pozitif sonu� bulmamıştır. �alışmamızda, DFS paterni g�steren 60 hastanın 7 (%11.7)'si SORH tanısı alırken, diğer paternlerin g�r�ld�ğ� grupta 67 hastanın 22 (%32.8)'si SORH [RA (n= 8); SS (n= 10); SSc (n= 2); PBS (n= 1); ilaca bağlı SLE (n= 1)] SORH tanısı almıştır. Diğer bir deyişle SORH tanılı 29 hastanın 6 (%20.7)‘sında anti-DFS70 antikoru pozitif olarak g�zlenirken, diğer ANA'lar negatif olarak saptanmıştır. �alışmamızda anti-DFS70 antikorunun pozitif saptanma sıklığının diğer �alışmalara g�re y�ksek olmasının nedeni klinisyenlerce DFS paterninin yeterince anlaşılamaması nedeniyle, ANA pozitif sonu�ların gereksiz endişeye yol a�ması ve hatalı SORH tanılarının ortaya �ıkması şeklinde yorumlanabilir.
�Literat�rde, anti-DFS70 antikorunun daha �ok gen�lerde g�r�ld�ğ� saptanmış olup, sebebinin DFS70 antijeninin timus dokusunda diğer dokulara g�re daha fazla eksprese edilmesi; ileri yaşla beraber g�r�lme sıklığının azalmasının ise timus dokusunun yıllar i�inde atrofiye uğramasından kaynaklanabileceği bildirilmiştir7,16. Watanabe ve arkadaşları16 anti-DFS70 antikoru pozitif 64 hastada, yaş ortalamasını kadınlarda 28 � 6, erkeklerde 30 � 5 olarak bulmuşlardır. Okamato ve arkadaşları17 da anti-DFS70 antikoru pozitif saptanan 22 alopesi hastasının 11 (%50)'inin, sekiz sağlıklı bireyin de 6 (%75)'sının yaş ortalamasının ikinci ve ���nc� dekatlar arasında olduğunu saptamışlardır. �alışmamızda da anti-DFS70 antikor pozitifliği ikinci ve ���nc� dekatlar arasında ve kadınlarda daha sık bulunmuştur.
IIF y�ntemi ile HEp-2 h�crelerinde DFS paterni saptanabilmesine rağmen, doğru şekilde tanımlayabilmek kolay değildir18. Bizzarro ve arkadaşları19 IIF y�nteminde DFS paterni g�steren orta ve y�ksek titrelerdeki hasta serum �rneklerinin, %86'sının DFS70 antijenine �zg�l ELISA y�ntemiyle tanımlanmasında başarısızlık olduğuna dikkat �ekmişlerdir. Bu �rneklerin analizinde farklı ticari kitlerin kullanılması HEp-2 slaytlarında tutarsız sonu�lara neden olmuştur. Araştırmacılar tutarsız sonu�ları farklı HEp-2 substratlarının hazırlanmasına, ELISA y�nteminde DFS70/LEDGF p75 epitop tipine ve IIF y�nteminde DFS paterninin deneyimsiz kişiler tarafından yorumlanmasına bağlamışlardır18. Mahler ve arkadaşları14 �alışmalarında anti-DFS70 pozitif saptanan yedi SLE hastasının altısında daha �nce tanımlanandan farklı tipte bir DFS boyanma paterni g�rd�klerini bildirilmişlerdir. Tutarsız sonu�larla ilgili diğer bir� sebep ise IIF y�nteminde DFS paterni g�sterebilen DFS70/LEDGF p75'ten farklı bir n�kleer otoantijenin varlığının olmasıdır. DFS70/LEDGF p75 transkripsiyon d�zenlenmesi ile ilişkili n�kleoprotein kompleksinin bir par�asıdır. IIF y�nteminde DFS70/LEDGF p75'in, DFS paternine benzer bir patern oluşturabilen proteinlerle etkileşim i�inde olup onlarla bir arada bulunduğu saptanmıştır18,20,21. Bizzaro ve arkadaşları22 yaptıkları başka bir �alışmada da DFS paterni g�steren 576 hastanın 175 (%30.4)'inde anti-DFS70 antikorunu CIA y�ntemiyle pozitif bulmuşlar ve daha spesifik bir y�ntem olan CIA y�ntemi kullanıldığında serumların yalnızca bir kısmının pozitif olduğunu, IIF y�nteminde ise DFS paterninin yeterince doğru olarak tanımlanamadığını belirtmişlerdir. DFS paterninin IIF y�nteminde yeterince doğru tanımlanamamasının, kişilerin yorumları arasındaki değişkenlik, laboratuvar personelinin DFS paternini tanımadaki yetersizliği ve HEp-2 h�crelerinde kullanılan �eşitli substratların farklı duyarlılıklarda olmasından kaynaklandığını belirtmişlerdir13,22.
IIF y�nteminde DFS paterninin klinik laboratuvarlarda �nceleri tanınıp tanınmadığı net değildir18,23. DFS paterninin homojen benzeri paternlerden ayrımı rutin laboratuvarları zorlamaktadır18,24. �alışmamızda IIF y�nteminde DFS paterni g�steren 60 hastanın 55 (%91.6)'inde, diğer paternleri g�steren 67 hastanın ise 3 (%4.5)'�nde IB y�ntemi ile anti-DFS70 antikorunu pozitif bulunmuştur. IIF y�ntemindeki DFS paterni floresan şiddeti ve IB testindeki anti-DFS70 sinyal eşik değeri arasında orta d�zeyde uyum saptanmıştır (rho= 0.49, p< 0.001). IIF y�nteminde, d�ş�k titrelerdeki DFS paterni ve metafazdaki kromatin bantlarını değerlendirmenin g�� olduğu tespit edilmiştir. DFS'deki kromatin bantlarının homojen benzeri patern ve mikst boyanma (gran�ler ve homojen) paternlerindeki kromatin bantlarından ayrımının zor olduğu; anti-DFS70 negatif bulunan d�rt hastanın kromatin bantlarının floresan şiddeti zayıf olduğu i�in değerlendirme hatası olabileceği d�ş�n�lm�şt�r. Diğer paternlerin g�r�ld�ğ� grupta ise anti-DFS70 antikoru pozitifliği saptanan �� hastada bir pozitif şiddetinde gran�ler ve n�kleer homojen boyanma paterni g�zlenmiş olup mikst boyanma paterni g�r�lmesinin DFS paternini maskelemiş olabileceği, �zellikle d�ş�k titrelerdeki pozitifliklerin değerlendirilmesinin daha zor olması nedeniyle ANA patern tanımlama hatalarına yol a�abileceği kanısına varılmıştır. Yapılan �alışmalar bizim bulgularımızı destekleyici y�nde olup, anti-DFS70 antikorunun doğru şekilde tanımlanmasında, IIF y�ntemine ek olarak IB, CIA veya ELISA y�ntemlerinden herhangi birisinin kullanılarak doğrulama yapılması ve testlerin konunun uzmanları tarafından yorumlanması �nerilmektedir18,25.
Sonu� olarak, doğru tanımlama i�in hastalarda tek bir ANA test y�ntemi kullanılmamalı; bu antikorların doğrulanmasında tanı algoritmasına iyi valide edilmiş daha spesifik ikinci bir imm�nolojik test eklenmelidir. IIF y�nteminde DFS paterni diğer ANA'larla birlikte bulunduğunda, d�ş�k titrelerdeki pozitiflikler tanımlanamamakta ve g�zden ka�abilmektedir. Anti-DFS70 pozitifliği diğer ANA'larla birlikte bulunduğunda hastanın klinik bulguları ile birlikte değerlendirilmeli, klinik tanı ve takibinin planlanmasında laboratuvar ile iletişim i�inde bulunulması �nerilmelidir.
KAYNAKLAR
- Suurmond J, Diamond B. Autoantibodies in systemic autoimmune diseases: specificity and pathogenicity. J Clin Invest 2015; 125(6): 2194-202.
- Mahler M, Fritzler MJ. Epitope specificity and significance in systemic autoimmune diseases. Ann N Y Acad Sci 2010; 1183: 267-87.
- Solomon DH, Kavanaugh AJ, Schur PH.� American College of Rheumatology Ad Hoc Committee on Immunologic Testing Guidelines. Evidence-based guidelines for the use of immunologic tests: antinuclear antibody testing. Arthritis Rheum 2002; 47(4): 434-44.
- Bayer BF, Fabian B, H�bl W. Immunofluorescence assays (IFA) and enzyme-linked immunosorbent assays (ELISA) in autoimmune disease diagnostics-technique, benefits, limitations and applications. Scand J Clin Lab Invest Suppl 2001; 235: 68-76.
- Abeles AM, Abeles M. The clinical utility of a positive antinuclear antibody test result. Am J Med 2013; 126(4): 342-8.
- Ganapathy V, Casiano CA. Autoimmunity to the nuclear autoantigen DFS70 (LEDGF): what exactly are the autoantibodies trying to tell us?� Arthritis Rheum 2004; 50(3): 684-8.
- Ge H, Si Y, Roeder RG. Isolation of cDNAs encoding novel transcription coactivators p52 and p75 reveals an alternate regulatory mechanism of transcriptional activation. EMBO J 1998; 17(22): 6723-9.
- Singh DP, Ohguro N, Kikuchi T, et al. Lens epithelium-derived growth factor: effects on growth and survival of lens epithelial cells, keratinocytes, and fibroblasts. Biochem Biophys Res Commun� 2000; 267(1): 373-81.
- Basu A, Sanchez TW, Casiano CA. DFS70/LEDGF p75: an enigmatic autoantigen at the interface between autoimmunity, AIDS, and cancer. Front Immunol 2015; 6: 116.
- Ochs RL, Muro Y, Si Y, et al. Autoantibodies to DFS 70 kd/transcription coactivator p75 in atopic dermatitis and other conditions. J Allergy Clin Immunol 2000; 105(6): 1211-20.
- Miyara M, Albesa R, Charuel J-L, et al. Clinical phenotypes of patients with anti-DFS70/LEDGF antibodies in a routine ANA referral cohort. Clin Dev Immunol 2013; 2013: 703759.
- Lee H, Kim Y, Han K, et al. Application of anti-DFS70 antibody and specific autoantibody test algorithms to patients with the dense fine speckled pattern on HEp-2 cells. Scand J Rheumatol 2016; 45(2): 122-8.
- Bizzaro N, Tonutti E, Tampoia M, et al. Specific chemoluminescence and immunoasdorption tests for anti-DFS70 antibodies avoid false positive results by indirect immunofluorescence. Clin Chim Acta 2015; 451(Pt B): 271-7.
- Mahler M, Parker T, Peebles CL, et al. Anti-DFS70/LEDGF antibodies are more prevalent in healthy individuals compared to patients with systemic autoimmune rheumatic diseases. J Rheumatol 2012; 39(11): 2104-10.
- Mariz HA, Sato EI, Barbosa SH, et al. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody-positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum 2011; 63(1): 191-200.
- Watanabe A, Kodera M, Sugiura K, et al. Anti-DFS70 antibodies in 597 healthy hospital workers. Arthritis Rheum 2004; 50(3): 892-900.
- Okamoto M, Ogawa Y, Watanabe A, et al. Autoantibodies to DFS70/LEDGF are increased in alopecia areata patients. J Autoimmun 2004; 23(3): 257-66.
- Ochs RL, Mahler M, Basu A, et al. The significance of autoantibodies to DFS70/LEDGF p75 in health and disease: integrating basic science with clinical understanding.� Clin Exp Med 2016; 16: 273-93.
- Bizzaro N, Tonutti E, Visentini D, et al. Antibodies to the Lens and Cornea in Anti-DFS70-Positive Subjects. Ann NY Acad Sci 2007; 1107(1): 174-83.
- Leoh LS, van Heertum B, De Rijck J, et al. The stress oncoprotein LEDGF/p75 interacts with the methyl CpG binding protein MeCP2 and influences its transcriptional activity. Mol Can Res 2012; 10(3): 378-91.
- Maertens GN, Cherepanov P, Engelman A. Transcriptional co-activator p75 binds and tethers the Myc-interacting protein JPO2 to chromatin. J Cell Sci 2006; 119(12): 2563-71.
- Bizzaro N, Tonutti E, Villalta D. Recognizing the dense fine speckled/lens epithelium-derived growth factor/p75 pattern on HEp-2 cells: not an easy task! Comment on the article by Mariz et al. Arthritis Rheum 2011; 63(12): 4036-7.
- Arbuckle MR, McClain MT, Rubertone MV, et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med 2003; 349(16): 1526-33.
- Fritzler MJ. The antinuclear antibody test: last or lasting gasp? Arthritis Rheum 2011; 63(1): 19-22.
- Mahler M, Hanly JG, Fritzler MJ. Importance of the dense fine speckled pattern on HEp-2 cells and anti-DFS70 antibodies for the diagnosis of systemic autoimmune diseases. Autoimmun Rev 2012; 11(9): 642-5.
İletişim (Correspondence):
Uzm. Dr. Gamze T�rkoğlu,
Malatya Eğitim ve Araştırma Hastanesi,
Tıbbi Mikrobiyoloji Laboratuvarı,
Malatya, T�rkiye.
Tel (Phone): +90 506 515 3601,
E-posta (E-mail): drgamzeturkoglu@hotmail.com