BK Vir�s (BKV) Kantitasyonunda Kullanılan İki Farklı Ger�ek Zamanlı
Polimeraz Zincir Reaksiyonu Y�nteminin Karşılaştırması ve BKV Genotip Tayini*
Evaluation of the Two Different Real Time Polymerase Chain Reaction Methods Used for
BK Virus (BKV) Quantification and BKV Genotype Assignment
Aylin ERMAN DALOĞLU1, Derya MUTLU1, İmran SAĞLIK2, Rabia CAN SARINOĞLU3, Esvet MUTLU1, Hubert G.M. NIESTERS4, Dilek �OLAK1
1 Akdeniz �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Antalya.
1 Akdeniz University Faculty of Medicine, Department of Medical Microbiology, Antalya, Turkey.
2 Uludağ �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Bursa.
2 Uludag University Faculty of Medicine, Department of Medical Microbiology, Bursa, Turkey.
3 Marmara �niversitesi, Pendik Eğitim ve Araştırma Hastanesi, Tıbbi Mikrobiyoloji, İstanbul.
3 Marmara University, Pendik Training and Research Hospital, Medical Microbiology, Istanbul, Turkey.
4 University Medical Center Groningen, Tıbbi Mikrobiyoloji Anabilim Dalı, Groningen, Hollanda.
4 University Medical Center Groningen, Department of Medical Microbiology, Groningen, The Netherlands.
* Bu �alışma, 2. Ulusal Viroloji G�nleri (22-24 Mart 2018, İzmir, T�rkiye)'nde bildiri olarak sunulmuştur.
Makale Atıfı: Erman Daloğlu A, Mutlu D, Sağlık İ, Can Sarınoğlu R, Mutlu E, Niesters HGM, �olak D. BK vir�s (BKV) kantitasyonunda kullanılan iki farklı ger�ek zamanlı polimeraz zincir reaksiyonu y�nteminin karşılaştırması ve BKV genotip tayini. Mikrobiyol Bul 2019;53(3):285-296.
�Z
BK vir�s (BKV) viral y�k kantitasyonu, b�brek transplant alıcılarında BKV'e bağlı gelişen nefropati� ve organ reddinin klinik olarak kontrol�nde belirgin role sahiptir. Bu �alışmada, b�brek transplant alıcılarında viral y�k tayininde BKV'nin farklı gen b�lgelerine y�nelik olarak tasarlanan iki farklı ger�ek zamanlı polimeraz zincir reaksiyonu (Rt-PCR) y�ntemi ile �l��len BKV DNA değerlerinin karşılaştırılması ve BKV genotiplerinin belirlenmesi ama�lanmıştır. İki farklı laboratuvarda (Lab-1 ve Lab-2), b�brek transplantasyonu yapılmış yetişkin ve �ocuk hastalara ait, daha �nce �alışılmış toplam 150 klinik �rnek (Lab-1'den 50 hastaya ait 50 plazma �rneği, Lab-2'den 58 hastaya ait 50 plazma ve 50 idrar �rneği) �alışmaya alınmıştır. Viral n�kleik asit izolasyonu Lab-1 ve Lab-2'de otomatize sistemler (sırası ile; EZ1, Qiagen, Almanya ve MagNA Pure 96, Roche Diagnostics, Almanya) ile elde edilmiştir. Rt-PCR işlemi Lab-1'de VP-1 gen b�lgesine y�nelik primer ve prob dizilerini i�eren amplifikasyon karışımı ile Rotor-Gene (Qiagen, Almanya) cihazında, Lab-2'de BKV VP-2 gen b�lgesine y�nelik primer ve prob dizilerini i�eren amplifikasyon karışımı ile ABI Prism 7500 (Applied Biosystems, ABD) cihazında ger�ekleştirilmiştir. BKV genotipleri, I-IV genotiplerine y�nelik primer ve problarla multipleks Rt-PCR ile araştırılmıştır. Her iki Rt-PCR y�nteminin kalitatif sonu�ları arasında orta derecede uyum saptanmış (ƙ= 0.56, p< 0.001), her iki laboratuvarda �rneklerin 82 (%54.6)'si pozitif, 37 (%24.6)'si negatif bulunmuştur. Lab-1 ve Lab-2'de pozitif �rneklerin ortanca viral y�kleri sırası ile; 4.1 x 104 kopya/ml (aralık: 321-6 x 109) ve 3.3 x 105 kopya/ml (aralık: 224-8.3 x 1010) olarak hesaplanmıştır. Her iki Rt-PCR y�nteminin kantitatif sonu�larının lineer regresyonu incelendiğinde; plazma (n= 52) �rnekleri i�in orta (R2= 0.52, p< 0.001), idrar (n= 30) �rnekleri i�in ise y�ksek derecede (R2= 0.88, p< 0.001) korelasyon saptanmıştır. Bland-Altman analizine g�re her iki testle pozitif bulunan t�m �rnekler i�in farkların ortalaması -0.58 log10 bulunmuş olup bu değer plazma �rneklerinde -0.29 log10, idrar �rneklerinde ise -1.1 log10'dur. T�m �rneklerde Lab-1 �l��mleri Lab-2'den daha d�ş�k seviyelerdedir. Viral y�k farkının -1.1 log10 olması; Lab-2'nin Lab-1'den ortalama olarak 1.1 log10 daha y�ksek �l��m yaptığını g�stermektedir. Bu bulguyu destekler şekilde; iki test arasında aynı �rneklerde �l��m farkı; %71.9 �rnekte 0.5 log10'dan, %29.2 �rnekte ise 1 log10'dan fazla bulunmuştur, sadece %28.1 �rnekte sonu�lar arasındaki fark klinik olarak kabul edilebilir aralık olan 0.5 log10'dan daha az �ıkmıştır. BKV genotiplendirmesi, kopya sayıları yeterli olan her biri farklı hastaya ait 74 �rneğe uygulanabilmiş ve genotip I (%81.7), IV (%15.5), II (%1.4) ve I+IV (%1.4) varlığı saptanmıştır. Genotip IV bulunan hastaların (n= 12), %66.6'sında 1 log10'dan fazla, %83.3'�nde 0.5 log10'dan fazla viral y�k �l��m farkı tespit edilmiş, kantitasyon uyumsuzluğunun en �ok genotip-IV hastalarında olduğu g�zlenmiştir. Sonu� olarak; iki farklı testin sonu�larının karşılaştırılması ama�landığında korelasyon ve lineer regresyon analizleri yetersiz kaldığı, �alışma sonu�larımızda da bu durumun a�ık�a g�zlendiği belirlenmiştir. D�nya Sağlık �rg�t�'n�n geliştirdiği uluslararası BKV standardı optimize edilinceye dek, her merkezin hastalarını aynı testle takip etmesi uygun olacaktır. Testlerin klinik korelasyonu, kullanılan mevcut testle sınırlı kalmaktadır. BKV kantitasyonunun yanlış yapılması klinik kararı etkilemektedir. Ger�ek değerinden d�ş�k �l��mler hastada BKV nefropatisi gelişmesine, y�ksek �l��mler ise gereksiz allogreft biyopsisi yapılmasına ve imm�nsupresyonun gereksiz yere azaltılmasına yol a�arak rejeksiyona zemin hazırlayacaktır.
Anahtar kelimeler: BK vir�s; ger�ek zamanlı polimeraz zincir reaksiyonu; kantitasyon; genotip.
ABSTRACT
BK virus (BKV) viral load quantification has a distinct role in the clinical control of BKV nephropathy and organ rejection� among renal transplant recipients. In this study, it was aimed to compare BKV DNA measurement values performed with two different real-time polymerase chain reaction (PCR) methods and to determine BKV genotypes in renal transplant recipients. Totally, 150 clinical samples tested previously in two different laboratories (Lab-1 and Lab-2) from adult and pediatric renal transplantation patients� were included in the study. Fifty plasma samples of 50 different patients from Lab-1, 50 plasma and 50 urine samples of 58 different patients from Lab-2 were� included in the study. Viral nucleic acid extraction was performed with automatized systems in Lab-1 and Lab-2 (EZ1, Qiagen, Germany and MagNA Pure 96, Roche Diagnostics, Germany; respectively;). Real-time PCR procedure was carried out in Lab-1 with an amplification mixture of primer, probe sequences targeting VP-1 gene region using Rotor-Gene (Qiagen, Germany) and in Lab-2 with an amplification mixture of primer, probe sequences targeting VP-2 gene region using ABI Prism 7500 (Applied Biosystems, USA). BKV genotyping was performed with multiplex PCR using primer, probe sequences for BKV genotypes I-IV. In both of the laboratories, 82 (54.6%) of the samples were found as positive, 37(24.6%) samples were found as negative and a moderate agreement was found between qualitative results of two real-time PCR methods (ƙ= 0.56, p< 0.001). Median viral load values were 4.1 x 104 copies/ml (321-6 x 109) in Lab-1 and 3.3 x 105 copies/ml (224-8.3 x 1010) in Lab-2 for positive samples. According to the lineer regression analysis of quantitative results, moderate (R2= 0.52, p< 0.001) and high (R2= 0.88, p< 0.001) correlation was found for plasma (n= 52) and urine (n= 30) samples, respectively. Bland-Altman analysis yielded a mean difference of -0.58 log10 for all samples. For plasma samples mean difference was -0.29 log10, while it was -1.1 log10 for urine samples. In all samples, Lab-1 measurements were lower than Lab-2 measurements. A mean difference of -1.1 log10 indicated that the measurement values of Lab-2 were more higher than Lab-1 measurments with an average of 1.1 log10. Supporting this result, 71.9% of the samples had a measurement difference more than 0.5 log 10 and 29.2% of the samples had a measurement difference more than 1 log10. Only 28.1% of the samples were measured within clinically acceptable log difference range (less than 0.5 log10). BKV genotyping was performed only for 74 different patient samples with sufficient copy numbers and genotype I (81.7%), IV (15.5%), II (1.4%), I+IV (1.4%) were detected. When the results were compared; 66.6% (n= 12) of the genotype IV samples had more than 1 log10 and 83.3% of them had more than 0.5 log10 viral load measurement difference. Correlation and linear regression analyzes� were insufficient� for the comparison ofthe results of the two different tests. It will be appropriate for each center to monitor patients with the same test until the international BKV standard developed by the World Health Organization is optimized. The clinical correlation of the tests is limited to the currently used test. The result of incorrect BKV quantification affects the clinical decision. Measurements less than the actual value will lead to the development of BKV nephropathy, and higher measurements will lead to unnecessary allograft biopsy and unnecessary reduction of immunosuppression.
Keywords: BK virus; real-time polymerase chain reaction; quantification; genotype.
Geliş Tarihi (Received): 17.12.2018 - Kabul Ediliş Tarihi (Accepted): 07.03.2019
GİRİŞ
BK vir�s (BKV) Polyomavirus ailesinde yer alan, yaklaşık 5000 baz �ifti (bp)'nden oluşan �ift sarmal �embersel DNA'ya sahip, ikozahedral kapsitli, zarfsız, k���k (40-45 nm �apında) bir vir�st�r. Erken, ge� ve kodlama yapmayan kontrol b�lgesi olmak �zere �� gen b�lgesi bulunmaktadır. Erken gen b�lgesi b�y�k T ve k���k t antijenlerini; ge� gen b�lgesi ise yapısal kapsit proteinleri olan VP1, VP2 ve VP3 ile yapısal olmayan bir protein olan agnoproteini kodlamaktadır1. BKV, maj�r kapsit proteini olan VP1'in gen dizisine g�re, farklı prevalans ve coğrafik dağılıma sahip d�rt genotipe ayrılmaktadır2. Genotip I'de d�rt alt grup (Ia, Ib-1, Ib-2 ve Ic), genotip IV'de ise altı alt grup (IVa-1, IVa-2, IVb-1, IVb-2, IVc-1 ve IVc-2) tanımlanmıştır. Alt grup Ib-2 yeni sınıflamada genotip V, Ib-1 ise genotip VI olarak belirlenmiştir3.
BKV primer enfeksiyonu, genellikle asemptomatik veya bir �st solunum yolu hastalığı şeklinde ge�irilmektedir. İnsidansı 2-5 yaş aralığında pik yaptığı i�in erken �ocukluk d�neminde solunum veya oral yolla bulaştığı d�ş�n�lmektedir. Sağlıklı erişkinlerde bildirilen BKV seroprevalansı genel olarak %90 civarındadır4,5.
Asemptomatik enfeksiyon sonrasında BKV, en sık �roepitelyal h�crelerde ikinci sıklıkta periferik kanın monon�kleer h�crelerinde latent olarak kalabilir. İmm�nkompetan hastalarda latent vir�se bağlı reaktivasyonlar herhangi bir klinik �nem taşımamaktadır. Ancak b�brek transplantasyonu, k�k h�cre transplantasyonu nedeniyle imm�nsupresif tedavi almakta olan bireylerde reaktivasyon ile ge�ici vir�ri ve viremi oluşabildiği gibi, allogreft disfonksiyonu, nefropati, �reter stenozu ve hemorajik sistit gibi ciddi klinik tablolar da gelişebilir1. Viremi vir�riden yaklaşık bir ay sonra gelişir ve viremi �ncesinde her zaman vir�ri g�zlenmektedir. BKV'nin kan dolaşımına yayılımının t�b�ler harabiyet sonucu perit�b�ler kılcal damarlar yoluyla olduğu d�ş�n�lmektedir4.
B�brek transplantasyonu yapılanlarda BKV enfeksiyonu saptandığında en �nemli tedavi y�ntemi imm�nsupresyonun azaltılmasıdır, ancak bu azaltma akut rejeksiyon gelişimi i�in risk oluşturabilir. Bu nedenle bu d�nemde hastaların� takibi b�y�k �nem taşımaktadır. B�brek transplantasyonu sonrasındaki d�nemde BKV reaktivasyonuna bağlı komplikasyonların �nlenmesi i�in erken tanı ve hastaların ger�ek zamanlı polimeraz zincir reaksiyonu (Rt-PCR) testi ile monit�rize edilmesi �nerilmektedir6.
G�n�m�zde BKV viral y�k�n�n saptanmasında kullanılan Rt-PCR testlerinde hen�z bir standardizasyon yoktur. D�nya Sağlık �rg�t� (DS�)'n�n uluslararası BKV kantitasyon standardı geliştirme �alışması tamamlanmış olmakla birlikte uygulamaya ge�ildiğinde, bu standardın farklı y�ntemler arası sonu�ların uyumuna ve farklı kurumlarda BKV klinik eşik değerlerinin tanımlanmasına imkan sağlayacağı bildirilmektedir7,8.
Ticari ya da laboratuvar tasarımı olsun, farklı Rt-PCR testleri; n�kleik asit ekstraksiyon y�ntemi, başlangı� vol�m�, se�ilen primer ve problar, testin uygulanım şekli, amplifikasyon koşulları gibi nedenlere bağlı olarak aynı �rnek i�in farklı sonu�lar verebilmektedir3.
Bu �alışmada b�brek transplant alıcılarında BKV'nin farklı gen b�lgelerine y�nelik olarak tasarlanan iki Rt-PCR y�ntemi ile �l��len BKV DNA değerlerinin karşılaştırılması ve BKV genotiplerinin belirlenmesi ama�lanmıştır.
GERE� ve Y�NTEM
Bu �alışma, Akdeniz �niversitesi Tıp Fak�ltesi Etik Kurulu Başkanlığı onayı ile ger�ekleştirildi (Tarih: 26.04.2017 ve Karar no: 247).
�alışma Grubu
İki farklı laboratuvarda (Lab-1, Lab-2) b�brek transplantasyonu yapılmış yetişkin ve �ocuk hastalara ait, daha �nce �alışılmış plazma ve idrar� �rnekleri �alışmaya alındı. Lab-1'den 50 hastaya ait 50 plazma �rneği, Lab-2'den 58 hastaya ait 50 plazma ve 50 idrar �rneği olmak �zere toplam 150 klinik �rnek test edildi. Araştırma boyunca �rnekler -80�C'de saklandı.
Lab-1'de Yapılan Testler
Viral y�k tayini: Viral DNA ekstraksiyonu ticari bir kit (EZ1 Virus Mini Kit, Qiagen, Almanya) ve otomatize cihaz (Biorobot EZ1 Advanced, Qiagen, Almanya) kullanılarak �retici firmanın �nerileri doğrultusunda 400 �l �rnekten 60 �l ekstrakt elde edecek şekilde yapıldı. Vats ve arkadaşları tarafından tanımlanan primer dizileri kullanılarak vir�s�n VP-1 b�lgesi i�erisindeki 83 bp b�lge amplifiye edildi (Tablo I)9,10. Amplifikasyon aşamasında, bir BKV negatif kontrol ve kantitasyonun sağlanabilmesi i�in pBR322 plazmidi i�erisine klonlanan Dunlop suşunun t�m dizisini i�eren pBKV (ATCC45025) ile, UV spektrofotometre kullanılarak log10 tabanına g�re değişen konsantrasyonlarda plazmit i�eren beş standart kullanıldı. İnternal kontrol olarak, hedef ile aynı t�p i�erisinde, gliseraldehit-3-fosfat dehidrogenaz (GAPDH) geni i�inde yer alan bir b�lge �oğaltıldı. �rnek başına d�şen reaksiyon karışım toplam hacim 25 �l olacak şekilde; Quantitect Prob PCR Master Mix (Qiagen, Almanya) ile birlikte Tablo I'de yer alan BKV'ye ve internal kontrole y�nelik primerler, problar, GAPDH amplikonu ve 5 �l ekstrakt i�ermekteydi. Amplifikasyon ve saptama işlemi i�in Rotor-Gene (Qiagen, Almanya) cihazı kullanıldı. PCR d�ng�s�; 95�C'de 12 dakika bir d�ng�; 95�C'de 15 saniye, 60�C'de 1 dakika ve 40�C'de 1 dakikadan oluşan 45 d�ng� olarak uygulandı. Testin analitik duyarlılığı ve saptama limiti 300 kopya/ml (2.5 log kopya/ml) olarak belirlendi.
Lab-2'de Yapılan Testler
Viral y�k tayini: Viral DNA ekstraksiyonu ticari bir kit (MagNA Pure 96 DNA-Viral NA Small Volume Kit, Roche Diagnostics, Almanya) ve otomatize cihaz (MagNA Pure 96 System, Roche Diagnositcs, Almanya) kullanılarak �retici firmanın �nerileri doğrultusunda 190 �l �rnekten 100 �l ekstrakt hacmi elde edilecek şekilde yapıldı. Fok herpesvir�s� (Phocine Herpesvirus-PhHV) i�eren internal kontrolden 10 �l klinik �rneğe eklendi. Vir�s�n VP-2 b�lgesi i�erisindeki 131 bp b�lge amplifiye edildi (Tablo I)11. Amplifikasyon aşamasında, bir BKV negatif kontrol ve kantitasyonun sağlanabilmesi i�in beş spesifik kantitasyon standardı kullanıldı. �rnek başına d�şen reaksiyon karışımı toplam hacim 50 �l olacak şekilde; "TaqMan Universal Master Mix (Applied Biosystems, Amerika Birleşik Devletleri)" ve 1 �l (5 mg/ml) sığır serum albumin (Roche Diagnostics, Almanya) ile birlikte Tablo I'de yer alan BKV'ye ve internal kontrole y�nelik primerler, problar, PhHV amplikonu ve 20 �l ekstrakt i�erecek şekilde hazırlandı. Amplifikasyon ve saptama işlemi i�in ABI PRISM 7500 (Applied Biosystems, ABD) cihazı kullanıldı. PCR; 50�C'de 2 dakika, 95�C'de 10 dakikayı takiben 42 d�ng�; 95�C 15 sn ve 60�C'de 1 dakika şeklinde uygulandı. Testin analitik duyarlılığı ve saptama limiti 100 kopya/ml (2 log kopya/ml) olarak belirlendi.
BKV genotip tayini: Farklı genotipler i�in gerekli primer ve problar eklenerek (VP-1 gen b�lgesine y�nelik), Rt-PCR ile aynı protokolde multipleks Rt-PCR yapıldı. Testin saptama limiti 1000 kopya/ml (3 log kopya/ml) olarak saptandı (Tablo I)11.
İstatistiksel Analiz
Verilerin istatistiksel analizinde SPSS Version 22.0 programı kullanıldı. İki Rt-PCR testi arasındaki kalitatif uyumun araştırılmasında McNemar testi kullanılarak kappa değeri (ƙ) hesaplandı. Kantitatif sonu�lar korelasyon, lineer regresyon ve Bland-Altman testleri ile analiz edildi. Normal dağılım �l��m� i�in Shapiro-Wilk testi uygulandı. İstatistiki değerlendirmede p< 0.05 olması anlamlı kabul edildi.
BULGULAR
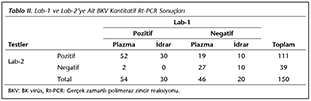
Her iki laboratuvarda t�m �rneklerin (n= 150) 82 (%54.6)'si pozitif, 37 (%24.6)'si� negatif bulunmuştur. Toplam 31 (%20.6) �rnekte (21 plazma, 10 idrar) uyumsuz sonu� elde edilmiştir (Tablo II). Her iki Rt-PCR y�nteminin kalitatif sonu�ları arasında orta derecede uyum saptanmıştır (ƙ= 0.56, p< 0.001). Her iki laboratuvarda plazma �rneklerinin (n= 100) 52 (%52)'si pozitif, 27 (%27)'si negatif bulunmuştur (ƙ= 0.56, p< 0.001). Yirmi bir (%21) plazma �rneğinde uyumsuz sonu� elde edilmiştir. İdrar �rnekleri i�in (n= 50), her iki laboratuvarda �rneklerin 30 (%60)'u pozitif, 10 (%20)'u negatif bulunmuştur (ƙ= 0.54, p< 0.001). On (%20) idrar �rneğinde uyumsuz sonu� elde edilmiştir (Tablo II).
Her iki Rt-PCR y�nteminin kantitatif sonu�larının logaritmalarının lineer regresyonu incelendiğinde; plazma (n= 52) �rnekleri i�in orta derecede (R2= 0.52, p< 0.001, y= 0.77x+1.3), idrar (n= 30) �rnekleri i�in ise y�ksek derecede (R2= 0.88, p< 0.001, y= 0.87x+1.87) korelasyon saptanmıştır (y= Lab-2, x= Lab-1).
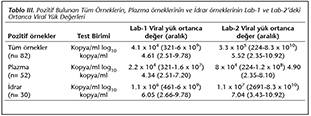
Her iki laboratuvarda pozitif saptanan t�m �rnekler,� pozitif saptanan plazma �rnekleri ve pozitif saptanan idrar �rnekleri i�in viral y�k ortanca değerleri arasında laboratuvarlar arası anlamlı bir fark g�r�lmemekle birlikte; sonu�lar tek tek incelendiğinde �zellikle idrar �rnekleri başta olmak �zere, Lab-2'de Lab-1'e g�re daha y�ksek �l��mler olduğu g�zlenmiştir (Tablo III).
Her iki laboratuvarda pozitif bulunan 82 �rneğin viral y�k �l��mlerinin logaritmik değerlerinin ortalamalarına karşı farklarının dağılımı Bland-Altman grafiğinde g�sterilmiştir (Şekil 1). Ortalama fark; b�t�n �rnekler i�in -0.58 log10 kopya/ml (standart sapma= 0.94), plazma �rnekleri i�in -0.29 log10 kopya/ml (standart sapma= 0.91), idrar �rnekleri i�in -1.1 log10 kopya/ml (standart sapma= 0.78) olarak bulunmuştur (Şekil 1).
İki laboratuvar arasındaki �l��m farkı; 24 (%29.2) �rnekte 1 log10'dan fazla (ortanca 1.63 log10 kopya/ml; aralık 1.07-3.21), 59 (%71.9) �rnekte ise 0.5 log10'dan fazla (ortanca: 0.84, aralık: 0.51-3.21) bulunmuştur.�
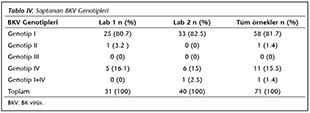
BKV genotiplendirmesi, kopya sayıları yeterli olan her biri farklı hastaya ait 74 �rnekte yapılmıştır. �� �rnekte tiplendirme yapılamamıştır. Yetmiş bir farklı hastada saptanan genotipler Tablo IV'te g�sterilmiştir. T�m �rnekler arasında; genotip IV bulunan hastaların (n= 12), %66.6'sında 1 log10'dan fazla, %83.3'�nde 0.5 log10'dan fazla viral y�k �l��m farkı saptanmıştır.
TARTIŞMA
Bu �alışmada, BKV'nin farklı gen b�lgelerini hedefleyen iki farklı Rt-PCR y�nteminin klinik �rneklerde BKV kantitasyonu a�ısından karşılaştırılması ve BKV genotip tayini ama�lanmıştır. İki Rt-PCR y�nteminin kalitatif sonu�ları arasında orta d�zeyde uyum bulunmuştur. Analitik duyarlılığı daha iyi olan Lab-2 testi ile daha fazla pozitiflik saptanmıştır. Kalitatif değerlendirmede uyumsuz �rneklerin �oğunluğunu plazma �rneklerinin oluşturduğu g�r�lm�şt�r. İdrara g�re plazmada daha d�ş�k BKV viral y�k değerlerine rastlandığı i�in, plazmadaki ufak viral y�k farklılıkları kalitatif sonu�ları daha y�ksek oranda etkilemektedir12. Kantitatif sonu�lar korelasyon ve lineer regresyon analizi ile incelenmiş; plazma �rnekleri i�in orta, idrar �rnekleri i�in y�ksek derecede korelasyon saptanmıştır. Korelasyon ve lineer regresyon analizleri iki değer arasında sadece doğrusal ilişkiyi değerlendirmekte ve iki y�ntem arasında y�ksek korelasyon olması sonu�ların uyumlu olduğu anlamına gelmemektedir. İki farklı testin sonu�larının birbirlerine yakınlık derecesinin araştırılmasında Bland-Altman analizi olarak tanımlanan; iki testten elde edilen �l��mlerin ortalamalarına karşı farklarının dağılım grafiğinin �izilmesi gerekmektedir. Sunduğumuz �alışmada her iki Rt-PCR sonu�ları arasında korelasyon ve lineer regresyon analizlerine g�re uyum saptanmakla birlikte; Bland-Altman analizine g�re her iki testle pozitif bulunan t�m �rnekler i�in ortalama fark -0.58 log10 bulunmakta, plazma �rneklerinde kantitatif sonu�lar daha uyumlu bulunurken (ortalama fark -0.29 log10), idrar �rneklerinde fark artarak -1.1 log10 değerine ulaşmaktadır. T�m �rneklerde Lab-1 �l��mleri Lab-2'den daha d�ş�k seviyelerde g�zlenmiştir. Ortalama viral y�k farkının -1.1 log10 olması; Lab-2'nin Lab-1'den ortalama olarak 1.1 log10 daha y�ksek �l��m yaptığını g�stermektedir. Bu bulguyu destekler şekilde; iki test arasında aynı �rneklerde �l��m farkı; %71.9 �rnekte 0.5 log10'dan, %29.2 �rnekte ise 1 log10'dan fazla bulunmuştur, sadece %28.1 �rnekte sonu�lar arasındaki fark klinik olarak kabul edilebilir aralıkta (0.5 log10'dan daha az) saptanmıştır. İki farklı testin sonu�larının karşılaştırılması ama�landığında korelasyon ve lineer regresyon analizleri yetersiz kalmaktadır, �alışma sonu�larımızda bu durum a�ık�a g�r�lmektedir. BKV'nin VP1 başta olmak �zere, b�y�k T antijen, k���k t antijen, VP2 gibi farklı gen b�lgelerine y�nelik hem ticari hem de laboratuvar tasarımı Rt-PCR y�ntemleri bulunmaktadır. Farklı gen b�lgelerinin hedeflendiği BKV Rt-PCR y�ntemlerinin karşılaştırıldığı �alışmalara benzer şekilde bu �alışmada da sonu�lar arasında uyumsuzluklar saptanmıştır13.
Amerikan Transplantasyon Derneği'nin 2009'da yayınlanan rehberinde, kanıt d�zeyi d�ş�k olsa da; renal transplant alıcılarının plazma BKV n�kleik asit testleri (NAT) ile izlemi �nerilmekte, 104 kopya/ml �zerindeki viral y�k değerlerinin BKV ilişkili nefropati a�ısından �nemli olduğu belirtilmektedir14. Ancak BKV NAT'ta hen�z bir standardizasyon sağlanamamış olması araştırmalarda farklı sonu�ları karşımıza �ıkarmaktadır. Hassan ve arkadaşlarının �alışmasında15; biyopsi ile BKV ilişkili nefropati tanısı alan 31 hastanın 11 (%35)'inde viral y�k d�zeylerinin 104 kopya/ml altında olduğu bildirilmiştir. Ruangkanchanasetr ve arkadaşları16 ise in situ hibridizasyon y�ntemi ile BKV ilişkili nefropati tanısı alan bir hastada BKV viremisi saptanmadığını rapor etmişlerdir. Hayden ve arkadaşlarının �alışmasında17 se�ilen hedef genin b�y�k T olması durumunda aynı �rneklerde yapılan �l��mlerin ortalama viral y�kleri arasında anlamlı farklar (2.70-7.20 log10) olduğu ve VP-1 genine y�nelik testler ile daha y�ksek değerler saptandığı bildirilmiştir. Fransa'da �ok merkezli bir �alışmada klinik �rneklerin ancak %68'inde �l��mler arası farkın 0.5 log10'dan k���k olduğu, %32 �rnekte �l��mler arasında 1.32-5.55 log10 fark bulunduğu vurgulanmıştır18. Tan ve arkadaşlarının, VP-1 gen b�lgesine y�nelik laboratuvar tasarımı BKV Rt-PCR ve b�y�k T antijen gen b�lgesine y�nelik Altona Realstar BKV ticari kitini karşılaştırdıkları �alışmalarında; iki test arasındaki ortalama viral y�k �l��m farkının Bland-Altman analizlerine g�re -0.7 log10 kopya/ml olduğu, Altona Realstar BKV ticari kiti ile daha d�ş�k �l��mler yapıldığı belirtilmiştir. Bunun yanı sıra uluslararası standart kullanımı ile değerler IU/ml olarak kalibre edildiğinde ortalama farkın -0.1 log10 kopya/ml'ye kadar gerilediğini g�zlemlemişlerdir7. Diğer yandan, Bateman ve arkadaşları19, dijital PCR y�ntemi ile yaptıkları �alışmada, hedef olarak BKV'nin b�y�k T b�lgesi se�ildiğinde VP-1 b�lgesine g�re DS� standardı ile yaklaşık d�rt kat daha d�ş�k �l��m yapıldığını belirterek, DS� standardındaki alt pop�lasyonların b�y�k T b�lgesinde delesyonlara yol a�tığını yeni nesil dizileme y�ntemi ile g�stermişlerdir. T�m bu �alışmaların sonu�ları, bizim sonu�larımızla birlikte; farklı BKV Rt-PCR testleri arasında hen�z tam bir standardizasyon sağlanamadığını, DS�'n�n hazırladığı standardın da geliştirilmesi gerekliliğini ortaya koymaktadır. Bu durumda; testler arasında standardizasyon sağlanana kadar, BKV viral y�k artışının takibinin aynı Rt-PCR y�ntemi ile yapılması �nemini korumaktadır. Testlerin klinik korelasyonu, hen�z mevcut kullanılan testle sınırlı kalmaktadır. Viral y�k �l��mlerindeki değişkenliklerin sebepleri; kullanılan �rnek matriksi, �rnek miktarı, n�kleik asit ekstraksiyon y�ntemi, primer ve probların se�imi, hedefin amplifikasyon g�c�, kullanılan standart ve kontroller arasındaki farklılıklar olabilmektedir15,20,21.
T�m d�nyada BKV genotip I'in en sık saptanan genotip olduğu bilinmektedir22. Ulaşılabildiği kadarı ile, �lkemizde BKV genotip tayini a�ısından en y�ksek olgu sayısına sahip olan �alışmamızda b�brek transplantasyonu yapılan hastalarda BKV genotip I (%81.7), IV (%15.5), II (%1.4) ve I + IV (%1.4) saptanmıştır. Hi�bir �rnekte genotip III saptanmamıştır. �lkemize ait �rneklerde BKV genotiplendirmesinin yapıldığı iki �alışmadan birinde; altı idrar �rneği incelenmiş, beş �rnekte genotip V (eski sınıflamada genotip Ib-2) ve bir �rnekte genotip Ia saptanmıştır23. Diğer �alışmada ise 13 yaşında b�brek transplant hastasında BKV Afrika varyantı bildirilmiştir24. �alışma sonu�larımız incelendiğinde; kantitasyon uyumsuzluğunun y�zde olarak en �ok genotip-IV belirlenen hastalarda olduğu g�zlenmiştir. Rt-PCR testleri arasındaki kantitasyon uyumsuzluklarının, �zellikle genotip-IV varlığında olabileceği bildirilmektedir3. Solis ve arkadaşları18 laboratuvarlar arası uyumsuzluklarda BKV genotiplerinin �nemli olabileceğini, kendi �alışmalarındaki uyumsuzlukdan BKV genotip II ve genotip IV'deki polimorfizmler dolayısı ile hedef gen ile primer-prob uygunsuzluğunun sorumlu olduğunu belirtmektedirler. Yapılan diğer araştırmalarda da BKV genomundaki nadir sekans polimorfizmlerine bağlı olarak BKV saptama duyarlılıklarının azaldığı ve hatta viral y�k kantitasyonunun etkilendiği belirtilmektedir25.
Bu �alışma ile ilgili bulgularımız sadece laboratuvar tasarımlı iki Rt-PCR y�ntemi i�in sınırlı olmaktadır. Hedef genlerde ve genotiplerde dizi analizi yapılamamıştır. Diğer laboratuvarlarda kullanılan farklı gen b�lgelerini hedefleyen, farklı ekstraksiyon ve amplifikasyon-saptama cihazları ile ger�ekleştirilen gerek ticari, gerek laboratuvar tasarımlı y�ntemlerde sonu�lar değişiklik g�sterebilir. Daha fazla �rnek sayısının incelenmesi ve genotip dağılımının dizi analizi ile desteklenmesi ve laboratuvarlar arası sonu�ların karşılaştırılabilmesine olanak sağlayarak hasta �rneklerini en doğru şekilde yansıtacak uluslararası bir standardın uygulamaya konulması gerekliliği bulunmaktadır.
Sonu� olarak; sunulan �alışmada iki farklı hedefe y�nelik BKV Rt-PCR testi arasında kalitatif olarak orta derecede korelasyon g�zlenmiş, �rneklerin ancak %28.1'inin sonu�ları arasında kantitatif olarak kabul edilebilir bir �l��m farkı saptanmıştır. DS�'n�n geliştirdiği uluslararası BKV standardı optimize edilinceye dek, her merkezin hastalarını aynı testle takip etmesi uygun olacaktır.� BKV kantitasyonunun yanlış yapılması klinik kararı etkilemektedir. Ger�ek değerinden d�ş�k �l��mler hastada BKV nefropatisi gelişmesine, y�ksek �l��mler ise gereksiz allogreft biyopsisi yapılmasına ve imm�nsupresyonun gereksiz yere azaltılmasına yol a�arak rejeksiyona zemin hazırlayacaktır.
TEŞEKK�R
Yayın yazarları olarak, bu �alışmaya katkılarından dolayı Annelies Riezebos-Brilman ve Lilli Rurenga-Gard'a teşekk�rlerimizi sunarız.
�IKAR �ATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir �ıkar �atışması bildirmemişlerdir.
KAYNAKLAR
- Ahsan N, Shah KV. Polyolmaviruses: an overview. Graft 2002;5(suppl):S9-S18.
- Gambarino S, Costa C, Astegiano S, Piasentin EA, Segoloni GP, Cavallo R, et al. Genotyping of polyomavirus BK by Real Time PCR for VP1 gene. Mol Biotechnol 2011;49(2):151-8.
- Hoffman NG, Cook L, Atienza EE, Limaye AP, Jerome KR. Marked variability of BK virus load measurement using quantitative real-time PCR among commonly used assays. J Clin Microbiol 2008;46(8):2671-80.
- Hirsch HH, Babel N, Comoli P, Friman V, Ginevri F, Jardine A, et al. European perspective on human polyomavirus infection, replication and disease in solid organ transplantation. Clin Microbiol Infect 2014;20(Suppl 7):74-88.
- Randhawa P, Vats A, Shapiro R, Weck K, Scantlebury V. BK Virus: Discovery, Epidemiology and Biology. Graft 2002;5(SUPPL):S19-S27.
- Hirsch HH, Randhawa P. BK polyomavirus in solid organ transplantation. Am J Transplant 2013;13(Suppl 4):179-88.
- Tan SK, Milligan S, Sahoo MK, Taylor N, Pinsky BA. Calibration of BK Virus Nucleic Acid Amplification Testing to the 1st WHO International Standard for BK Virus. J Clin Microbiol 2017;55(3):923-30.
- Govind S, Hockley J, Morris C; the Collaborative Study Group. Collaborative Study to establish the 1st WHO International Standard for BKV DNA for nucleic acid amplification technique (NAT)-based assays. World Health Organization, www.who.int, WHO/BS/2015.2270.
- Mutlu D, Saglik I, Koyun M, Comak E, Mutlu E, Uslu Gokceoglu A, et al. BK virus infections in pediatric kidney transplant recipients. Mikrobiyol Bul 2013;47(3):461-71.
- Vats A, Shapiro R, Singh Randhawa P, Scantlebury V, Tuzuner A, Saxena M, et al. Quantitative viral load monitoring and cidofovir therapy for the management of BK virus-associated nephropathy in children and adults. Transplantation 2003;75(1):105-12.
- Gard L, Niesters HG, Riezebos-Brilman A. A real time genotyping PCR assay for polyomavirus BK. J Virol Methods 2015;221:51-6.
- Descamps V, Martin E, Morel V, Francois C, Helle F, Duverlie G, et al. Comparative Evaluation of three nucleic acid-based assays for BK Virus quantification. J Clin Microbiol 2015;53(12):3822-7.
- Stellrecht KA, Espino AA, Nattanmai SM, Jackson WF, Conti DJ. Comparison of three real-time PCR for the quantification of polyomavirus BK. J Clin Virol 2013;56(4):354-9.
- KDIGO. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009;9(Suppl 3):1-150.
- Hassan S, Mittal C, Amer S, Khalid F, Patel A, Delbusto R, et al. Currently recommended BK virus (BKV) plasma viral load cutoff of ≥ 4 log10/ml underestimates the diagnosis of BKV-associated nephropathy: a single transplant center experience. Transpl Infect Dis 2014;16(1):55-60.
- Ruangkanchanasetr P, Pumchandh N, Satirapoj B, Termmathurapoj S, Pongthanapisith V. Biopsy-proven Bk virus nephropathy without detectable Bk viremia in a one-year post-kidney transplant recipient. Southeast Asian J Trop Med Public Health 2015;46(4):657-61.
- Hayden RT, Yan X, Wick MT, Rodriguez AB, Xiong X, Ginocchio CC, et al. Factors contributing to variability of quantitative viral PCR results in proficiency testing samples: a multivariate analysis. J Clin Microbiol 2012;50(2):337-45.
- Solis M, Meddeb M, Sueur C, Domingo-Calap P, Soulier E, Chabaud A, et al. Sequence Variation in Amplification Target Genes and Standards Influences Interlaboratory Comparison of BK Virus DNA Load Measurement. J Clin Microbiol 2015;53(12):3842-52.
- Bateman AC, Greninger AL, Atienza EE, Limaye AP, Jerome KR, Cook L. Quantification of BK Virus Standards by Quantitative Real-Time PCR and Droplet Digital PCR Is Confounded by Multiple Virus Populations in the WHO BKV International Standard. Clin Chem 2017;63(3):761-9.
- Muldrew KL, Lovett JL. An in-house assay for BK polyomavirus quantification using the Abbott m2000 RealTime system. J Med Microbiol 2013;62(11):1714-20.
- Sueur C, Solis M, Meddeb M, Soulier E, Domingo-Calap P, Lepiller Q, et al. Toward standardization of BK virus monitoring: evaluation of the BK virus R-gene kit for quantification of BK viral load in urine, whole-blood, and plasma specimens. J Clin Microbiol 2014;52(12):4298-304.
- Sawinski D, Goral S. BK virus infection: an update on diagnosis and treatment. Nephrol Dial Transplant 2015;30(2):209-17.
- Zheng HY, Nishimoto Y, Chen Q, Hasegawa M, Zhong S, Ikegaya H, et al. Relationships between BK virus lineages and human populations. Microbes Infect 2007;9(2):204-13.
- Colakoglu S, Dursun H, Cengiz N, Bulat MC, Noyan A. The African variant of BKV in a Turkish renal transplant patient. Diagn Microbiol Infect Dis 2014;79(2):245-6.
- Randhawa P, Kant J, Shapiro R, Tan H, Basu A, Luo C. Impact of genomic sequence variability on quantitative PCR assays for diagnosis of polyomavirus BK infection. J Clin Microbiol 2011;49(12):4072-6.
İletişim (Correspondence):
Prof. Dr. Dilek �olak,
Akdeniz �niversitesi Tıp Fak�ltesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
07070, Antalya, T�rkiye.
Tel (Phone): +90 242 249 6000/6405-6264,
E-posta (E-mail): dcolak@akdeniz.edu.tr