T�rkiye'de Bir Referans Hastanede Akciğer �rneklerinden Sıklıkla İzole Edilen
Yavaş �reyen T�berk�loz Dışı Mikobakteriler ve İla� Duyarlılık Sonu�larının Değerlendirilmesi
Frequently Isolated Slow Growing Nontuberculous Mycobacteria from Pulmonary Samples and
Evaluation of Drug Susceptibility Testing Results in a Referral Hospital in Turkey
İsmail CEYHAN1, Şeref �ZKARA2, M�jgan Zuhal G�LER2, G�ng�r DULKAR2, Resul ALTINSOY2, Sedat VEZİR2
1 Balıkesir �niversitesi Tıp Fak�ltesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Balıkesir.
1 Balıkesir University Faculty of Medicine, Department of Medical Microbiology, Balıkesir, Turkey.
2 Atat�rk G�ğ�s Hastalıkları ve G�ğ�s Cerrahisi Eğitim ve Araştırma Hastanesi, Ankara.
2 Ataturk Chest Diseases and Chest Surgery Training and Research Hospital, Ankara, Turkey.
Makale Atıfı: Ceyhan İ, �zkara Ş, G�ler MZ, Dulkar G, Altınsoy R, Vezir S. T�rkiye'de bir referans hastanede akciğer �rneklerinden sıklıkla izole edilen yavaş �reyen t�berk�loz dışı mikobakteriler ve ila� duyarlılık sonu�larının değerlendirilmesi. Mikrobiyol Bul 2019;53(3):330-335.
�Z
T�berk�loz dışı mikobakteri (TDM)'lerin �oğu doğada serbest yaşayan ve fırsat�ı patojen mikroorganizmalardır. TDM'ler �ok �eşitli enfeksiyonlara neden olabilirler. Ancak bunlar arasında en sık g�r�len klinik tablo pulmoner TDM hastalığıdır. Bu �alışmada, Atat�rk G�ğ�s Hastalıkları ve G�ğ�s Cerrahisi Eğitim ve Araştırma Hastanesi Mikrobiyoloji Laboratuvarında 2014 ve 2018 tarihleri arasında t�berk�loz (TB) �n tanısı alan kişilere ait hasta �rneklerinden izole edilen yavaş �reyen TDM izolatlarının tanımlanması ve ticari mikrodil�syon plak y�ntemiyle ila� duyarlılıklarının değerlendirilmesi ama�lanmıştır. �alışmaya akciğer TB ş�pheli hastalardan elde edilen toplam 435 adet TDM izolatı dahil edilmiştir. �rneklere homojenizasyon ve dekontaminasyon işlemi uygulandıktan sonra aside diren�li boyamanın ardından otomatize MGIT-BACTEC960 sistemi ve iki farklı katı besiyerinde (L�wenstein Jensen ve Ogawa) k�lt�r� yapılarak aside diren�li bakteri (ARB) araştırılmıştır. K�lt�rden izole edilen ARB pozitif bakteriler kart testi (MPB64, Capilla TB-Neo) ve polimeraz zincir reaksiyonu (PCR) temelli ters hibridizasyon "line probe assay (LPA)" (GenoType MycobacteriumCM/AS Hain Lifescience, Almanya) y�ntemiyle tanımlanmıştır. K�lt�rlerden DNA izolasyonu yapıldıktan sonra, mikobakteri 23S rRNA "spacer" b�lgesine �zg� primerler kullanılarak PCR y�ntemi uygulanmıştır. Elde edilen biyotinlenmiş PCR �r�n�, nitrosel�l�z şeritler �zerinde mikobakteri t�rlerine �zg� problarla �retici firmanın �nerilerine g�re hibridize edilerek değerlendirilmiştir. Bu �alışmada akciğer hastalarından sırasıyla Mycobacterium avium (n= 77, %17.7), Mycobacterium intracellulare (n= 70, %16.1), Mycobacterium szulgai (n= 19, %4.4), Mycobacterium kansasii (n= 10, %2.3) ve Mycobacterium smiae (n= 9, %2.1) yavaş �reyen mikobakteri t�rleri saptanmıştır. İla� duyarlılık testinde CLSI tarafından CLSI/M24-A2 rehberi ile �nerilen "oleic asit, albumin dextrose catalase" ile zenginleştirilmiş, katyon-ayarlı Mueller-Hinton (CAMH) sıvı besiyerinde mikrodil�syon y�ntemi kullanılmıştır. Test, kullanıma hazır ticari ila�lı plaklarda (SLOMYCO-Sensititre, TREK Diagnostic Systems Ltd, Birleşik Krallık) yapılmıştır. M.intracellulare, M.avium, M.kansasii ve M.smiae'nın klaritromisine duyarlılıkları sırasıyla %100, %99, %100 ve %100 oranlarında saptanmıştır. M.intracellulare ve M.avium i�in moksifloksasine duyarlılık sırasıyla %91, %64 ve linezolide ise %80, %74 olarak bulunmuştur. M.kansasii, M.simiae'den daha fazla oranda bir�ok ilaca duyarlı bulunmuştur. M.kansasii'nin rifabutin, rifampisin, moksifoksasin, amikasin, linezolid, trimetoprim-s�lfametoksazol (TMP-SMZ), siprofloksasin ve etambutole duyarlılığı sırasıyla %100, %90, %100, %100, %100, %80, %70 ve %50 oranlarında bulunmuştur. Bu �alışma, akciğer �rneklerinden sık izole edilen yavaş �reyen TDM'lerin t�r ayrımı ve ila� duyarlılık testleri ile tedaviye rehberlik edebileceğini g�stermiştir.
Anahtar kelimeler: T�berk�loz dışı mikobakteri (TDM); ila� duyarlılık testi; akciğer hastalığı.
ABSTRACT
Most of the nontuberculous mycobacteria (NTM) are opportunistic pathogenic microorganisms and free-living in nature. NTM can cause a wide range of infections. However, pulmonary NTM disease is the most frequent clinical picture. The aim of this study was to identify and evaluate drug susceptibility of slow growing NTM isolated from pulmonary samples of patients prediagnosed as tuberculosis between 2014 and 2018 in Atat�rk Chest Diseases and Chest Surgery Training and Research Hospital Microbiology Laboratory by a commercial microtube dilution plaque method. A total of 435 NTM strains obtained from suspected TB patients were included in the study. After the samples were processed by homogenization and decontamination and acid-fast staining, culture in two solid media (L�wenstein-Jensen, Ogawa) and in MGIT-BACTEC960 automated system were performed. Acid-fast bacilli isolated from culture media were identified by using cart test (MPB64, Capilla TB-Neo) and polymerase chain reaction (PCR) based reverse hybridization "line probe assay (LPA)" method (GenoType MycobacteriumCM/AS, Hain Lifescience, GmbH, Germany). After DNA isolation from the culture, PCR was performed by using the primers specific for mycobacterial 23S rRNA spacer region. PCR products were then hybridized with the probes specific for Mycobacterium species on nitrocellulose strips according to the recommendations of the manufacturer and the results were evaluated. In this study, Mycobacterium avium (n= 77, 17.7%), Mycobacterium intracellulare (n= 70, 16.1%), Mycobacterium szulgai (n= 19, 4.4%), Mycobacterium kansasii (n= 10, 2.3%) ve Mycobacterium smiae (n= 9, 2.1%) were isolated as slowly growing mycobacteria from the pulmonary patients. Susceptibility testing was performed in cation-adjusted Mueller-Hinton broth (CAMH), supplemented with "oleic acid, albumin dextrose catalase" according to CLSI/M24-A2 guideline recommendations. For the antibiotic susceptibility test, ready-to-use plaque drugs for slow-growing mycobacteria (SLOMYCO-Sensititre, TREK Diagnostic Systems Ltd, UK), were used. M.intracellulare, M.avium, M.kansasii and M.smiae isolates were found to be sensitive to clarithromycin %100, %99, %100 and %100, respectively. For M.intracellulare and M.avium isolates, moxifloxacin and linezolid sensitivity values were found to be 91%, 64% and 80%, 74% respectively. M.kansasii isolates were more sensitive than M.simiae isolates to the most of the drugs. M.kansasii isolates, were susceptible to rifabutin, rifampin, moxifloxacin, amikacin, linezolid, trimethoprim-sulfamethoxazole (TMP-SMX), ciprofloxacin and etambutol, with the frequencies of 100%, 90%, 100%, 100%, 80%, 70% and 50%, respectively. The study showed that the species identification and drug susceptibility testing of frequently isolated slow-growing NTM's from pulmonary specimens could guide for the treatment.
Keywords: Nontuberculous mycobacteria (NTM); drug susceptibility testing; pulmonary disease.
Geliş Tarihi (Received): 27.12.2018 - Kabul Ediliş Tarihi (Accepted): 21.03.2019
GİRİŞ
Mycobacterium tuberculosis complex (MTBC) dışındaki mikobakteriler t�berk�loz dışı mikobakteriler (TDM) olarak adlandırılırlar. TDM'lerin �oğu doğada yaygın olarak bulunur ve fırsat�ı patojenler olarak bilinirler1. TDM'ler son yıllarda klinik olgulardan daha sık izole edilmeye başlanmıştır. TDM'ler �oğunlukla akciğerlerde hastalık oluştururlar2-4. Tedaviye başlayabilmek i�in izole edilen etkenlerin t�r ayrımı yanında klinik ve radyolojik bulguların birlikte değerlendirilmesi gerekmektedir3,4.
TDM akciğer enfeksiyonlarının tedavisi zaman alıcı, zor ve maliyetlidir. Sıklıkla MAC (Mycobacterium avium, Mycobacterium intracellulare), Mycobacterium kansasii, Mycobacterium malmoense ve Mycobacterium xenopi gibi yavaş �reyen TDM'ler enfeksiyonlarda etken olarak bildirilmektedir2. Tedavileri, t�re �zg� �oklu ila� kullanımına dayanmaktadır. MAC, M.kansasii, M.malmoense ve M.xenopi i�in sıklıkla makrolidler, etambutol, rifampisin, rifabutin, Mycobacterium simiae'nın ise amikasin, linezolid, moksifloksasin ve trimetoprim-s�lfametoksazol (TMP-SMZ) kombinasyonları �nerilmektedir2,3. TDM'lere duyarlılık testi yapılmasının �nemi gittik�e artmaktadır2,3,5. �zellikle �nceden anti-mikobakteriyel ila�larla tedavi g�rm�ş hastalarda hedef ila�lara y�nelik duyarlılık testleri daha kritik değer taşımaktadır2,3. Bu �alışmada, hastanemizin merkezi tanı laboratuvarında akciğer �rneklerinden izole edilen TDM'lerin t�r ayrımınının yapılması ve standardize duyarlılık sonu�larının elde edilmesi ile tedaviye rehberlik etmedeki rol�n� g�stermek ama�lanmıştır.
GERE� ve Y�NTEM
�alışmaya Haziran 2014-Haziran 2018 tarihleri arasında hastanemize akciğer TB ş�phesiye başvuran hastalara ait �rnekler dahil edildi. Akciğer kaynaklı bu �rnekler NaOH-NALC y�ntemi sonrasında k�lt�rde saptanan �remeler aside diren�li boyama ve TB y�n�nden kart testine (MPB64, Capilla TB-Neo) alındı. K�lt�r i�in iki katı (Ogawa, L�wenstein-Jensen) ve bir sıvı otomatize k�lt�r sistemi (BACTEC-MGIT 960, Becton-Dicenton, ABD) kullanıldı. Kart testi negatif �rneklere t�r belirleme amacıyla "line probe assay" (GenoType/Mycobacterium-CM/AS, Hain-Lifescience, GmbH, Almanya) testi uygulandı. Bu işlem i�in k�lt�r �rneklerinden �nce DNA izolasyonu ve polimeraz zincir reaksiyonu (PCR) işleminden sonra elde edilen biyotinlenmiş �r�n nitrosel�l�z şeritler �zerinde �zg�l problarla hibridize edildi ve kolorimetrik olarak g�r�nt�lenerek değerlendirildi.
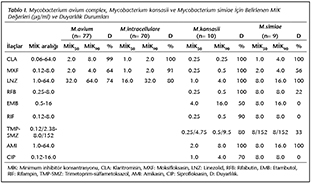
Duyarlılık testi, i�inde katlanarak artan ila� konsantrasyonları [klaritromisin (CLA; 0.06-64.0 �g/ml), rifabutin (RFB; 0.25-8.0 �g/ml), etambutol (EMB; 0.5-16.0 �g/ml), moksifloksasin (MXF; 0.12-8.0 �g/ml), rifampin (RIF; 0.12-8.0 �g/ml), trimetoprim/sulfametoksazol (TMP-SMZ; 0.12/2.38-8.0-152.0 �g/ml), amikasin (AMI; 1.0-64.0 �g/ml), linezolid (LZD; 1.0-64.0 �g/ml) ve siprofloksasin (CIP; 0.12-16.0 �g/ml)] bulunan U-tabanlı "SLOMYCO-Sensititre" (TREK Diagnostic Systems Ltd, Birleşik Krallık) hazır plakları kullanılarak yapıldı. Test i�in �nce 0.5 McFarland ayarına uygun bakteri s�spansiyonu hazırlandı. Bu s�spansiyondan 50 �l alınarak OADC ile zenginleştirilmiş katyon-ayarlı Mueller Hinton besiyerine (10 ml) ilave edildi. �oklu kanallı pipet kullanılarak her bir kuyucuğa 100 �l ekim yapıldı. Plaklar şeffaf �zel plastik ile kapatıldı. 35�C'de 7-14 g�n ink�be edildi. Y�ntemin uygulanması ve değerlendirilmesinde CLSI/M24-A2 rehberinde belirtilen �neriler esas alındı5.
BULGULAR
�alışmanın ger�ekleştirildiği d�nemde kontaminasyon olduğu d�ş�n�len izolatlar �alışma dışı bırakılarak toplam 435 adet TDM �rediği belirlenmiştir. Ayrıca, �alışmada �� ve daha az sayıda izole edilen TDM'ler değerlendirmeye alınmamıştır.
�alışmada klinikle uyumlu, patojen kabul edilen izolatların t�r ayrımı sonucunda M. avium (n= 77, %17.7), M.intracellulare (n= 70, %16.1), Mycobacterium szulgai (n= 19, %4.4), M.kansasii (n= 10, %2.3) ve M.smiae (n= 9, %2.1) t�rleri tanımlanmıştır.
MAC, M.kansasii ve M.smiae'nın klaritromisin i�in duyarlılık oranları sırasıyla ≥ %99, %100, %100 olarak bulunmuştur. MİK90 değerleri ise sırasıyla ≤ 8 �g/ml, 0.25 �g/ml ve ≤ 4 �g/ml olarak saptanmıştır. M.intracellulare ve M.avium'un ise moksifloksasine ve linezolide olan duyarlılıkları sırasıyla %91, %64 ve %80, %74 olarak bulunmuştur. �alışmada elde edilen sonu�lar Tablo I' de yer almaktadır.
TARTIŞMA
Akciğer enfeksiyonu yapan yavaş �reyen TDM'lerin epidemiyolojik dağılımı d�nyada b�lgesel olarak değişkenlik g�stermekte ancak sıklıkla MAC ve M.kansasii olguları bildirilmektedir6. �lkemizde yapılan bir �alışmada klinik �rneklerden MAC, M.kansasii, M.szulgai ve M.smiae'nin sırasıyla %26.6, %10, %6.7 ve %3.3 oranında izole edildiği bildirilmiştir7. �alışmamızda aynı bakteri t�rleri sırasıyla %33.8, %4.4, %2.3 ve %2.1 oranlarında saptanmıştır.
Yapılan antibiyotik duyarlılık �alışmalarında TDM'lerin MİK değerlerinin değişkenlik g�sterebildiği g�r�lmektedir. Litvinov ve arkadaşlarının yaptıkları bir �alışmada8 M.avium'un klaritromisin, moksifloksasin ve linezolid i�in MİK50-MİK90 değerleri sırasıyla 4.0-16.0 μg/ml, 2.0-4.0 μg/ml ve 32.0-64.0 μg/ml, M.intracellulare i�in ise sırasıyla 1.0-4.0 μg/ml, 2.0-4.0 μg/ml ve 16.0-32.0 μg/ml olarak bulunmuştur. Aynı �alışmada M.kansasii'nin klaritromisin, moksifloksasin, linezolid, rifabutin, etambutol, rifampisin, TMP-SMZ, amikasin ve siprofloksasin i�in MİK50-MİK90 değerleri sırasıyla 0.5-4.0 μg/ml, 0.5-4.0 μg/ml, 4.0-32.0 μg/ml, 0.25-2.0 μg/ml, 4.0-16.0 μg/ml, 0.25-2.0 μg/ml, 8.0/152.0-8.0/152.0 μg/ml, 8.0-32.0 μg/ml ve 4.0-16.0 μg/ml olarak saptanmıştır. Heidarieh ve arkadaşları9 M.kansasii'nin MİK değerlerini rifabutin (2.0-8.0 μg/ml), rifampisin (2.0-8.0 μg/ml) ve TMP-SMZ (8.0-16.0 μg/ml) i�in y�ksek, diğerlerinde ise d�ş�k tespit etmişlerdir. Bu �alışmada araştırmacılar ayrıca M.simiae'nın M.kansasii'ye g�re rifabutin (0.125-1.0 μg/ml) gibi birka� ila� hari� daha y�ksek MİK değerlerine sahip olduğunu g�stermişlerdir. �alışmamızda M.simiae'nın, test edilen t�m ila�larda daha y�ksek MİK değerlerine sahip olduğunu saptadık. Guna ve arkadaşları yaptıkları bir �alışmada10 M.kansasii'nin MİK50-MİK90 değerlerini klaritromisin, moksifloksasin, linezolid, etambutol ve rifampisin i�in sırasıyla < 0.06-0.125 μg/ml, < 0.06-0.125 μg/ml, 0.5-1.0� μg/ml, 4.0-4.0 μg/ml, 0.125-0.25 μg/ml olarak bildirmişlerdir. Heidarieh ve arkadaşlarının9 verilerinin aksine, �alışmamız ve diğer bir�ok araştırmacıların sonu�ları8,10 MAC ve M.kansasii'nin klaritromisine duyarlılığının y�ksek olduğunu g�stermektedir. M.simiae'nın kinolon, etambutol, TMP-SMZ, rifabutin ve rifampisine karşı saptadığımız farklı duyarlılık/diren� sonu�ları ise Heidarieh ve arkadaşlarının9 verilerine yakın bulunmuştur. Diğer araştırmacılar ile �alışmamızdaki duyarlılık sonu�ları arasındaki farklılıklar b�y�k olasılıkla kullanılan y�ntem, izolat sayısı ve/veya izolatların �zellikleri gibi fakt�rlerden kaynaklanmaktadır8-10.
Sonu� olarak, �alışmamız akciğer enfeksiyonlarından izole edilen TDM'lerin t�r ayrımlarının ve duyarlılık testlerinin yapılmasının �nemini ortaya koymuştur. Bu �alışmada, "SLOMYCO-Sensititre"nin bazı hedef ila�lar i�in uygulanmasının ve değerlendirmesinin kolay, standardize bir y�ntem olduğu ve maliyet dikkate alınarak klinisyene yol g�sterebileği sonucuna varılmıştır.
�IKAR �ATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir �ıkar �atışması bildirmemişlerdir.
KAYNAKLAR
- Pfyffer GE, Mycobacterium: General Characteristics, Laboratory Detection, and Staining Procedures, pp:536-69. In: Jorgensen JH, Pfaller MA (eds), Manual of Clinical Microbiology. 2015, 11th ed. American Society for Microbiology Press Washington DC.
- Wassilew N, Hoffmann H, Andrejak C, Lange C. Pulmonary disease caused by non-tuberculous mycobacteria. Respiration 2016;91(5):386-402.
- Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An Official ATS/IDSA Statement: Diagnosis, Treatment, and Prevention of Nontuberculous Mycobacterial Diseases. Am J Respir Crit Care Med 2007;175(4):367-416.
- Somoskovi A, Salfinger M. Nontuberculous mycobacteria in respiratory infections advances in diagnosis and identification. Clin Lab Med 2014;34(2):271-95.
- Clinical and Laboratory Standards Institute. Susceptibility Testing of Mycobacteria, Nocardiae and Other Aerobic Actinomycetes, Approved Standard CLSI Documents M24-A2. 2011, 2nd ed. Clinical and Laboratory Standards Institute. Wayne, Pennsylvania.
- Prevots DR, Marras TK. Epidemiology of human pulmonary infection with nontuberculous mycobacteria: a review. Clin Chest Med 2015;36(1):13-34.
- Bi�men C, Coşkun M, G�nd�z AT, Senol G, Cirak AK, Tibet G. Identification of atypical mycobacteria isolated from clinical specimens by line probe assay (LIPA). Mikrobiyol Bul 2007;41(4):503-10.
- Litvinov V, Makarova M, Galkina K, Khachaturiants E, Krasnova M, Guntupova L, et al. Drug susceptibility testing of slowly growing non-tuberculous mycobacteria using SlomycoTest-System. PLoS One 2018;13(9):e0203108.
- Heidarieh P, Mirsaeidi M, Hashemzadeh M, Feizabadi MM, Bostanabad SZ, Nobar MG, et al. In-vitro antimicrobial susceptibility of nontuberculous mycobacteria in Iran. Microb Drug Resist 2016;22(2):172-8.
- Guna R, Munoz C, Dominguez V, Garcia-Garcia A, Galvez J, de Julian-Ortiz JV, et al. In-vitro activity of linezolid, clarithromycin and moxifloxacin against clinical isolates of Mycobacterium kansasii. J Antimicrob Chemother 2005;55(6):950-3.
İletişim (Correspondence):
Do�. Dr. İsmail Ceyhan,
Balıkesir �niversitesi Tıp Fak�ltesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
�ağış Yerleşkesi, Balıkesir, T�rkiye.
Tel (Phone): +90 266 612 3770
E-posta (E-mail): isceyhan@gmail.com