Marmara Üniversitesi Hastanesinde Yatan İshalli
Hastalardan İzole Edilen
Clostridium difficile Kökenlerinde Toksin Genlerinin Araştırılması*
Investigation
of Toxin Genes of Clostridium difficile Strains Isolated from
Hospitalized
Patients with Diarrhoea at Marmara University Hospital
Umut DENİZ1, Nurver ÜLGER1, Burak AKSU1, Melda KARAVUŞ2, Güner SÖYLETİR1
1 Marmara Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
1 Marmara University Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
2 Marmara Üniversitesi Tıp Fakültesi, Halk Sağlığı Anabilim Dalı, İstanbul.
2 Marmara University Faculty of Medicine, Department of Public Health, Istanbul, Turkey.
* Bu çalışma, 19. ESCMID Kongresi (16-19 May 2009, Helsinki, Finland)'nde poster (P781) olarak sunulmuştur.
ÖZET
Toksijenik Clostridium difficile kökenleri kendiliğinden iyileşen ishalden, yaşamı tehdit eden kolite kadar değişen antibiyotikle ilişkili hastalıklara yol açmaktadır. Bu enfeksiyonların patogenezinde, bakteri tarafından üretilen toksin A ve toksin B büyük rol oynamaktadır. Ancak son yıllarda, bazı ülkelerde, virülansı yüksek yeni C.difficile kökenlerine (varyant toksin veya binary toksin pozitif) bağlı, antibiyotik ile ilişkili ishal epidemileri tanımlanmıştır. Bu çalışmada, hastanemizde yatan ishalli hastalardan izole edilen C.difficile kökenlerinin toksin gen profillerinin araştırılması amaçlanmıştır. Çalışmaya, Eylül 2006-Mart 2008 tarihleri arasında Marmara Üniversitesi Hastanesinde yatan, ishali olan 633 hastanın dışkı örnekleri dahil edilmiştir. Tüm örneklerde C.difficile toksin varlığı, ticari bir enzim immünoassay (ImmunoCard Toxins A&B EIA; Meridian Diagnostics, Belçika) kiti ile araştırılmıştır. Örneklerin kültürü sikloserin-sefoksitin-fruktoz agar (CCFA; BioMerieux, Fransa) kullanılarak anaerop koşullarda yapılmış; izolatlar, klasik yöntemlerle ve Rapid ID 32A (BioMerieux, Fransa) kiti ile tanımlanmıştır. Dışkı örneklerinden izole edilen C.difficile kökenlerinin toksin üretimi "Triage C.difficile Panel" (Biosite Diagnostics, İtalya) ve "ImmunoCard Toxins A&B EIA" (Meridian Diagnostics, Belçika) ticari kitleri ile; toksin A (tcdA), toksin B (tcdB) ve binary toksin (cdtA ve cdtB) genleri ise "in-house" polimeraz zincir reaksiyonu (PCR) ile araştırılmıştır. Çalışmamızda, 26'sı erkek ve yaş ortalaması: 35.9 ± 27.6 yıl (yaş aralığı 2-> 65 yıl) olan 50 (%7.9) hastanın dışkı örneğinden C.difficile üretilmiştir. İzole edilen tüm kökenlerde (n= 50), "Triage C.difficile Panel" kiti ile glutamat dehidrogenaz enzimi pozitif bulunmuş, aynı kit ile bunların 28 (%56)'inde toksin A varlığı da saptanmıştır. Doğrudan dışkı örneklerine uygulanan EIA testi ile toksin pozitiflik oranı %4.7 (30/633) olarak saptanmış, buna karşın C.difficile izolatlarından (n= 50) hazırlanan kültür filtratlarında aynı yöntemle toksin pozitifliği %5.7 (36/633) olarak bulunmuştur. Buna göre, EIA kitinin dışkı örneklerinde toksini belirleme açısından duyarlılığının %85.7 olduğu belirlenmiştir. Kültür filtratlarında toksin pozitifliği saptanan 36 kökenin hepsinde PCR ile toksin A ve toksin B genlerinin (tcdA+/tcdB+) varlığı tespit edilmiştir. İzolatlar arasında varyant kökenlere (tcdA-/tcdB+) veya binary toksin genine sahip kökenlere rastlanmamıştır. Çalışmamızda ayrıca, toksijenik C.difficile izole edilen hastaların %77.8 (28/36)'inin beta-laktam grubu (penisilin, sefalosporin ve imipenem) antibiyotik kullanım öyküsü olduğu görülmüştür. Sonuç olarak, hastanemizde yatan ishalli hastalara ait C.difficile izolatlarının toksin gen profilleri ile ilgili olarak elde edilen bulgularımız, gerek hastanemizin gerekse ülkemizin veri tabanları için bir kaynak oluşturacaktır. Şu an için varyant kökenler veya binary toksin genine sahip kökenlerle ilgili bir risk mevcut olmamakla birlikte, ileride oluşabilecek salgınların kontrolünde bu tip araştırmaların sürdürülmesi ve izolatların özelliklerinin izlenmesinin önemli olduğu kanısına varılmıştır.
Anahtar sözcükler: Clostridium difficile; toksin A; toksin B; binary toksin.
ABSTRACT
Toxigenic Clostridium difficile strains cause a spectrum of antibiotic-associated diseases ranging from self-limited diarrhea to severe life-threatening colitis. Pathogenesis primarily involves the action of two important cytotoxins, namely toxin A and toxin B. However, epidemics of C.difficile-associated disease due to the novel, highly virulent strains of C.difficile (binary toxin positive and toxin A variant) have been recognised in hospitals of some countries. The aim of this study was to investigate the toxin gene profiles of C.difficile strains isolated from hospitalized patients with diarrhea. The stool specimens collected from 633 inpatients at Marmara University Hospital, Istanbul, Turkey, between September 2006-March 2008, were included to the study. The presence of C.difficile toxins in the samples has been screened by a commercial enzyme immunoassay kit (ImmunoCard Toxins A&B EIA; Meridian Diagnostics, Belgium). Stool samples were also cultivated on cycloserin-cefoxitin-fructose agar (CCFA; BioMerieux, France) at anaerobic conditions, and the isolates were identified by conventional methods and Rapid ID 32A (BioMerieux, France) system. Toxin production of C.difficile strains isolated from stool cultures have been detected by commercially available "Triage C.difficile Panel" (Biosite Diagnostics, Italy) and "ImmunoCard Toxins A&B EIA" (Meridian Diagnostics, Belgium) kits. In-house polymerase chain reaction (PCR) was performed to investigate the presence of genes for toxin A (tcdA), toxin B (tcdB) and binary toxin (cdtA and cdtB). Stool specimens from 50 (7.9%) patients (age range: 2-> 65 years; mean age: 35.9 ± 27.6 years; 26 were male) yielded C.difficile in culture. All of 50 isolates were found positive for glutamate dehydrogenase enzyme and 28 (56%) were found positive for toxin A with "Triage C.difficile Panel" kit. Toxin positivity rate was detected as 4.7% (30/633) with EIA test performed in stool samples directly, however this rate was 5.7% (36/633) in culture filtrates of the isolates (n= 50), with the same test. Since EIA test yielded false negative results in six samples, the sensitivity of this test was estimated as 85.7% by means of the detection of toxin in direct stool samples. All of the 36 toxin-producing C.difficile isolates were found positive for toxin A and toxin B genes (tcdA+/tcdB+), however there were neither variant strains (tcdA-/tcdB+) nor binary toxin gene positive isolates among tested bacteria. Our results have also indicated that 77.8% (28/36) of patients who harbored toxigenic C.difficile strains have the history of beta-lactam antibiotic (penicillin, cephalosporin and imipenem) use. It was thought that the data of this study would constitute a database on the toxin gene profiles of C.difficile in hospitalized patients with diarrhea both in our hospital and Turkey. The current data have indicated that for the time being there were no risk for isolates producing new toxin variants or binary toxin, however, continuous monitorization of such C.difficile strains is of crucial importance in order to detect the emergence of those strains and establish necessary control and preventive measures.
Key words: Clostridium difficile; toxin A; toxin B; binary toxin; Turkey.
Geliş Tarihi (Received): 31.08.2010 • Kabul Ediliş Tarihi (Accepted): 25.11.2010
GİRİŞ
Anaerop, sporlu, gram-pozitif bir bakteri olan Clostridium difficile kökenlerinin, antibiyotikle ilişkili ishale neden oldukları ilk kez 1977 yılında gösterilmiştir1. C.difficile enfeksiyonlarının yakından takip edildiği ülkelerde, 1990'lı yıllarda bu enfeksiyonların insidansında bir artışın başladığı, 2006 ve 2007 yıllarında artış oranının en üst seviyeye ulaştığı belirlenmiştir2. Bazı Avrupa ve Kuzey Amerika ülkelerinde salgınlara yol açan, ağır seyirli enfeksiyonlara neden olan endemik kökenler tanımlanmıştır. Virülansı yüksek bu C.difficile 027/NAP1/BI kökenlerinin diğer bölgelere de yayıldığı ve tüm dünya ülkeleri için tehdit oluşturduğu görülmektedir3.
Antibiyotikle ilişkili ishale neden olan C.difficile kökenleri, Toksin-A (Tox-A) ve Toksin-B (Tox-B) olarak adlandırılan iki farklı toksin üretmektedir. Etki mekanizmaları benzer olan bu toksinler, endositozla bağırsak epitel hücresine girmekte ve hücrede aktin iskeletini etkileyerek hücre ölümüne neden olmaktadır. Toksinlerin, aynı zamanda birtakım sitokinlerin salgılanmasına, böylece inflamatuvar yanıtın gelişmesine ve psödomembranların oluşmasına yol açtıkları da anlaşılmıştır4. Önceleri, Tox-A'nın bağırsak epitelinde zedelenme oluşturduğu, ardından Tox-B'nin etkisini gösterdiği, dolayısıyla Tox-B'nin tek başına aktif olamayacağı düşünülmekte iken, moleküler tekniklerin gelişmesiyle, Tox-A olmaksızın Tox-B'nin sitotoksik etki gösterdiği anlaşılmıştır4. Son yıllarda yapılan araştırmalarda, sadece Tox-B üreten kökenler tanımlanmış, bunun yanı sıra başka birtakım varyant kökenler de bildirilmiştir. Bazı kökenlerin fazla miktarda Tox-A ve Tox-B salgıladığı, bunlarda toksin ekspresyonu üzerinde negatif regülasyon yapan tcdC geninde bozukluk olduğu tespit edilmiştir. Çeşitli ülkelerde hastane salgınlarına yol açan virülansı yüksek 027/NAP1/BI kökeninin, tcdC geninde delesyon olduğu, buna bağlı olarak yüksek düzeyde Tox-A ve Tox-B salgıladığı belirlenmiştir. 027/NAP1/BI kökeninin aynı zamanda binary toksin (B-Tox) olarak tanımlanan üçüncü bir toksin ürettiği de gösterilmiştir3. B-Tox üreten C.difficile kökeni ilk kez 1988 yılında Popoff ve arkadaşları5 tarafından psödomembranöz kolitli bir hastadan izole edilmiştir. Yapılan çalışmalarda B-Tox'in, aktine özgül ADP-ribozil transferaz aktivitesine sahip olduğu, aktin monomerinin ADP ribozillenmesini sağlayarak hücre iskeletinde bozulmaya neden olduğu anlaşılmıştır. Farklı bir gen; CDT ile eksprese olan B-Tox, C.difficile kökenlerinde tek başına bulunabildiği gibi, diğer toksin A ve B salgılayan veya varyant kökenlerde de bulunabilmektedir.
Bu çalışmada, hastanede yatan ishalli hastaların dışkı örneklerinden izole edilen C.difficile kökenlerinde, polimeraz zincir reaksiyonu (PCR) yöntemiyle Tox-A, Tox-B ve B-Tox genleri incelenmiş, kökenlerin toksin profili belirlenmiş ve varyant gen veya binary toksin genleri taşıyıp taşımadıkları araştırılmıştır.
GEREÇ ve YÖNTEM
Araştırma Etik Kurulu tarafından 02.05.2008 tarih ve B.30.2.MAR.0.01.02/AEK/302 sayılı karar ile onaylanan bu çalışmaya, Eylül 2006-Mart 2008 tarihleri arasında Marmara Üniversitesi Hastanesi, Mikrobiyoloji Laboratuvarına toksin incelemesi isteği ile gönderilen dışkı örnekleri dahil edildi. Kültür için, dışkı örnekleri gerek doğrudan, gerekse alkol şok işlemi uygulandıktan sonra sikloserin-sefoksitin-fruktoz agara (CCFA; BioMerieux, Fransa) ekildi ve anaerop ortamda inkübasyona bırakıldı6. Ard arda gönderilen dışkı örneklerinden üretilen aynı hastaya ait C.difficile izolatlarından birisi çalışmaya alındı; iki yaş altındaki hastalara ait örnekler çalışma dışında tutuldu.
İzole edilen kökenler, geleneksel yöntemler (koloni morfolojisi, karakteristik kötü koku, mikroskopik görünüm) ve Rapid ID 32A (BioMerieux, Fransa) kiti ile biyokimyasal reaksiyonları değerlendirilerek tanımlandı6. Aynı zamanda Tox-A varlığını da saptayan, bakteri yapısında bulunan glutamat dehidrogenaza karşı özgül antikorları içeren ticari bir kit (Triage C.difficile Panel; Biosite Diagnostics, İtalya) kullanılarak C.difficile tanısı doğrulandı.
Toksin varlığı, ticari bir enzim immunoassay (EIA) kiti ile hem doğrudan dışkı örneklerinden hem de bakteri kültür filtratından, üretici firmanın (ImmunoCard Toxins A&B, Meridian Diagnostics, Belçika) önerilerine göre araştırıldı. Bakteri kültür filtratının hazırlanması için, izole edilen C.difficile kökenleri beyin-kalp-infüzyon sıvı besiyerine (BHIB; Becton Dickinson, Almanya) ekildi ve anaerop ortamda beş gün inkübe edildi. Elde edilen kültürlerin 3000 rpm'de 20 dakika santrifüj sonrasında üst sıvısı alınarak çalışıldı7.
Toksin genlerinin saptanması için, C.difficile kolonisinden alınarak, 200 µl, DNAaz-RNAaz içermeyen suda, McFarland 1 (3 x 108 kob/ml) bulanıklığında süspansiyon hazırlandı. Süspansiyon 20 dakika 95°C'de ısıtıldıktan sonra iki dakika 10.000 rpm'de çevrilerek, bakteri DNA'sının bulunduğu üst sıvı kullanıldı8. Uygun primerler kullanılarak PCR ile toksin genlerinin (tcdA, tcdB, CdtA ve CdtB) varlığını araştırıldı9,10 (Tablo I). Pozitif kontrol olarak, toksin A ve B üreten NCTC 11223 (Prof. Dr. M. Yücesoy; Dokuz Eylül Üniversitesi Tıp Fakültesi Mikrobiyoloji Anabilim Dalından temin edilmiştir) ve binary toksin üreten HU 25591 (Prof. Dr. E. Nagy; Szeged Üniversitesi, Klinik Mikrobiyoloji Enstitüsü, Macaristan'dan temin edilmiştir) C.difficile kökenleri kullanıldı. Elde edilen PCR ürünleri, etidyum bromür eklenmiş %2'lik agaroz jelde yürütülerek oluşan bantlar değerlendirildi.
Örneklerinden C.difficile üretilen hastaların laboratuvar bulguları [kanda polimorfonükleer lökosit (PMNL) sayısı, dışkıda lökosit varlığı] ve risk faktörleri (ishal öncesi antibiyotik kullanma öyküsü, altta yatan hastalık varlığı, kemoterapi öyküsü) derlenerek elde edilen verilerle birlikte değerlendirildi. İstatistiksel değerlendirmede Pearson's X2 ve Fisher's exact testleri uygulandı ve p< 0.05 değeri anlamlı kabul edildi.
BULGULAR
Çalışmaya alınan 633 dışkı örneğinden toplam 50 (%7.9) C.difficile kökeni izole edilmiştir. Örneklerinden C.difficile izole edilen 50 hastanın yaş ortalaması 35.94 ± 27.67 yıl olup 26 (%52)'sı erkek, 24 (%48)'ü kadındır. Hastaların 20 (%40)'si çocuk (2-18 yaş), 30 (%60)'u ise erişkin (19-> 65 yaş) yaş grubuna dahildir. Olguların 22 (%44)'si dahili bilimler, 20 (%40)'si çocuk hastalıkları, 6 (%12)'sı cerrahi bilimler, 2 (%4)'si ise yoğun bakım ünitesinde yatan hastalardır.
İzole edilen tüm kökenlerde (n= 50), "Triage C.difficile Panel" kiti ile glutamat dehidrogenaz enzimi pozitif bulunmuş, aynı kit ile bunların 28 (%56)'inde Tox-A varlığı da saptanmıştır.
Dışkı örneklerinin doğrudan EIA testi ile çalışılması sonunda, toksin pozitifliği %4.7 (30/633) olarak tespit edilmiştir. Dışkı örneğinde toksin pozitif bulunan ve kültür filtratında toksin saptanmayan örnek olmazken, dışkı örneğinde toksin saptanmayan hastaların altısından elde edilen izolatlarda (kültür filtratında) toksin pozitif bulunmuştur. Dolayısıyla çalışmamızda, EIA testi, hem dışkıdan hem de izole edilen C.difficile'nin kültür filtratlarından toksin varlığını araştırmak için kullanılmış, 6 (%16.6) hastanın dışkı örneğinde yalancı negatiflik saptanmıştır. Buna göre EIA kitinin, dışkı örneklerinde toksini belirleme açısından duyarlılığı %85.7, seçiciliği %100, pozitif prediktif değeri %100, negatif prediktif değeri ise %99 olarak hesaplanmıştır.
Her iki ticari kit ile elde edilen sonuçlar karşılaştırıldığında, Tox-A'yı tespit eden "Triage C.difficile Panel" (Biosite Diagnostics, İtalya) ile 28 izolat pozitif bulunmuş, aynı izolatlar "ImmunoCard Toxins A&B" (Meridian Diagnostics, Belçika) kiti ile de pozitif saptanmıştır. Sonuçlardaki bu farklılıktan yola çıkarak; ilk kitin saptayamadığı ancak ikinci kit ile pozitif saptanan iki kökenin varyant kökenler (Toksin A negatif/Toksin B pozitif) olabileceği varsayımında bulunulmuştur.
Toksin genlerini saptamaya yönelik yapılan PCR testinde, 36 (%72) hastadan izole edilen kökenlerde hem Tox-A hem de Tox-B genlerinin varlığı tanımlanmış, B-Tox ise hiçbir kökende saptanamamıştır. EIA kitiyle pozitif bulunan kökenler (n= 30), PCR ile de toksin A ve B genleri açısından pozitif bulunmuştur. Bunun yanı sıra "Triage C.difficile Panel" kiti ile toksin saptanamayan sekiz kökende de PCR ile tcdA geni belirlenmiş, dolayısıyla Tox-A varyant kökenlerine rastlanmamıştır.
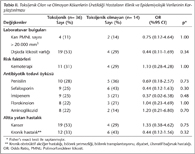
Hasta bilgileri, antibiyotik kullanımı ile ilişkili ishal gelişimi yönünden irdelendiğinde, beta-laktam grubu antibiyotiklerin öne çıktığı gözlenmiş, bunu florokinolonlar ve aminoglikozidler izlemiştir. Hastaların 28'inde tek, 17'sinde çoklu (11'inde ikili, altısında ise üçlü) antibiyotik kullanımı söz konusu iken, beş hastada herhangi bir antibiyotik kullanım öyküsü saptanmamıştır. Toksijenik ve nontoksijenik kökenlerin üretildiği hastalar, lökositoz ve risk faktörlerinin varlığı gibi diğer sorgulanan değişkenler açısından karşılaştırıldığında istatistiksel olarak anlamlı bir fark bulunamamıştır (Tablo II).
TARTIŞMA
Ülkelere ve merkezlere göre değişiklik göstermekle beraber, son dönemlerde C.difficile enfeksiyonlarının morbidite ve mortalitesinde belirgin bir artış gözlenmektedir11,12,13,14. Bu artışta, mikroorganizmanın virülansındaki farklılıklar ve uygulanan antibiyotik tedavisindeki değişikliklerin önemli rolü vardır11. Özellikle 2000'li yılların ilk yarısında, dünyanın çeşitli ülkelerinden virülansı yüksek C.difficile 027/NAP1/BI kökenine bağlı, mortalite oranı yüksek salgınlar bildirilmiştir12.
Hastanede yatan ishalli hastaların dışkı örneklerinden C.difficile izolasyonu, izolatların toksin üretiminin saptanması ve PCR ile toksin genlerinin araştırılmasının amaçlandığı bu çalışmada, 2006-2008 yılları arasında laboratuvarımıza gönderilen 633 hastaya ait dışkı örneğinin 50 (%7.8)'sinden C.difficile üretilmiş ve kökenlerin 36 (%72)'sının toksijenik olduğu saptanmıştır. 1996 yılında hastanemizde yapılan benzer çalışmada da, C.difficile ile kolonizasyon oranı %6.9 (14/202) olarak saptanmış, bu kökenlerin %71.4'ünde toksin pozitifliği bulunmuştur15. Elde ettiğimiz sonuçlar, hastanemizde yapılan önceki çalışmanın sonuçlarıyla benzerlik göstermektedir.
C.difficile'ye bağlı ishal oluşumunda en önemli risk faktörlerinden birisi antibiyotik kullanımıdır. Kullanılan antibiyotikler, ülkeden ülkeye, hastaneden hastaneye, hatta aynı hastanede servisler arasında bile farklılık göstermektedir4. Macaristan'da yapılan bir çalışmada, en sık beta-laktam grubu antibiyotiklerin, ikinci olarak da kinolon kullanımının C.difficile enfeksiyonuna yol açtığı bildirilmiştir16. İsveç'te beş büyük hastanenin yer aldığı çok merkezli bir çalışmada, trimetoprim-sülfametoksazol, piperasilin, sefalosporin ve klindamisinin kullanılmasıyla C.difficile enfeksiyonu riskinin arttığı gösterilmiştir17. Ülkemizde Ercis ve arkadaşları18 tarafından yapılan çalışmada, psödomembranöz kolitli 68 hastanın büyük çoğunluğunun (n= 32) beta-laktam/beta-laktamaz inhibitör kombinasyonları kullandığı, bunu aminoglikozid (n= 12) ve sefalosporin (n= 8) kullanan hastaların izlediği bildirilmiştir18. Altındiş ve arkadaşlarının19 2007 yılında yaptığı çalışmada ise, C.difficile izolasyon oranı %14.3 (13/91) olarak saptanmış; hastaların %84.6 (11/13)'sının ampisilin/sulbaktam kullandığı belirtilmiştir. Benzer şekilde çalışmamızda, toksijenik C.difficile izole edilen hastaların büyük çoğunluğunun (28/36) beta-laktam grubu (penisilin, sefalosporin ve imipenem) antibiyotikleri kullandıkları görülmüştür (Tablo II).
C.difficile'ye bağlı ishallerin gelişmesinde rol oynayan diğer bir risk faktörü, altta yatan ciddi hastalıkların varlığıdır. Kronik hastalığı olanların daha sık ve daha uzun süre hastanede yatırılmaları, genelde yaşlı ve düşkün olan bu tip hastaların temel kişisel temizliklerini yeterince yapamamaları C.difficile ile kolonize olma olasılığını artırmakta; kişiyi enfeksiyonlara açık hale getirmektedir20. Buchner ve arkadaşlarının21 çalışmasında, kanser, kemoterapi, solunum yolu enfeksiyonları ve böbrek yetmezliği gibi çeşitli hastalıkların C.difficile enfeksiyonları riskini artırdığı gösterilmiştir. Wroblewska ve arkadaşlarının22, 1998-2002 yılları arasında hastanede yatan yetişkin hastalarda yaptıkları çalışmada, toksin pozitif C.difficile izolatlarının en fazla hematoloji/onkoloji servislerinde (%51) görüldüğü bildirilmektedir. Çalışmamızda da, toksijenik C.difficile üretilen hastaların 19'unda kanser, 12'sinde kronik hastalık olmak üzere %86'sında altta yatan hastalık mevcuttur.
Son yıllarda pediatri servislerinde de C.difficile enfeksiyonu görülme sıklığında artış olduğu bildirilmekte ve bu hasta grubunun da yakından izlenmesi önerilmektedir23. Hastanemizde, dışkı örneğinden C.difficile üretilen hastaların 20 (%40)'sinin pediatri servislerinde yatan hastalar olduğu izlenmiş ve bunların da %45'inde malignite, %20'sinde ise kalıtsal bir defektin varlığı saptanmıştır. Dolayısıyla, hastanede uzun süre yatmayı gerektiren hastalıkların bulunması nedeniyle pediatri servisinin de C.difficile yönünden daha sıkı takip edilmesi gerekmektedir.
Yıllar içinde C.difficile'de toksin üretimini araştıran farklı yöntemler geliştirilmiş; önceleri sadece Tox-A'yı daha sonraları toksin A ve B'yi birlikte saptayan kitler hazırlanmış ve referans olarak kabul edilen sitotoksisite yöntemi ile karşılaştırmaları yapılmıştır. Bu yöntemlerin duyarlılıkları %66-93, özgüllükleri ise %89-99 arasında bildirilmektedir24. Çalışmamızda, dışkı kültürlerinde üretilen C.difficile kökenlerinin 28 (%56)'i, Tox-A'yı saptayan "Triage C.difficile Panel" ile, 36 (%72)'sı ise her iki toksini de saptayan "ImmunoCard Toxins A&B EIA" kiti ile pozitif bulunmuştur. "Triage C.difficile Panel" kitiyle negatif bulunan sekiz kökende, PCR yöntemiyle Tox-A geninin saptanması, kitin duyarlılığının düşük olmasına bağlanmış ve bu testlerin fenotipik olarak varyant kökenlerin ayırımında yeterli olamayacağını düşündürmüştür.
Çalışmamızda "ImmunoCard Toxins A&B EIA" kiti ile 633 dışkı örneğinin 30'unda toksin varlığı saptanmıştır. Dışkı kültürlerinden izole edilen C.difficile kökenlerinde yine aynı kit ile toksin yapımı araştırıldığında, dışkı örneklerinin negatif saptanmasına karşın altı kökende toksin pozitif bulunmuştur. Yapılan bazı çalışmalarda, rutin incelemelerde dışkı örneklerinde toksin bulunmamasına karşın, izole edilen C.difficile kökenlerinde toksin pozitifliğinin saptanabildiği ve bu durumun dışkı örneğinin nakli sırasında, ısı değişikliği veya fekal proteolitik enzimlerin etkisiyle toksin yapısındaki bozulmadan kaynaklanabileceği vurgulanmaktadır25,26. Bizim çalışmamızda, C.difficile kültür filtratında toksin pozitifliğinin, doğrudan dışkı örneklerinde saptananlara göre daha fazla olması, rutinde EIA analiziyle beraber dışkıda C.difficile kültürünün yapılması gerekliliğini bir kez daha ortaya koymaktadır. Ancak anaerop kültür yöntemleri, zahmetli ve zaman alıcı olması ve özel donanım gerektirmesi nedeniyle birçok laboratuvarda uygulanmamaktadır. Bu nedenle, klinisyenle iyi bir iletişim kurularak dışkı örneğinin uygun şekilde alınıp, laboratuvara en kısa sürede nakledilmesi sağlanmalı, gerektiğinde örnek tekrar alınmalı ve böylece toksinin saptanma olasılığı artırılmalıdır.
Bazı C.difficile kökenlerinin klasik olarak bilinen Tox-A (tcdA) ve Tox-B (tcdB) dışında binary toksin (B-Tox) salgıladıkları bildirilmiştir10. B-Tox varlığının saptanması için geliştirilmiş ticari bir kit henüz mevcut değildir. Toksin A ve B'nin negatif olduğu, ancak hücre kültüründe sitotoksik etkinin gözlendiği durumlarda B-Tox'dan kuşkulanılmakta ve tanıya gitmek için PCR ile B-Tox geni (Cdt A ve Cdt B) araştırılmaktadır. PCR yöntemi, tcdA, tcd B, Cdt A ve Cdt B genlerine sahip kökenlerin yanı sıra tcdA-/tcdB+ gibi birtakım varyant kökenleri de belirleyebilir26. Polonya'da yapılan bir çalışmada, 58 toksijenik C.difficile kökeninin 41'inde tcdA+/B+ genleri saptanmış; bunların 5 (5/58; %8.6)'inde aynı zamanda B-Tox geni de bulunmuş; diğer 17 kökende ise tcd A-/B+ şeklinde gen varyantları tespit edilmiştir27. Fransa'da, enfeksiyon etkeni toksijenik C.difficile kökenlerinde toksin genlerinin araştırıldığı çalışmada, B-Tox prevalansı %6 (22/369) olarak saptanmış, bu 22 kökenin aynı zamanda tcdA ve tcdB geni de taşıdığı bildirilmiştir28. Türkiye'nin de aralarında bulunduğu 14 Avrupa ülkesinden 38 hastanenin yer aldığı çok merkezli bir çalışmada, 2005 yılında iki aylık zaman diliminde 411 ishalli hastadan üretilen C.difficile kökenleri incelenmiştir29. Bunlardan 354'ü toksijenik olup, %24.3'ü varyant gene sahip bulunmuştur. B-Tox geni, toksijenik kökenlerin %17.2'sinde tespit edilmiş, bu geni taşıyan kökenlerin hepsinde aynı zamanda toksin A-/B+ varyant genleri de gözlenmiştir29. Hastanemizden gönderilen kökenler de dahil olmak üzere, Türkiye'den izole edilmiş kökenler içerisinde varyant köken ve B-Tox genine sahip bakteriye rastlanmamıştır.
Bizim yaptığımız bu çalışmada, izole edilen 50 kökenin, PCR ile toksin geni saptanan 36'sının hepsinde tcdA ve tcdB geni birlikte bulunmuş; hiçbirinde varyant gen veya B-Tox genine rastlanmamıştır. Ancak yine de, toksin araştırılması isteği ile laboratuvara gelen dışkı örneklerinin, gerek yalancı negatifliğin önüne geçmek gerekse epidemiyolojik ve antibiyotiklere duyarlılık durumlarını saptayabilmek için kültürünün rutin olarak yapılması ve bakterilerin özelliklerinin yakından takip edilmesi gerektiği kanısına varılmıştır. C.difficile için yeni ortaya çıkabilecek epidemik kökenlerin saptanması, oluşabilecek değişikliğin zamanında tespit ve kontrol edilmesi açısından kökenlerin toksin genotiplerinin bilinmesi önemlidir. Sonuçlarımızın hastanemiz için bir veri tabanı oluşturacağına ve ülkemizde C.difficile toksin genleriyle ilgili yapılacak çalışmalarda kaynak teşkil edeceğine inanmaktayız.
KAYNAKLAR
- Bartlett JG. Historical perspectives on studies of Clostridium difficile and C.difficile infection. Clin Infect Dis 2008; 46(Suppl 1): S4-11. [Özet] [Tam Metin] [PDF]
- Pearson A. Historical and changing epidemiology of healthcare-associated infections. J Hosp Infect 2009; 73(4): 296-304. [Özet]
- O'Connor JR, Johnson S, Gerding DN. Clostridium difficile infection caused by the epidemic BI/NAP1/027 strain. Gastroenterology 2009; 136(6): 1913-24. [Özet]
- Poxton IR, McCoubrey J, Blair G. The pathogenicity of Clostridium difficile. Clin Microbiol Infect 2001; 7(8): 421-7. [Özet] [Tam Metin] [PDF]
- Popoff MR, Rubin EJ, Gill DM, Boquet P. Actin-specific ADP-ribosyltransferase produced by a Clostridium difficile strain. Infect Immun 1988; 56(9): 2299-306. [Özet] [PDF]
- Summanen P, Baron EJ, Citron DM, Wexler HM, Finegold SM (eds), Laboratory tests for diagnosis of Clostridium difficile enteric disease, pp: 133-41. In: Wadsworth Anaerobic Bacteriology Manual. 1993, 5th ed. Star Publishing Company, California, USA.
- Yücesoy M, McCoubrey J, Brown R, Poxton RI. Detection of toxin production in Clostridium difficile strains by three different metods. Clin Microbiol Infect 2002; 8(7): 413-8. [Özet] [Tam Metin] [PDF]
- Kato H, Kato N, Watanabe K, et al. Identification of toxin A-negative, toxin B-positive Clostridium difficile by PCR. J Clin Microbiol 1998; 36(8): 2178-82. [Özet] [Tam Metin] [PDF]
- Kato N, Ou CY, Kato H, et al. Identification of toxigenic Clostridium difficile by the polymerase chain reaction. J Clin Microbiol 1991; 29(1): 33-7. [Özet] [PDF]
- Stubbs S, Rupnik M, Gibert M, et al. Production of actin-specific ADP-ribosyltransferase (binary toxin) by strains of Clostridium difficile. FEMS Microbiol Lett 2000; 186(2): 307-12. [Özet]
- Carter GP, Rood JI, Lyras D. The role of toxin A and toxin B in Clostridium difficile-associated disease: past and present perspectives. Gut Microbes 2010; 1(1): 58-64. [Özet] [Tam Metin] [PDF]
- Kuijper EJ, Coignard B, Tüll P, ESCMID Study Group for Clostridium difficile; EU Member States; European Centre for Disease Prevention and Control. Emergence of Clostridium difficile-associated disease in North America and Europe. Clin Microbiol Infect 2006; 12(Suppl 6): 2-18. [Özet] [Tam Metin] [PDF]
- Gilca R, Hubert B, Fortin E, Gaulin C, Dionne M. Epidemiological patterns and hospital characteristics associated with increased incidence of Clostridium difficile infection in Quebec, Canada, 1998-2006. Infect Control Hosp Epidemiol 2010; 31(9): 939-47. [Özet]
- Rdelings MD, Sorvillo F, Mascola L. Increase in Clostridium difficile-related mortality rates, United States, 1999-2004. Emerg Infect Dis 2007; 13(9): 1417-19. [Özet] [Tam Metin] [PDF]
- Soyletir G, Eskiturk A, Kilic G, Korten V, Tozun N. Clostridium difficile acquisition rate and its role in nosocomial diarrhoea at a university hospital in Turkey. Eur J Epidemiol 1996; 12(4): 391-4. [Özet]
- Urban E, Tusnadi A, Terhes G, Nagy E. Prevalence of gastrointestinal disease caused by Clostridium difficile in a university hospital in Hungary. J Hosp Infect 2002; 51(3): 175-8. [Özet]
- Wiström J, Norrby SR, Myhre EB, et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J Antimicrob Chemother 2001; 47(1): 43-50. [Özet] [Tam Metin] [PDF]
- Ercis S, Ergin A, Hascelik G. Six years evaluation of Clostridium difficile associated diarrhea. Mikrobiyol Bul 2004; 38(1-2): 45-50. [Özet]
- Altindis M, Usluer S, Ciftci H, Tunc N, Cetinkaya Z, Aktepe OC. Investigation of the presence of Clostridium difficile in antibiotic associated diarrhea patients by culture and toxin detection methods. Mikrobiyol Bul 2007; 41(1): 29-37. [Özet]
- Barbut F, Petit JC. Epidemiology of Clostridium difficile associated infections. Clin Microbiol Infect 2001; 7(8): 405-10. [Özet] [Tam Metin] [PDF]
- Buchner AM, Sonnenberg A. Medical diagnoses and procedures associated with Clostridium difficile colitis. Am J Gastroenterol 2001; 96(3): 766-72. [Özet]
- Wroblewska MM, Swoboda-Kopec E, Rokosz A, Nurzynska G, Bednarska A, Luczak M. Detection of Clostridium difficile and its toxin A (tcdA) in stool specimens from hospitalised patients. Pol J Microbiol 2005; 54(2): 111-5. [Özet]
- Kim J, Smathers SA, Prasad P, Leckerman KH, Coffin S, Zaoutis T. Epidemiological features of Clostridium difficile-associated disease among inpatients at children's hospitals in the United States, 2001-2006. Pediatrics 2008; 122(6): 1266-70. [Özet] [Tam Metin] [PDF]
- Alfa MJ, Swan B, VanDekerkhove B, Pang P, Harding GK. The diagnosis of Clostridium difficile-associated diarrhea: comparison of Triage C.difficile panel, EIA for Tox A/B and cytotoxin assays. Diagn Microbiol Infect Dis 2002; 43(4): 257-63. [Özet]
- Bouza E, Pelaez T, Alonso R, Catalan P, Munoz P, Creixems RM. "Second-look" cytotoxicity: an evaluation of culture plus cytotoxin assay of Clostridium difficile isolates in the laboratory diagnosis of CDAD. J Hosp Infect 2001; 48(3): 233-7. [Özet]
- Rupnik M. How to detect Clostridium difficile variant strains in a routine laboratory. Clin Microbiol Infect 2001; 7(8): 417-20. [Özet] [Tam Metin] [PDF]
- Pituch H, Rupnik M, Obuch-Woszczatynski P, Grubesic A, Meisel-Mikolajczyk F, Luczak M. Detection of binary-toxin genes (cdt A and cdt B) among Clostridium difficile strains isolated from patients with C.difficile-associated diarrhoea (CDAD) in Poland. J Med Microbiol 2005; 54(Pt 2): 143-7. [Özet] [Tam Metin] [PDF]
- Gonçalves C, Derce D, Barbut F, Burghoffer B, Petit JC. Prevalence and characterization of a binary toxin (actin-specific ADP-ribosyltransferase) from Clostridium difficile. J Clin Microbiol 2004; 42(5): 1933-9. [Özet] [Tam Metin] [PDF]
- Barbut F, Mastrantonio P, Delme M, Brazier J, Kuijper E, Poxton I; European Study Group on Clostridium difficile (ESGCD). Prospective study of Clostridium difficile infections in Europe with phenotypic and genotypic characterisation of the isolates. Clin Microbiol Infect 2007; 13(11): 1048-57. [Özet] [Tam Metin] [PDF]
İletişim (Correspondence):
Dr. Nurver (Toprak) Ülger,
Marmara Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Haydarpaşa Kampüsü, İstanbul, Türkiye.
Tel (Phone): +90 216 414 4732,
E-posta (E-mail): nurverulger@yahoo.com