Pseudomonas aeruginosa Klinik İzolatlarında
VITEK 2 Sistemiyle Yapılan Meropenem Duyarlılık Testinin
Performans Değerlendirmesi
Performance
Evaluation of VITEK 2 System in Meropenem Susceptibility Testing of
Clinical Pseudomonas aeruginosa Isolates
İbrahim
Çağatay ACUNER1, Gülçin BAYRAMOĞLU2, Asuman BİRİNCİ3,
Çiğdem ÇEKİÇ CİHAN4,
Yüksel BEK5, Belma DURUPINAR3
1 Yeditepe Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
1 Yeditepe University Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
2 Karadeniz Teknik Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Trabzon.
2 Karadeniz Technical University Faculty of Medicine, Department of Medical Microbiology, Trabzon, Turkey.
3 Ondokuz Mayıs Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Samsun.
3 Ondokuz Mayis University Faculty of Medicine, Department of Medical Microbiology, Samsun, Turkey.
4 Çorum Göğüs Hastalıkları Hastanesi, Merkez Laboratuvarı, Çorum.
4 Corum Pulmonary Diseases Hospital, Central Laboratory, Corum, Turkey.
5 Ondokuz Mayıs Üniversitesi Tıp Fakültesi, Biyoistatistik Anabilim Dalı, Samsun.
5 Ondokuz Mayis University Faculty of Medicine, Department of Biostatistics, Samsun, Turkey.
ÖZET
Pseudomonas aeruginosa toplumdan edinilmiş veya nozokomiyal enfeksiyonlarla ilişkili olan önemli bir fırsatçı patojendir. Çok ilaca dirençli (ÇİD) P.aeruginosa suşlarının neden olduğu epidemiler artmakta ve çeşitli hastane servislerinde ve coğrafi bölgelerde yayılmaktadır. ÇİD P.aeruginosa enfeksiyonlarının tedavisinde karbapenemler en etkili antibiyotiklerdendir ve başlangıç tedavisinde meropenem en başarılı alternatiftir. Özellikle ciddi enfeksiyonlarda, tedavinin uygunsuz veya yetersiz başlanması, bağımsız olarak, istenmeyen klinik ve ekonomik sonuçlarla ilişkilidir. Bu durumda duyarlılık testinin, doğru ve hızlı olarak yapılabilmesi önceliklidir. Otomatize mikrobiyoloji sistemlerinin çoğunluğu, 8-12 saat içinde hızlı sonuçlar sağlayabilmektedir. Antimikrobiyal duyarlılık testlerinde, özellikle bazı mikroorganizma-antimikrobiyal ilaç grupları için, otomatize sistemlerde konvansiyonel yöntemlere kıyasla sorunlar yaşandığı bildirilmiştir. Daha önce literatürde, özellikle P.aeruginosa'ya karşı yapılan karbapenem duyarlılık testlerinde başarısız sonuçlar bildirilmiştir. Bu çalışmaların çoğunluğu, "Food and Drug Administration (FDA, ABD)" performans analizi şemasının (Class II Special Controls Guidance Document: Antimicrobial Susceptibility Test Systems) basitleştirilmiş biçimi olarak tasarlanmıştır. Ancak, bu çalışmaların çoğunun çalışma tasarımında majör yetersizlikler vardır. Bunlar arasında, yetersiz örneklem büyüklüğü, uygun olmayan referans yöntem kullanımı, tekrarlanabilirlik testlerinin eksikliği ve çalışma izolatlarının yorumlama kategorilerine yetersiz dağılımı dikkat çekicidir. Literatürde, yeterli örneklem büyüklüğü ile (n ≥ 100), otomatize mikrobiyoloji sistemlerinde klinik P.aeruginosa izolatlarının karbapenem antimikrobiyal duyarlılık testi performansını değerlendiren yalnızca beş adet çalışmaya rastlanmaktadır. Ancak bu çalışmaların çoğunun da çalışma tasarımında bir veya birkaç majör yetersizlik vardır. Dahası, bu çalışmaların hiçbirisi, VITEK 2 sisteminin performansını çalışma tasarımında majör bir yetersizlik olmaksızın değerlendirmemiştir. Bu nedenle bu çalışma, VITEK 2 sisteminin (bioMérieux, Fransa) klinik P.aeruginosa izolatlarının meropenem antimikrobiyal duyarlılık testindeki performansını, çalışma tasarımında majör bir yetersizlik olmaksızın değerlendirmeyi amaçlamıştır. Çalışma, tekrarlardan arındırılmış klinik kökenli P.aeruginosa izolatlarında (n= 142) yapılmıştır. İzolatlar, Ondokuz Mayıs Üniversitesi Hastanesi Tıp Laboratuvarları Kültür Koleksiyonları Birimindeki izolat koleksiyonlarından seçilmiştir. Çalışma koleksiyonu, konvansiyonel testler ve VITEK 2 otomatize mikrobiyoloji sistemiyle tanımlanmıştır. Referans yöntemi olarak, "Clinical and Laboratory Standards Institute" tarafından standardize edilmiş sıvı mikrodilüsyon yöntemi kullanılmıştır. Tüm deney basamaklarında, P.aeruginosa ATCC 27853 kalite kontrol suşu kullanılmıştır. Meropenemin (AstraZeneca, ABD) iki-kat dilüsyonları, 64 mg/L ve 0.125 mg/L konsantrasyonları arasında test edilmiştir. FDA önerilerine uygun olarak, çalışma izolatlarının minimum inhibitör konsantrasyonlarının ölçek içinde olduğu ve her iki yöntemde de beş ardışık dilüsyon aralığında dağıldığı gösterilmiştir. Tekrarlanabilirlik testlerinde, 15 izolat VITEK 2 sistemi ile üçer kez test edilmiştir. Tekrarlanabilirlik testlerinin sonuçları, referans olarak test moduna (bir izolat için en sık elde edilen test sonucu) kıyasla değerlendirilmiştir. Tekrarlanabilirlik %100 olarak saptanmıştır. Referans yönteme kıyasla VITEK 2 sisteminin esansiyel ve kategorik uyumu, sırasıyla, %83.8 ve %96.5 olarak belirlenmiştir. Çok büyük ve küçük uyumsuzluk oranları sırasıyla, %1.4 ve %2.8 olarak izlenirken, büyük uyumsuzluk saptanmamıştır. FDA performans ölçütlerine göre esansiyel uyum sonuçları kabul edilemezken, kategorik uyum kabul edilebilir bulunmuştur. Kappa istatistiği ile yöntemler arasında çok iyi düzeyde uyum belirlenmiştir (k= 0.938). Sonuç olarak, VITEK 2 sistemi, P.aeruginosa klinik izolatlarının duyarlılık testinde kabul edilebilir performans sergilemiştir. Pazara giriş öncesi alınan onay uygun bir validasyonu garanti etmeyebileceği için, laboratuvarda günlük kullanım için uygulanmadan önce otomatize mikrobiyoloji sistemlerinin antimikrobiyal duyarlılık testi performansı en azından verifiye edilmeli, performans değerlendirmesi sonuçlarını bildiren literatür bile eleştirel olarak okunmalıdır.
Anahtar sözcükler: Pseudomonas aeruginosa; meropenem; antimikrobiyal duyarlılık testi; performans değerlendirmesi; VITEK 2 sistem.
ABSTRACT
Pseudomonas aeruginosa is an important opportunistic pathogen associated with various community-acquired or nosocomial infections. Multi-drug resistant P.aeruginosa strains increasingly cause epidemics and spread in various hospital wards and geographic regions. Carbapenems are among the most effective antimicrobials in the treatment of multi-drug resistant P.aeruginosa infections, and meropenem is the most successful among alternatives in initial therapy. Particularly in severe infections, inappropriate or inadequate initial antimicrobial therapy is independently associated with adverse clinical and economic outcomes. Availability of accurate and rapid susceptibility testing is a priority. Most of the automated microbiology systems can provide rapid results within 8 to 12 hours. In comparison to standard methods, problems in the antimicrobial susceptibility testing of particular microorganisms and antimicrobial agents have been reported for automated microbiology systems. Failures have been reported previously especially in the susceptibility testing of P.aeruginosa versus carbapenem. Most of these studies are designed according to the Food and Drug Administration (FDA, USA) performance analysis scheme (Class II Special Controls Guidance Document: Antimicrobial Susceptibility Test Systems) in a simplified form. However, there are many lacking issues in the design of most of these studies. Among these, insufficient sample size, use of inappropriate reference method, lack of reproducibility testing, and inadequate distribution of study isolates in interpretative categories are of notice. There are only few studies in the literature that evaluate the performance of automated systems in antimicrobial susceptibility testing of carbapenems in clinical P.aeruginosa isolates with a sufficient sample size (n ≥ 100). However, most of these studies still have one or more major deficiencies in the study design. Furthermore, none of these studies evaluate the performance of VITEK 2 system without a major deficiency in study design. Therefore, we aimed to evaluate the performance of VITEK 2 system (bioMérieux, France) in antimicrobial susceptibility testing of carbapenems in clinical P.aeruginosa isolates in a well-designed study. The study was conducted on nonrepetitive P.aeruginosa isolates (n= 142) of clinical origin. Isolates were selected from the isolate collections of Culture Collection Unit of the Medical Laboratories at Ondokuz Mayis University Hospital. The study collection was characterized with conventional tests and the VITEK 2 automated microbiology system. Broth microdilution method standardized by Clinical and Laboratory Standards Institute was used as the reference method. P.aeruginosa ATCC 27853 was used as the quality control strain in all experimental steps. Two-fold dilutions of meropenem (AstraZeneca, USA) concentrations between 64 mg/L and 0.125 mg/L were tested. In compliance with FDA recommendations, minimum inhibitory concentrations of study isolates were shown to be on-scale and distributed within the range of five sequential dilutions in both methods. In reproducibility testing, 15 organisms were tested with VITEK 2 system in triplicate. Results of the reproducibility tests were evaluated in comparison to the test mode (the most frequent test result for the isolate) as a reference. Overall reproducibility was 100%. Essential and categorical agreements of the VITEK 2 system in comparison to the reference method were 83.8% and 96.5%, respectively. Very major and minor discrepancy rates were 1.4% and 2.8%, respectively. There was no major discrepancy. While the results of the essential agreement was not acceptable, categorical agreement was acceptable according to the FDA performance criteria. There was very good agreement between methods as shown by the kappa value (k= 0.938). In conclusion, VITEK 2 system exhibited acceptable performance in the meropenem susceptibility testing of clinical P.aeruginosa isolates. As pre-market approval may not guarantee proper validation, performance of the automated microbiology systems in antimicrobial susceptibility testing should at least be verified and the literature that reports performance evaluation results should be read critically before implementation for routine use in laboratory.
Key words: Pseudomonas aeruginosa; meropenem; antimicrobial susceptibility testing; performance evaluation; VITEK 2 system.
Geliş Tarihi (Received): 15.02.2011 • Kabul Ediliş Tarihi (Accepted): 07.03.2011
GİRİŞ
Pseudomonas aeruginosa, ileri düzeyde bakteriyel direnç için örnek bir fenomen olarak öne sürülmüştür1. P.aeruginosa'nın klinik ve çevresel izolatlarında, virülans genleri yüksek oranda korunmuştur2. Günümüzde, çok ilaca dirençli (ÇİD) P.aeruginosa enfeksiyonları, endemik durumdan epidemik duruma geçmekte, çeşitli hastane birimlerinde ve değişik coğrafi alanlarda yayılmaktadır3. ÇİD P.aeruginosa suşlarının prevalansı, dünyanın çeşitli bölgelerinde değişiklik göstermekte ve klinik P.aeruginosa izolatlarının çoklu direnç oranında belirgin bir artış eğilimi saptanmaktadır4,5. Avrupa ülkelerinde, antipsödomonal ilaçlara (florokinolonlar, seftazidim, aminoglikozidler, karbapenemler ve piperasilin) direnç %1-50 arasında değişmektedir6. Karbapeneme dirençli izolatların %20'sinin aktarılabilir metallo-beta-laktamaz taşıyor olması dikkat çekici olup, tedavi edilemez P.aeruginosa enfeksiyonlarının ortaya çıkabileceği uyarısında bulunulmaktadır7,8. Yakın zamanda, "pan-resistant" P.aeruginosa klonları ile oluşan epidemiler bildirilmiştir5.
Karbapenemler, ÇİD P.aeruginosa enfeksiyonlarının tedavisinde en etkili antibiyotiklerdir9. İmipeneme kıyasla meropenem, P.aeruginosa'nın klinik izolatlarına karşı daha etkilidir5. ÇİD gram-negatif bakterilerle oluşan nozokomiyal enfeksiyonlarda uygulanan ilk seçenek ampirik tedavide, meropenemin yeterli tedaviyi sağlayabildiği gösterilmiştir10. Uygun olmayan ve artmış antimikrobiyal kullanımı, artmış kolonizasyon baskısı ve çoklu dirençli suşların ortaya çıkışı ile ilişkilendirilmiştir11. Hızlı ve doğru uygulanan antibiyotik duyarlılık testinin, antimikrobiyal kullanımını azalttığı ve uygun ampirik tedavi yapılmasını sağladığı belirtilmektedir12. Uygun olmayan başlangıç tedavisinin hızlı ve doğru olarak düzeltilmesi, antimikrobiyal duyarlılık testi sonuçlarının kısa çevrim süresi içinde bildirilmesi ile ilişkilidir12,13,14. Geleneksel antimikrobiyal duyarlılık testi yöntemlerinde yapılan yeniliklerle veya yeni nesil teknoloji platformlarından yararlanarak, sonuç süresinin kısalması sağlanabilmektedir15,16.
Günümüzde, mikrobiyoloji laboratuvarlarında yaygın olarak kullanılan ve antimikrobiyal duyarlılık testi sonuçlarının 8-12 saat içinde elde edilmesini sağlayan, VITEK 2 (bioMérieux, Fransa), Phoenix (Becton-Dickinson, ABD) ve MicroScan (Siemens, ABD) gibi otomatize sistemler mevcuttur15,17. Ancak, bilgimize göre, uygun bir referans yöntemi ve yeterli örneklem büyüklüğü ile P.aeruginosa izolatlarında karbapenem antimikrobiyal duyarlılık testi için otomatize mikrobiyolojik sistemlerin performansını değerlendiren yalnızca birkaç çalışma vardır18,19,20,21,22. Bu çalışmalar arasında, P.aeruginosa izolatlarında meropenem antimikrobiyal duyarlılık testi için VITEK 2 sisteminin performansını değerlendiren bir çalışma18 olmakla birlikte, tekrarlanabilirlik testlerini yaparak ve test edilen bakteri popülasyonunu ardışık iki katlık dilüsyonlarla en az beş konsantrasyon düzeyi değerini temsil eden izolatları kapsayacak biçimde seçerek değerlendiren bir çalışma yoktur. Bu çalışmanın amacı, P.aeruginosa izolatlarında meropenem antimikrobiyal duyarlılık testi için VITEK 2 otomatize mikrobiyoloji sisteminin performansının, bu iki özelliği de içerecek biçimde değerlendirilmesidir.
GEREÇ ve YÖNTEM
Çalışma, tekrardan arındırılmış ve klinik kaynaklı P.aeruginosa izolatlarında (n= 142) yapıldı. İzolatlar, Ondokuz Mayıs Üniversitesi Hastanesi Tıp Laboratuvarları Kültür Koleksiyonları Birimindeki izolat koleksiyonundan seçildi. İzolatlar, %5 koyun kanlı agarda (TSA II, BD Diagnostic Systems, ABD) 37°C'de 18 saatlik inkübasyonla üretildi ve aynı koşullarda pasajları yapıldı. Suşların saflık kontrolü, Eosin-Methylene Blue (EMB) agar besiyerine (Difco, Becton-Dickinson, ABD) ve ardından Mueller-Hinton (MH) agar besiyerine (Oxoid, İngiltere) ekilerek yapıldı. P.aeruginosa tanımlaması için, oksidaz ve katalaz pozitifliği, pigment üretimi ve 42°C'de üreme ölçütleri kullanıldı23. İzolatlar, VITEK 2 otomatize mikrobiyoloji sisteminde de, üreticinin talimatlarına uygun olarak tanımlandı.
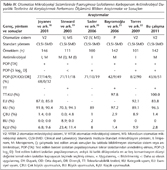
Referans antimikrobiyal duyarlılık testi olarak, "Clinical and Laboratory Standards Institute (CLSI)" tarafından standardize edilmiş olan sıvı mikrodilüsyon yöntemi uygulandı24,25. Referans suş olarak, P.aeruginosa ATCC 27853 kullanıldı25. Kontrol suşu dahil, çalışmaya katılan tüm izolatların minimum inhibitör konsantrasyonu (MİK), iki kat azalan dilüsyonlarla 64 mg/L ve 0.125 mg/L konsantrasyon aralığında meropenem (AstraZeneca, ABD) ve sabit olarak 5 x 105 cfu/ml son yoğunluğunda bakteri inokülumu içeren katyon-ayarlı MH sıvı besiyeri (Mast Diagnostics, Almanya) ile hazırlanan sıvı mikrodilüsyon plaklarının, 18 saat 35°C'de inkübe edilmesi sonrasında saptandı24,25. VITEK 2 sisteminde, kontrol suşunu da içeren tüm izolatların meropeneme duyarlılık testleri çalışıldı. Bu amaçla, üreticinin önerilerine uygun olarak hazırlanan bakteri izolatlarının süspansiyonları, AST-N021 (bioMérieux, Fransa) antimikrobiyal duyarlılık testi kartlarına ekildi ve aygıt sisteminin inkübatör/okuyucu bölümüne yerleştirildi. On sekiz saatlik inkübasyondan sonra, otomatize değerlendirme algoritmasına göre saptanan MİK değerleri rapor olarak alındı. Performans analizinde, FDA önerilerine uygun olarak, esansiyel uyum değerlendirmesinin yapılabilmesi için, çalışmaya katılan çeldirici P.aeruginosa klinik izolatlarından elde edilen MİK sonuçlarının dağılımının, her iki antimikrobiyal duyarlılık yöntemiyle de, ardışık iki katlık dilüsyonlarla en az beş konsantrasyon düzeyini kapsadığı ve değerlendirilebilir sonuç ölçeği içinde yer aldığı gösterildi26 (Tablo I).
VITEK 2 otomatize mikrobiyoloji sisteminin tekrarlanabilirlik testlerinde, 15 izolat üçer kez tekrar edilerek çalışıldı26. Test modu (bir izolat için elde edilen en sık test sonucu) referans kabul edilerek, buna kıyasla, ≥ %95 kategori uyumu saptanırsa, tekrarlanabilirlik testlerinin sonucu kabul edilebilir olarak değerlendirildi26. Karşılaştırmalı performans değerlendirmesinde, FDA tanımları, hesaplama yöntemleri ve performans ölçütleri kullanıldı26. FDA ölçütlerine göre26, kabul edilebilir performans değerleri şöyledir: Esansiyel uyum ≥ 95.71 (örneklem büyüklüğü 140 iken hesaplanan ortalama değerdir; %95 güven aralığında 90.91-98.41 arasındaki değerler kabul edilebilirdir), kategorik uyum ≥ %90; çok büyük uyumsuzluk ≤ %1.5; büyük uyumsuzluk ≤ %3. Yöntemler arasındaki uyum, kappa istatistiği ile de araştırıldı.
BULGULAR
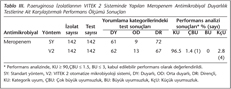
Çalışmanın birinci basamağında, P.aeruginosa izolatlarının VITEK 2 sisteminde yapılan meropenem antimikrobiyal duyarlılık testinin kategorik tekrarlanabilirliği %100 olarak saptanmıştır (Tablo II). Çalışmanın ikinci basamağında, standart sıvı mikrodilüsyon yöntemi ve VITEK 2 sistemi ile karşılaştırmalı olarak test edilen 142 P.aeruginosa izolatının meropenem antimikrobiyal duyarlılık testlerinin sonuçlarında, iki yöntem arasındaki esansiyel ve kategorik uyum değerleri, sırasıyla, %83.8 ve %96.5 olarak belirlenmiştir (Tablo III). Çok büyük uyumsuzluk oranı %1.4; büyük uyumsuzluk oranı %0; küçük uyumsuzluk oranı %2.8 olarak saptanmıştır. Çalışmalarda, kalite kontrol suşunun test sonuçları, CLSI standardına göre kabul edilebilir sınırlar içindedir. Çalışmada, P.aeruginosa izolatları için VITEK 2 sisteminde yapılan meropenem antimikrobiyal duyarlılık testinin standart mikrodilüsyon yöntemine kıyasla kategorik tekrarlanabilirliği ve kategorik uyumu FDA ölçütlerine göre kabul edilebilir bulunurken, esansiyel uyumu kabul edilebilir bulunmamıştır. Kappa istatistiği ile yöntemler arasında çok iyi düzeyde uyum bulunmuştur (k= 0.938).
TARTIŞMA
Ciddi yoğun bakım enfeksiyonu olan olgularda, uygun veya yeterli başlangıç tedavisi için ampirik olarak bir antimikrobiyal seçiminin yapılması ve laboratuvardan bildirilen antimikrobiyal duyarlılık testi sonucuna göre gereğinde bu seçimin değiştirilmesi klinik başarıyı etkilemektedir10,12,13,14. Yoğun bakım ünitelerinde gelişen ciddi nozokomiyal enfeksiyonlarda, predominant patojen P.aeruginosa'dır10. Yoğun bakım ünitelerinde gelişen ciddi nozokomiyal enfeksiyonlarda, meropeneme dayalı ampirik tedavi şemaları, diğer alternatiflere kıyasla, uygun veya yeterli tedaviyi sağlamakta daha başarılıdır9,10. Hızlı sonuç üreten otomatize antimikrobiyal duyarlılık testlerinin, antimikrobiyal seçiminde yapılan düzeltmeyi hızlandırdığı ve antimikrobiyal kullanımında azalma sağladığı gösterilmiştir12. Bugüne kadar yayınlanmış çalışmalar arasında, P.aeruginosa izolatlarında meropenem antimikrobiyal duyarlılık testi için VITEK 2 sisteminin performansını değerlendiren yalnızca bir çalışma vardır18. Bizim çalışmamızda, diğer çalışmadan farklı olarak, VITEK 2 otomatize mikrobiyoloji sisteminin P.aeruginosa izolatlarında meropenem antimikrobiyal duyarlılık testi için performansı, tekrarlanabilirlik testleri yapılarak ve test edilen bakteri izolatları popülasyonunu ardışık iki katlık dilüsyonlarla en az beş konsantrasyon düzeyi değerini temsil eden izolatları kapsayacak biçimde seçilerek değerlendirilmiştir. VITEK 2 otomatize sisteminin esansiyel uyum performansı (%83.8), standart yönteme kıyasla kabul edilebilir bulunmamış; buna karşın kategorik uyum performansı (%96.5) standart yönteme kıyasla kabul edilebilir bulunmuştur.
Uygun bir referans yöntemi ve yeterli örneklem büyüklüğü ile (örn. n ≥ 100) P.aeruginosa izolatlarında karbapenem antimikrobiyal duyarlılık testi için otomatize mikrobiyoloji sistemlerinin performansını değerlendiren sınırlı sayıda çalışma vardır18,19,20,21,22 (Tablo IV). Bu çalışmalarda, farklı otomatize sistemler ve karbapenemler birlikte veya ayrı olarak, standart sıvı mikrodilüsyon yöntemine karşı denenmiştir24,25. Joyanes ve arkadaşları18, VITEK 2 sistemini kullanarak, 146 P.aeruginosa klinik izolatında, imipenem ve meropenem için antimikrobiyal duyarlılık testlerinin performansını değerlendirmişlerdir. Bu çalışma, uygun bir referans yöntemi ve yeterli örneklem büyüklüğü ile özellikle VITEK 2 sisteminde P.aeruginosa'nın meropeneme karşı antimikrobiyal duyarlılık testinin performansının test edilmesi bakımından, literatürde bizim çalışmamızla karşılaştırılabilecek tek çalışmadır18. Joyanes ve arkadaşlarının18 çalışmasında, referans yönteme kıyasla, imipenem ve meropenem için esansiyel uyum, sırasıyla %87 ve %85 olarak saptanmıştır. İmipenem ve meropenem için kategorik uyum ise sırasıyla %91.8 ve %90.4 olarak bulunmuştur18. Meropenem için çok büyük uyumsuzluk ve büyük uyumsuzluk bulunmamış; küçük uyumsuzluk oranı ise %9.6 olarak belirlenmiştir18. Bu çalışmada, VITEK 2 sisteminin P.aeruginosa klinik izolatlarında, imipenem ve meropenem için antimikrobiyal duyarlılık testlerinin esansiyel uyum performansı FDA ölçütlerine göre kabul edilemez iken, kategorik uyumu kabul edilebilirdir18. Joyanes ve arkadaşları18 bu sonuçlara göre, VITEK 2 sisteminin P.aeruginosa klinik izolatlarında, imipenem ve meropenem için antimikrobiyal duyarlılık testlerinin güvenilebilir olduğu yorumunu yapmışlardır. Çalışmamızda, Joyanes ve arkadaşlarının18 çalışmasıyla uyumlu olarak, VITEK 2 sisteminin P.aeruginosa klinik izolatlarında meropeneme karşı antimikrobiyal duyarlılık testinin esansiyel uyum performansı FDA ölçütlerine göre kabul edilemez bulunurken (%83.8), kategorik uyumu kabul edilebilir bulunmuştur (%96.5). Çalışmamızda, Joyanes ve arkadaşlarının18 çalışmasından farklı olarak, tekrarlanabilirlik testleri yapılmış, en az beş MİK düzeyini temsil eden izolatlar ile meropeneme karşı orta duyarlı kategoride yer alan çeldirici izolatlar test edilmiş ve %1.4 oranında çok büyük uyumsuzluk saptanmıştır (Tablo IV). Steward ve arkadaşları19, VITEK ve MicroScan sistemlerini kullanarak, P.aeruginosa klinik izolatlarında (n= 111), imipenem ve meropenem için antimikrobiyal duyarlılık testlerinin performansını değerlendirmişler; VITEK sisteminin meropeneme karşı duyarlılık testi performansını, FDA ölçütlerine göre kategorik uyum bakımından kabul edilebilir (%94.3) bulurken, çok büyük uyumsuzluk oranını kabul edilemez (%4.8) bulmuşlardır (Tablo IV). Sader ve arkadaşları20, VITEK, VITEK 2 ve MicroScan otomatize sistemlerini kullanarak, 100 P.aeruginosa klinik izolatında, imipenem için antimikrobiyal duyarlılık testlerinin performansını ölçmüşlerdir. Bu araştırıcılar, VITEK 2 sisteminin P.aeruginosa izolatlarında imipeneme karşı antimikrobiyal duyarlılık testi performansının, FDA ölçütlerine göre kategorik uyum bakımından kabul edilemez (%89) olduğunu saptamışlardır20 (Tablo IV). Bayramoğlu ve arkadaşları21, Phoenix otomatize sistemini kullanarak, P.aeruginosa klinik izolatlarında (n= 142), meropenem için antimikrobiyal duyarlılık testinin performansını analiz etmişler ve FDA ölçütlerine göre kategorik uyumu kabul edilebilir (%97.2) bulmuşlardır (Tablo IV). Torres ve arkadaşları22, VITEK 2 sistemini kullanarak, 101 P.aeruginosa klinik izolatında imipenem için antimikrobiyal duyarlılık testinin performansını değerlendirmişler ve FDA ölçütlerine göre esansiyel uyum (%92.1), kategorik uyum (%89.1) ve çok büyük uyumsuzluk oranını (%8.9) kabul edilemez bulmuşlardır (Tablo IV).
Otomatize mikrobiyoloji sistemlerinin antimikrobiyal duyarlılık testi performanslarının, genellikle referans yöntemlerle uyumlu olduğu kabul edilmekle birlikte, bazı organizma-antimikrobiyal kombinasyonları için belirli sorunlar olduğu gözlenmektedir15. Özellikle standart yönteme kıyasla direnç varlığının saptanmasında hata anlamına gelen çok büyük uyumsuzluk (referans yöntem "dirençli" sonucu verirken, yeni yöntemle "duyarlı" sonucu elde edilmesi) oranının kabul edilebilirlik ölçütünden fazla olması (> %1.5), rutin uygulamada kullanım için değerlendirilen yeni bir yöntem için önemli bir sorun oluşturmakta ve klinik olarak artan tedavi başarısızlığı olasılığı nedeniyle hatalı tıbbi uygulamalara yol açabilmektedir. Örneğin; standart disk difüzyon yöntemlerinde ve otomatize sistemlerde, özellikle P.aeruginosa-karbapenem kombinasyonlarının test edilmesinde sorunlar olduğu bildirilmiştir. Steward ve arkadaşları19, MicroScan sisteminde P.aeruginosa izolatlarının imipenem ve meropenem direncinin belirlenmesinde, çok büyük uyumsuzluk oranlarının yüksek olduğunu (sırasıyla, %2.3 ve %4.8) saptamışlardır. Bayramoğlu ve arkadaşları21, Phoenix sisteminde P.aeruginosa izolatlarının meropenem direncinin saptanmasında, çok büyük uyumsuzluk oranının yüksek olduğunu (%2.9) bildirmişler; Torres ve arkadaşları22 da, VITEK 2 sisteminde P.aeruginosa izolatlarının imipenem direncinin belirlenmesinde bu oranı yine yüksek (%8.9) olarak rapor etmişlerdir. Çalışmamızda, VITEK 2 otomatize sisteminde, P.aeruginosa klinik izolatlarının meropenem direncinin saptanmasında, çok büyük uyumsuzluk oranı kabul edilebilir düzeyde (%1.4) bulunmuştur.
Yöntemden bağımsız olarak, karbapenem direncinin saptanmasındaki sorunların, diğer gram-negatif bakterilere kıyasla P.aeruginosa'nın daha yavaş ve zor üremesi, kompleks direnç mekanizmalarına sahip olması, kapsül yapısı ile mukoid koloni oluşturabilmesi ve diğer olası bilinmeyen faktörlere bağlı olabileceği ileri sürülmüştür27,28,29,30. Bu tür sorunların, otomatize sistemler gibi kısa inkübasyon süreli sistemlerde daha sık olarak gözlenebileceği, zira bazı direnç mekanizmalarının fenotipik ekspresyonunun bir gecelik üreme süresine gereksinimi olduğu belirtilmiştir15. Özellikle P.aeruginosa'da meropenem direncinin belirlenmesinde, standart disk difüzyon yönteminde de uyumsuz sonuçlar elde edilebildiği bildirilmiştir29,30. Ancak, otomatize sistemlerin antimikrobiyal duyarlılık testi performansının analiziyle ilgili olarak literatürde yer alan çalışma tasarımlarının çoğunda, bildirilen performans değerlendirmesi sonuçlarının geçerliliğini tartışmalı kılan başlıca eksiklikler vardır. Bu çalışmaların çoğu FDA performans analizi önerilerinin basitleştirilmiş biçimini içermektedir26. Bunlar arasında, tekrarlanabilirlik testlerinin yapılmaması, test edilecek izolatların seçiminde duyarlı, orta duyarlı ve dirençli izolat oranlarının (test öncesi prevalansın test sonrası elde edilen performans sonuçlarını etkilemesi nedeniyle) ve MİK değerleri dağılımının dikkate alınmaması veya bildirilmemesi, yetersiz örneklem büyüklüğü ile çalışılması, uygun bir referans yöntemin kullanılmaması gibi eksiklikler yer almaktadır. Bilgimize göre bizim çalışmamız, tekrarlanabilirlik testleri yapılarak ve test edilen bakteri izolatları popülasyonunu ardışık iki katlık dilüsyonlarla en az beş konsantrasyon düzeyi değerini temsil eden izolatları kapsayacak biçimde yapılan tek çalışmadır.
Sonuç olarak, bu çalışmada, önemli enfeksiyonlara yol açabilen P.aeruginosa'nın tedavisinde en etkili antibiyotiklerden olan meropenemin antimikrobiyal duyarlılık testinin yapılmasında günümüzde yaygın olarak kullanılan ve hızlı sonuç veren otomatize sistemlerden biri olan VITEK 2 sisteminin sonuçlarının kategorik uyum bakımından güvenilir olduğu gösterilmiştir. Yaygın olarak kullanılan otomatize mikrobiyoloji sistemlerinin antimikrobiyal duyarlılık testlerindeki performansları, validasyon onayı ile piyasaya giriş aşamasından sonra, kullanılacağı laboratuvarda, uygun çalışma tasarımı ile verifikasyon yapılarak değerlendirilmeli ve literatürde bildirilen performans analizleri de eleştirel olarak incelenmelidir.
KAYNAKLAR
- Strateva T, Yordanov D. Pseudomonas aeruginosa - a phenomenon of bacterial resistance. J Med Microbiol 2009; 58(Pt 9): 1133-48. [Özet] [Tam Metin] [PDF]
- Bradbury RS, Roddam LF, Merritt A, Reid DW, Champion AC. Virulence gene distribution in clinical, nosocomial and environmental isolates of Pseudomonas aeruginosa. J Med Microbiol 2010; 59 (Pt 8): 881-90. [Özet] [Tam Metin] [PDF]
- Cantón R, Coque TM, Baquero F. Multi-resistant gram-negative bacilli: from epidemics to endemics. Curr Opin Infect Dis 2003; 16(4): 315-25. [Özet]
- Gould IM. The epidemiology of antibiotic resistance. Int J Antimicrob Agents 2008; 32(Suppl 1): S2-9. [Özet]
- Souli M, Galani I, Giamarellou H. Emergence of extensively drug-resistant and pandrug-resistant gram-negative bacilli in Europe. Euro Surveill 2008; 13(47): 1-12. [Özet]
- European Antimicrobial Resistance Surveillance System. EARSS 2008 Annual Report. Available at: http://www.rivm.nl/earss/Images/EARSS%202008_final_ tcm61-65020.pdf
- Walsh TR, Toleman MA, Poirel L, Nordmann P. Metallo-beta-lactamases: the quiet before the storm? Clin Microbiol Rev 2005; 18(2): 306-25. [Özet] [Tam Metin] [PDF]
- Livermore DM. Has the era of untreatable infections arrived? J Antimicrob Chemother 2009; 64(Suppl 1): i29-36. [Özet] [Tam Metin] [PDF]
- Zavascki AP, Carvalhaes CG, Picão RC, Gales AC. Multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii: resistance mechanisms and implications for therapy. Expert Rev Anti Infect Ther 2010; 8(1): 71-93. [Özet]
- Vogelaers D, De Bels D, Forêt F, et al. Patterns of antimicrobial therapy in severe nosocomial infections: empiric choices, proportion of appropriate therapy, and adaptation rates--a multicentre, observational survey in critically ill patients. Int J Antimicrob Agents 2010; 35(4): 375-81. [Özet]
- Tacconelli E. Antimicrobial use: risk driver of multidrug resistant microorganisms in healthcare settings. Curr Opin Infect Dis 2009; 22(4): 352-8. [Özet]
- Kerremans JJ, Verboom P, Stijnen T, et al. Rapid identification and antimicrobial susceptibility testing reduce antibiotic use and accelerate pathogen-directed antibiotic use. Antimicrob Chemother 2008; 61(2): 428-35. [Özet] [Tam Metin] [PDF]
- Kollef MH. Inadequate antimicrobial treatment: an important determinant of outcome for hospitalized patients. Clin Infect Dis 2000; 31(Suppl 4): S131-8. [Özet] [Tam Metin] [PDF]
- Harbarth S, Nobre V, Pittet D. Does antibiotic selection impact patient outcome? Clin Infect Dis 2007; 44(1): 87-93. [Özet] [Tam Metin] [PDF]
- Richter SS, Ferraro MJ. Susceptibility testing instrumentation and computerized expert systems for data analysis and interpretation, pp: 245-56. In: Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA (eds), Manual of Clinical Microbiology. 2007, 9th ed. ASM Press, Washington DC.
- Acuner IC, Eroglu C. Unacceptable performance and the lack of reproducibility results in the report of colorimetric methods for early detection of vancomycin and oxacillin resistance in Staphylococcus aureus. J Clin Microbiol 2006; 44(6): 2318-9. [Tam Metin] [PDF]
- Eigner U, Schmid A, Wild U, Bertsch D, Fahr AM. Analysis of the comparative workflow and performance characteristics of the VITEK 2 and Phoenix systems. J Clin Microbiol 2005; 43(8): 3829-34. [Özet] [Tam Metin] [PDF]
- Joyanes P, del Carmen Conejo M, Martínez-Martínez L, Perea EJ. Evaluation of the VITEK 2 system for the identification and susceptibility testing of three species of nonfermenting gram-negative rods frequently isolated from clinical samples. J Clin Microbiol 2001; 39(9): 3247-53. [Özet] [Tam Metin] [PDF]
- Steward CD, Mohammed JM, Swenson JM, et al. Antimicrobial susceptibility testing of carbapenems: multicenter validity testing and accuracy levels of five antimicrobial test methods for detecting resistance in Enterobacteriaceae and Pseudomonas aeruginosa isolates. J Clin Microbiol 2003; 41(1): 351-8. [Özet] [Tam Metin] [PDF]
- Sader HS, Fritsche TR, Jones RN. Accuracy of three automated systems (MicroScan WalkAway, VITEK, and VITEK 2) for susceptibility testing of Pseudomonas aeruginosa against five broad-spectrum beta-lactam agents. J Clin Microbiol 2006; 44(3): 1101-4. [Özet] [Tam Metin] [PDF]
- Bayramoglu G, Acuner IC, Sinirtas M, Gedikoglu S, Durupinar B. Performance evaluation of the BD Phoenix automated microbiology system in meropenem susceptibility testing of clinical Pseudomonas aeruginosa isolates. Saudi Med J 2006; 27(12): 1921-3.
- Torres E, Villanueva R, Bou G. Comparison of different methods of determining beta-lactam susceptibility in clinical strains of Pseudomonas aeruginosa. J Med Microbiol 2009; 58(5): 625-9. [Özet] [Tam Metin] [PDF]
- Blondell-Hill E, Henry DA, Speert D. Pseudomonas, pp: 734-48. In: Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA (eds), Manual of Clinical Microbiology. 2007, 9th ed. ASM Press, Washington DC.
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial tests for bacteria that grow aerobically. Approved Standard, M07-A8. 2008, 8th ed. CLSI, Wayne, Pennsylvania.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. 19th Informational Supplement, M100-S19. 2009. CLSI, Wayne, Pennsylvania.
- Food and Drug Administration, Center for Devices and Radiological Health. Guidance for Industry and FDA. Class II Special Controls Guidance Document: Antimicrobial Susceptibility Test (AST) Systems. 2009, US Department of Health and Human Services, Maryland, USA.
- O'Rourke EJ, Lambert KG, Parsonnet KC, Macone AB, Goldmann DA. False resistance to imipenem with a microdilution susceptibility testing system. J Clin Microbiol 1991; 29(4): 827-9. [Özet] [PDF]
- Burns JL, Saiman L, Whittier S, et al. Comparison of agar diffusion methodologies for antimicrobial susceptibility testing of Pseudomonas aeruginosa isolates from cystic fibrosis patients. J Clin Microbiol 2000; 38(5): 1818-22. [Özet] [Tam Metin] [PDF]
- Henwood CJ, Livermore DM, James D, Warner M; Pseudomonas Study Group. Antimicrobial susceptibility of Pseudomonas aeruginosa: results of a UK survey and evaluation of the British Society for Antimicrobial Chemotherapy disc susceptibility test. J Antimicrob Chemother 2001; 47(6): 789-99. [Özet] [Tam Metin] [PDF]
- Akan OA, Uysal S. Evaluation of disk diffusion test for carbapenem sensitivity in Acinetobacter baumannii and Pseudomonas aeruginosa strains. Mikrobiyol Bul 2005; 39(3): 273-9. [PDF]
İletişim (Correspondence):
Yrd. Doç. Dr. İbrahim Çağatay Acuner,
Yeditepe Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
Kayışdağı Caddesi 34755 İstanbul, Türkiye.
Tel (Phone): +90 216 578 0000/3218,
E-posta (E-mail): cagatay.acuner@yeditepe.edu.tr