Kateter ile İlişkili Hastane Enfeksiyonlarından İzole
Edilen Metisiline Dirençli Stafilokoklarda
Biyofilm ile İlişkili Antibiyotik Duyarlılığının Araştırılması*
Investigation
of Biofilm-Associated Antibiotic Susceptibilities of Methicillin-Resistant
Staphylococci
Isolated from Catheter-Related Nosocomial Infections
Fulya BAYINDIR BİLMAN1, Füsun CAN2, Melek KAYA3, Ayşe Canan YAZICI4
1 Diyarbakır Bölge Eğitim ve Araştırma Hastanesi, Mikrobiyoloji Laboratuvarı, Diyarbakır.
1 Diyarbakir Regional Training and Research Hospital, Microbiology Laboratory, Diyarbakir, Turkey.
2 Koç Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İstanbul.
2 Koc University Faculty of Medicine, Department of Medical Microbiology, Istanbul, Turkey.
3 Sincan Dr. Nafiz Körez Devlet Hastanesi, Mikrobiyoloji Laboratuvarı, Ankara.
3 Sincan Dr. Nafiz Korez State Hospital, Microbiology Laboratory, Ankara, Turkey.
4 Başkent Üniversitesi Tıp Fakültesi, Biyoistatistik Anabilim Dalı, Ankara.
4 Baskent University Faculty of Medicine, Department of Biostatistics, Ankara, Turkey.
* Bu çalışma, Başkent Üniversitesi Tıp Fakültesi ve Sağlık Bilimleri Araştırma Kurulu tarafından 12.02.2009 tarih ve KA09/08 proje numarasıyla onaylanan ve Başkent Üniversitesi Araştırma Fonunca desteklenen tez çalışmasıdır.
ÖZET
Hastanede yatış sürecinde yaygın olarak kullanılan kateterlerin en önemli komplikasyonu, hastalarda katetere bağlı lokal ve/veya sistemik enfeksiyonların gelişme riskidir. Bu çalışmada, kateterlerden izole edilen metisiline dirençli stafilokokların planktonik ve biyofilm sesil hücrelerinin antibiyotik duyarlılığının araştırılması, karşılaştırılması ve antibiyotiklerin tek başına ve kombinasyonlar halinde gösterdiği antimikrobiyal etkinin değerlendirilmesi amaçlanmıştır. Çalışmaya, Başkent Üniversitesi Tıp Fakültesi Hastanesinde 2006-2009 yılları arasında çeşitli servis ve yoğun bakım ünitelerinde yatarak tedavi gören hastaların kateter kültürlerinden izole edilen 15 metisiline dirençli Staphylococcus aureus (MRSA) ve 15 metisiline dirençli koagülaz-negatif stafilokok (MRKNS) olmak üzere toplam 30 suş dahil edilmiştir. Tüm suşların, planktonik hücre aşamasında ve in vitro koşullarda biyofilm oluşturduktan sonra sesil hücrelerinde çeşitli antibiyotiklere (vankomisin, siprofloksasin, rifampisin, gentamisin, meropenem, tigesiklin, linezolid, seftazidim, sefazolin) karşı duyarlılıkları sıvı mikrodilüsyon yöntemiyle araştırılmış; minimum inhibitör konsantrasyonu (MİK) ve minimum bakterisidal konsantrasyon (MBK) değerleri belirlenmiştir. Tüm antibiyotiklerin hem planktonik hem de biyofilmdeki etkinlikleri önce tek başlarına, ardından ikili ve üçlü antibiyotik kombinasyonları oluşturularak çoklu kombinasyonlu bakterisidal test (ÇKBT) yöntemiyle MİK ve MBK şeklinde saptanmıştır. Her bir antibiyotikle planktonik ve biyofilm hücrelerinde elde edilen veri seti istatistiksel olarak iki oran z testiyle analiz edilmiştir. Çalışmada, planktonik hücreler ve biyofilm arasında genel olarak duyarlılıklarda anlamlı azalmalar belirlenmiştir (p< 0.01). Hem ikili hem de üçlü kombinasyonlarla yapılan çalışmaların sonucunda da planktonik form ile biyofilm arasında kombinasyonların çoğunda duyarlılıkta anlamlı azalma olduğu görülmüştür (p< 0.01). Kombinasyonlar arasında suşların %90'ından fazlasını inhibe edebilenler karşılaştırıldığında, ikili ve üçlü kombinasyonlar arasında anlamlı bir fark saptanmamıştır. Vankomisin ve tigesiklin, tüm izolatlar için planktonik hücreler ve biyofilm sesil hücrelerinde en etkin olan antibiyotikler olarak izlenmiş; gerek ikili gerekse üçlü kombinasyonlarda vankomisin ve rifampisin içerenler biyofilm ortamında en iyi aktiviteyi göstermişlerdir. Bu araştırmanın verileri, biyofilm ile ilişkili enfeksiyonlarda kombine antibiyotik tedavisi tercihinin, özellikle de ikili kombinasyonlarla tedavinin akılcı yaklaşım olacağını düşündürmektedir.
Anahtar sözcükler: Kateter; hastane enfeksiyonu; planktonik hücre; biyofilm; duyarlılık, metisiline dirençli stafilokok.
ABSTRACT
Risks for development of local and/or systemic infections are the most important complications of catheters that are widely used during hospitalization process. The aims of this study were to investigate and compare the antibiotic susceptibilities of methicillin-resistant staphylococci isolated from catheters, in planktonic and biofilm forms, and to evaluate the antimicrobial effects of antibiotics on those forms alone and in combinations. A total of 30 strains [15 methicillin-resistant Staphylococcus aureus (MRSA) and 15 methicillin-resistant coagulase-negative staphylococci (MR-CNS)] isolated from catheter cultures of patients hospitalized in different clinics and intensive care units in Baskent University Medical School Hospital between 2006-2009, were included in the study. The antibiotic sensitivities of MRSA and MR-CNS isolates were investigated in vitro in planktonic phase and on sessile cells after biofilm was formed. Vancomycin, ciprofloxacin, rifampicin, gentamicin, meropenem, tigecycline, linezolid, ceftazidime and cephazolin were used for antibiotic susceptibility testing. The sensitivity of planktonic cells to antibiotics was primarily investigated, so that minimal inhibitor concentration (MIC) and minimal bactericidal concentration (MBC) values were determined by broth microdilution method. Afterwards, each strain was transformed to sessile cell in a biofilm environment, and MIC and MBC values were also determined for sessile cells. Double and triple antibiotic combinations were prepared, the effectiveness of combinations were studied on both planktonic and biofilm cells with multiple-combination bactericidal testing (MCBT) method. The data set obtained from planktonic and biofilm cells for each antibiotic analyzed via two proportion z test. Statistically significant decreases were found in the sensitivities of sessile cells when compared to planktonic cells (p< 0.01). The tests performed with the use of double and triple antibiotic combinations also showed the susceptibility decrease between planktonic and biofilm forms to be significant in most of the combinations (p< 0.01). The comparison of double and triple antibiotic combinations against planktonic and sessile cells as determined by the inhibition of more than 90% of the strains, revealed no significant difference . Vancomycin and tigecycline were the most effective antibiotics for all isolates in planktonic and sessile cells. Combinations containing vancomycin and rifampicin showed the best activity both double and triple antibiotic combinations against biofilm. In conclusion, our data indicated that combination therapy, especially double combinations of antibiotics seem to be a rational approach for biofilm-related infections.
Key words: Catheter; nosocomial infection; planktonic cell; biofilm; susceptibility; methicillin-resistant staphylococci.
Geliş Tarihi (Received): 13.01.2013 • Kabul Ediliş Tarihi (Accepted): 17.06.2013
GİRİŞ
Hastanede, özellikle de yoğun bakım üniteleri (YBÜ)'nde yatan hastalarda tanı ve tedavi amacıyla yaygın olarak kullanılan kateterler, tıbbi yararlarının yanı sıra enfeksiyon başta olmak üzere birçok sorunun kaynağıdır. Avrupa'da yapılan çok merkezli bir çalışmada, kateter ile ilişkili kan dolaşımı enfeksiyonu (KİKDE) insidansı, epidemiyolojisi, maliyeti ve mortalite oranları araştırılmış ve ülkeler arasında farklılıklar olmak üzere; 1.12-4.2 KİKDE/1000 kateter günü, 8400-14400 KİKDE epizodu/yıl, 1000-1584 ölüm/yıl, 35.9-163.9 milyon Euro maliyet yükü oranları tespit edilmiştir1. YBÜ'de ortaya çıkan hastane enfeksiyonlarının çoğu kan dolaşımı enfeksiyonu olup, gram-pozitif ve gram-negatif etkenlerin eşit sıklıkta izole edildiği vurgulanmaktadır2,3. Bu ünitelerde kolonize olan mikroorganizmaların çeşitli yüzeylerde biyofilm yapabilme eğilimi, bu etkenlerle oluşan enfeksiyonların tedavisinde ciddi sorunlar oluşturmaktadır4. Biyofilm içindeki bakterilerin (sesil), serbest (planktonik) bakterilere göre daha yavaş ürediği ve daha farklı davrandığı saptanmış; biyofilm bakterileri arasında özel bir iletişim olduğu (Quorum Sensing; QS) ve bu iletişim sisteminin kateterle ilişkili enfeksiyonlar (KİE) için önemli bir virülans faktörü olduğu belirlenmiştir5,6. Biyofilm direncinde konvansiyonel antibiyotik direncinden farklı mekanizmalar rol oynamaktadır7,8. Biyofilm içine antibiyotiğin düşük orandaki penetrasyonu, burada bulunan besin maddelerinin sınırlı olması, yavaş üreme ve adaptif baskı yanıtının oluşu, bakterinin çok aşamalı savunmasını oluşturmaktadır. Biyofilm direnci; biyofilm popülasyonu içindeki fenotipik varyantların ortaya çıkması, genel baskı yanıtının uyarılması, atım pompalarının ve QS sistemlerinin etkin hale gelmesini kapsamaktadır7.
Deri florasının baskın üyeleri olan KNS'ler, sıklıkla yabancı cisimlere bağlanmayı da sağlayan glikokaliks (slime) oluşturabilmeleri nedeniyle KİE'de Staphylococcus aureus ile birlikte en sık karşılaşılan etkenlerdir. Slime üretimine bağlı olarak KNS suşlarının antibiyotik direncinde de önemli artış saptanmaktadır9,10. Bu çalışmanın amacı kateterlerden izole edilen metisiline dirençli stafilokoklarda planktonik hücrelerle kıyaslandığında, biyofilm sesil hücrelerinde antibiyotik duyarlılığındaki değişimin tek başına ve kombinasyonlar oluşturularak incelenmesidir. Tek başına iken dirençli olduğu bilinen ancak kombinasyonlarda, biyofilm sesil hücreleri üzerindeki etkinliğinin araştırılması amacıyla beta-laktam antibiyotikler de kombinasyonlara eklenmiştir.
GEREÇ ve YÖNTEM
Bu çalışma, Başkent Üniversitesi Tıp Fakültesi Etik Kurul onayı ile gerçekleştirildi. Başkent Üniversitesi Tıp Fakültesi Hastanesinde 2006-2009 yılları arasında çeşitli servislerde ve YBÜ'lerde yatarak tedavi gören hastaların kateterlerinde üremiş 15 metisiline dirençli S.aureus (MRSA) ve 15 metisiline dirençli koagülaz-negatif stafilokok (MRKNS) çalışmaya dahil edildi. İzolatlar konvansiyonel yöntemlerle tanımlandı.
Çalışmada antibiyotik olarak; vankomisin (Sigma, V2002), linezolid (Pfizer, Amerika), siprofloksasin (Fako, 3585), rifampisin (Sigma, R3501), gentamisin (Sigma, G3632) ve tigesiklin (Wyeth Research, ABD) kullanıldı. Kombinasyonlarda, biyofilm sesil hücreleri üzerindeki etkinliğinin araştırılması amacıyla beta-laktam antibiyotiklerden seftazidim (Sigma, C3809), sefazolin (Sigma, C5020) ve meropenem (Astra Zeneca, İngiltere) de ikili ve üçlü kombinasyonlara eklendi. Tigesiklin hariç diğer antibiyotikler "Clinical and Laboratory Standards Institute (CLSI)"ün11 önerdiği direnç sınır değerleri dikkate alınarak hazırlanıp, kullanılıncaya kadar -80°C'de saklandı (Tablo I). Tigesiklin her çalışmada taze olarak hazırlandı.
Antibiyotik Duyarlılıklarının Belirlenmesi
Planktonik hücrelerin antibiyotik duyarlılığı CLSI önerileri doğrultusunda standart sıvı mikrodilüsyon yöntemiyle araştırılarak minimum inhibitör konsantrasyonu (MİK) ve minimum bakterisidal konsantrasyon (MBK) değerleri belirlendi. Daha sonra her bir suş ile biyofilm oluşturulup sesil hücrelerde aynı antibiyotikler için yine MİK ve MBK değerleri tespit edildi. Ardından ikili ve üçlü antibiyotik kombinasyonları oluşturulup çoklu kombinasyonlu bakterisidal test (ÇKBT) yöntemiyle hem planktonik hücrelerde hem de biyofilmde etkinlikleri belirlendi.
Planktonik Hücrelerde MİK ve MBK Değerlerinin Belirlenmesi
Antibiyotik dilüsyonları gentamisin ve vankomisin için ilk kuyucukta 64 mg/L; rifampisin, siprofloksasin, tigesiklin ve linezolid için ilk kuyucukta 32 mg/L olacak şekilde hazırlandı. Besiyeri olarak %2 oranında NaCl içeren katyon ayarlı Mueller-Hinton sıvı besiyeri (MHB; BBL, Fransa) kullanıldı. Steril U tabanlı 96 kuyucuklu polistren plaklara (Nunc, Danimarka) 100'er µl MHB dağıtıldı; ardından hazırlanan antibiyotik solüsyonlarından plakların ilk sütunundaki kuyucuklara 100'er µl eklenerek seri dilüsyonları yapıldı ve 12. sütun üreme kontrol olarak bırakıldı. Bakterilerin 24 saatlik kültürlerinden 0.5 McFarland bulanıklığına göre bakteri süspansiyonu hazırlanıp, son inokulüm konsantrasyonu 5 x 105 cfu/ml olacak şekilde, 1/100 oranında sulandırıldı ve 100'er µl tüm kuyucuklara dağıtıldı. Tüm plaklar 37°C'de 18-24 saat inkübe edilerek ertesi gün sonuçlar hem gözle değerlendirildi hem de optik okuyucuda (ELx800, Universal Microplate Reader, Bio-Tek) 530 nm dalga boyunda okutuldu. Her iki sonuç birlikte değerlendirilerek, üremenin inhibe olduğu en son kuyucuktaki antibiyotik konsantrasyonu MİK değeri olarak belirlendi. Hiç üreme görülmeyen kuyucuklardan 10'ar µl alınarak triptik soy agar (BD, Fransa) yüzeyine damla ekimi yapıldı. Plaklar 37°C'de 18-24 saat inkübe edilerek, üremenin inhibe olduğu en düşük konsantrasyon MBK değeri olarak kabul edildi. Tüm testler iki kez çalışıldı ve S.aureus ATCC 25923 suşu kalite kontrol olarak kullanıldı.
Biyofilmde MİK ve MBK Değerlerinin Belirlenmesi
Biyofilm deneyleri iğneli kapaklı polistren plaklarda (Nunc, Danimarka) uygulandı. Tüm suşların taze pasajlarından MHB-II (BBL, Fransa) ile 0.5 McFarland yoğunluğunda süspansiyon hazırlandı. Plaklara 100'er µl dağıtılıp, üzerine polistren yapıda iğneli kapaklar kapatılarak 18-24 saat 37°C'de çalkalanarak inkübe edildi. Sesil hücreler ile çalışmada antibiyotik dilüsyonları planktonikten farklı olarak iki dilüsyon üstünden başlayacak şekilde hazırlandı. Yeni plaklara önce 100'er µl MHB-II dağıtılıp, birinci sıra kuyucuklara 100'er µl antibiyotik eklenerek seri dilüsyon yapıldı. Daha sonra önceden biyofilmin oluşturulduğu iğneli kapaklar bu yeni plaklara kapatıldı. Plaklar 37°C'de 18-24 saat inkübe edildi. Ertesi gün optik okuyucuda 530 nm dalga boyunda ve gözle okunarak üremenin inhibe olduğu en düşük konsantrasyon biyofilm inhibitör konsantrasyon (BİK) değeri olarak belirlendi. Biyofilm bakterisidal konsantrasyon (BBK) değerlerinin belirlenmesi amacıyla, steril 96 kuyucuklu U tabanlı yeni plaklara MHB-II besiyerinden 100'er µl dağıtılıp, BİK değerleri belirlenen iğneli kapak transfer edildi. Sonikatörde beş dakika kuvvetle çalkalanıp tekrar 37°C'de 18-24 saat inkübasyona bırakıldı. Ertesi gün optik okuyucuda (530 nm) ve gözle okunarak üremenin görülmediği en düşük konsantrasyon BBK olarak belirlendi.
Planktonik Hücrelerde Çoklu Kombinasyonlu Bakterisidal Test (ÇKBT)
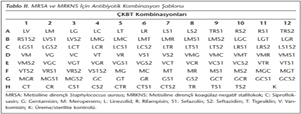
MRSA ve MRKNS izolatları için iki farklı çalışma düzeneği oluşturuldu. Bu izolatların dirençli olduğu kabul edilen meropenem, sefazolin ve seftazidim içeren 20 ikili, 44 üçlü kombinasyon ve diğer antibiyotiklerle de 15 ikili ve 15 üçlü antibiyotik kombinasyonu seçildi. Böylece toplam 94 farklı kombinasyon hazırlandı. Önce mikroplak üzerinde tüm kombinasyonların yerleştirildiği bir şablon hazırlandı (Tablo II). Antibiyotikler hazırlanırken, CLSI'nın11 önerdiği direnç sınır değerleri dikkate alındı. Buna göre gentamisin ve meropenem 16 mg/L, siprofloksasin ve rifampisin 4 mg/L, linezolid 8 mg/L, seftazidim, sefazolin 32 mg/L, tigesiklin 0.5 mg/L ve vankomisin S.aureus için 16 mg/L, KNS'ler için 32 mg/L direnç sınırı olarak kabul edildi ve her bir antibiyotik ÇKBT için 10 kat konsantre edilerek hazırlandı. Antibiyotikler önceden planlanan şablona uygun olacak şekilde kuyucuklara 10'ar µl dağıtıldı. Üçlü ve ikili kombinasyonlarda her bir antibiyotikten 10'ar µl koyularak, 10 µl de %2 NaCl içeren MHB-II eklendi. Bakterilerin taze pasajlarından 0.5 McFarland bulanıklığına göre bakteri süspansiyonu hazırlanıp son inokulüm konsantrasyonu 5 x 105 cfu/ml olacak şekilde, 1/100 oranında sulandırıldı. Antibiyotikler dağıtıldıktan sonra tüm kuyucuklara hazırlanan bu bakteri süspansiyonlarından 70'er µl ilave edildi; böylece tüm kuyucuklarda toplam hacim 100 µl'ye tamamlandı. Mikroplaklar 37°C'de 18-24 saat inkübe edildikten sonra üremenin inhibisyonu gözle ve optik okuyucuda (530 nm) değerlendirildi. Üreme olmayan kuyucuklardan 10'ar µl alınarak triptik soy agar yüzeyine damla ekimi yapıldı; 37°C'de 18-24 saat inkübe edildi ve ertesi gün üreme olmayan kuyucuklarda bakterisidal etki araştırıldı.
Biyofilmde ÇKBT
Biyofilm deneyleri yine iğneli kapaklı polistren plaklarda çalışıldı. Tüm suşların taze pasajlarından 0.5 McFarland yoğunluğunda süspansiyon hazırlandı. Plaklara 100'er µl dağıtılıp, üzerine iğneli kapaklar kapatılarak 18-24 saat 37°C'de çalkalanarak inkübe edildi. Antibiyotiklerin ikili ve üçlü olacak şekilde kombinasyonları yukarıda bahsedildiği şekilde hazırlandı. Yeni bir U tabanlı mikroplağa antibiyotik kombinasyonları şablondaki gibi dağıtılıp üzerine 70'er µl MHB-II eklendi; biyofilm oluşturulmuş iğneli kapaklar, antibiyotik kombinasyonlarını içeren bu yeni mikroplağa aktarıldı ve 37°C'de 18-24 saat inkübe edildi. Üremenin biyofilmde inhibisyonu, gözle ve optik okuyucuda (530 nm) okutularak değerlendirildi. Biyofilmde bakterisidal konsantrasyonların belirlenmesi amacıyla steril U tabanlı yeni plaklara MHB-II besiyeri 100'er µl dağıtılıp, iğneli kapak bu plağa transfer edildi. Sonikatörde beş dakika kuvvetle çalkalanıp 37°C'de 18-24 saat inkübe edildi ve ertesi gün optik okuyucuda (530 nm) ve gözle okunarak üremenin görülmediği kuyucukta bakterisidal etki varlığı belirlendi.
İstatistiksel Analiz
Veri seti iki oran z testiyle analiz edildi. Sonuçlar gözlem sayısı (n) ve oran (%) olarak ifade edildi; p< 0.05 düzeyi istatistiksel olarak anlamlı kabul edildi. İstatistiksel analizler MINITAB 15.0 istatistik yazılımıyla gerçekleştirildi.
BULGULAR
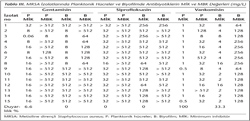
Çalışmada MRSA izolatlarında, tüm antimikrobiyallerin biyofilm ortamında duyarlılıklarının azaldığı izlenmiştir (Tablo III). Gentamisin (GEN) için planktonik hücrede duyarlılık oranı %6.6 olarak bulunmuşken biyofilm hücrelerinin tamamında direnç tespit edilmiştir. MRSA izolatlarında biyofilm ortamında en yüksek duyarlılık tigesiklin (%86.6) ile elde edilmiştir. MRSA izolatlarının tamamı planktonik iken vankomisin (VAN), tigesiklin (TIG) ve linezolid (LIN)'e duyarlı bulunmuş; ancak biyofilmde bu antibiyotiklere duyarlılık sırasıyla %86.6, %33.3 ve %26.6 olarak saptanmıştır. LIN ve VAN etkinliğinin biyofilm hücrelerine anlamlı olarak azaldığı görülmüştür (p< 0.01). MRSA izolatları siprofloksasin (CIP) ve rifampisin (RIF)'e hem planktonik formda hem de biyofilmde %100 dirençli bulunmuştur. Diğer tüm antibiyotiklerde planktonik hücredeki MBK değerleri genellikle biyofilmlere göre daha düşük gözlenirken, TIG'da ise MBK değerlerinin biyofilmde 2-4 kat daha düşük olduğu dikkati çekmiştir.
MRKNS izolatları değerlendirildiğinde; hem planktonik (%100) hem de biyofilm ortamındaki (%33.3) hücrelerin VAN'a duyarlılığının MRSA ile benzer olduğu gözlenmiştir (Tablo IV). Ayrıca RIF (sırasıyla %66.6 ve %66.6) ve CIP'ın (sırasıyla %26.6 ve %20) planktonik ve biyofilm ortamında benzer duyarlılık gösterdiği saptanmıştır. MRKNS izolatlarında elde edilen sonuçlara göre, planktonik formda suşların tamamı VAN, TIG ve LIN'a duyarlı iken, GEN'e %40, CIP'a %26.6 ve RIF'a %66.6'sı duyarlı bulunmuştur. Biyofilm ortamında rifampisine suşların duyarlılığı planktonik hücreler ile aynı oranda saptanırken, GEN, VAN, LIN ve TIG duyarlılıklarında azalma (p< 0.01) gözlenmiştir.
MRSA izolatlarında planktonik hücreler GEN + CIP, GEN + RIF ve CIP + RIF kombinasyonları haricinde diğer kombinasyonlara %90'ın üzerinde duyarlı bulunmuştur (Tablo V). CIP + RIF kombinasyonuna tüm suşlar dirençli olarak saptanmıştır. VAN içermeyen ikili kombinasyonların çoğunda, biyofilm ortamında planktonik hücrelerde elde edilen etkinlik düzeyine ulaşılamamıştır. Biyofilm ortamında en iyi aktivite VAN ile olan ikili kombinasyonlarda görülmüş; özellikle VAN + RIF, hem MRSA hem de MRKNS izolatlarında planktonik hücrelerde ve biyofilmde en etkin olan kombinasyon olarak izlenmiştir.
MRKNS izolatlarında beta-laktamlı kombinasyonlardan VAN + sefazolin (CEZ) ve meropenem (MER) + TIG ile hem planktonik hem de biyofilm hücrelerinde %100 duyarlılık saptanırken, VAN + seftazidim (CTZ) ve TIG + CEZ kombinasyonunda planktonik hücrelerde %100, biyofilmde ise %93 oranında duyarlılık bulunmuştur. MRKNS izolatlarında da planktonik hücrelerde ikili kombinasyonlara suşların %47-100'ü duyarlı bulunmuş; biyofilm ortamında ise beta-laktam içermeyen tüm antibiyotik kombinasyonlarında duyarlılıklarda azalma görülmüştür (p< 0.01). MRKNS suşlarının planktonik ve biyofilm hücrelerine LIN + MER (%87), VAN + CEZ ve MER + TIG (%100) kombinasyonları eşit etkinlik göstermiştir. Gerek planktonik gerekse sesil hücrelere en etkin kombinasyon VAN + RIF olarak belirlenmiştir.
Üçlü kombinasyonlarda MRSA izolatlarında GEN + CIP + RIF kombinasyonunun, bu antibiyotiklerin ikili kombinasyonlarında gözlendiği şekilde planktonik ve biyofilmde etkinlikleri düşük bulunmuştur (Tablo VI). Diğer tüm kombinasyonların etkinliği planktonik hücrelerde %73'ün üzerindedir. Ancak biyofilmde VAN hariç tüm kombinasyonların etkinliğinde düşüş gözlenmiş, VAN + CIP + RIF kombinasyonunda ise biyofilm ortamında planktonik hücrelere göre anlamlı olmayan hafif bir artış izlenmiştir. Üçlü kombinasyonların MRKNS izolatlarına etkinliği incelendiğinde planktonik ve biyofilm hücreleri üzerinde belirgin bir aktivite azalması görülmemiştir. VAN + GEN + CIP ve VAN + CIP + TIG kombinasyonlarında biyofilm hücrelerine etkinliğin planktonik hücrelere göre anlamlı olmayan hafif bir artış, VAN + CIP + RIF kombinasyonunda ise belirgin bir artış gözlenmiştir.
MRSA izolatlarında üçlü kombinasyonlarda izolatların %90'ından fazlasını inhibe etme yönünden, planktonik ile biyofilm hücrelerine etkinlik arasındaki fark istatistiksel olarak anlamlı bulunmuştur (p< 0.001). MRSA izolatlarında hem planktonik hem de biyofilm hücrelerinin %90'ından fazlasını inhibe eden ikili kombinasyonlar ile üçlü kombinasyonlar karşılaştırıldığında, aralarında istatistiksel yönden anlamlı fark bulunmamıştır.
Üçlü kombinasyonların MRKNS izolatları üzerindeki etkinliğine bakıldığında, hem planktonik hem de biyofilmde suşların %60-90'ını inhibe eden oran yüksek bulunmuştur. Üçlü kombinasyonlarda izolatların %90'ından fazlasını inhibe etme yönünden planktonik ile biyofilm hücrelerine etkinlik arasında istatistiksel yönden anlamlı fark (p> 0.01) saptanmamıştır. MRKNS izolatlarında planktonik hücrelerin %90'ından fazlasını inhibe eden ikili kombinasyonlar ile üçlü kombinasyonlar karşılaştırıldığında aralarında istatistiksel yönden üçlü kombinasyonlar lehine anlamlı fark (p< 0.01) tespit edilmiştir. Ancak biyofilm hücrelerinde aynı analiz yapıldığında istatistiksel yönden anlamlı fark bulunmamıştır.
Beta-laktam antibiyotikleri içeren kombinasyon sonuçları değerlendirildiğinde; MRSA suşlarından farklı olarak, MRKNS'de biyofilmde elde edilen sonuçlar daha başarılı bulunmuştur. Beta-laktam içeren ikili kombinasyonlarda; MRSA suşlarında VAN'lı kombinasyonların dışındaki duyarlılık yüzdeleri planktonik hücrelerde yüksek iken biyofilmde düşük çıkmıştır. Oysa MRKNS izolatlarında farklı olarak biyofilmde de ikili kombinasyonlarda genel olarak yüksek duyarlılık elde edilmiştir. Biyofilm duyarlılığı ikili kombinasyonlardan MER + TIG ile VAN + CEZ'e, üçlü kombinasyonlardan da VAN + MER + CIP, VAN + MER + TIG, VAN + CIP + CEZ ve VAN + CIP + CTZ'ye %100 olarak belirlenmiştir. Beta-laktam antibiyotikler ile oluşturulan bu kombinasyonların, MRKNS suşlarında, biyofilm ortamında oldukça başarılı sonuçları ilgi çekici bir bulgudur.
Bakterisidal etkinlik sonuçları değerlendirildiğinde, kombinasyonlar tüm suşlarda planktonik hücrelerde oldukça başarılı bulunmuştur. Bununla birlikte, biyofilmde MRSA izolatlarında VAN + MER + TIG ve VAN + CEZ + TIG kombinasyonları %60 öldürücü (killing) etki gösterirken; aynı kombinasyonlar MRKNS izolatlarının %80'inde öldürücü etki göstermiştir.
TARTIŞMA
Çalışmamızda, kateter gibi yabancı cisimlerin yüzeyinde oluşturdukları slime faktör sayesinde, kendilerini bu biyofilm matriksinin içine saklayarak hem immün sistemden hem de antimikrobiyal maddelerden koruyabilen stafilokoklarda, artan antibiyotik direnci araştırılmış, çeşitli antibiyotik kombinasyonlarının planktonik hücreler ve biyofilm sesil hücrelerindeki inhibe edici ve öldürücü etkinliği de belirlenmiştir. Elde ettiğimiz bulgulara göre stafilokokal biyofilmlerde vankomisinin tek başına düşük etkinlik gösterdiği saptanmıştır. Benzer şekilde Souli ve arkadaşları10 slime-pozitif KNS suşlarında, Saginur ve arkadaşları12 ise MRSA suşlarında, biyofilm ortamında vankomisine duyarlılıkta belirgin azalma olduğunu bulmuşlardır. Çalışmamızda, vankomisinin ancak diğer ilaçlarla kombine edildiğinde biyofilm hücreleri üzerinde güçlü etkinliğe sahip olduğu gözlemlenmiştir.
Çalışmamızda rifampisin, Souli ve arkadaşları10 ile uyumlu olarak MRKNS izolatlarında biyofilm üzerinde planktonik hücreler ile eşit etkinlikte bulunmuştur. Bu araştırıcılar10 siprofloksasinin biyofilmdeki etkinliğinde %9.5 azalma saptamışlardır. MRKNS izolatlarımızda siprofloksasinin planktonik hücreler üzerinde iyi bir etkinliği olmamasına rağmen, bu çalışmaya benzer şekilde biyofilm ortamında duyarlılıkta %6.6 azalma olduğu görülmüştür.
Biyofilmlerde, ÇKBT yöntemini kullanarak antibiyotik kombinasyonlarını inceleyen Saginur ve arkadaşlarının12 verilerine göre, ikili kombinasyonlar içinde en etkili VAN + RIF bulunmuş; üçlü kombinasyonlardan da RIF + VAN + GEN ve RIF + VAN + CIP biyofilmde de planktonikte olduğu gibi %100 duyarlı çıkmıştır. Çalışmamızda da üçlü kombinasyonlar arasında en etkin olanlardan birisi VAN + CIP + RIF kombinasyonudur. MRKNS suşları için biyofilm ortamında Saginur ve arkadaşlarının12 bulgularını destekler şekilde bu kombinasyonun aktivitesi daha da yüksek bulunmuştur. Ancak bu araştırıcıların12 çalışmasından farklı olarak çalışmamızda, ikili ve üçlü kombinasyonlarda planktonik hücreler ve biyofilm ortamında %90 inhibisyon açısından anlamlı fark bulunmamıştır.
Bu çalışmada MRSA izolatlarında, Molina ve arkadaşlarının13 bulgularından farklı sonuçlar elde edilmiştir. Bizim çalışmamızda rifampisine hem planktonik hücrelerde hem de biyofilm ortamında tüm izolatlar dirençli bulunmuş, gentamisine ise sadece bir izolat planktonik ortamda duyarlı bulunmuştur.
Çalışmamızda tigesiklin aktivitesi, MRSA planktonik hücreleri ve biyofilmde yakın oranlarda tespit edilmiştir (sırasıyla %100 ve %86.6). Smith ve arkadaşları14, biyofilm hücrelerinde linezolid ve tigesiklinin MRSA planktonik hücreleri üzerinde çok etkin olmasına rağmen, biyofilm ortamında etkinliklerinin belirgin olarak azaldığını ve bu antibiyotiklerin kateterde biyofilm ile ilişkili enfeksiyonların tedavisinde yeterli etkinlikte olamayacağını belirtmektedirler. Bizim çalışmamızda da Smith ve arkadaşlarının14 bulgularına benzer şekilde biyofilm ortamında linezolid aktivitesinde azalma saptanmıştır. MRSA izolatlarında tüm antibiyotiklerde planktonik hücreler için elde edilen MBK değerleri çoğunlukla biyofilm ortamına göre daha düşük gözlenmiş, tigesiklinde ise MBK değerlerinin biyofilmde 2-4 kat daha düşük olduğu dikkati çekmiştir. Tigesiklin ile elde edilen bu ilginç sonuç için; biyofilm ortamı içinde henüz tam olarak çözümleyemediğimiz bir etkenin ya da koşulun, tigesiklinin bakteriler üzerindeki sidal etkisini daha düşük konsantrasyonda göstermesine neden olduğu düşünülmüştür. Bu konuda yapılmış çalışmalarda, stafilokokal biyofilmlerde tigesiklinin biyofilm kalınlığını azalttığı, biyofilmdeki bakterilerin üremesini üçüncü günde tamamen inhibe ettiği ve N-asetilsistein ile kombinasyonundaki başarısı göz önüne alındığında bu ikilinin kateter koruyucu olarak tercih edilebileceği bildirilmektedir15,16,17. Labthavikul ve arkadaşları18 tigesiklinin aderan Staphylococcus epidermidis hücreleri üzerinde planktonik hücrelere göre daha iyi aktivite gösterdiğini ve KİKDE tedavisinde tercih edilebileceğini belirtmişlerdir. Ancak tigesiklinin biyofilm ortamındaki inhibitör ve bakterisidal konsantrasyonlarının planktonik hücre sonuçları ile yakın olması, bu çalışmada farklı bir bulgu olarak karşımıza çıkmış ve tigesiklinin KİE'de iyi bir seçenek olabileceğini düşündürmüştür.
Meropenem, sefazolin ve seftazidime özellikle MRSA ve MRKNS suşlarında direnç görüldüğü halde, seftobiprol gibi yeni moleküllerin etkinliği üzerine yapılan yayınlarda düşük pH'da görülen yüksek duyarlılık değerlerinden dolayı bu üç antibiyotik çalışmamıza dahil edilmiştir19. Bizim çalışmamızda da bu üç antibiyotik tek başına iken MRSA ve MRKNS suşlarında tamamen etkisiz olmasına rağmen, ilginç olarak, özellikle diğer ilaçlarla kombinasyonlarda başarılı bulunmuştur. MRSA ve MRKNS izolatlarında bu antibiyotiklerin vankomisin, linezolid ve tigesiklin içeren kombinasyonlarına yüksek oranda duyarlılık gözlenmiştir. Biyofilmde MRSA suşlarında VAN + MER kombinasyonu en iyi aktiviteyi gösterirken, üçlü kombinasyonlarda en iyi etkinlik VAN + MER + CTZ kombinasyonunda belirlenmiştir. MRKNS izolatlarında MER + TIG ile VAN + CEZ'e hem planktonik hücrede hem de biyofilmde %100 duyarlılık görülmüştür. Üçlü kombinasyonlarda da vankomisinin meropenem, sefazolin ve seftazidim ile tüm kombinasyonları oldukça yüksek etkinlik göstermiştir.
Biyofilmde MRSA suşlarında vankomisin tek başına kullanıldığında elde edilen MBK değerleri 64 mg/L'nin üzerinde iken, vankomisinin meropenem, seftazidim ve tigesiklinli kombinasyonlarında suşların yarısından fazlasında bakterisidal etki görülmesi sinerjiyi düşündürmektedir. Bu sonuçlar, "Beta-laktam grubu antibiyotiklerin vankomisin ile kombinasyonu farklı mekanizmalarla direnci azaltıyor mu?" sorusunu akla getirmektedir. Bu etkinliğin, adı geçen antimikrobiyallerin vankomisinin biyofilm ortamına penetrasyonunu artırmasına bağlı olabileceği ya da biyofilm ortamında metabolik dengelerde yaptıkları henüz bilinmeyen değişikliklerden kaynaklanabileceği düşünülmüştür. Bu hipotetik yaklaşımların aydınlatılabilmesi için ileri araştırmalara gereksinim vardır. Etki mekanizmaları dikkate alındığında vankomisinin yavaş bakterisidal etki gösterdiği ve bu nedenle bakterileri özellikle yüksek inokulümde daha belirgin olarak beta-laktamlardan daha yavaş öldürdüğü bilinmektedir. Özellikle metisiline duyarlı S.aureus bakteriyemisi ve endokarditlerinde beta-laktam grubu antibiyotikler vankomisinden daha yüksek etkinlik göstermektedir20. Rochon-Edouard ve arkadaşlarının21 disk difüzyon yöntemiyle yaptıkları çalışmada, sefazolin ve imipenemin vankomisin ile kombine edildiğinde MRSA izolatlarına karşı güçlü bakterisidal etkiye sahip oldukları gösterilmiştir. Time kill yönteminin kullanıldığı in vitro bir çalışmada, beta-laktam (seftriakson, seftazidim, sefpodoksim) grubu antibiyotiklerle vankomisin kombinasyonlarının MRSA izolatlarında benzer şekilde sinerjistik etki oluşturduğu bildirilmektedir22. Bir başka çalışmada da, sefazolinin vankomisin ile kombinasyonunda time kill yöntemiyle MRSA suşlarında öldürme oranlarında artış olduğu rapor edilmiştir23.
Sonuç olarak çalışmamızın verileri, biyofilm ile ilişkili enfeksiyonlarda kombine tedavi tercihinin, özellikle de ikili kombinasyonların akılcı tedavi yaklaşımı olacağını düşündürmektedir. Bu bulgular, klinik bakımdan in vivo verilerle desteklendiği takdirde KİKDE tedavisinde daha başarılı sonuçların elde edilebileceği kanısına varılmıştır.
KAYNAKLAR
- Tacconelli E, Smith G, Hieke K, Lafuma A, Bastide P. Epidemiology, medical outcomes and costs of catheter-related bloodstream infections in intensive care units of four European countries: literature and registry-based estimates. J Hosp Infect 2009; 72(2): 97-103.
- Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995; 274(8): 639-44.
- Yılmaz N, Köse Ş, Ağuş N, Ece G, Akkoçlu G, Kıraklı C. Yoğun bakım ünitesinde yatan hastaların kan kültürlerinde üreyen mikroorganizmalar, antibiyotik duyarlılıkları ve nozokomiyal bakteriyemi etkenleri. ANKEM Derg 2010; 24(1): 12-9.
- Rosenthal VD, Maki DG, Jamulitrat S, et al. International Nosocomial Infection Control Consortium (INICC) report, data summary for 2003-2008, issued June 2009. Am J Infect Control 2010; 38(2): 95-104.
- Williams P. Quorum sensing. Int J Med Microbiol 2006; 296(2-3): 57-9.
- Li YH, Tian X. Quorum sensing and bacterial social interactions in biofilms. Sensors (Basel) 2012; 12(3):2519-38.
- Stewart PS. Mechanisms of antibiotic resistance in bacterial biofilms. Int J Med Microbiol 2002; 292(2): 107-13.
- Altun HU, Şener B. Biyofilm enfeksiyonları ve antibiyotik direnci. Hacettepe Tıp Derg 2008; 39(2): 82-8.
- Kotilainen P, Nikoskelainen J, Huovinen P. Antibiotic susceptibility of coagulase-negative staphylococcal blood isolates with special reference to adherent, slime-producing Staphylococcus epidermidis strains. Scand J Infect Dis 1991; 23(3): 325-32.
- Souli M, Giamarellou H. Effects of slime produced by clinical isolates of coagulase negative staphylococci on activities of various antimicrobial agents. Antimicrob Agents Chemother 1998; 42(4): 939-41.
- Clinical and Laboratory Standards Institute. Antimikrobik Duyarlılık Testleri için Uygulama Standartları. Ondokuzuncu Bilgi Eki, M100-S19, 2009. Gür D (Çeviri ed), Türk Mikrobiyoloji Cemiyeti Yayını, İstanbul.
- Saginur R, Stdenis M, Ferris W, et al. Multiple combination bactericidal testing of staphylococcal biofilms from implant-associated infections. Antimicrob Agents Chemother 2006; 50(1): 55-61.
- Molina A, Del Campo R, Maiz L, et al. High prevalence in cystic fibrosis patients of multiresistant hospital-acquired methicillin-resistant Staphylococcus aureus ST228-SCCmecI capable of biofilm formation. J Antimicrob Chemother 2008; 62(5): 961-7.
- Smith K, Perez A, Ramage G, Gemmell CG, Lang S. Comparison of biofilm-associated cell survival following in vitro exposure of meticillin-resistant Staphylococcus aureus biofilms to the antibiotics clindamycin, daptomycin, linezolid, tigecycline and vancomycin. Int J Antimicrob Agents 2009; 33(4): 374-8.
- Raad I, Hanna H, Jiang Y, et al. Comparative activities of daptomycin, linezolid, and tigecycline against catheter-related methicillin-resistant Staphylococcus bacteremic isolates embedded in biofilm. Antimicrob Agents Chemother 2007; 51(5): 1656-60.
- Presterl E, Lassnigg A, Eder M, Reichmann S, Hirschl AM, Graninger W. Effects of tigecycline, linezolid and vancomycin on biofilms of viridans streptococci isolates from patients with endocarditis. Int J Artif Organs 2007; 30(9): 798-804.
- Aslam S, Trautner BW, Ramanathan V, Darouiche RO. Combination of tigecycline and N-acetylcysteine reduces biofilm-embedded bacteria on vascular catheters. Antimicrob Agents Chemother 2007; 51(4): 1556-8.
- Labthavikul P, Petersen PJ, Bradford PA. In vitro activity of tigecycline against Staphylococcus epidermidis growing in an adherent-cell biofilm model. Antimicrob Agents Chemother 2003; 47(12): 3967-9.
- Lemaire S, Glupczynski Y, Duval V, et al. Activities of ceftobiprole and other cephalosporins against extracellular and intracellular (THP1 macrophages and keratinocytes) forms of methicillin-susceptible and methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2009; 53(6): 2289-97.
- Taşova Y. Dirençli gram-pozitif bakteri infeksiyonlarinda güncel tedavi. Yoğun Bakım Derg 2012; 10(3): 147-64.
- Rochon-Edouard S, Pestel-Caron M, Lemeland JF, Caron F. In vitro synergistic effects of double and triple combinations of beta-lactams, vancomycin, and netilmicin against methicillin-resistant Staphylococcus aureus strains. Antimicrob Agents Chemother 2000; 44(11): 3055-60.
- Climo MW, Patron RL, Archer GL. Combinations of vancomycin and beta-lactams are synergistic against staphylococci with reduced susceptibilities to vancomycin. Antimicrob Agents Chemother 1999; 43(7): 1747-53.
- Hagihara M, Wiskirchen DE, Kuti JL, Nicolau DP. In vitro pharmacodynamics of vancomycin and cefazolin alone and in combination against methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother 2012; 56(1): 202-7.
İletişim (Correspondence):
Uzm. Dr. Fulya Bayındır Bilman,
Diyarbakır Bölge Eğitim ve Araştırma Hastanesi,
Mikrobiyoloji Laboratuvarı, Diyarbakır, Türkiye.
Tel (Phone): +90 412 258 0060,
E-posta (E-mail): f_bilman@hotmail.com