Çok İlaca Dirençli Acinetobacter baumannii İzolatlarında Virülans Faktörlerinin Araştırılması*
Investigation of the Virulence Factors of Multidrug-Resistant Acinetobacter baumannii Isolates
Bayrı ERAÇ1, Fethiye Ferda YILMAZ1, Mine HOŞGÖR LİMONCU1, İsmail ÖZTÜRK1, Şöhret AYDEMİR2
1 Ege Üniversitesi Eczacılık Fakültesi, Farmasötik Mikrobiyoloji Anabilim Dalı, İzmir.
1 Ege University Faculty of Pharmacy, Department of Pharmaceutical Microbiology, Izmir, Turkey.
2 Ege Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, İzmir.
2 Ege University Faculty of Medicine, Department of Medical Microbiology, Izmir, Turkey.
* Bu çalışma, Ege Üniversitesi Rektörlüğü Bilimsel Araştırma Fonu (No: 11/ECZ/013) tarafından desteklenmiştir.
ÖZET
Acinetobacter baumannii, ventilatörle ilişkili pnömoni, bakteriyemi, menenjit, üriner sistem ve yara enfeksiyonları gibi insan sağlığını tehdit eden önemli nozokomiyal enfeksiyonlara neden olan fırsatçı bir patojendir. Çok ilaca dirençli (ÇİD) A.baumannii suşlarının neden olduğu enfeksiyonlarda tedavi seçenekleri oldukça kısıtlıdır. Günümüze kadar A.baumannii izolatlarıyla yapılan çalışmaların çoğu antibiyotik direnci, tedavi protokolleri ve epidemiyolojik veriler üzerine odaklanmasına karşın, bu bakterinin virülans faktörleriyle ilgili çalışmaların sayısı azdır. Biyofilm oluşturma, serum direnci, hareket, efluks pompası ve demir kazanımı gibi özellikler, bakterinin olumsuz ortam koşullarında hayatta kalmasını ve enfeksiyon oluşturmasını kolaylaştırmaktadır. Bu çalışmada, klinik önemi gittikçe artan ÇİD A.baumannii izolatlarının virülansıyla ilişkili temel özelliklerin araştırılması hedeflenmiştir. Çalışmaya, Ege Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalında Aralık 2011-Mart 2012 tarihleri arasında çeşitli klinik örneklerden izole edilen, siprofloksasin-imipenem-trimetoprim/sülfametoksazole dirençli 65 A.baumannii suşu alınmıştır. İzolatların klonal yakınlıkları, "Enterobacterial repetitive intergenic consensus (ERIC)" dizilerine özgü ERIC-2 primeri kullanılarak PCR ile incelenmiştir. Her klondan bir temsilci seçilerek, bu suşlarda biyofilm oluşturma, siderofor üretimi, serum direnci, "twitching (seğirme)" ve "swarming (yayılma)" hareketleri ile efluks pompası varlığı araştırılmıştır. Çalışmaya alınan ÇİD A.baumannii suşlarının yedi ana grup altında toplandığı, bu klonlardan en büyüğünün incelenen izolatların %86'sını kapsadığı belirlenmiştir. Alt gruplar da dahil olacak şekilde tüm klonlardan temsili birer suş alınarak, toplam 16 bakteride virülansla ilişkili özellikler araştırılmıştır. Biyofilm oluşturma kapasitesi incelenen bu suşlardan 12'sinin güçlü, üçünün orta, birinin ise zayıf biyofilm üreticisi olduğu belirlenirken, hiçbir suşta siderofor üretimi saptanamamıştır. On altı suştan ikisinin, serumun bakterisidal etkisine dirençli, birinin orta duyarlı, 13'ünün ise duyarlı olduğu bulunmuştur. Çalışmamızda, sadece bir suşta "twitching", yedi suşta ise "swarming" hareketi gözlenmiştir. "Twitching" görülen izolatta aynı zamanda "swarming" de saptanmıştır. Siprofloksasin ile efluks pompası varlığı araştırılan 16 suştan hiçbirinde bu yönde bir bulguya rastlanmazken, doksisikline dirençli beş suştan ikisinde efluks pompası tespit edilmiştir. İncelenen suşlarda, biyofilm oluşturmanın en yaygın gözlenen özellik olduğu, bunun yanı sıra serum direnci, "swarming" hareketi ve spektrumunda tetrasiklinleri içeren bir efluks pompasının da virülansla ilişkili özellikler arasında yer aldığı belirlenmiştir. Biyofilm oluşumuna tüm klonlarda, serum direncine ise sadece en baskın klonun temsilcilerinde rastlanmıştır. Hareket ve efluks pompası varlığı ise belirli bir klona özgü değildir. Hastanemizde olduğu gibi tüm dünyada nozokomiyal enfeksiyonların en önemli etkenlerinden olan ÇİD A.baumannii izolatlarının patojenitesinde rol oynayan özelliklerin ortaya konması, gerekli enfeksiyon kontrol önlemlerinin alınması ve yeni tedavi seçeneklerinin araştırılmasında yol gösterici olacaktır.
Anahtar sözcükler: Acinetobacter baumannii; çoklu ilaç direnci; virülans faktörü.
ABSTRACT
Acinetobacter baumannii is an opportunistic human pathogen which causes life-threatening nosocomial infections such as ventilator-associated pneumonia, bacteremia, meningitis, urinary tract and wound infections. Treatment options are very limited for infections caused by multi-drug resistant (MDR) A.baumannii strains. Until recently, the majority of studies related to A.baumannii have focused on antibiotic resistance, treatment protocols and epidemiological data, however, there have been few studies addressing the virulence factors of this organism. The features such as biofilm formation, serum resistance, motility, efflux pumps and iron acquisition mechanisms help the bacterium to survive in adverse environmental conditions and facilitate the development of an infection. The aim of the present study was to investigate the basic characteristics that contribute to the virulence of clinically important MDR A.baumannii isolates. Sixty-five ciprofloxacin-imipenem-trimethoprim/sulfamethoxazole-resistant A.baumannii strains isolated from various clinical specimens between December 2011 and March 2012 at Ege University Faculty of Medicine, Department of Medical Microbiology were included in the study. The clonal relationship of the isolates was analyzed by PCR using Enterobacterial repetitive intergenic consensus (ERIC)-2 primer. Biofilm formation, serum resistance, twitching and swarming motility, efflux pump and siderophore production were sought in representatives of each clone. Investigated MDR A.baumannii isolates were classified into seven main clusters, and the largest cluster included 86% of the strains. The virulence-associated features were investigated in 16 representative strains, including sub-groups. Twelve, three and one of the examined strains were determined to be strong, intermediate and weak biofilm producers, respectively. Siderophore production was not encountered in any of the isolates. Of the sixteen strains, two, one and thirteen isolates were found to be resistant, moderately susceptible and susceptible to bactericidal effect of serum, respectively. In our study, swarming motility was observed in seven strains while twitching motility was observed in only one strain. Swarming was simultaneously detected with twitching in one isolate. The presence of an efflux pump was investigated with ciprofloxacin in 16 representative strains but none of them were positive. However, eflux pump was determined in two of the five doxycycline resistant strains. Biofilm production was the most commonly observed characteristic among the examined strains. In addition, serum resistance, swarming and an efflux pump which has a spectrum including tetracyclines, were also determined among features associated with virulence. While the biofilm production was encountered at the members of all clones, serum resistance was found only in the representatives of the most dominant clone. Motility and the presence of an efflux pump were not associated with a particular clone. MDR A.baumannii strains are among the most important agents of nosocomial infections in our hospital and all over the world. Revealing the characteristics that play a role in the pathogenesis of these isolates, will contribute to infection control measures and to the investigation of new treatment options.
Key words: Acinetobacter baumannii; multidrug-resistance; virulence factors.
Geliş Tarihi (Received): 17.07.2013 • Kabul Ediliş Tarihi (Accepted): 04.01.2014
GİRİŞ
Acinetobacter türleri, su, toprak, hayvan dokuları gibi çeşitli ortamlarda bulunmakta; nadiren de insan deri mikroflorasında yer alabilmektedir1. Acinetobacter baumannii kompleks adı altında toplanan A.baumannii, A.nosocomialis ve A.pitti gibi yakın türler, genellikle tıbbi cihazlar, sağlık çalışanları ve hastalardan izole edilmekte olup, ventilatörle ilişkili pnömoni, bakteriyemi, menenjit, üriner sistem ve yara enfeksiyonları gibi insan sağlığını tehdit eden önemli enfeksiyonlara neden olmaktadırlar1,2. Bu nedenle A.baumannii, özellikle yoğun bakım ünitelerinde gelişen nozokomiyal enfeksiyonların önemli etkenlerinden biridir ve hem Türkiye'de hem dünyada önemli bir sağlık problemi haline gelmiştir3,4. Birçok ilaca doğal olarak dirençli olması ve kolaylıkla yeni direnç mekanizmaları kazanabilmesi, neden olduğu enfeksiyonların tedavisini güçleştirmektedir1. Çok ilaca dirençli (ÇİD) A.baumannii izolatlarının tedavisinde genellikle karbapenemler, amikasin, tigesiklin ve polimiksinler kullanılmakla birlikte, tüm bu ajanlara dirençli suşlar da görülebilmektedir5,6.
Günümüze kadar A.baumannii izolatlarıyla yapılan çalışmaların çoğu antibiyotik direnci, tedavi protokolleri ve epidemiyolojik veriler üzerine odaklanmasına karşın, bu bakterinin virülans faktörleriyle ilgili çalışmalar kısıtlıdır1,7. Şu ana kadar önemi kanıtlanmış moleküler virülans faktörleri arasında; dış membran proteini A (OmpA), lipopolisakkarit, polisakkarit kapsül, penisilin bağlayan protein-7/8, lipolitik enzimler, tip-I pili, asinetobaktin ve dış membran kesecikleri sayılabilmektedir1,8. Tüm bu moleküler virülans faktörleri, biyofilm oluşturma, serum direnci, hareket ve demir kazanımı gibi patojenite açısından önemli süreçlerde rol alıp, bakterinin olumsuz ortam koşullarında hayatta kalmasını ve enfeksiyon oluşturmasını kolaylaştırmaktadır1,2. Bu çalışmada, klinik önemi gittikçe artan A.baumannii izolatlarının virülansı ile ilişkili temel özelliklerin araştırılması hedeflenmiştir.
GEREÇ ve YÖNTEM
Bakteri İzolatları ve Klonal İlişki
Ege Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı Bakteriyoloji Laboratuvarında Aralık 2011-Mart 2012 tarihleri arasında izole edilen Acinetobacter türlerinin tanımlanmasında ve siprofloksasin, imipenem, meropenem, trimetoprim-sülfametoksazol (TMP-SXT), sefepim, netilmisin, ampisilin-sulbaktam, sefaperazon-sulbaktam, tigesiklin ve kolistin duyarlılıklarının belirlenmesinde Vitek-2 (bio-Merieux, Fransa) sistemi kullanıldı. Çalışmaya, siprofloksasin, imipenem ve TMP-SXT'ye dirençli 65 A.baumannii suşu dahil edildi.
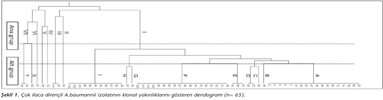
A.baumannii izolatlarının klonal yakınlıkları, "Enterobacterial repetitive intergenic consensus (ERIC)" dizilerine özgü ERIC-2 primeri kullanılarak PCR ile araştırıldı9. Suşlar arasındaki ilişkiyi değerlendirebilmek amacıyla, bant paternlerinden yararlanılarak "Jaccard" katsayıları (SJ) hesaplandı10. Bu katsayılar kullanılarak, MEGA 4.0 yazılımıyla11"Unweighted Pair Group Match Average (UPGMA)" metoduna göre dendogram oluşturuldu. SJ< 0.8 ise, iki suş klonal olarak farklı, 0.8 ≤ SJ< 1.0 ise klonal ilişkili, SJ= 1.0 ise aynı suş olarak kabul edildi. Daha sonra her klondan bir temsilci seçilerek, bu suşlarda aşağıda belirtilen virülans ile ilişkili faktörlerinin varlığı araştırıldı.
Biyofilm Oluşturma
Suşların biyofilm oluşturma kapasiteleri, Stepanovic ve arkadaşlarının12 spektrofotometrik mikroplak yöntemi modifiye edilerek araştırıldı. Buna göre, 180 µl %0.25 glikoz eklenmiş triptik soy buyyon (TSB, Oxoid) besiyeri düz tabanlı mikroplaklar içerisine dağıtıldı; üzerine 20 µl 0.5 McFarland standardına göre ayarlanmış bakteri süspansiyonu eklenip, 18-20 saat 35°C'de inkübe edildi. Süre sonunda mikroplak steril fosfat tamponu ile yıkandı ve ters çevrilerek kurutuldu. Kuyucuklar üzerine, biyofilmin fiksasyonunu sağlamak amacıyla metanol ilave edildi, 20 dk sonra boşaltılıp ters çevrilerek oda sıcaklığında kurutuldu. Son olarak %0.1'lik kristal viyole çözeltisi ile 15 dk bekletilerek, oluşan biyofilmin boyanması sağlandı. Süre sonunda kuyucuklar musluk suyu ile yıkandı ve kurumaya bırakıldı. Spektrofotometrede (VersaMax, Molecular Devices) ölçüm yapılmadan 30 dk önce kuyucuklara %95'lik etanol ilave edildi ve 570 nm'de okunan optik dansite değerlerine göre biyofilm oluşumu negatif, zayıf, orta ve güçlü olarak yorumlandı. Pozitif kontrol olarak Enterococcus faecalis ATCC 29212 suşu kullanıldı.
Siderofor Üretimi
Düşük demir varlığında siderofor üretimi, Schwyn ve Neiland'ın13 kullandığı yöntem esas alınarak, Chrome Azurol-S (CAS) agarda fenotipik olarak araştırıldı. Besiyerinin mavi renginin turuncuya dönüşmesi, siderofor üretiminin göstergesi olarak değerlendirildi. Besiyerinin kalite kontrolü amacıyla doymuş 8-hidroksikinolin çözeltisi kullanıldı.
Serum Direnci
Suşların serum direnci, kobay serumu (Sigma, Almanya) kullanılarak, Benge yöntemi14 ile belirlendi. Kontrol ekimleri ile karşılaştırıldığında üreme oranı %1'in altına düşen izolatlar seruma duyarlı, %90'ın üzerinde üreme gösterenler seruma dirençli, bu iki oran arasında üreme gösterenler ise seruma orta duyarlı olarak değerlendirildi.
Hareket
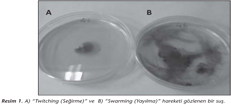
Suşların hareket özellikleri, Eijkelkamp ve arkadaşlarının15 kullandığı yöntemin modifiye edilmesiyle araştırıldı. Bu yöntemde "twitching (seğirme)" ve "swarming (yayılma)" hareketi için kullanılan Mueller-Hinton (Oxoid) ve Luria Bertani (Difco) besiyerlerine %1'lik trifeniltetrazolyum klorid (TTC) çözeltisi eklenerek, bakteri üremesinin olduğu bölgelerin daha kolay görülmesi sağlandı. Zon çapı > 10 mm olan izolatlar için "twitching", zon çapı > 20 mm olan izolatlar için ise "swarming" hareketi pozitif olarak yorumlandı.
Efluks Pompası
Efluks pompası varlığı, seçilen suşlardan siprofloksasin ve/veya doksisikline dirençli bulunanlarda fenotipik olarak araştırıldı16. 25 µg/ml konsantrasyondaki 1-(1-naftilmetil) piperazin (NMP) varlığında, siprofloksasin ve doksisiklin minimum inhibitör konsantrasyon (MİK) değerlerindeki değişim incelendi. MİK değerlerinde en az dört katlık azalma gözlenmesi, efluks pompasının göstergesi olarak yorumlandı.
BULGULAR
Çalışmaya alınan ÇİD A.baumannii suşlarının izole edildiği klinikler ve örnekler ile antibiyotik direnç paternleri Tablo I'de görülmektedir. Suşların çoğunluğunun, göğüs hastalıkları ve anestezi yoğun bakım ünitelerinden gelen trakeal aspirat ve kan örneklerinden izole edildiği saptanmıştır. Siprofloksasin, imipenem, TMP-SXT, sefepim ve ampisilin-sulbaktamın yanı sıra meropenem ve sefaperazon-sulbaktama da -birer izolat dışında- tüm suşların dirençli olduğu gözlenmiştir. İncelenen antibiyotikler arasında en etkilisinin kolistin olduğu, bunu netilmisin ve tigesiklinin izlediği belirlenmiştir. ERIC-PCR ile elde edilen bant paternlerine göre, incelenen suşların yedi ana grup altında toplandığı (Şekil 1), bunlardan en büyüğünün, 56 izolatı içeren ve dokuz alt gruba ayrılan bir klon (I) olduğu saptanmıştır. Diğer klonlar; bir, iki ya da üç üyesi bulunan küçük gruplardır (II-VII). Alt gruplar da dahil olacak şekilde tüm ana gruplardan birer suş alınarak, toplam 16 bakteride virülansla ilişkili özellikler araştırılmıştır.
Klonal grupları temsil eden A.baumannii suşlarında virülans ile ilişkili faktörlerinin dağılımı Tablo II'de görülmektedir. Biyofilm oluşturma kapasitesi incelenen 16 suştan 12'sinin "güçlü", üçünün "orta" ve birinin ise "zayıf" biyofilm üreticisi olduğu belirlenmiştir. En büyük klonu temsil eden 9 suştan 8'inin "güçlü" biyofilm üreticisi olduğu gözlenmiştir. Bakterilerin demir iyonu kazanımında önemli rol oynayan siderofor üretimi, incelenen hiçbir suşta saptanamamıştır. On altı suştan ikisinin, serumun bakterisidal etkisine dirençli, birinin orta duyarlı, 13'ünün ise duyarlı olduğu bulunmuştur. Çalışmamızda "twitching" ve "swarming" olmak üzere iki değişik hareket formu, sırasıyla, petri kabıyla agarın temas ettiği yüzeyde ve agar yüzeyinde araştırılmış, sadece bir suşta "twitching", 7 suşta ise "swarming" gözlenmiştir. "Twitching" görülen suşta aynı zamanda "swarming" de saptanmıştır (Resim 1). Efluks pompası varlığı araştırılan 16 suştan hiçbirinde, NMP varlığında siprofloksasin MİK değerlerinde anlamlı bir azalma saptanmamıştır. Doksisikline dirençli 5 suştan 2'sinin MİK değerlerinde ise, efluks pompası varlığına işaret eden anlamlı düşüşler gözlenmiştir.
TARTIŞMA
A.baumannii tüm dünyada, özellikle yoğun bakım ünitelerinde gelişen nozokomiyal enfeksiyonların en önemli etkenlerinden biridir ve günümüzde, kullanımdaki tüm ajanlara dirençli suşların varlığı bilinmektedir. Çok ilaca dirençli (ÇİD) A.baumannii izolatlarının konak içinde ve dışında hayatta kalmasında ve enfeksiyon oluşturmasında biyofilm oluşturma, serum direnci, hareket, demir kazanımı ve efluks pompası gibi faktörler rol oynamaktadır.
Çalışmamız kapsamında incelenen 65 ÇİD A.baumannii izolatının klonal yakınlıkları ERIC-PCR yöntemiyle araştırılmıştır. Bu yöntem ile elde edilen bant paternleri analiz edildiğinde, dokuz alt gruba ayrılan 56 üyeli bir klonun (I), çalışmamızda incelenen ÇİD A.baumannii suşlarının %86'sını kapsadığı belirlenmiştir. Bu veri, hastanemiz kliniklerinde saptanan dirençli A.baumannii suşlarının büyük bölümünün aynı klondan türediğine işaret etmektedir. Türkiye'de iki büyük merkezden izole edilen karbapeneme dirençli A.baumannii suşlarında OXA-tipi karbapenemaz varlığı ile klonal ilişkinin araştırıldığı bir çalışmada, direncin her iki merkezde de büyük ölçüde klonal yayılım gösteren suşlara bağlı olduğu bildirilmiştir17. Aynı çalışmada, incelenen suşlarda en etkili antibiyotikler olarak polimiksin-B ve tigesiklinin saptanması da bizim bulgularımızla uyumludur. Yapılan uluslararası bir değerlendirmede, belli bazı klonların ÇİD A.baumannii izolatlarının dünya genelinde yaygınlaşmasında rol oynadığı rapor edilmiştir4. Yedi yıllık bir süreçte, ÇİD A.baumannii izolatlarında "repetitive extragenic palindromic sequence-based PCR (rep-PCR)" yöntemiyle moleküler yakınlıkların ve karbapenemaz aktivitesindeki oksasilinazların araştırıldığı bir çalışmada, incelenen 100 suştan 62'sinin, 13 ana paternden birine dahil olduğu belirtilmiştir18. En çok üyesi olan klonlarda 9-10 suşun bulunduğu bu çalışmada, ÇİD A.baumannii sorununun uzun süreden beri varlığını sürdüren birkaç farklı klondan kaynaklandığı sonucuna varılmıştır18.
A.baumannii birçok biyotik ve abiyotik yüzeyde biyofilm oluşturabilmektedir. Hastane ortamındaki çeşitli yüzeylerde kolonize olmasını, antibiyotik direncini ve konak immün sisteminden kaçmasını kolaylaştıran biyofilm yapısı, önemli bir virülans faktörüdür19. ÇİD A.baumannii izolatlarının biyofilm oluşturma kapasitesinin yüksek olduğunu gösteren veriler vardır8,20. Bizim çalışmamızda biyofilm oluşumu incelenen 16 suştan 12'sinin güçlü, üçünün orta derecede biyofilm üreticisi olması, ÇİD A.baumannii ile biyofilm oluşturma arasındaki ilişkiyi desteklemektedir. Klinik A.baumannii izolatlarında çeşitli virülans faktörlerinin incelendiği bir çalışmada21, 86 suştan 64'ünde biyofilm oluşumu gözlenmiş, bunlardan 10 tanesinin güçlü, 27 tanesinin orta ve yine 27 tanesinin zayıf biyofilm ürettiği saptanmıştır. Bizim çalışmamızda ise incelenen tüm temsilci suşlarda biyofilm oluşumu görülmüştür.
Bakterilerin demir iyonu kazanımında; (a) siderofor adı verilen endojen demir-III şelatörlerinin üretimi, (b) "hem" gibi dış kaynaklı şelatörleri almaları veya (c) demir-II iyonlarını doğrudan almaları şeklinde üç temel yol izledikleri belirtilmektedir22. Antunes ve arkadaşları22, demir kazanımında rol oynayan 16 genin varlığını, genotipik olarak farklı 50 klinik A.baumannii suşunda araştırmış ve tüm suşlarda iki farklı sisteme (asinetobaktin ve hidroksamat tipi) ait genlerin bulunduğunu bildirmişlerdir. Bu suşlardaki demir şelatörlerinin miktarı ve aktivitesine bakıldığında, arada büyük farklar olduğu da rapor edilmiştir22. Çalışmamızda incelenen hiçbir suşta siderofor saptanamamış olmasının, kullanılan yöntemin analitik duyarlılığının düşük olmasından, veya pH, sıcaklık gibi fizikokimyasal koşullardan kaynaklandığı düşünülmüştür. Ayrıca, sideroforların in vivo olarak, enfeksiyon sürecinde eksprese edildiği yönünde bulgular da vardır19.
İncelenen temsilci suşlardan çoğunun serumun bakterisidal etkisine duyarlı olduğu, iki alt grup temsilcisinin ise dirençli olduğu gözlenmiştir. Suşların temsil ettikleri grupların sayıları dikkate alındığında, çalışmamızdaki seruma dirençli bakterilerin oranı %30.7'dir. Cevahir ve arkadaşları23, klinik örneklerden izole edilmiş 48 A.baumannii suşunda insan serumunun etkisini inceledikleri çalışmada, seruma dirençli bakterilerin oranını %81.2 olarak saptamışlardır. Çeşitli su kaynaklarından izole edilen Acinetobacter türlerinde virülans faktörlerinin incelendiği bir çalışmada da, seruma dirençli suşların oranları, kaynağa göre, %64 ile %30 arasında değişmektedir24. Seruma direnç oranlarındaki bu çeşitliliğin, suşların izole edildiği kaynaklardan ve yöntemlerdeki farklılıklardan ileri geldiği düşünülmektedir.
Geleneksel olarak hareketsiz olarak bilinen Acinetobacter cinsinden bazı izolatların hareket edebildikleri ve bunun fimbria varlığıyla ilişkili olduğu rapor edilmiştir15. Antunes ve arkadaşları7, tüm genom dizisi belirlenmiş dört A.baumannii suşunun hareket özelliklerini üç farklı besiyerinde araştırmışlar, bunlardan sadece birinde hem "twitching" hem de "swarming" gözlemlerken, birinde de yalnızca "swarming" hareketi belirlemişlerdir. Avustralya'da gerçekleştirilen bir çalışmada15, 50 klinik A.baumannii izolatı hareket açısından değerlendirilmiş, 16 tanesinde "twitching", ikisinde ise "swarming" hareketi saptanmıştır. "Swarming" gözlenen iki suşta aynı zamanda "twitching" de görülmüş ve bu iki hareket şeklinin birbiri ile bağlantılı olmayıp, ayrı fenotipik özellikler olduğu belirtilmiştir15. Aynı çalışmada güçlü biyofilm üreten suşlarda, "twitching" hareketine daha sık rastlandığı da vurgulanmıştır15. Bizim çalışmamızda ise, incelenen 16 izolatın yedisinde "swarming" hareketi belirlenmiş, bunlardan birinin orta, diğerlerinin ise güçlü biyofilm üreten suşlar olduğu gözlenmiştir.
Efluks pompaları A.baumannii'nin birçok antibiyotiğe direnç geliştirmesinde önemli rol oynamaktadır. Pannek ve arkadaşlarının25 yaptığı bir çalışmada, A.baumannii izolatlarında, efluks pompası inhibitörleri olan Phe-arg-eta-naphthylamide (PABN) ve NMP'nin etkileri karşılaştırılmıştır. Bu çalışmada PABN'nin sadece klaritromisin, rifampisin ve linezolid MİK değerlerinde azalmaya yol açtığı, buna karşın NMP'nin özellikle kloramfenikol, tetrasiklin ve florokinolon grubu antibiyotiklerin etkinliğini artırdığı saptanmıştır25. Bu bulgular ışığında, efluks pompası varlığının fenotipik olarak araştırılmasında NMP tercih edilmiştir. Bir diğer çalışmada, NMP'nin 100 µg/ml konsantrasyonda, antibiyotik içermeyen kontrol kuyucuklarında A.baumannii izolatlarının üremesini inhibe ettiği belirtilmiştir26. Bu nedenle 25 µg/ml konsantrasyonda NMP kullanılan çalışmamızda, siprofloksasin ile efluks pompasına dair bir ipucu saptanmazken, doksisikline dirençli beş suştan ikisinde efluks pompası varlığı fenotipik olarak gösterilmiştir. Çoban ve arkadaşları26, siprofloksasine orta duyarlı A.baumannii suşlarında NMP'nin zon çaplarını duyarlılık sınırına çektiğini, dirençli suşlardan ise sadece ikisinde bunu başarabildiğini bildirmişlerdir. Bu çalışma, NMP'nin siprofloksasine dirençli izolatlar üzerindeki etkisinin sınırlı olduğunu ortaya koymaktadır26. Sun ve arkadaşları27, tigesikline dirençli klinik A.baumannii suşlarında NMP'nin tigesiklin MİK değerlerini 2-8 kat düşürdüğünü ve dirençte AdeABC efluks pompasının aşırı ekspresyonunun rol oynadığını saptamışlardır. AdeABC efluks pompası, A.baumannii izolatlarında ilk bulunan "resistance-nodulation-cell division (RND)" sistemi olup, beta-laktamlar, aminoglikozidler, florokinolonlar, tetrasiklinler, makrolidler, kloramfenikol ve tigesiklini hücre dışına atabilmektedir. Ayrıca, Acinetobacter türlerinde tetrasiklin direncinden sorumlu tet (A-E) efluks pompalarının olduğu da bilinmektedir28.
Çalışmamızda ÇİD A.baumannii izolatlarında biyofilm oluşumu, siderofor sentezi, serum direnci, hareket ve efluks pompası gibi bakterinin virülansında rol oynayan özellikler araştırılmıştır. Klonal grup temsilcilerinin tümünde biyofilm oluşumu gözlenirken, hiçbirinde siderofor üretimi saptanamamıştır. Serum direncine sadece en baskın klon (I) temsilcilerinde rastlanırken, hareket ve efluks pompası varlığı ise belirli bir klona özgü değildir. İncelenen suşlarda, biyofilm oluşturmanın en yaygın gözlenen özellik olduğu, bunun yanı sıra serum direnci, "swarming" hareketi ve spektrumunda tetrasiklinlerin de bulunduğu bir efluks pompasının patojeniteyle ilişkili özellikler arasında yer aldığı belirlenmiştir. Hastanemizde olduğu gibi tüm dünyada nozokomiyal enfeksiyonların en önemli etkenlerinden olan ÇİD A.baumannii izolatlarının virülansında rol oynayan özelliklerinin bilinmesi, gerekli enfeksiyon kontrol önlemlerinin alınması ve yeni tedavi seçeneklerinin araştırılmasında yol gösterici olacaktır.
KAYNAKLAR
- McConnell MJ, Actis L, Pachon J. Acinetobacter baumannii: human infections, factors contributing to pathogenesis and animal models. FEMS Microbiol Rev 2013; 37(2): 130-55.
- Howard A, O'Donoghue M, Feeney A, Sleator RD. Acinetobacter baumannii: an emerging opportunistic pathogen. Virulence 2012; 3(3): 243-50.
- Taşbakan MS, Pullukçu H, Korkmaz Ekren P, et al. Colistin use in ventilator-associated pneumonia due to panresistant Pseudomonas aeruginosa and Acinetobacter baumannii. Mikrobiyol Bul 2009; 43(1): 61-70.
- Karah N, Sundsfjord A, Towner K, Samuelsen Ø. Insights into the global molecular epidemiology of carbapenem non-susceptible clones of Acinetobacter baumannii. Drug Resist Updat 2012; 15(4): 237-47.
- Cai Y, Chai D, Wang R, Liang B, Bai N. Colistin resistance of Acinetobacter baumannii: clinical reports, mechanisms and antimicrobial strategies. J Antimicrob Chemother 2012; 67(7): 1607-15.
- Kempf M, Rolain JM. Emergence of resistance to carbapenems in Acinetobacter baumannii in Europe: clinical impact and therapeutic options. Int J Antimicrob Agents 2012; 39 (2): 105-14.
- Antunes LC, Imperi F, Carattoli A, Visca P. Deciphering the multifactorial nature of Acinetobacter baumannii pathogenicity. PLoS One 2011; 6(8): e22674.
- Aşık G. Current approaches to explain the virulence of Acinetobacter baumannii. Mikrobiyol Bul 2011; 45(2): 371-80.
- Luzzaro F, Mantengoli E, Perili M, et al. Dynamics of a nosocomial outbreak of multidrug-resistant Pseudomonas aeruginosa producing the PER-1 extended-spectrum -lactamase. J Clin Microbiol 2001; 39(5): 1865-70.
- Soll DR. The ins and outs of DNA fingerprinting the infectious fungi. Clin Microbiol Rev 2000; 13(2): 332-70.
- Tamura K, Dudley J, Nei M, Kumar S. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0. Mol Biol Evol 2007; 24(8): 1596-9.
- Stepanovic S, Vukovic D, Dakic I, Savic B, Svabic-Vlahovic M. A modified microtiter-plate test for quantification of staphylococcal biofilm formation. J Microbiol Methods 2000; 40(2): 175-9.
- Louden BC, Haarmann D, Lynne AM. Use of blue agar CAS assay for siderophore detection. J Microbiol Biol Educ 2011; 12(1): 51-3.
- Benge GR. Bactericidal activity of human serum against strains of Klebsiella from different sources. J Med Microbiol 1988; 27(1): 11-5.
- Eijkelkamp BA, Stroeher UH, Hassan KA, Papadimitrious MS, Paulsen IT, Brown MH. Adherence and motility characteristics of clinical Acinetobacter baumannii isolates. FEMS Microbiol Lett 2011; 323(1): 44-51.
- Yedekçi S, Eraç B, Hoşgör-Limoncu M. Detection of the efflux pump-mediated quinolone resistance in ESBL positive Escherichia coli and Klebsiella pneumoniae isolates by phe-arg-eta-naphthylamide. Turk J Pharm Sci 2012; 9(1): 67-74.
- Gur D, Korten V, Unal S, Deshpande LM, Castanheira M. Increasing carbapenem resistance due to the clonal dissemination of oxacillinase (OXA-23 and OXA-58)- producing Acinetobacter baumannii: report from the Turkish SENTRY program sites. J Med Microbiol 2008; 57(12): 1529-32.
- Ergin A, Hascelik G, Eser OK. Molecular characterization of oxacillinases and genotyping of invasive Acinetobacter baumannii isolates using repetitive extragenic palindromic sequence-based polymerase chain reaction in Ankara between 2004 and 2010. Scand J Infect Dis 2013; 45(1): 26-31.
- Gordon NC, Wareham DW. Multidrug-resistant Acinetobacter baumannii: mechanisms of virulence and resistance. Int J Antimicrob Agents 2010; 35(3): 219-26.
- Lee HW, Koh YM, Kim J, et al. Capacity of multidrug-resistant clinical isolates of Acinetobacter baumannii to form biofilm and adhere to epithelial cell surfaces. Clin Microbiol Infect 2008; 14(1): 49-54.
- Cevahir N, Demir M, Kaleli İ, Gürbüz M, Tikveşli S. Evaluation of biofilm production, gelatinase activity and mannose-resistant hemagglutination in Acinetobacter baumannii strains. J Microbiol Immunol Infect 2008; 41(6):513-8.
- Antunes LC, Imperi F, Towner KJ, Visca P. Genome-assisted identification of putative iron-utilization genes in Acinetobacter baumannii and their distribution among a genotypically diverse collection of clinical isolates. Res Microbiol 2011; 162(3): 279-84.
- Cevahir N, Kaleli İ, Demir M, Yıldırım U, Çevik E, Gürbüz M. Investigation of serum resistance for Pseudomonas aeruginosa and Acinetobacter baumannii strains. Mikrobiyol Bul 2006; 40(3): 251-5.
- Doughari HJ, Ndakidemi PA, Human IS, Benade S. Virulence, resistance genes, and transformation amongst environmental isolates of Escherichia coli and Acinetobacter spp. J Microbiol Biotechnol 2012; 22(1): 25-33.
- Pannek S, Higgins PG, Steinke P, et al. Multidrug efflux inhibition in Acinetobacter baumannii: comparison between 1-(1-naphthylmethyl)-piperazine and phenyl-arginine-beta-naphthylamide. J Antimicrob Chemother 2006; 57(5): 970-4.
- Coban AY, Guney AK, Tanriverdi Cayci Y, Durupinar B. Effect of 1-(1-Naphtylmethyl)-piperazine, an efflux pump inhibitor, on antimicrobial drug susceptibilities of clinical Acinetobacter baumannii isolates. Curr Microbiol 2011; 62(2): 508-11.
- Sun JR, Perng CL, Chan MC, et al. A truncated AdeS kinase protein generated by ISAba1 insertion correlates with tigecycline resistance in Acinetobacter baumannii. PLoS One 2012; 7(11): e49534.
- Akin FE, Bayram A, Balci I. Comparison of disc diffusion, E-test, and broth microdilution methods for the determination of resistance to colistin, polymyxin B, and tigecycline in multi-resistant Acinetobacter baumannii isolates. Mikrobiyol Bul 2010; 44(2): 203-10.
İletişim (Correspondence):
Yrd. Doç. Dr. Bayrı Eraç,
Ege Üniversitesi Eczacılık Fakültesi,
Farmasötik Mikrobiyoloji Anabilim Dalı,
35100 Bornova, İzmir, Türkiye.
Tel (Phone): +90 232 311 4083,
E-posta (E-mail): eracb@yahoo.com