Sağlık Çalışanlarında İnaktif SARS-CoV-2 Aşılaması Sonrası Yan Etkiler, Serokonversiyon Oranları ve Antikor Yanıtını Etkileyen Faktörler
Factors Affecting Side Effects, Seroconversion Rates and Antibody Response After Inactivated SARS-CoV-2 Vaccination in Healthcare Workers
Şebnem ŞENOL AKAR1 , Sinem AKÇALI2 , Yunus ÖZKAYA3 , Fatma Merve GEZGİNCİ3 , Beyhan CENGİZ ÖZYURT3 , Gülizar DENİZ3 , Ferya KARADAĞ YALÇIN4 , Deniz ÖZER1 , Pınar DÜNDAR ERBAY3 , Erhan ESER3
1Manisa Celal Bayar Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Kinik Mikrobiyoloji Anabilim Dalı, Manisa.
1Manisa Celal Bayar University Faculty of Medicine, Department of Infectious Diseases and Clinical Microbiology, Manisa, Turkey.
2Manisa Celal Bayar Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Manisa.
2Manisa Celal Bayar University Faculty of Medicine, Department of Medical Microbiology, Manisa, Turkey.
3Manisa Celal Bayar Üniversitesi Tıp Fakültesi, Halk Sağlığı Anabilim Dalı, Manisa.
3Manisa Celal Bayar University Faculty of Medicine, Department of Public Health, Manisa, Turkey.
4Manisa Celal Bayar Üniversitesi Tıp Fakültesi, Hafsa Sultan Eğitim ve Araştırma Hastanesi, Sağlık Hizmetleri Müdürlüğü, Manisa.
4Manisa Celal Bayar University Faculty of Medicine, Hafsa Sultan Teaching and Research Hospital, Health Services Department, Manisa, Turkey.
*Bu çalışma, Manisa Celal Bayar Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü (Proje No: 2021-008) tarafından desteklenmiştir. Bu çalışma, 9. Türkiye EKMUD Uluslararası Bilimsel Platformu (20-23 Mayıs 2021)’nda sözlü bildiri olarak sunulmuştur.
Makale Atıfı:Şenol Akar Ş, Akçalı S, Özkaya Y, Gezginci FM, Cengiz Özyurt B, Deniz G ve ark. Sağlık çalışanlarında inaktif SARS-CoV-2 aşılaması sonrası yan etkiler, serokonversiyon oranları ve antikor yanıtını etkileyen faktörler. Mikrobiyol Bul 2021;55(4):519-538.
ÖZ
Bu çalışmada, sağlık çalışanlarında inaktif şiddetli akut solunum sendromu koronavirüs-2 (SARS-CoV-2), CoronaVac® (Sinovac, Çin) aşısının etkinliği, yan etkileri ve serokonversiyon verilerini prospektif olarak değerlendirmek amaçlanmıştır. Çalışmaya inaktif SARS-CoV-2 ile aşılanan, çalışma başlangıcında taranarak seronegatif olduğu saptanan (COV2T® SARS-CoV-2 total, Siemens, ABD) 1053 sağlık çalışanı dahil edilmiştir. İlk aşıdan (n= 939) ve ikinci aşıdan (n= 771) 28 gün sonra oluşan IgG türü antikorlar kantitatif olarak (ADVIA Centaur® SARS-CoV-2 IgG, Siemens, ABD) araştırılmıştır. Ek olarak ikinci aşıdan 28 gün sonra alınan kan örneklerinde nötralizan antikorlar ELISA tabanlı bir testle (ACE2-RBD Neutralization Assay, Dia-Pro, İtalya) araştırılmıştır. Aşının antikor yanıtı istatistiksel olarak tek değişkenli (ki-kare, Fisher’s exact testi, Student’s t testi, Mann-Whitney U, tek yönlü ANOVA ve Kruskall Wallis ANOVA testleri) analizlerle ve doğrusal regresyon modelleri ile araştırılmıştır. Araştırmada ayrıca ikinci aşıdan 28 gün sonra alınan kan örneklerinde çalışılan kantitatif IgG testi ile nötralizan antikor test sonuçları arasındaki tutarlılık da değerlendirilmiştir. Analizler, SPSS 23.0 ve Stata ile yapılan istatistik çözümlemelerle logaritmik olarak dönüştürülmüş veriler üzerinde yapılmış, tip 1 hata düzeyi 0.05 olarak kabul edilmiştir. Katılımcıların %31.3’ü birinci aşı sonrasında, %26.8’i ise ikinci aşı sonrasında en az bir yan etki bildirmiştir. En sık görülen yan etki %20.4-21.7 ile aşı bölgesinde ağrıdır. Yan etkiler nedeniyle bir sağlık kurumuna başvurma sıklığı birinci aşıdan sonra %1.0, ikinci aşıdan sonra %0.8 olmuştur. Birinci aşıdan 28 gün sonra yeterli kantitatif IgG oluşturanların yüzdesi %25.3 (%95 GA= 22.5-28.1), ikinci aşıdan 28 gün sonra %97.9 (%95 GA= 96.91-98.93) olarak bulunmuştur. İkinci aşıdan 28 gün sonra nötralizan antikor pozitifliği %97.7 olarak saptanmıştır. Tek değişkenli analizlerde, inaktif SARS-CoV-2 aşısına karşı kantitatif IgG yanıtını anlamlı olarak artıran özellikler genç yaş (p< 0.01), kadın cinsiyet (p< 0.01), sigara içmemek (p< 0.001), kronik hastalığı olmamak (p= 0.019), bu yıl grip aşısı yaptırmış olmak (p= 0.012), aşırı kilolu veya obez olmamak (p= 0.020) ve aşılama öncesinde SARS-CoV-2 enfeksiyonu geçirmek (p< 0.001) olarak saptanmıştır. Ayrıca yardımcı sağlık personeli olanların diğer çalışanlara göre anlamlı düzeyde daha düşük antikor yanıtı gösterdiği belirlenmiştir (p< 0.001). Çoklu doğrusal regresyon modellerinde ise cinsiyet, yaş ve sigara içmeye ek olarak önceki SARS-CoV-2 polimeraz zincir reaksiyonu pozitifliğinin aşı sonrası kantitatif IgG yanıtını anlamlı düzeyde etkilediği gözlenmiştir. İkinci aşı sonrası 28. günde yapılan testlerde “enzyme linked immunosorbent assay (ELISA)” tabanlı nötralizan antikor testi ile kantitatif IgG testleri %99 uyumlu bulunmuştur (Kappa p= 0.783). CoronaVac® 18-64 yaş sağlık çalışanlarında tek bir aşıdan 28 gün sonra %25 ve ikinci aşıdan 28 gün sonra %97 oranında yeterli antikor yanıtı sağlamıştır. Antikor yanıtı genç yaşlarda, kadınlarda, sigara içmeyenlerde ve daha önce SARS-CoV-2 ile karşılaşmış olanlarda anlamlı düzeyde daha yüksek bulunmuştur. Gerçek yaşamda aşının bireyleri hastalıktan ne kadar koruduğu konusunda faz 3 ve faz 4 sonuçlarına gereksinim vardır.
Anahtar kelimeler: COVID-19 aşısı; inaktif aşı; COVID-19 antikor testi; COVID-19 aşısı yan etkiler
ABSTRACT
In this study, it was aimed to prospectively evaluate the efficacy, side effects and seroconversion data of inactive severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2), CoronaVac® (Sinovac, China) vaccine in healthcare workers. A total of 1053 healthcare workers who were initially seronegative (COV2T® SARS-CoV-2 Total Siemens, USA) and vaccinated with inactivated SARS-CoV-2 were included in the study. Quantitative IgG antibodies (ADVIA Centaur® SARS-CoV-2 IgG, Siemens, USA) were investigated 28 days after the first vaccine (n= 939) and the second vaccine (n= 771). In addition, neutralizing antibodies were evaluated via “enzyme linked immunosorbent assay (ELISA)” test (ACE2-RBD Neutralization Assay, Dia-Pro, Italy) 28 days after the first vaccine. Antibody response of the vaccine was evaluated statistically by univariate (Chi-square, Fisher’s exact test, Student’s t test, Mann-Whitney U, one-way ANOVA and Kruskall Wallis ANOVA tests) analysis and linear regression models. The consistency between quantitative IgG test and neutralizing antibody test was also evaluated in blood samples taken 28 days after second vaccination. Statistical analysis was determined in logarithmically transformed data with statistical analysis with SPSS 23.0 and Stata, and type 1 error level was accepted as 0.05. At least one side effect was reported by 31.3% and 26.8% of the participants after the first and second vaccine, respectively. The most frequent side effect was pain at the injection site with a frequency of 20.4% vs 21.7%. The frequency of applying to a health center due to side effects was 1.0% after the first vaccine and 0.8% after the second vaccine. The percentage of those who produced sufficient quantitative IgG was found as 25.3% (95% CI= 22.5-28.1) 28 days after the first vaccine and 97.9% (95% CI= 96.91-98.93) after the second vaccine. Neutralizing test antibody positivity was found as 97.7% 28 days after the second vaccine. In univariate analysis, the characteristics that significantly increased the quantitative IgG response against inactivated SARS-CoV-2 vaccine were young age (p< 0.01), female gender (p< 0.01), being a non-smoker (p< 0.001), not having a chronic disease (p= 0.019), having had the flu vaccine this year (p= 0.012), not being overweight or obese (p= 0.020), and having a SARS-CoV2 infection prior to vaccination (p< 0.001). In addition, allied health personnel showed significantly lower antibody responses than the other workers (p< 0.001). Multiple linear regression models revealed that, female gender, younger age, smoking and previous COVID-19 polymerase chain reaction test positivity significantly affected the quantitative IgG response after vaccination. A 99% agreement was found between the ELISA-based neutralizing antibody test and the quantitative IgG test (Kappa p= 0.783) performed on the 28th day after the second vaccination. CoronaVac® provides adequate antibody response in 25% of healthcare workers aged 18-64, after 28 days from a single vaccine, and 97% after 28 days from the second vaccine. Antibody response was significantly higher in younger ages, women, non-smokers, and those who had previously encountered SARS-CoV-2. Phase 3 and phase 4 results are needed to show effectiveness of this vaccine in real life.
Keywords: COVID-19 vaccine; inactivated vaccine; COVID-19 antibody testing; COVID-19 vaccine side effects.
Geliş Tarihi (Received): 08.05.2021 - Kabul Ediliş Tarihi (Accepted):04.08.2021
GİRİŞ
Şiddetli akut solunum virüsü koronavirüs-2 (SARS-CoV-2) aşıları, pandemiyi sonlandırmada en umut verici yaklaşım olarak kabul edilmektedir[1]. Matematik modeller, dünyadaki tüm düşük-orta gelirli ülkeler (DOGÜ)’de aşının ulaşılabilir olmasını en erken 2023 yılının Eylül ayı olacağını, bu ülkelerin soğuk zincir ve uygulama teknolojisi kolaylığı açısından inaktif aşılara şiddetle gereksinim duyduğunu göstermektedir. Bu nedenle SARS-CoV-2 inaktif aşılarının bağışıklık yanıtının ortaya konması özellikle DOGÜ için hayati öneme sahiptir[2].
Bu süreçte ülkemiz 14 Ocak 2021 tarihinde öncelikli olarak sağlık çalışanları (SÇ)’nda inaktif SARS-CoV-2 aşılamasını başlatmış, süreç içinde risk grupları genişletilerek toplum aşılamasına geçilmiştir[3]. SÇ’nin aşılama ile hızla ve güvenle korunması salgının kontrolünde en önemli unsurlardandır[4].
Ülkemizde sağlık çalışanlarının büyük çoğunluğunun aşılandığı inaktif SARS-CoV-2 aşısı olan CoronaVac® (Sinovac, Çin), faz 1 ve 2 çalışmalarında iyi tolere edildiğini ve antikor yanıtını iyi indüklediğini kanıtlamıştır[5]. Yan etkileri nadir, çoğu hafif ve geçicidir. En sık yan etki enjeksiyon bölgesinde ağrıdır ve tüm yaş gruplarında yan etki oranları benzer bulunmuştur[5],[6],[7],[8].
CoronaVac®’ın 12 000’den fazla kişiyi içeren, sonuçları henüz yayımlanmayan faz 3 çalışmasında %50.3 etkin olduğu bildirilmiştir[7]. Bu aşıyla aşılanan SÇ ile salgının şiddetli olduğu bir dönemde aynı şehir halkı karşılaştırılarak tasarlanan çalışmada[9] aşıdan 4-5 hafta sonra etkililiğin %68.4 (%95 GA= %51.0-80.8) ve %73.8 (%95 GA= %57.0-84.8) olduğu belirtilmektedir. CoronaVac®’ın kamuoyu ile paylaşılan faz 3 Türkiye sonuçlarında aşı etkililiğinin %83.5 olduğu bildirilmiştir[10],[11].
Aşı yanıtının değerlendirildiği bir parametre olan aşı sonrası serokonversiyon oranı koruyuculuğu tam olarak göstermese de önemli bir immün yanıt göstergesi olarak kabul edilmektedir[12]. Virüsün inhibisyonunu sağlama fonksiyonu olan antikorlar “nötralizan antikor” olarak adlandırılmaktadır. SARS-CoV-2 virüsüne karşı oluşan nötralizan antikorlar ağırlıklı olarak “spike (S)” proteininde yer alan reseptör bağlayıcı bölge (RBD)’ye karşı oluşmaktadır[13]. Bu antikorların fonksiyonlarını veya etkilerini değerlendirmede kullanılan altın standart yöntem, “Plak redüksiyon nötralizasyon testi (PRNT)” olarak bilinmektedir. Yoğun iş gücü ve maliyet gerektiren bu test, özel donanımlı araştırma laboratuvarlarında (biyogüvenlik düzey 3) çalışılabilmektedir. SARS-CoV-2’nin çeşitli antijenlerine karşı gelişen antikorların varlığını ve kantitatif değerini tespit etmek için immünoenzim tabanlı testler “enzyme-linked immunosorbent assay (ELISA)” geliştirilmiştir. İnaktif SARS-CoV-2 CoronaVac® aşısının nötralizan antikor seropozitivite oranları faz 1 ve 2 çalışmalarında 18-59 yaşlarda %97-100 iken 60 yaş üzeri gönüllülerde nötralizan antikor oluşumu %98-99 olarak saptanmıştır5,6. Çalışmalarda SARS-CoV-2, RBD-spesifik IgG pozitiflik oranı ile plak nötralizasyon testlerinin korele sonuçlar verdiği gözlenmiştir[6],[13].
Herhangi bir canlı virüs ya da hücre kullanmadan, biyogüvenlik düzey 2 laboratuvarında uygulanabilen ve hızlı sonuç veren “Surrogate virus neutralization test (sVNT)” olarak isimlendirilen ELISA temelli nötralizan antikor testleri geliştirilmiştir. Aşı veya hastalık sonrası oluşan antikorların nötralize edici etkisinin, anjiyotensin dönüştürücü enzim 2 (ACE2) ve RBD arasındaki bağlanmanın inhibisyonu ile araştırıldığı bu testlerin altın standart olarak bilinen in vivo nötralizasyon yöntemine göre özgüllüğünün %95, duyarlılığının %90’ın üzerinde bulunduğu bildirilmiştir[14],[15].
Bu çalışmada, CoronaVac® (Sinovac, Çin) inaktif SARS-CoV-2 aşısının etkinliği, yan etkileri ve serokonversiyonunu ortaya koymayı amaçlayan prospektif SÇ kohort araştırmasının, aşı sonrası erken dönem sonuçları sunulmuştur. Çalışmada ayrıca aşı sonrası gelişen anti-SARS-CoV-2 RBD spesifik IgG antikor testlerinin sVNT ile karşılaştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Bu çalışma, T.C. Sağlık Bakanlığı (Tarih: 08.01.2021 ve Sayı: 2021-01-05T23_01_51) ve Manisa Celal Bayar Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu (Tarih: 18.01.2021 ve Karar No: 133) onayı ile gerçekleştirildi.
Araştırma Düzeni ve Veri Toplama
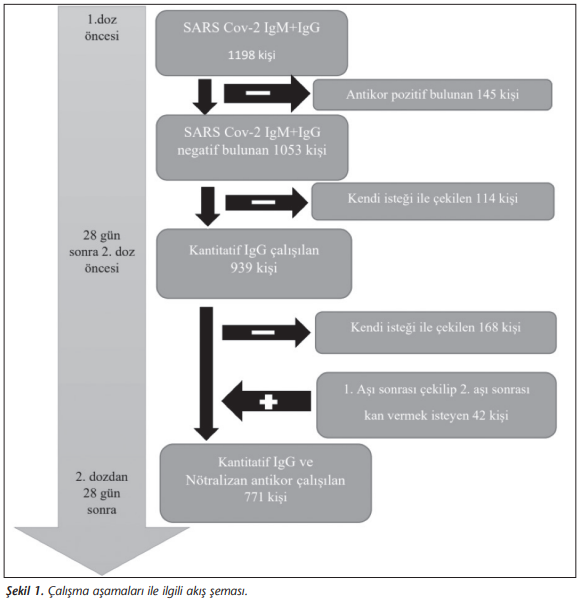
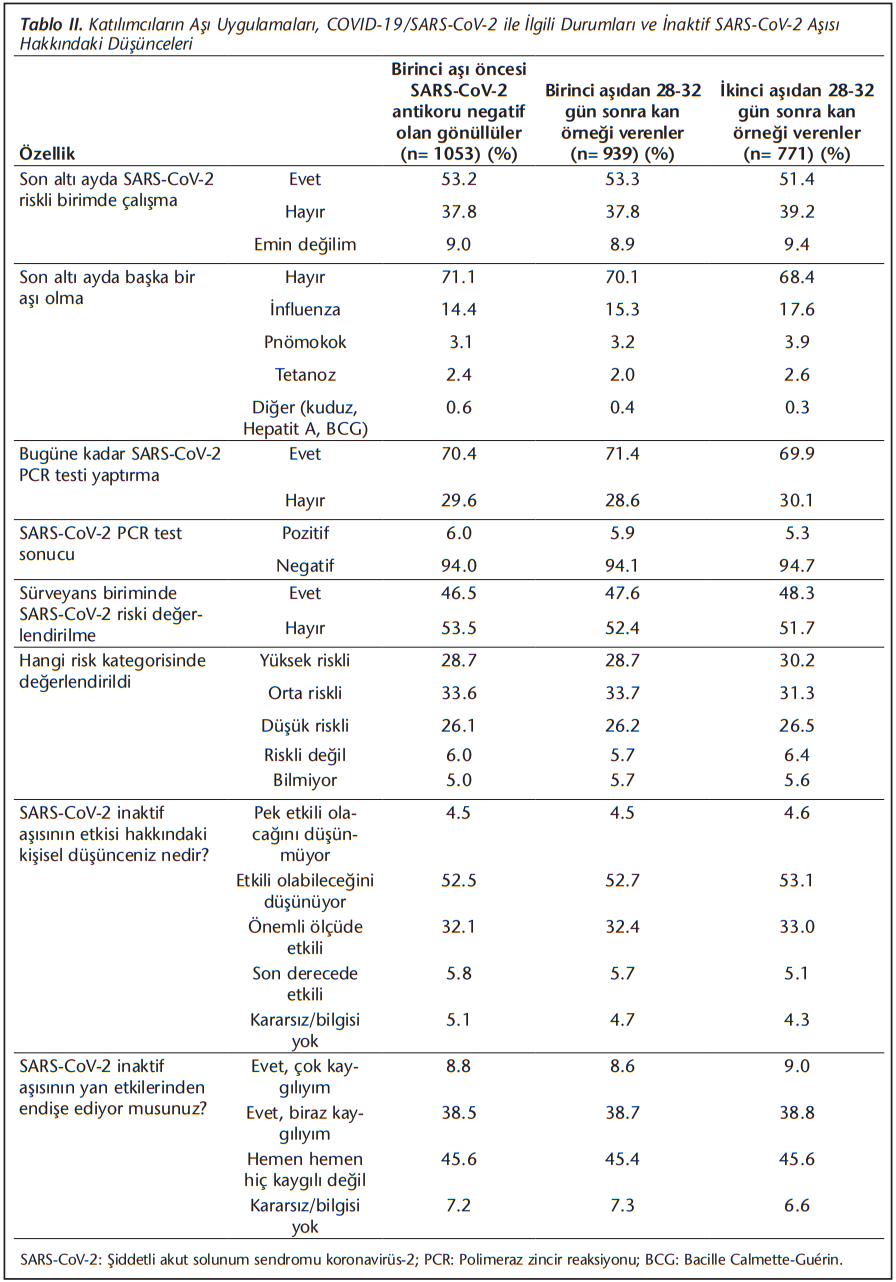
Aşı öncesi SARS-CoV-2 açısından seronegatif olan bir üniversite hastanesinde çalışan gönüllü SÇ’de, ikinci aşıdan hemen önce alınan örneklerde ilk aşının kantitatif IgG antikor yanıtı ve ikinci aşıdan en az 28 gün sonra alınan örneklerde kantitatif IgG ve ELISA tabanlı bir test ile nötralizan antikor yanıtı araştırıldı. Araştırma veri ve örnek toplama akış şeması (Şekil 1)’de verilmiştir. Çalışmanın verileri 18 Ocak-18 Mart 2021 tarihleri arasında toplandı. Çalışma başlangıcında hasta onam formu ile birlikte bir anket formu doldurmaları istendi; iletişim adresleri, demografik bilgiler ve sağlık durumu, sosyal alışkanlıkları ile 11 Mart 2020’den bu yana koronavirüs 2019 (COVID-19) hastalığı ve risk durumu ile ilgili sorular soruldu. COVID-19 tanısı aldığını veya temaslı olduğunu belirten katılımcıların durumları, çalışan sağlığı birimindeki kayıtlar ile konfirme edildi. Katılımcılardan istedikleri iletişim kanalı ile birinci ve ikinci aşılamayı takip eden 7-14. günler arasında internet üzerinden veya basılı olarak bir anket formu doldurarak yan etki ile ilgili değerlendirmeler yapmaları istendi.
Serum Örnekleri
Çalışmaya dahil edilen kişilerden yaklaşık 10 ml venöz kan alındı. Kanlar alındıktan sonra iki saat içinde, beş dakika süreyle 5000 devir/dakika santrifüj işlemin tabi tutularak serumlar ayrıştırıldı. Serumlar aynı gün anti SARS-CoV-2 antikor testine alındı; aynı gün çalışılması mümkün olmayanlar 72 saat içinde test edilmek üzere buzdolabında +4°C’ye kaldırıldı. Artan serum örnekleri 1.5 ml’lik alikotlar halinde ependorf tüplerinde -20°C’de saklandı.
Katılımcılar
Bir üniversite hastanesinde çalışan ve aşısının ilk dozunu hastanemizde yaptıran 1702 sağlık çalışanı, akademik ve hizmet personeli çalışmaya davet edildi; aşı kohordu başlangıcındaki bütün katılımcıların SARS-CoV-2 antikorlarının negatif olduğundan emin olabilmek amacıyla çalışmaya katılmayı kabul eden 1198 çalışandan birinci aşıdan hemen önce alınan kan örneklerinde total (IgM + IgG) antikor araştırıldı. Antikor pozitifliği saptanan 145 katılımcı daha önce doğrulanmış SARS-CoV-2 polimeraz zincir reaksiyonu (PCR) pozitifliği olsun ya da olmasın çalışmadan dışlandı. SARS-CoV-2 antikoru saptanmayan 1053 çalışan, birinci aşıdan ve ikinci aşından 28 gün sonra aşı antikor yanıtlarını saptamak amacıyla kan örneği vermeye davet edildi. Birinci aşıdan en az 28 gün sonra 939 gönüllü, ikinci aşıdan en az 28 gün sonra 771 gönüllü kan örneği verdi. Araştırmaya katılım, en az bir aşı olanlarda (1053/1702) %70.4, başlangıçta antikor taramasında katılanlar arasında birinci aşıdan sonra (939/1053) %89.2, ikinci aşıdan sonra (771/1053) %73.2 olarak saptandı (Şekil 1).
Serolojik Testler
Birinci aşı öncesi SARS-CoV-2 antikorlarını test etmek için, virüs spike yapısına karşı oluşan IgM ve IgG antikorlarını kemilüminesan enzim immünoassay (CLIA) yöntemiyle total olarak tespit eden ticari antikor kiti COV2T® (Siemens, ABD) kullanıldı. Serum örneğinde bulunan antikor miktarıyla orantılı olarak ortaya çıkan bağıl ışık miktarı (RLU) sistem tarafından kalibratör değerlerine göre belirlenen indeks ile (cut-off) karşılaştırılarak, ≥ 1 şeklindeki sonuçlar reaktif (pozitif), < 1 şeklinde elde edilen sonuçlar non-reaktif (negatif) olarak değerlendirildi.
Kantitatif IgG testleri ADVIA Centaur® SARS-CoV-2 IgG (Siemens, ABD) kitleri kullanılarak CLIA yöntemiyle çalışıldı. Test virüs S proteini RBD’ye karşı oluşan IgG tipi antikorları kantitatif olarak saptamaktadır. Kitin saptama aralığı 0.5-150 U/ml olup, ≥ 1.00 U/ml’nin üzerindeki değerler pozitif olarak değerlendirildi. Üretici firma kullanım kılavuzunda testin duyarlılığı %96.4, özgüllüğü %99.9, DSÖ’nün önerdiği ortak birim olan 1 BAU/ml= 21.8 U/ml olarak belirtilmektedir[13].
Nötralizan antikor, ACE2-RBD neutralization assay (Dia-Pro, İtalya) kitleri kullanılarak ELISA yöntemiyle araştırıldı. Test, virüs spike (S) proteini reseptör bağlama alanına (RBD) karşı oluşan IgG tipi antikorları semi-kantitatif olarak saptamaktadır. Plazma/serumlarda bulunan antikorların nötralize edici etkisinin “ACE2 ve RBD arasındaki bağlanmanın inhibisyonu ile” araştırıldığı bir testtir. Birin üzerindeki S/CO değerleri pozitif olarak değerlendirilmektedir. Altın standart in vivo nötralizasyon yöntemine göre özgüllük %95’in, duyarlılık %90’ ın üzerindedir[14]. Test kitleri üretici firmaların önerileri doğrultusunda çalışıldı. Testlerin hiçbiri kullanılan testin kantitasyon değerinin üstünde bulunmadığından dilüsyon yapılmadı.
İstatistiksel Analiz
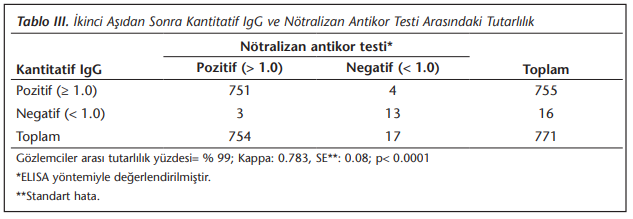
Kategorik değişkenler yüzde ve oranlarla, sayısal (sürekli ya da süreksiz) değişkenler aritmetik ve antikor titreleri için geometrik ortalamalarla, dağılım aralığı ve çeyrekler arası aralık (Inter Quantil Range, IQR) ile tanımlandı. Antikor yanıtları hem kategorize edilerek aşıya karşı nötralizan antikor pozitifliği seroprevalansı verileri, hem de tek değişkenli ve çok değişkenli çözümleyici istatistiklerde logaritmik olarak dönüştürülmüş S/CO düzeyleri kullanıldı. İkinci aşıdan sonra, 1.0 kesme değeri ile değerlendirilen kantitatif IgG ile nötralizan antikor testi arasında gözlemciler arası tutarlılık ve Kappa tutarlılık testi kullanıldı.
Tek değişkenli karşılaştırmalarda parametrik durumlarda ki-kare, Student’s t, tek yönlü varyans analizi (ANOVA), parametrik olmayan durumlarda Mann Whitney U ve Jonckheere-Terpstra testleri; Post-Hoc karşılaştırmalarda Tukey’s b ve Mann-Whitney U testleri kullanıldı. Çok değişkenli çözümlemelerde çoklu doğrusal regresyon testi kullanıldı. Tüm çözümlemelerde tip 1 hata sınır değeri 0.05 olarak alındı. İstatistik çözümlemelerde SPSS ve Stata istatistik paketleri kullanıldı.
BULGULAR
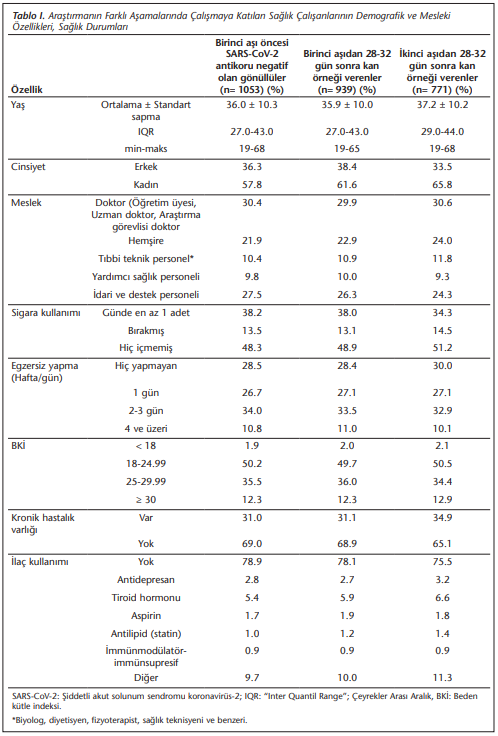
Birinci ve ikinci aşı sonrası katılım birlikte değerlendirildiğinde, sırasıyla gönüllülerin %57.86’sı kadın olarak tespit edilmiştir. Uygulanan ankette %34.3-38.2’si halen sigara kullandıklarını, %28.5-30.0’u hiç egzersiz yapmadığını belirtmiştir. Çalışmaya katılanların %47.3-47.8’inin fazla kilolu ya da obez olduğu saptanmıştır. Katılımcıların %31.0-34.7’sinde en az bir kronik hastalığın bulunduğu, %21.1-24.5’inin ise düzenli olarak ilaç kullandığı saptanmıştır (Tablo 1). SÇ’nin %28.9-31.6’sı 2021 yılı içinde en az bir kez başka bir aşı olmuştur. SÇ’nin %51.4-53.2’si COVID-19 açısından riskli birimde çalışmış, %46.5-48.3’ü hastane “COVID-19 Sürveyans Birimi” tarafından en az bir kez riskli kategoride değerlendirilmiştir. Başlangıç aşamasında çalışmaya katılanlar ile birinci ve ikinci aşı sonrası çalışmaya katılanlar, sosyodemografik özellikler açısından birbirlerine benzer bulunmuştur ((Tablo 1) ve (Tablo 2)).
Çalışanların %37.9-38.1’i aşının önemli ölçüde/son derecede etkili olabileceğini, %4.5-4.6’sı ise pek etkili olmadığını düşünürken, yaklaşık yarısı yan etkiler konusunda kaygılı olduklarını belirtmiştir (Tablo 2).
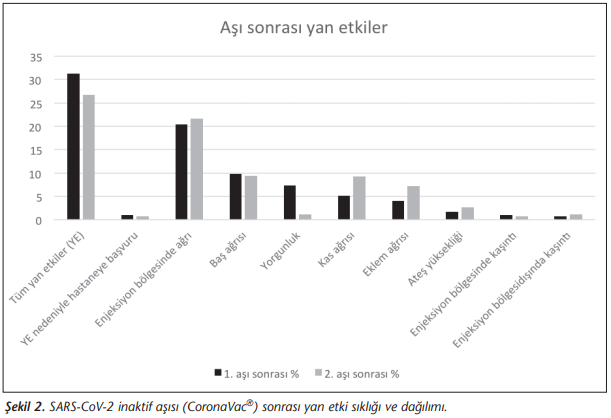
Katılımcıların %31.3’ü birinci aşı sonrasında, %26.8’i ise ikinci aşı sonrasında en az bir yan etki bildirmiştir. Lokal yan etki sıklığı birinci ve ikinci aşı sonrasında %22.5 ve 23.5; enjeksiyon bölgesi dışında en az bir yan etki görülme oranı ise birinci ve ikinci aşı sonrasında %18.7 ve 18.0 olarak saptanmıştır; yan etkiler nedeniyle bir sağlık kurumuna başvurma sıklığı sırasıyla %1.0, %0.8 olmuştur (Şekil 2). En sık görülen lokal yan etki %20.4-21.7 ile aşı bölgesinde ağrı olmuştur. En sık görülen sistemik yan etkinin ise %9.4-9.9 ile baş ağrısı olduğu belirlenmiştir (Şekil 2).
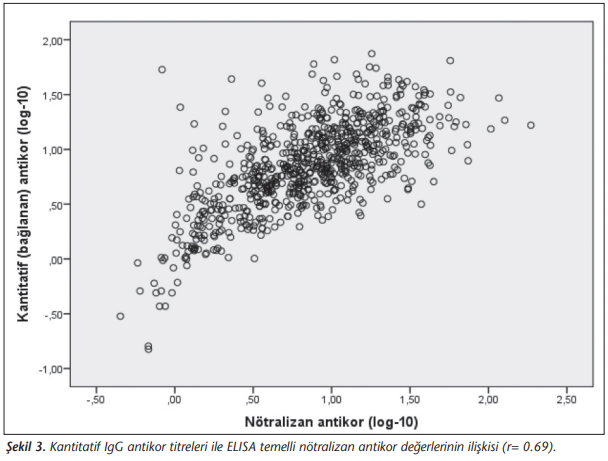
İkinci aşıdan en az 28 gün sonra tespit edilen kantitatif IgG ve nötralizan antikor testlerinin gözlemciler arası tutarlılığı, kantitatif IgG antikor titreleri ve nötralizan antikor testlerin S/CO değerleri > 1.0 kesme değeri ile dikotomize edildiğinde %99.0 olarak bulunmuştur (Kappa p< 0.001) (Tablo 3). Kantitatif antikor titreleri ile ELISA temelli nötralizan test antikor S/CO değerlerinin korelasyon katsayısı 0.69 olarak saptanmıştır (Şekil 3).
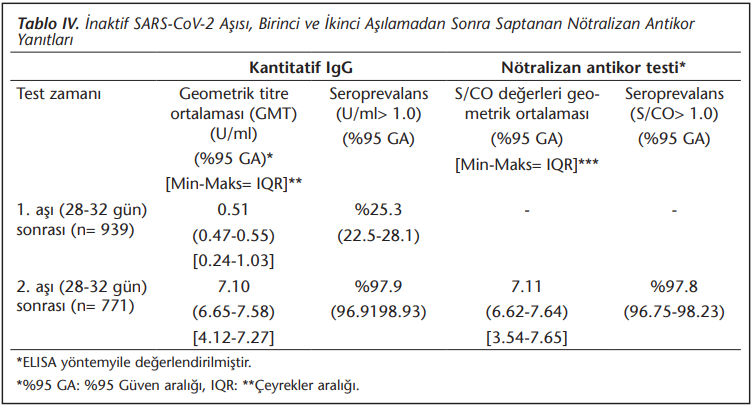
Birinci aşıdan en az 28 gün sonra yeterli (> 1.0) kantitatif IgG oluşturanların yüzdesi %25.3 (%95 GA= 22.5-28.1), geometrik ortalama titre (GMT)= 0.5 (%95 GA= 0.47-0.55) iken, ikinci aşıdan en az 28 gün sonra bu değerler %97.9 (%95 GA= 96.91-98.93), GMT= 7.1 (%95 GA= 6.65-7.58) olarak saptanmıştır. İkinci aşıdan en az 28 gün sonra nötralizan antikor pozitifliği ise %97.7 (%95 GA= 96.75-98.23) olup, S/CO değerleri geometrik ortalaması 7.1 (%95 GA= 6.62-7.64) olarak bulunmuştur (Tablo 4).
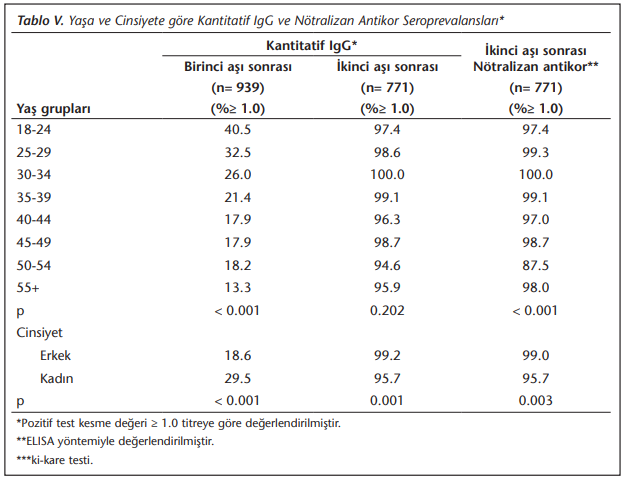
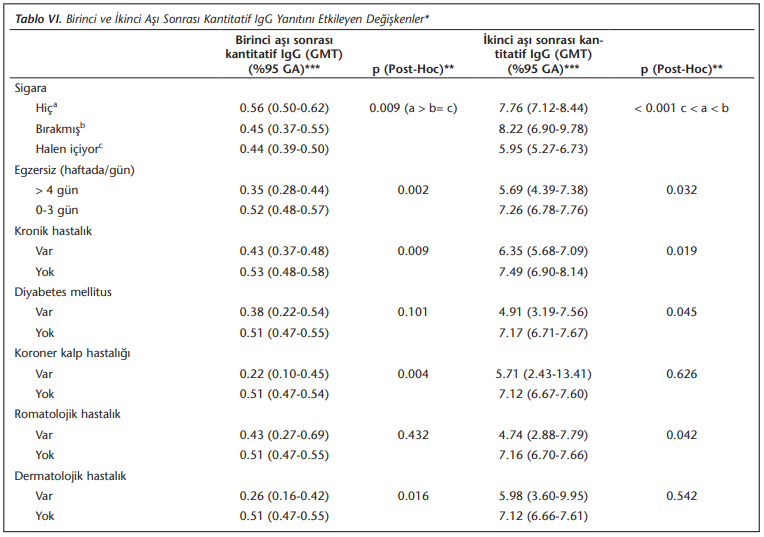
(Tablo 5)’te izlendiği gibi özellikle birinci aşıdan sonra kantitatif IgG titresi ve nötralizan antikor S/CO değerleri yaş ilerledikçe anlamlı olarak düşmektedir (p< 0.001).
Kadınlarda aşıya bağlı antikor yanıtı hem kantitatif IgG titreleri, hem nötralizan antikor pozitifliği hem de nötralizan antikor S/CO değerleri karşılaştırıldığında erkeklerden daha yüksek olduğu saptanmıştır (p≤ 0.01) (Tablo 5).
Tek değişkenli analizlerde, inaktif SARS-CoV-2 aşısına karşı kantitatif IgG oluşumunu yaş ve cinsiyet dışında belirgin şekilde etkileyen değişkenler; sigara içmek, kronik hastalığı bulunmak -özellikle diyabet hastası olmak, romatolojik hastalığı bulunmak-, aşırı kilolu veya obez olmak, yardımcı sağlık personeli olmak ve aşı öncesi PCR ile doğrulanmış COVID-19 enfeksiyonu geçirmektir. (Tablo 6)’da sunulan verilere ayrıntılı olarak bakıldığında, halen sigara içiyor olmak ikinci aşı sonrasında da kantitatif IgG yanıtını anlamlı düzeyde olumsuz etkilemektedir (p< 0.001). Sürekli ilaç kullanmayı gerektiren en az bir kronik hastalığı olan bireylerin gerek birinci (p= 0.009), gerekse ikinci aşı sonrası (p= 0.019) kantitatif IgG yanıtları, kronik hastalığı olmayanlara göre anlamlı düzeyde daha düşük bulunmuştur. Tip 2 diyabeti (p= 0.045) ve romatolojik hastalığı (p= 0.042) olan olguların özellikle ikinci aşıdan sonraki antikor yanıtlarının anlamlı düzeyde daha düşük olduğu belirlenmiştir.
İkinci aşıdan sonra nötralizan antikor yanıtı, bu yıl grip aşısı olanlarda (n= 136), olmayanlardan daha yüksek bulunmuştur (p= 0.012).
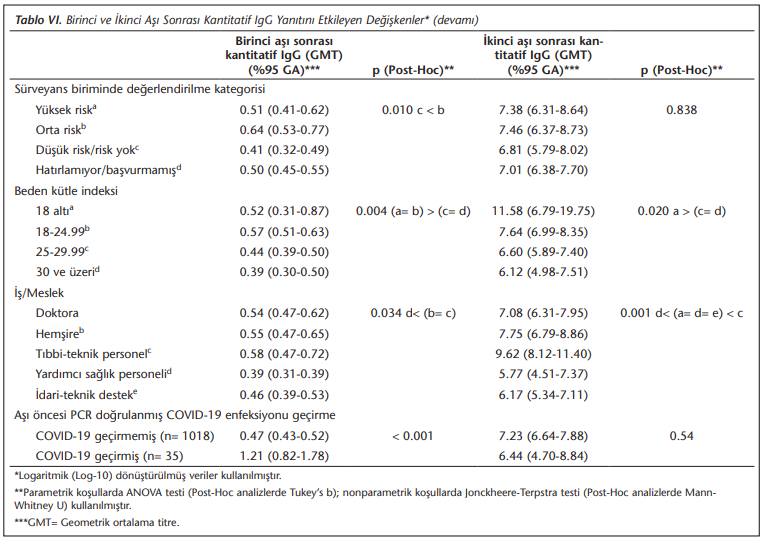
Aşı öncesi dönemde, hastane sürveyans biriminde riskli değerlendirilmiş olan bireylerin, birinci aşı sonrası daha iyi antikor yanıt ürettikleri (p= 0.010) ancak bu etkinin ikinci aşı sonrasında kaybolduğu belirlenmiştir. Aşı öncesi PCR testi ile doğrulanmış COVID-19 enfeksiyonu geçirmiş olan 35 katılımcıdan, aşı öncesi antikor testi ile sonucu negatif olan ve ikinci aşı sonrası kan örneği veren 27 olguda ikinci aşı sonrası nötralizan antikor yanıtı, aşı öncesi COVID-19 enfeksiyonu geçirmemiş olanlara göre daha yüksek bulunmuştur (p= 0.007) ancak kantitatif IgG verileri değerlendirildiğinde istatistiksel olarak anlamlı bir farklılık saptanmamıştır.
Fazla kilolu ya da obez olmanın, aşının antikor yanıtına olan olumsuz etkisi birinci aşıdan sonra beden kitle endeksi (BKİ) 24.99’un üstünde olanlarda görülürken, bu etkinin ikinci aşı sonrasında devam ettiği (p= 0.004) ancak bu kez 18.0’in altında BKİ’ye sahip bireylerin (p= 0.020) daha iyi antikor yanıtı verdikleri görülmüştür. Çalışanların iş/meslekleri analiz edildiğinde gerek birinci (p= 0.034) gerekse ikinci aşıdan sonra (p= 0.001), özellikle yardımcı sağlık personelinin anlamlı düzeyde daha düşük antikor yanıtı verdiği saptanmıştır.
Nötralizan antikor yanıtı bu yıl grip aşısı olmuş olanlarda daha yüksek (p= 0.012), yardımcı sağlık personelinde ise diğer çalışanlardan daha düşük (p= 0.001) olarak tespit edilmiştir.
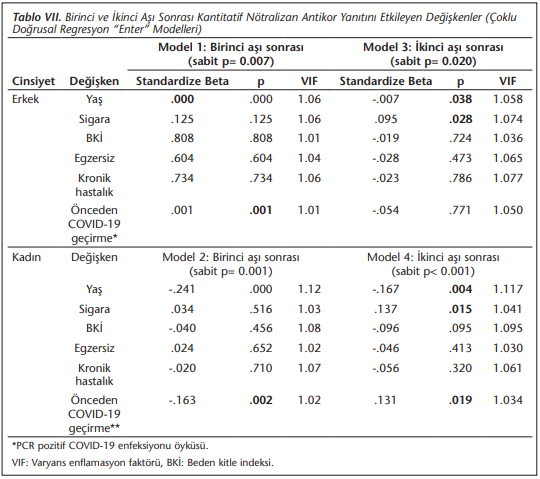
Tek değişkenli istatistik karşılaştırmalarında istatistiksel olarak önemli bulunan değişkenlerin dahil edildiği, kadın ve erkekler için birinci ve ikinci aşı sonrası kantitatif IgG yanıtının incelendiği çoklu doğrusal regresyon modellerinde, birinci aşıdan sonra erkeklerde ve kadınlarda yaş ve önceki COVID-19 PCR testi pozitifliğinin antikor yanıtında etkili olduğu (Model 1 ve Model 2) saptanmıştır (Tablo 7). İkinci aşıdan sonraki antikor yanıtını erkeklerde ortaya koyan Model 3’te antikor yanıtını sadece yaş ve sigaranın etkilediği, kadınlarda ise (Model 4) yaş ve sigara içmeye ek olarak önceki COVID-19 PCR testi pozitifliğinin de etkili olduğu belirlenmiştir (Tablo 7).
TARTIŞMA
Yakın tarihin en uzun süreli salgınında aşıların koruma potansiyelleri, normal yaşama dönme konusunda toplumu umutlandırmaktadır. En kısa zamanda toplumda yaygın, güvenli ve maksimum koruyuculuğu olan aşıyı uygulamak gerekliliği inkar edilemeyen bir gerçektir. Ülkemiz 2021 yılı Ocak ayı ortalarında SÇ ile başladığı aşılama programını topluma kademeli olarak yayarak Mart ayı sonuna kadar inaktif bir aşı olan CoronaVac® aşısı ile devam ettirmiştir.
Sürecin en ağır yükünü taşıyan ve hastalığın ciddiyetini bizzat deneyimleyen SÇ arasında ülkemizde erken kullanım ruhsatı alan bu inaktif SARS-CoV-2 aşısı oldukça rağbet görmüş, hatta net bir öneri olmamakla birlikte yakın dönemde hastalığı geçirmiş SÇ bile aşılanmayı talep etmiştir. Hastanemizde aşılamanın başladığı ilk bir haftada 1886 SÇ (toplam çalışanların yaklaşık %89’u) aşılanmış olup, bunların 53’ü son üç ayda hastalığı geçiren ve antikorunun halen pozitif olduğunu bilen kişilerdir.
Salgının birinci dalgasında (Mart-Ağustos 2020) hastanemizin henüz yayımlanmamış olan seroprevalans araştırması sonuçlarına göre taranan 1177 SÇ’nin 18 (%1.5)’inin enfekte olduğu saptanmıştır. Üçüncü dalgaya karşılık gelen bu çalışmanın verilerine bakıldığında enfeksiyon prevalansının (145/1198) %12.1’e çıktığını, birinci dalga ile üçüncü dalga arasında sekiz kata varan bir artış olduğu görülmektedir.
Bu araştırmanın başlangıcında görece yeterli olan araştırmaya katılım ilk ve ikinci aşıdan sonra giderek düşmekle birlikte, izlemdeki kayıplarla izlemi sürdürenler arasında çeşitli demografik değişkenler açısından fark bulunmamıştır (Şekil 1).
CoronaVac®’ın Brezilya ve Şili faz 3 ön-basım sonuçları paylaşılmış, Türkiye verilerinin ise metodolojisi yayımlanmış, faz 3 sonuçları basın aracılığı ile kamuoyuna duyurulmuştur. Bu sonuçlara göre aşılama sonrasında ciddi yan etkiler görülmezken, en çok görülen yan etkiler yorgunluk, baş ağrısı, kas ağrısı, ateş, titreme ve enjeksiyon yerinde ağrıdır[7],[8],[10],[11]. Faz 2 verilerinde hayatı tehdit eden hiçbir yan etki görülmediği, gruplara göre tüm yan etkilerin, deneklerin %25-35’i arasında görüldüğü ve en sık karşılaşılan yan etkinin enjeksiyon bölgesinde ağrı olduğu bildirilmiştir[5],[6]. Çalışmamızda da uyumlu olarak katılımcıların %26.8-31.3’ü (sırasıyla lokal ve sistemik) en az bir yan etki bildirmiştir. Lokal yan etki sıklığı birinci ve ikinci aşı sonrasında %22.5 ve 23.5 olup yan etkiler nedeniyle bir sağlık kurumuna başvurma sıklığı ise sırasıyla %1.0 ve %0.8 olmuştur (Şekil 2).
Aşıların koruyuculuğu doğal humoral ve hücresel bağışıklık yanıtının kompleks etkileşimiyle olduğundan, antikor yanıtı aşının koruyuculuğunu tam olarak göstermese de önemli bir immün yanıt göstergesi olarak kabul edilir[12]. Araştırmamızda CoronaVac®’ın antikor üretme yeteneği ikinci aşıdan en az 28 gün sonra %97.9 olarak saptanmıştır. Ancak birinci aşıdan en az 28 gün sonra alınan örneklerde katılımcıların sadece %25.3’ünde antikor yanıtı gözlenmiştir. Aşının faz 2 çalışmasında 0-28. günlerde aşılama yapılan kısmında 18-59 yaş aralığındaki gönüllülerin sadece ikinci dozdan sonraki 28. günde antikor yanıtı araştırılmış ve yanıt %99.2 olarak bulunmuştur. Faz 2 çalışmasının 0-14 gün aşılama yapılan kısmında bu değer ikinci aşıdan 14 gün sonra %96.5 iken 28. günde %97.4’e ulaşmıştır[5],[6]. Saptadığımız sonuç bize, 0-28 gün aşılama protokolü uygulandığında antikor devamının güvenle sağlanması için doz arasının daha fazla açılmaması konusuna dikkat çekilmesi gerektiğini düşündürmüştür.
Araştırmada kullandığımız nötralizan antikor testinde > 1 üzerindeki S/CO değerleri pozitif olarak değerlendirilmekle birlikte, çalışmamızda pozitifliğin erkeklerde %95 kadınlarda %99 gibi yüksek bir düzeyde bulunması nedeniyle, antikor yanıtını etkileyen değişkenlerin ortaya konmasında, pozitiflik yüzdeleri yerine S/CO değerleri kullanılmıştır. Analizler logaritmik dönüştürülmüş veriler üzerinden yapılmıştır.
Çalışmamızda antikor yanıtı gençlerde yaşlılara göre daha yüksektir. Bu bulgu, GMT’ler kullanılarak çeşitli aşılar için erişkinlerde yapılan birçok araştırmanın bulgularıyla da uyumludur[16],[17].
Aşı sonrası antikor yanıtı kadınlarda pek çok aşıda olduğu gibi çalışmamızda da anlamlı derecede yüksek bulunmuştur[12]. Cinsiyet ile ilişkili bu fark seks hormonlarının, yardımcı T hücrelerinin veya B hücrelerinin fonksiyonel farklılıklarının sonucu olabileceği gibi, tek başına bu durumu tam olarak açıklamamaktadır çünkü kadınlardaki bu yüksek antikor yanıtı, pre-pubertal ve hormon replasman tedavisi almayan menopoz sonrası kadınlarda da devam etmekte ve bazı aşılarda da erkeklerde anlamlı derecede artmış antikor yanıtı görülmektedir. Enfeksiyöz ajanların hastalık sürecinde de cinsiyetler arası fark bulunduğundan, aşı sonrası humoral immün yanıtta cinsiyet farkı görülmesi sürpriz olmayacaktır[18],[19],[20].
Araştırmamızda CoronaVac®’ın antikor GMT’lerini anlamlı olarak etkileyen diğer bazı değişkenler; herhangi bir eşlik eden bulaşıcı olmayan hastalık bulunması, aşırı kilolu olma, sigara içme ve önceden var olan bağışıklıktır. Bulgularımız, genel olarak aşılarda görülen humoral bağışıklık yanıtını etkileyen değişkenlerle tutarlılık göstermektedir. Bulgularımıza paralel olarak özellikle diyabetin, çeşitli aşıların antikor yanıtını düşürdüğü diğer çalışmalarda da bildirilmektedir[21],[22]. Çalışmamızda saptadığımız BKİ ve sigara içme ile aşı antikor yanıtı arasındaki ters ilişki, kaynakçadaki diğer çalışmalarda da tespit edilmiştir[23],[24].
Bu çalışmada, aşı öncesi antikoru negatif olan ancak PCR ile doğrulanmış COVID-19 enfeksiyonu geçirmiş olan kişilerde, birinci aşıdan sonra oluşan antikor yanıtının daha önce COVID-19 enfeksiyonu geçirmemiş olanlara göre anlamlı derecede daha yüksek olduğu saptanmıştır. Benzer sonuçlar, daha önce farklı aşılar üzerinde yapılan çalışmalarda da gösterilmiştir[16],[25].
Bu araştırmanın diğer bir dikkati çeken bulgusu, SÇ arasında yardımcı sağlık personelinin diğer çalışanlardan daha düşük nötralizan antikor yanıtının saptanmasıdır. Bu durum, yardımcı sağlık personelinin daha alt sosyoekonomik düzeyde olması, sürekli yoksunluk ve stresle daha fazla karşı karşıya olmasıyla açıklanabilir. Nitekim literatürde annesi daha eğitimsiz çocukların ve stresin, aşıların antikor yanıtını azalttığı yönünde kanıtlar vardır[26],[27].
Bu çalışmada, daha önce influenza aşısı olmuş bireylerin ilk aşıdan sonra daha iyi bir antikor yanıtı oluşturdukları tespit edilmiştir. Bu çapraz bir reaksiyon olabilir. Özellikle HIV ve HCV gibi enfeksiyonlara karşı oluşan antikor yanıtında yalancı pozitif sonuçların, çeşitli hastalıkların yanı sıra diğer viral enfeksiyonların varlığında ve kısa süre önce aşı uygulaması gibi durumlarda ortaya çıkabileceği bildirilmektedir[28]. Diğer aşıların COVID-19 aşılarıyla etkileşimi şu anda bilinmeyen bir konudur; sadece BCG aşısının rutin olarak uygulandığı ülkelerde özellikle birinci dalgada salgının yayılımının daha kontrollü olduğunu bildiren bazı kaynaklar mevcuttur[29].
Buraya kadar olan değerlendirmelerimiz tek değişkenli analiz bulgularına göre yapılmıştır. Ancak cinsiyete göre tabakalanmış çok değişkenli modellerde cinsiyet ve yaşa ek olarak her iki cinsiyette de sigara içmek ve aşı öncesi geçirilmiş COVID-19’un antikor yanıtında etkili olan değişkenler olduğu, tek değişkenli analizlerde anlamlı bulunan diğer değişkenlerin önemini yitirdiği tespit edilmiştir.
Çalışmamızda aşı sonrası 28. günde antikor yanıtını ölçmek amacıyla kullandığımız ELISA tabanlı nötralizan antikor testi ile kantitatif IgG testleri son derecede uyumlu bulunmuştur. İçlerinde CoronaVac® aşısının faz 3 çalışmasının Şili ayağının da bulunduğu pek çok yayında ELISA tabanlı nötralizan antikor testlerinin hem PRNT ile hem de kantitatif antikor testleri ile uyumlu olduğunu bildiren çalışmalar mevcuttur[6],[8],[14],[30].
Çalışmamızda mevcut birtakım kısıtlılıklar vardır. En temel kısıtlılığımız çalışmanın sadece genç erişkin yaş grubu ve belirli bir meslek grubunda yapılmış olmasıdır. Çalışmamızın sonuçları 65 yaş ve üstü yaşlı nüfusa ve toplumun tüm sosyoekonomik tabakalarına genellenemez. Bu araştırmada aşının sadece humoral (nötralizan antikor) yanıtı ortaya konmuş; hücresel bağışıklık hakkında bir bilgi sunulamamıştır. Bu nedenle sonuçlarımızın bu aşının bireyleri hastalıktan ne düzeyde koruyacağı konusunda yeterli bir kanıt sağladığı düşünülemez.
Bu çalışmada, aşının antikor yanıtını etkileyen değişkenler katılımcıların özbildirimi ile elde edildiğinden, öznel bilgilere dayalı çıkarımlarda bulunmak sonuçların kanıt değerini düşürebilir. Ayrıca literatürde kanıtları gösterilen, aşının antikor yanıtını etkileyen psikolojik stres, uyku düzeni, başta A, D, E vitaminleri ve çinko olmak üzere vitamin, mineral destekli beslenme gibi bazı değişkenler bu çalışmada sorgulanamamıştır.
Sonuç olarak, bir inaktif SARS-CoV-2 aşısı olan CoronaVac® 18-64 yaş SÇ’de tek bir aşıdan 28 gün sonra %25 ve ikinci aşıdan 28 gün sonra %97 oranında yeterli antikor yanıtı sağlamaktadır. Antikor yanıtı kadınlarda, genç yaşlarda, sigara içmeyenlerde ve daha önce SARS-CoV-2 ile karşılaşmış olanlarda anlamlı düzeyde daha yüksektir. Gerçek yaşamda aşının bireyleri hastalıktan ne kadar koruduğu konusunda faz 3 ve faz 4 sonuçlarına gereksinim vardır.
ETİK KURUL ONAYI
Bu çalışma, T.C. Sağlık Bakanlığının (Tarih: 08.01.2021 ve Sayı: 2021-01-05T23_01_51) ve Manisa Celal Bayar Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulunun (Tarih: 18.01.2021 ve Karar No: 133) onayı ile gerçekleştirildi.
ÇIKAR ÇATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir çıkar çatışması bildirmemişlerdir.
KAYNAKLAR
- World Health Organization (WHO). COVID-19 vaccine tracker and landscape. Available from: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines (Accessed date: 30 Apr 2021).
- McDonnell A, Van Exan R, Lloyd S, Subramanian L, Chalkidou K, La Porta A, et al. COVID-19 Vaccine predictions: using mathematical modelling and expert opinions to estimate timelines and probabilities of success of COVID-19 vaccines. Center for Global Development, Washington, DC, October, 2020. Available from: https://www.cgdev.org/publication/covid-19-vaccine-predictions (Accessed date: 2 Apr 2021)
- T.C. Sağlık Bakanlığı COVID-19 Aşısı Bilgilendirme Platformu. https://covid19asi.saglik.gov.tr/TR-77706/covid-19-asisi-ulusal-uygulama-stratejisi.html (Accessed date: 2 Apr 2021).
- Barranco R, Ventura F. COVID-19 and infection in health-care workers: An emerging problem. Med Leg J 2020; 88(2): 65-6.
- Wu Z, Hu Y, Xu M, Chen Z, Yang W, Jiang Z, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2021; 21(6): 803-12.
- Zhang Y, Zeng G, Pan H, Li C, Hu Y, Chu,K, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: A randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis 2020; 21: 181-92.
- Palacios R, Batista AP, Albuquerque CSN, Patino EG, Santos JP, Pessoa-Conde MTR, et al. Efficacy and safety of a COVID-19 inactivated vaccine in healthcare professionals in Brazil: The PROFISCOV study (preprint). Available from: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3822780
- Bueno SM, Abarca K, Gonzalez PA, Galvez NMS, Soto JA, Duerte LF, et al. Interim report: Safety and immunogenicity of an inactivated vaccine against SARS-CoV-2 in healthy chilean adults in a phase 3 clinical trial (preprint). Available from: https://www.medrxiv.org/content/10.1101/2021.03.31.21254494v1
- Faria E, Guedes AR, Oliveira MS, Moreira MVG, Maia FL, Barboza AS, et al. Performance of vaccination with CoronaVac in a cohort of healthcare workers (HCW)- preliminary report (preprint). Available from: https://www.medrxiv.org/content/10.1101/2021.04.12.21255308v1
- Akova M, Unal S. A randomized, double-blind, placebo-controlled phase III clinical trial to evaluate the efficacy and safety of SARS-CoV-2 vaccine (inactivated, Vero cell): a structured summary of a study protocol for a randomised controlled trial. Trials 2021; 22(1): 276.
- TRT Haber. Çin aşısının Faz-3 sonucu açıklandı: Etkinlik oranı yüzde 83,5 (3 Mart 2021). Avaialble from: https://www.trthaber.com/haber/gundem/cin-asisinin-faz-3-sonucu-aciklandi-etkinlik-orani-yuzde-835-561195.html
- Zimmermann P, Curtis N. Factors That Influence the Immune Response to Vaccination. Clin Microbiol Rev 2019; 32(2): e00084-18.
- Banjar A, Al-Tawfiq JA, Alruwaily A, Alserehi H, Al-Qunaibet A, Alaswad R, et al. Seroprevalence of antibodies to SARS-CoV-2 among blood donors in the early months of the pandemic in Saudi Arabia. Int J Infect Dis 2021; 104: 452-7.
- Abe KT, Li Z, Samson R, Samavarchi-Tehrani P, Valcourt EJ, Wood H, et al. A simple protein-based surrogate neutralization assay for SARS-CoV-2. JCI Insight 2020; 5(19): e142362.
- Mendrone-Junior A, Dinardo CL, Ferreira SC, Nishya A, Salles NA, Almeida Neto C, et al. Correlation between SARS-COV-2 antibody screening by immunoassay and neutralizing antibody testing. Transfusion 2021; 61(4): 1181-90.
- Bayas JM, Vilella A, Bertran MJ, Vidal J, Batalla J, Asenjo MA, et al. Immunogenicity and reactogenicity of the adult tetanus-diphtheria vaccine. How many doses are necessary? Epidemiol Infect 2001; 127(3): 451-60.
- Rubins JB, Puri AK, Loch J, Charboneau D, MacDonald R, Opstad N, et al. Magnitude, duration, quality, and function of pneumococcal vaccine responses in elderly adults.J Infect Dis 1998; 178(2): 431-40.
- McElhaney JE, Zhou X, Talbot HK, Soethout E, Bleackley RC, Granville DJ, et al. The unmet need in the elderly: how immunosenescence, CMV infection, co-morbidities and frailty are a challenge for the development of more effective influenza vaccines. Vaccine 2012; 30(12): 2060-7.
- Kennedy RB, Ovsyannikova IG, Pankratz VS, Vierkant RA, Jacobson RM, Ryan MA, et al. Gender effects on humoral immune responses to smallpox vaccine. Vaccine 2009; 27(25-26): 3319-23.
- Cook IF. Sexual dimorphism of humoral immunity with human vaccines. Vaccine 2008; 26(29-30): 3551-5.
- Janbakhsh A, Mansouri F, Vaziri S, Sayad B, Afsharian M, Rahimi M, et al. Effect of selenium on immune response against hepatitis B vaccine with accelerated method in insulindependent diabetes mellitus patients. Caspian J Intern Med 2013; 4(1): 603-6.
- McElhaney JE, Garneau H, Camous X, Dupuis G, Pawelec G, Baehl S, et al. Predictors of the antibody response to influenza vaccination in older adults with type 2 diabetes. BMJ Open Diabetes Res Care 2015; 3(1): e000140.
- Sheridan PA, Paich HA, Handy J, Karlsson EA, Hudgens MG, Sammon AB, et al. Obesity is associated with impaired immune response to influenza vaccination in humans. Int J Obes 2012; 36: 1072-7.
- Yang S, Tian G, Cui Y, Ding C, Deng M, Yu C, et al. Factors influencing immunologic response to hepatitis B vaccine in adults. Sci Rep 2016; 6: 27251
- Mugitani A, Ito K, Irie S, Eto T, Ishibashi M, Ohfuji S, et al. Immunogenicity of the trivalent inactivated influenza vaccine in young children less than 4 years of age, with a focus on age and baseline antibodies. Clin Vaccine Immunol 2014; 21(9): 1253-60.
- Kohut ML, Cooper MM, Nickolaus MS, Russell DR, Cunnick JE. Exercise and psychosocial factors modulate immunity to influenza vaccine in elderly individuals. J Gerontol A Biol Sci Med Sci 2002; 57(9): M557-M562.
- Glaser R, Kiecolt-Glaser JK, Malarkey WB, Sheridan JF. The influence of psychological stress on the immune response to vaccines. Ann N Y Acad Sci 1998; 840: 649-55.
- Aaby P, Benn CS, Flanagan KL, Klein SL, Kollmann TR, Lynn DJ, et al. The non-specific and sex-differential effects of vaccines. Nat Rev Immunol 2020; 20(8): 464-70.
- Tenchov R. Do other vaccines protect you from COVID-19? Available from: https://www.cas.org/blog/other-vaccines-covid19 (Accessed date: 2 Apr 2021).
- Younes S, Al-Jighefee H, Shurrab F, Al-Sadeq DW, Younes N, Dargham SR, et al. Diagnostic efficiency of three fully automated serology assays and their correlation with a novel surrogate virus neutralization test in symptomatic and asymptomatic SARS-COV-2 individuals. Microorganisms 2021; 9(2): 245.
İletişim (Correspondence):
Dr. Şebnem Şenol Akar,
Manisa Celal Bayar Üniversitesi Tıp Fakültesi,
Enfeksiyon Hastalıkları ve Kinik Mikrobiyoloji Anabilim Dalı,
Manisa, Türkiye.
E-posta (E-mail):sebsenol@yahoo.com