Hastanemize Başvuran Akut Gastroenteritli Hastalarda Yeni
Görülmeye Başlayan A Grubu Rotavirüs G10, G12 Genotiplerinin Araştırılması
Investigation of Group A Rotavirus G10, G12 Genotypes Emerging in Patients
with Acute Gastroenteritis in a Tertiary Care Hospital
Hande KAHRAMAN1 , Aylin ALTAY KOÇAK2 , Katren ALBAKKOUR1 , Hager MUFTAH1 , Buket DALGIÇ3 , Kayhan ÇAĞLAR1 , Kamruddin AHMED4 , Gülendam BOZDAYI1
1Gazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Tıbbi Viroloji Bilim Dalı, Ankara.
1Gazi University Faculty of Medicine, Department of Medical Microbiology, Division of Medical Virology, Ankara, Turkey.
2Başkent Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
2Baskent University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
3Gazi Üniversitesi Tıp Fakültesi, Çocuk Gastroenteroloji Bilim Dalı, Ankara.
3Gazi University Faculty of Medicine, Division of Pediatric Gastroenterology, Ankara, Turkey.
4Malaysia Sabah Üniversitesi Tıp ve Sağlık Bilimleri Fakültesi, Borneo Tıp ve Sağlık Araştırma Merkezi, Kota Kinabalu, Sabah, Malezya.
4Universiti Malaysia Sabah Faculty of Medicine and Health Sciences, Borneo Medical and Health Research Centre, Kota Kinabalu, Sabah, Malaysia.
*Bu çalışma Gazi Üniversitesi Bilimsel Araştırma Projeleri tarafından desteklenmiştir (Proje No: 2017-51).
*Bu çalışma Uluslararası XXXVIII. Türk Mikrobiyoloji Kongresi (4-8 Kasım 2018)’nde sözlü bildiri olarak sunulmuştur.
Makale Atıfı:Kahraman H, Altay Koçak A, Albakkour K, Muftah H, Dalgıç B, Çağlar K ve ark. Hastanemize başvuran akut gastroenteritli hastalarda yeni görülmeye başlayan A grubu rotavirüs G10, G12 genotiplerinin araştırılması. Mikrobiyol Bul 2021;55(4):553-567.
ÖZ
Rotavirüsler dünyada 0-5 yaş arasındaki çocuklarda en sık karşılaşılan, mortalite ve morbidite oranı yüksek olan viral gastroenterit etkenidir. Bu çalışmada laboratuvarımıza ishal etiyolojisi araştırılması için dışkı örnekleri gönderilen hastalarda, rotavirüs enfeksiyonu sıklığını belirlemek, bölgemizde yaygın görülen rotavirüs genotiplerini ve son zamanlarda dünya genelinde sık görülmeye başlayan G10, G12 genotiplerini araştırmak amaçlanmıştır. Çalışmamızda Kasım 2016 ve Şubat 2018 tarihleri arasında başvuran, 0-92 yaş arasındaki 476 hastanın dışkı örnekleri immünokromatografik hızlı test ve “enzyme-linked immunosorbent assay (ELISA)” ile çalışılmıştır. ELISA pozitif örneklere nested revers transkriptaz polimeraz zincir reaksiyonu (nRT-PCR) çalışılarak agaroz jel elektroforezi yardımıyla genotiplendirme yapılmıştır. Dışkı örneklerinin %18.3’ünde ve %17’sinde sırasıyla immünokromatografik test ve ELISA ile rotavirüs pozitif bulunmuştur. Tüm ELISA pozitif örnekler, RT-PCR ile de pozitif olarak tespit edilmiştir. Kadın hastaların %18.5’i, erkek hastaların %15.7’si pozitif olarak saptanmış ve cinsiyetler arasında rotavirüs pozitifliği istatistiksel olarak anlamlı bulunmamıştır. Rotavirüs pozitifliği en fazla 6-12 (%23.5) yaş grubunda görülmüş; bunu 13-24 ay (%17.3), 25-36 ay (%16) yaş grupları izlemiştir. Rotavirüs olgularının en yaygın olarak ilkbaharda görüldüğü saptanmıştır. Örneklerin sırasıyla %37, %7.4, %16.1, %6.2, %9.9, %2.5, %26’sında G1, G2, G3, G4, G9, G10 ve G12 saptanmıştır. G12, G1’den sonra en sık görülen genotip olarak tespit edilmiştir. En yaygın G ve P genotip kombinasyonu G1P[8] (%17.2) olarak bulunmuştur. Bunu G12P[8] (%11.11) ve G3P[8] (%11.11)’in takip ettiği saptanmıştır. P genotipleri arasında P[8] (%53) dominant genotip olarak bulunmuştur. Çalışmamızda çocukluk çağı ishal etkeni olan rotavirüsün, ileri yaşlarda da karşımıza çıkabileceği ve hatta dünya genelinde insanlarda enfeksiyon yapan yeni genotiplerin de etken olabileceği gözlenmiştir. Bu nedenle moleküler epidemiyolojik çalışmalarda G10, G12 gibi yeni genotiplerin de araştırılmasının önemli olduğu kanaatine varmış bulunmaktayız.
Anahtar kelimeler: Rotavirüs enfeksiyonu; G10; G12; nested PCR; RT-PCR.
ABSTRACT
Rotaviruses are the most common cause of viral gastroenteritis with the highest mortality and morbidity rates in children aged 0-5 years. The aim of this study was to determine the frequency of rotavirus infection in patients whose stool samples were sent to microbiology laboratory to investigate the etiology of diarrhea, to investigate the rotavirus genotypes that are common in our region and G10, G12 genotypes that have recently become common in the world. Fecal samples of 476 patients aged between 0-92 years who applied between November 2016 and February 2018 were studied via immunochromatographic rapid test and enzyme-linked immunosorbent assay (ELISA) methods. ELISA positive samples were studied by nested reverse transcriptase chain reaction (RT-PCR) and genotyped by agarose gel electrophoresis. Rotavirus was found positive in 18.3% and 17% of stool samples by immunochromatographic test and ELISA, respectively. All ELISA positive samples were also detected as positive by RT-PCR. 18.5% of female patients and 15.7% of male patients were found to be positive and rotavirus positivity was not statistically significant between genders. The frequency of rotavirus in different age groups was 23.5% (6-12 years), 17.3% (13-24 months) and 16% (25-36 months). It was determined that rotavirus cases were most common in the spring. G1, G2, G3, G4, G9, G10, and G12 were detected in 37%, 7.4%, 16.1%, 6.2%, 9.9%, 2.5%, 26% of the samples, respectively. G12 was the most common genotype after G1. The most common G and P genotype combination was G1P[8] (17.2%). This was followed by G12P[8] (11.11%) and G3P[8] (11.11%). P[8] (53%) was found to be the dominant P genotype. In this study, it was observed that rotavirus, which is the cause of childhood diarrhea, can also be encountered in advanced ages and even new genotypes that infect humans worldwide may also be the causative agents. Therefore, we concluded that it is important to investigate new genotypes such as G10 and G12 in molecular epidemiological studies.
Keywords: Rotavirus infection; G10; G12; nested PCR; RT-PCR.
Geliş Tarihi (Received): 05.04.2021 - Kabul Ediliş Tarihi (Accepted):04.08.2021
GİRİŞ
Rotavirüs, Reoviridea ailesi içerisinde yer alan 11 segmentli bir RNA virüsüdür. Dünyada 0-5 yaş arasındaki çocuklarda en sık karşılaşılan, mortalite ve morbidite oranı en yüksek olan viral gastroenterit etkenidir[1]. Enfeksiyonların çoğu toplum kökenli olsa da rotavirüsler altı aylıktan küçük bebeklerde nozokomiyal ishalin de başlıca nedenidir[2]. Çocuklar yaşamlarının ilk yıllarında rotavirüsle enfekte olurlar. Bu enfeksiyonlar genellikle klinik bulgularla geçirilir. Daha sonra geçirilen, tekrarlayan enfeksiyonların kliniği daha hafif seyretmektedir[3]. Rotavirüs enfeksiyonları yetişkinlerde genellikle hafif seyirlidir ancak bağışıklık sistemi baskılanmış (organ transplantasyonu, kazanılmış immün yetmezlik sendromu [acquired immun deficiency syndrome (AIDS)], vb.) kişilerde klinik şiddetli olabilir[4],[5]. Rotavirüs enfeksiyonu, 2016 yılında dünya genelinde 0-5 yaş arasındaki çocuklarda, 104 733’ü Sahra altı Afrika’da görülen, tahminen 128 500 ölüme ve 258 milyondan fazla ishal atağına neden olmuştur[6]. Dünya Sağlık Örgütü (DSÖ) rotavirüs enfeksiyonundan korunmak için canlı, oral iki rotavirüs aşısını önermektedir: Rotarix® ve RotaTeq®[7]. Aşılama programının Avrupa’da uygulanmasından önce beş yaşından küçük çocuklarda 3.6 milyon rotavirüse bağlı ishal atağının meydana geldiği ve 87 000’den fazla hastaneye yatış, yaklaşık 700 000 ayaktan tedavi ve 231 ölüm gerçekleştiği bildirilmiştir. Rotavirüs aşı programı uygulanan ülkelerde, 0-1 yaş bebeklerde rotavirüs gastroenteriti nedeniyle hastaneye yatışlarda %70-90’lık bir düşüş görülmüştür[8].
Akut gastroenterit Türkiye’de ciddi bir halk sağlığı problemidir ve her yıl beş yaşın altındaki 352 000’den fazla çocuğu etkilemektedir[7],[9]. Ülkemizde, T.C. Sağlık Bakanlığı Halk Sağlığı Genel Müdürlüğü Başkanlığı tarafından yürütülen iki sürveyans programı sonrası, akut gastroenteriti olan 0-5 yaş arası çocuklarda, 2012-2014 yılları arasında %78.2, 2014-2016 yılları arasında %85.3 rotavirüs pozitifliği bulunmuştur[10],[11].
Rotavirüs genotipleri arasında G1, G2, G3, G4 ve G9 dünya genelinde en yaygın görülen tiplerdir. Virüsün segmentli genomik yapısından dolayı yeni genotipler oluşabilmekte ve bu genotiplerin dağılımı coğrafi bölgelere göre farklılık gösterebilmektedir. Dünyada yeni önem kazanan, G12 ilk kez Filipinler’de 1990 yılında insanda tanımlanmıştır ve 2002’den itibaren birçok çalışmada bildirilmiştir[12],[13],[14]. G10 ise öncesinde çoğunlukla hayvanlarda bulunurken, insanlarda ilk kez Birleşik Krallık’ta 1992 yılında saptanmıştır. G10 genotipinin varlığı daha sonraki çalışmalarda insanlarda da gösterilmiştir[15],[16],[17].
Rotavirüs için ticari olarak mevcut antijen saptama testlerinden immünokromatografik hızlı tanı testleri yaygın kullanılmakta, “enzyme-linked immunosorbent assay (ELISA)” da laboratuvarlarda yüksek duyarlılıkla kullanılabilmektedir[6],[18]. Dışkı örneklerinden G ve P tipleri nested revers transkriptaz polimeraz zincir reaksiyonu (nRT-PCR) yöntemiyle tespit edilebilmektedir[18].
Bu çalışmada Gazi Üniversitesi Tıp Fakültesi Hastanesi Tıbbi Viroloji Laboratuvarına ishal etiyolojisi araştırılması için dışkı örnekleri gönderilen hastalarda, rotavirüs enfeksiyonu sıklığını belirlemek, bölgemizde yaygın olan rotavirüs genotiplerini saptamak ve özellikle son zamanlarda dünya genelinde görülmeye başlayan G10 ve G12 genotiplerini araştırmak amaçlanmıştır.
GEREÇ ve YÖNTEM
Bu çalışma, Gazi Üniversitesi Tıp Fakültesi Etik Kurulu onayı ile gerçekleştirildi (Tarih: 19.01.2017 ve Karar No: E.19037).
Örneklerin Toplanması
Çalışmamızda Gazi Üniversitesi Tıp Fakültesi Hastanesi'ne Kasım 2016 ve Şubat 2018 tarihleri arasında akut gastroenterit şikayetiyle başvuran 476 hastanın laboratuvarımıza rotavirüs hızlı antijen testi çalışılması amacıyla gönderilen dışkı örnekleri çalışıldı. Örnekler 1.5 ml’lik mikrosantrifüj tüplerine alındı, ELISA ve RT-PCR testleri için toplanarak -80°C’de çalışılacağı zamana kadar saklandı.
Rotavirüs Antijeninin Saptanması
Dışkı örneklerinde, immünokromatografik yöntemle rotavirüs antijen tespiti için ALL TEST™ (MedNet GmbH, Almanya) kiti kullanılarak üreticinin talimatları doğrultusunda çalışıldı. Olgulardan alınan dışkı örneklerinde aynı zamanda rotavirüs grup A antijen pozitifliği, 1:9 oranında fosfat tamponlu serum fizyolojik (PBS) ile sulandırılmış örneklerde ELISA yöntemiyle (Rotaclone, Meridian Bioscience, ABD) araştırıldı. Sulandırılan örnekler vortekslendikten sonra 12 000 rpm’de bir dakika santrifüj edilerek süpernatant kısmı kullanıldı.
Viral RNA İzolasyonu
Rotavirüs antijeni ELISA testi ile pozitif bulunan hastaların dışkı örneklerinden Qiamp viral RNA mini kit (Qiagen, Almanya) kullanılarak spin-kolon yöntemiyle çift zincirli viral RNA elde edildi. İzolasyonu yapılan örnekler PCR yapılana kadar -80°C’de saklandı.
Rotavirüs VP7 ve VP4 Amplifikasyonu
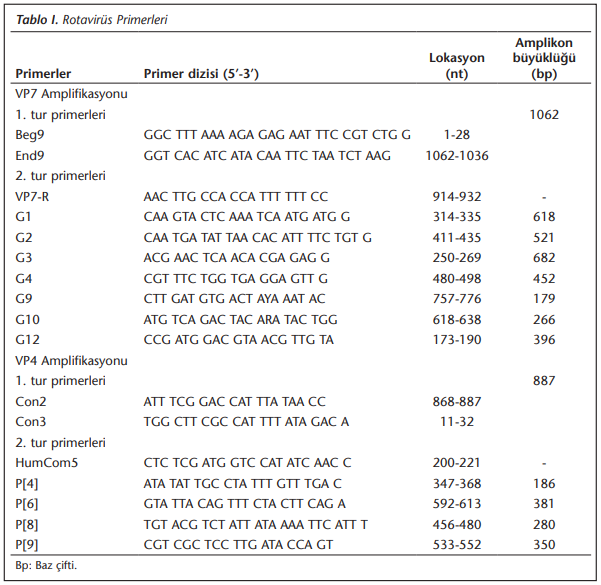
Protein VP4 ve VP7 gen bölgelerinin amplifikasyonu için RT-PCR, Access Quick RT-PCR kiti (Promega Corporation, Madison, ABD) kullanılarak yapıldı. Protein VP4 gen amplifikasyonu Con2 ve Con3 primerleri ile, VP7 gen amplifikasyonu ise Beg9 ve End9 primerleri ile çalışıldı. Spesifik G ve P genotiplendirme reaksiyonları PCR karışımı (Promega Corporation, Madison, ABD) ve tipe özgü primerler ile ısı döngü cihazı (ThermoHybaid PCR Px2, İngiltere) kullanılarak gerçekleştirildi. G tiplendirme için G1, G2, G3, G4, G9, G10 ve G12; P tiplendirme için P[4], P[6], P[8] ve P[9] tiplerine özgü primerler kullanıldı (Tablo 1)[19],[20],[21],[22].
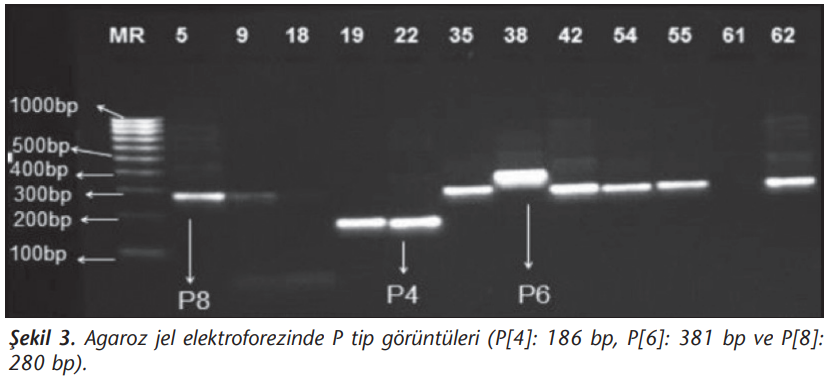
Agaroz Jel Elektroforezi
RT-PCR sonucunda oluşan amplifikasyon ürünleri, etidyum bromür içeren %2’lik agaroz jelde yürütülerek örneklerdeki amplifikasyon ürün uzunluğuna göre rotavirüs pozitifliği ve genotipleri belirlendi.
İstatistiksel Analiz
İstatistiksel değerlendirme, IBM SPSS Statistics 22.0 programı kullanılarak yapıldı. Rotavirüs pozitifliği açısından cinsiyet, mevsimler ve yaş grupları arasındaki istatistiksel farklılıklar Pearson ki-kare testi ile değerlendirildi, tüm analizlerde p< 0.05 değeri anlamlı kabul edildi.
BULGULAR
Çalışmamızda Gazi Üniversitesi Tıp Fakültesi Hastanesi'ne, Kasım 2016 ve Şubat 2018 tarihleri arasında başvuran, 0-92 yaş arasındaki 476 hastanın, farklı kliniklerden laboratuvarımıza rotavirüs hızlı antijen testi çalışılması amacıyla gönderilen dışkı örnekleri kullanılmıştır. Örneklerin 86 (%18.1)’sında immünokromatografik test ile rotavirüs antijeni pozitif bulunmuştur. İmmünokromatografik test sonucu pozitif ve negatif olan 476 hastanın tümüne ELISA testi çalışılmış ve 81 hasta (%17) pozitif bulunmuştur. ELISA testi pozitif tüm örneklere RT-PCR çalışılmıştır. ELISA ile pozitif bulunan 81 hastanın tümünde PCR ile de rotavirüs pozitifliği tespit edilmiştir.
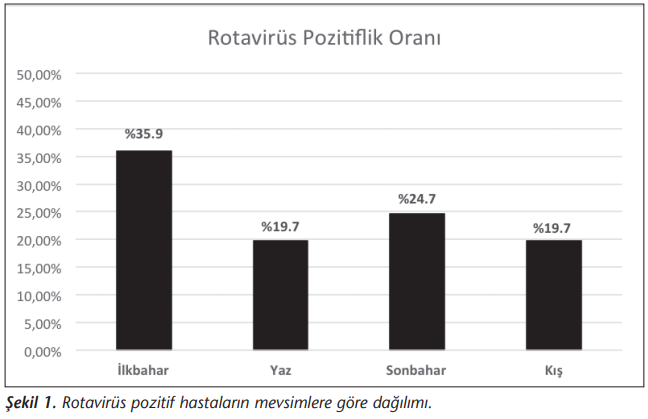
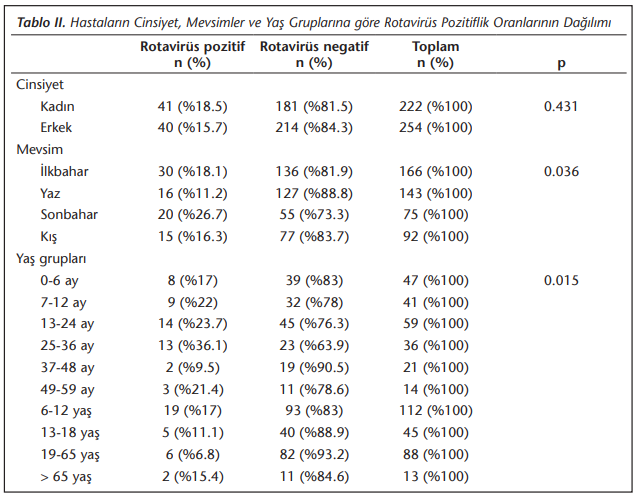
Kadın hastaların %18.5’i, erkek hastaların %15.7’si pozitif olarak saptanmış ve cinsiyet ve rotavirüs pozitifliği arasında istatistiksel olarak anlamlı bir ilişki bulunmamıştır (p= 0.431). Yaş gruplarına göre rotavirüs oranları incelendiğinde rotavirüsün en sık 25-36 aylık grupta (%36.1) saptandığı, 19-65 yaş grubunda ise en düşük oranda (%6.8) olduğu görülmüştür. Buna göre rotavirüs pozitifliği ve yaş grupları arasında istatistiksel olarak anlamlı bir ilişki saptanmıştır (p= 0.015). Rotavirüs pozitif olgular sırasıyla ilkbahar (%35.9), sonbahar (%24.6), kış (%19.7) ve yaz (%19.7) mevsiminde görülmüştür (Şekil 1) ve mevsimlere göre rotavirüs pozitiflikleri arasında istatistiksel olarak anlamlı ilişki bulunmuştur (p= 0.036) (Tablo 2).
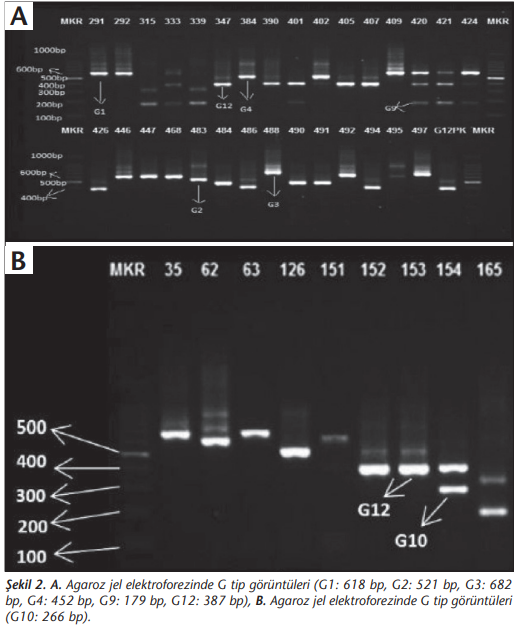
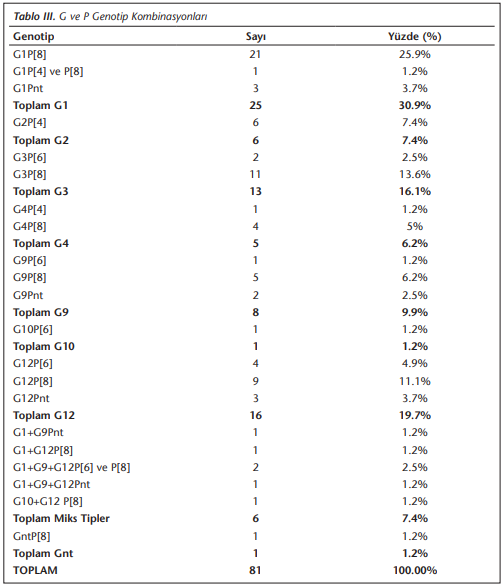
Toplam 81 hastanın 80’inde G tipleri belirlenirken, bir örnekte tiplendirme yapılamamıştır. Çalışmamızda yedi farklı G tipi elde edilmiştir. Örneklerin sırasıyla %37, %7.4, %16.1, %6.2, %9,9, %2.5, %26’sında G1, G2, G3, G4, G9, G10 ve G12 saptanmıştır (Şekil 2). P tiplendirmede ise 71 örneğin P tipleri belirlenirken, 10 (%12.3) örnekte tiplendirme yapılamamıştır. Çalışmamızda üç farklı P tipi elde edilmiştir (Şekil 3). Buna göre %65.4 P[8], %9.9 P[6], %8.6 oranında P[4] ve sırasıyla %2.5 ile %1.2 oranında P[6], P[8] ve P[4], P[8] beraber saptanmıştır (Tablo 3).
TARTIŞMA
Hastanemize tüm yaş gruplarından gastroenterit şikayetiyle başvuran hastalardan toplanan 476 örnekte rotavirüs sıklığı immünokromatografik hızlı test, ELISA ve PCR yöntemleriyle çalışılmış; sıklık cinsiyete, mevsimlere, yaş gruplarına göre incelenmiştir. Çalışmamızda immünokromatografik yöntemle %18.1, ELISA yöntemiyle %17 oranında rotavirüs antijen pozitifliği saptanmıştır. Ülkemizde ve dünya genelinde rotavirüs sıklığını araştıran çeşitli çalışmalar yapılmıştır. Kaşifoğlu ve arkadaşları, 2005-2011 yılları arasında yaptıkları çalışmada[23] 0-16 yaş arası gastroenteritli hastalardan toplanan 1241 dışkı örneğinde enzime bağlı floresan yöntemiyle “enzyme-linked flourescence assay (ELFA)” (Vidas; bioMerieux, Fransa) %19.9 oranında pozitiflik saptanmıştır. Samancı ve arkadaşlarının Diyarbakır’da Ocak 2010-Aralık 2015 yılları arasında, akut gastroenterit nedeniyle başvuran 0-18 yaş grubundaki 55 035 çocukta yaptığı çalışmada[24] ELISA (Triturus-bioMerieux, Fransa) yöntemiyle %14.1 oranında pozitiflik elde etmiştir. Avcı ve arkadaşları, 2012-2014 yılları arasında, ELISA yöntemiyle (Premier™ Rotaclone® EIA; Meridian Bioscience, ABD) rotavirüs pozitifliğini 0-5 yaş arası akut gastroenteritli 982 çocuk hastada %19.6 olarak bulmuşlardır[25]. Buna göre ülkemizde farklı yıllarda enzim-bağlı yöntemlerle rotavirüs antijeni araştıran testler ile yapılan rotavirüs sıklığı çalışmalarında oldukça benzer sonuçlar alındığı görülmektedir. Afrad ve arkadaşları, Haziran 2006-Mayıs 2012 tarihleri arasında Bangladeş’te yaptıkları çalışmada[26] 9678 diyareli hastadan alınan dışkı örneklerinin %20.3’ünde ELISA (Dakopatts; Kopenhag, Danimarka) ile rotavirüs pozitifliği bulmuşlardır. Çin’de Tian ve arkadaşları[27], 2011-2016 yılları arasında 0-5 yaş arası diyareli çocuklarda ELISA (ProSpectT Rotavirus microplate assay; ThermoFisher, ABD) ile 3668 dışkı örneğini incelediklerinde, %20.8’inde rotavirüs pozitifliği tespit etmişlerdir. Bu çalışmalarda ve bizim çalışmamızda, hastaların rotavirüs aşısı olup olmadıkları bilinmemektedir. Rotavirüs aşısı henüz ülkemizde ulusal aşı programında yer almasa da, son 10 yıldır ülkemizde kullanımdadır ve ailelerin bir kısmı çocuklarına rotavirüs aşısı yaptırmaktadır ancak net bir veri bulunmamaktadır.
Rotavirüs antijeni saptanması için, DSÖ’nün 2018 rehberinde[28] Premier™ Rotaclone®, ProSpecT™ ve RIDASCREEN® kitleri önerilmektedir. Bu testlerin duyarlılıkları %75-82, özgüllükleri %100 olarak saptanmıştır[28]. Çalışmamızda Premier™ Rotaclone® (Meridian Biosciences; Cincinnati, Ohio, ABD) ELISA kiti ile pozitif bulunan örneklerin tamamında PCR ile de pozitiflik elde edilmiştir. Bu kitin kullanıldığı çalışmalarda da gördüğümüz gibi, elde edilen sonuçların rotavirüsün tanısında kullanılan PCR gibi güvenilir moleküler yöntemlerle uyum gösterdiğini düşünmekteyiz.
Çalışmamızda kadın hastaların %18.5’i, erkek hastaların %15.7’si pozitif olarak saptanmış ve bu çalışmalara benzer şekilde cinsiyetler arasında rotavirüs pozitifliği istatistiksel olarak ilişkili bulunmamıştır (p= 0.431). Bulut ve arkadaşlarının Ağustos 2012-Temmuz 2015 tarihleri arasında yaptığı bir çalışmada[29] 0-5 yaş arası çocuklardan toplanan 107 dışkının 83’ünde PCR ile rotavirüs pozitif bulmuş ve bunların 53 (%63.8)’ünün kadın, 30 (%36.1)’unun erkek olduğu saptanmıştır. Çalışmalarında cinsiyete göre rotavirüs pozitifliği istatistiksel olarak anlamlı bulunmamıştır. Burkina Faso’da Bonkoungou ve arkadaşlarının Kasım 2008-Şubat 2010 tarihleri arasında 0-5 yaş arası 447 çocukta yaptığı çalışmada[30] kadınlardan daha fazla erkek olduğu fakat hastalar arasında istatistiksel olarak cinsiyet farkının anlamlı olmadığı görülmüştür.
RV saptanma oranları yaş gruplarına göre incelendiğinde, en yüksek 25-36 aylık (%36.1) çocuklarda olduğu görülmüştür. Bu yaş grubunun kreşe başlama yaşı olması ve elle virüs bulaşının yaygın olması nedeniyle beklenen bir sonuç olarak karşımıza çıkmıştır. Bu yaş grubunu %23.7 ile 13-24 aylık çocuklar takip etmiştir. Güreser ve arkadaşları, Ocak 2013-Eylül 2014 yılları arasında Çorum’da yaptıkları çalışmada31 0-18 yaş arası çocuklarda, rotavirüsün en sık 7-24 ay (%22) ve 25 ay-4 yaş (%21.2) arasında, en az 5-10 yaş (%14.8) ve 11-17 yaş (%3.1) arasında görüldüğü saptanmıştır. Kırdar ve arkadaşları[32], Aydın’da Ocak-Aralık 2013 tarihleri arasında akut gastroenteritli 0-5 yaş arası 502 çocuğun %15’inde immünokromatografik yöntemle RV saptamışlar ve en sık 12-24 aylık bebeklerde olduğunu görmüşlerdir. Borsa ve arkadaşları, Mayıs 2010-Nisan 2011 tarihleri arasında 0-5 yaş arası 944 çocukta yaptıkları çalışmada33 immünokromatografik yöntemle %19.9 oranında pozitiflik bulmuşlar ve pozitifliğin en sık 12-24 aylık çocuklarda (%28.2) olduğunu saptamışlardır. Çalışmamızda, yaş ilerledikçe RV pozitifliğinin azaldığı gözlenmiştir. En düşük pozitiflik 19-65 yaş (%6.8) arasında saptanırken, 65 yaşın üzerinde (%15.4) tekrar yükseldiği görülmüştür. Yaşlı popülasyonda immün sistemin zayıflaması ve antikor yanıtının kaybolmuş olabileceği gibi etkiler olsa da, çalışmamızdaki bu yaş grubunda az sayıda hasta (n= 13) bulunması nedeniyle rotavirüs sıklığının artmasını bu duruma bağlamak doğru bir yorum olmayabilir.
Çalışmamızda rotavirüs pozitif olgular, tüm mevsimlerde saptanmakla birlikte en sık ilkbaharda görülmüştür. Mevsimlere göre rotavirüs pozitifliği arasında istatistiki olarak anlamlı ilişki bulunmuştur (p< 0.05). Doğan ve arkadaşları, Temmuz 2012-Temmuz 2013 tarihleri arasında, Gaziantep’te yaptıkları çalışmada[34] pozitifliğin en fazla kış (%17.1), ikinci sıklıkla ilkbahar (%13.3) mevsiminde olduğunu tespit etmişler; mevsimlere göre rotavirüs pozitifliği arasında anlamlı ilişki bulmuşlardır. Konca ve arkadaşları, Mart 2012-Şubat 2013 tarihleri arasında Adıyaman’da yaptıkları çalışmada[35] rotavirüsün en sık sonbahar mevsiminde görüldüğünü saptamışlardır. Sugeçti ve arkadaşları, Ocak 2014-Aralık 2014 tarihleri arasında Zonguldak’ta yaptıkları çalışmada[36] rotavirüs pozitifliğinin en sık ilkbaharda (%37.2) olduğunu, mevsimlere göre rotavirüs pozitifliği bakımından anlamlı ilişki olmadığını göstermişlerdir. Rotavirüs enfeksiyonlarının bu çalışmalarda da gösterildiği gibi sonbahardan ilkbahara kadar enfeksiyonlara sebep olduğu gösterilmiştir. Ancak yine bazı çalışmalarda[37],[38] en sıklıkla bu üç mevsimde görüldüğü belirtilse de, rotavirüs aslında tüm yıl boyunca hastalık etkeni olabilmektedir.
Dünyada farklı kıtalarda genotiplerin sıklığında değişiklik görülebilmekte, yeni görülmeye başlayan farklı genotipler yıllar içinde ortaya çıkabilmektedir. Türkiye’nin coğrafi konumu, komşu ülkelerdeki genotiplerin ülkemize yayılmasında ve görülen genotiplerin yıllara göre değişim göstermesinde önemli bir rol oynamaktadır. Dünyada en sık görülen rotavirüs genotipleri 1995’ten önce G1, G2, G3 ve G4 iken, 1995’ten sonra G9 genotipi ortaya çıkmıştır[39]. Ülkemizde ise yeni yapılan çalışmalarda G1 ve G9 sıklığının değiştiği ancak en yaygın görülen beş genotip içinde her ikisinin de yer aldığı saptanmıştır[10],[11]. Günümüzde dünya genelinde G tiplerinden G1, G2, G3, G4, G9, G12 ve P tiplerinden P[4], P[6], P[8] en sık görülen rotavirüs genotipleri olarak karşımıza çıkmaktadır. Çalışmamızda P genotipleri içinde dünyada ve ülkemizde de olduğu gibi en sık P[8] genotipi saptanmıştır.
Genotip kombinasyonlarından G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] ve G12P[8] dünyada görülen genotiplerin %90’ını oluşturmaktadır[40]. Ülkemizde de bu genotip kombinasyonları sık görülmekte ancak yıllar içinde en sık görülen genotipler değişebilmektedir. Durmaz ve arkadaşlarının 2012-2014 yılları arasında, 0-5 yaş arası çocukları kapsayan, Türkiye genelinde 23 ilde, 35 farklı hastanede gerçekleştirdikleri sürveyans çalışmasında[11] antijen pozitif bulunan 2102 örneğin 1644 (%78.2)’ünde PCR ile rotavirüs pozitif bulunmuştur; en yaygın genotip kombinasyonu G9P[8] (%40.5) iken bunu sırasıyla G1P[8] (%21.6), G2P[8] (%9.3), G2P[4] (%6.5), G3P[8] (%3.5) ve G4P[8] (%3.4)’in takip ettiği görülmüştür. Durmaz ve arkadaşlarının Eylül 2014-Ağustos 2016 tarihleri arasında 15 ilde, 20 farklı hastanede gerçekleştirdikleri sürveyans çalışmasında[10] ise, akut gastroenterit nedeniyle yatan 0-5 yaş arası çocukları kapsayan, 1639 rotavirüs antijeni pozitif dışkı örneğinin 1396 (%85.3)’sında PCR ile rotavirüs pozitifliği bulmuşlardır. En yaygın genotipler sırasıyla G1P[8] %24.6, G3P[8] %19.6, G9P[8] %12.2, G2P[4] %9.5, G2P[8] %6.5 ve G4P[8] %4.8 olarak bulunmuştur.
Çalışmamızda Türkiye’de yapılan çoğu çalışmaya benzer şekilde en sık genotip kombinasyonu olarak G1P[8] (%17.2) saptanmıştır. Durmaz ve arkadaşları 2012-2014, Bulut ve arkadaşları 2012-2015, Azaran ve arkadaşlarının 2015-2016 yılları arasında en sık saptadıkları G9P[8] genotipini dördüncü sıklıkta (%6.16); Meral ve arkadaşlarının 2009-2010, Luchs ve arkadaşlarının 2012-2014 yılları arasında en sık bulduğu G3P[8]’i, bizim çalışmamızda ikinci sıklıkta tespit edilmiştir[11],[29],[41],[42]. Rajendran ve arkadaşlarının en sık bulduğu G2P[4] genotip kombinasyonu çalışmamızda az sıklıkta görülmüş; Brezilya ve Belçika’da aşılamadan sonra artış gösteren G2 genotipi çalışmamızda beşinci sıklıkta tespit edilmiştir[43]. Konstantopoulos ve arkadaşlarının 2008-2010, Çataloluk ve arkadaşlarının 2000-2002 yılları arasında en sık saptadığı G4P[8] genotipi ise yine daha az sıklıkta görülmüştür[44],[45].
G12 genotipi, özellikle gelişmekte olan ülkelerde yapılan çalışmalarla benzer oranda bizim çalışmamızda da yüksek saptanmıştır. Türkiye’de de daha önce yapılan çalışmalara göre daha yüksek oranda G12 genotipi (%26) saptamış bulunmaktayız. Çalışmamıza geniş yaş aralığında hasta grubu alınmış ve genotip G12 en sık 6-12 yaş grubunda görülmüştür (Bulgularda verilmemiştir). Yüksek G12 oranının beş yaş üstü grupta saptanması, ülkemizde G12 ile henüz karşılaşılmaya başlandığının ve son yıllarda artışta olduğunun bir göstergesidir. Dünyada çok sayıda yayında G12 genotipi bildirilmesine[46],[47],[48],[49] rağmen Türkiye’de yapılan çalışmalar çok az sayıdadır. Aydın ve arkadaşlarının Ocak 2012-Kasım 2013 tarihleri arasında Erzurum’da, 0-5 yaş arası çocuklarda yaptıkları çalışmada[50] G1P[8] en sık (%42.2) görülen genotipken, G9P[8] (%21.1) ve G12P[6] (%11)’nın onu takip ettiğini, G12P[8]’in %4.6 oranında olduğunu saptamışlardır. Durmaz ve arkadaşlarının 2012-2014 yılları arasında yaptığı Türkiye geneli rotavirüs sürveyans çalışmasında[10] G12P[8] (%0.42), G12P[6] (%0.12), G12P[11] (%0.12), G12P[6][8] (%0.06) G12P[nt] (%0.06); 2014-2016 yıllarında yaptıkları sürveyans çalışmasında[11] G12P[8] %0.64, G12P[6] %0.21, G12P[nt] %0.14 oranında saptamışlardır. Çalışmamızda da, G12P[8] (%11.1) ve G12P[6] (%4.9) kombinasyonları saptanmıştır. Son yıllarda dünya genelinde görülen G12 tiplerindeki artış ülkemize de yansımaya başlamıştır. Türkiye’de G12 tipini kapsayan çalışmaların az sayıda olması nedeniyle ülkemizdeki moleküler epidemiyolojik çalışmalara G12 genotipinin eklenmesinin ve araştırılmasının önemli olduğu düşüncesindeyiz.
Sığırlarda yaygın şekilde görülen G10 genotipinin, insanlarda da gastrointestinal enfeksiyonlara neden olduğu bildirilmiştir. İnsanlardan izole edilen G10’un moleküler incelenmesi sonucunda, hayvanlardaki rotavirüslerin insandakilere anlamlı benzerliği ortaya çıkmış ve bu zoonotik geçişi düşündürmüştür[51]. İnsan dışkısında G10 genotiplerinin son zamanlarda Afrika ve Hindistan’da ortaya çıktığı saptanmıştır[22]. Genellikle G10 ile ilişkili P tiplerinin P[8], P[4], P[11] ve P[6] olduğu görülmüştür[52]. Santos ve arkadaşlarının 1989-2004 yılları arasında beş kıtada 52 ülkeden bildirilen 124 çalışmadan yaptıkları derlemede[53] Asya kıtasında 44 olguda G10P[11], bir olguda G10P[14]; Güney Amerika’da bir olguda G10P[9] saptandığını belirtmişlerdir. Durmaz ve arkadaşlarının, 2012-2014 ve 2014-2016 tarihleri arasında yaptıkları sürveyans çalışmalarında[10],[11] sırasıyla G10P[8] (%0.3), G10P[4][8] (%0.06), G10P[4] (%0.14), G1G10P[4] (%0.06) genotip kombinasyonlarını bulmuşlardır. Çalışmamızda özellikle aradığımız diğer bir genotip olan G10 ise G10G12P[8] (%1.23), G10P[6] (%1.23) kombinasyonları şeklinde %2.46 oranında literatürdeki çalışmalara benzer şekilde az sıklıkta saptanmıştır.
Ülkemizde kullanılan aşılar G9, G10, G12 genotiplerini içermemektedir. Kullanımda olan aşılar, çapraz reaksiyonla aşı içeriğinde olmayan genotiplere karşı da bir miktar koruyuculuk göstermekle birlikte, daha yüksek koruyuculuk sağlanması için epidemiyolojik çalışmaların artırılarak ülkemize en uygun aşı profilinin oluşturulması sağlanmalıdır.
ETİK KURUL ONAYI
Bu çalışma, Gazi Üniversitesi Etik Komisyonunun onayı ile gerçekleştirildi (Tarih: 19.01.2017 ve Karar No: E.19037).
ÇIKAR ÇATIŞMASI
Yazarlar bu makale ile ilgili herhangi bir çıkar çatışması bildirmemişlerdir.
KAYNAKLAR
- Greenberg HB, Estes MK. Rotaviruses: from pathogenesis to vaccination. Gastroenterology 2009; 136(6): 1939-51.
- Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z, et al. Nosocomial rotavirus infection in European countries: a review of the epidemiology, severity and economic burden of hospital- acquired rotavirus disease. Pediatr Infect Dis J 2006; 25(1 Suppl): S12-21.
- Glass RI, Bresee J, Jiang B, Parashar U, Yee E, Gentsch J. Rotavirus and rotavirus vaccines. Adv Exp Med Biol 2006; 582: 45-54.
- Parashar UD, Nelson EA, Kang G. Diagnosis, management, and prevention of rotavirus gastroenteritis in children. BMJ 2013; 347: f7204.
- Stelzmueller I, Wiesmayr S, Swenson BR, Biebl M, Goegele H, Margreiter R, et al. Rotavirus enteritis in solid organ transplant recipients: an underestimated problem? Transpl Infect Dis 2007; 9(4): 281-5.
- Troeger C, Khalil IA, Rao PC, Cao S, Blacker BF, Ahmed T, et al. Rotavirus Vaccination and the Global Burden of Rotavirus Diarrhea Among Children Younger Than 5 Years. JAMA Pediatr 2018; 172(10): 958-65.
- Rotavirus vaccines. WHO position paper - January 2013. Wkly Epidemiol Rec 2013; 88(5): 49-64.
- Poelaert D, Pereira P, Gardner R, Standaert B, Benninghoff B. A review of recommendations for rotavirus vaccination in Europe: Arguments for change. Vaccine 2018; 36(17): 2243-53.
- Temel Sağlık İstatistikleri Modülü (TSİM). Available from: http://tsim.saglik.gov.tr/tsim
- Durmaz R, Bakkaloglu Z, Unaldi O, Karagoz A, Korukluoglu G, Kalaycioglu AT, et al. Prevalence and diversity of rotavirus A genotypes cirulating in Turkey during a 2-year sentinel surveillance period, 2014-2016. J Med Virol 2018; 90(2): 229-38.
- Durmaz R, Kalaycioglu AT, Acar S, Bakkaloglu Z, Karagoz A, Korukluoglu G, et al. Prevalence of rotavirus genotypes in children younger than 5 years of age before the introduction of a universal rotavirus vaccination program: report of rotavirus surveillance in Turkey. PLoS One 2014; 9(12): e113674.
- Dhital S, Sherchand JB, Pokhrel BM, Parajuli K, Shah N, Mishra SK, et al. Molecular epidemiology of Rotavirus causing diarrhea among children less than five years of age visiting national level children hospitals, Nepal. BMC Pediatr 2017; 17(1): 101.
- Islamuddin M, Khan WH, Gupta S, Tiku VR, Khan N, Akdag AI, et al. Surveillance and genetic characterization of rotavirus strains circulating in four states of North Indian children. Infect Genet Evol 2018; 62: 253-61.
- Pongsuwanna Y, Guntapong R, Chiwakul M, Tacharoenmuang R, Onvimala N, Wakuda M, et al. Detection of a human rotavirus with G12 and P[9] specificity in Thailand. J Clin Microbiol 2002; 40(4): 1390-4.
- Esona MD, Page NA, Akran VA, Armah GE, Steele AD. Characterization of 2 human genotype G10 rotavirus strains, 3008CM and 1784/CI/1999, isolated in Cameroon and Cote d’Ivoire during the 1999-2000 rotavirus season. J Infect Dis 2010; 202(Supp l): S212-9.
- Santos N, Lima RC, Pereira CF, Gouvea V. Detection of rotavirus types G8 and G10 among Brazilian children with diarrhea. J Clin Microbiol 1998; 36(9): 2727-9.
- Armah GE, Hoshino Y, Santos N, Binka F, Damanka S, Adjei R, et al. The global spread of rotavirus G10 strains: Detection in Ghanaian children hospitalized with diarrhea. J Infect Dis 2010; 202(Supp l): S231-8.
- World Health Organization (WHO). Manual of rotavirus detection and characterization methods. Geneva: World Health Organization, 2009. Available from: http://www.who.int/iris/handle/10665/70122
- Gouvea V, Glass RI, Woods P, Taniguchi K, Clark HF, Forrester B, et al. Polymerase chain reaction amplification and typing of rotavirus nucleic acid from stool specimens. J Clin Microbiol 1990; 28(2): 276-82.
- Gunasena S, Nakagomi O, Isegawa Y, Kaga E, Nakagomi T, Steele AD, et al. Relative frequency of VP4 gene alleles among human rotaviruses recovered over a 10-year period (1982-1991) from Japanese children with diarrhea. J Clin Microbiol 1993; 31(8): 2195-7.
- Uchida R, Pandey BD, Sherchand JB, Ahmed K, Yokoo M, Nakagomi T, et al. Molecular epidemology of rotavirus diarrhea among children and adults in Nepal: detection of G12 strains with P[6] or P[8] and a G11P[25] strain. J Clin Microbiol 2006; 44(10): 3499-505.
- Iturriza-Gomara M, Kang G, Gray J. Rotavirus genotyping: keeping up with an evolving population of human rotaviruses. J Clin Virol 2004; 31(4): 259-65.
- Kasifoglu N, US T, Aslan FG, Akgun Y. 2005-2011 Yılları Arasında Saptanan Rotavirus Antijen Pozitiflikleri. Türk Mikrobiyol Cem Derg 2011; 41(3): 111-5.
- Samanci S, Kosker M, Celik M, Arac E. Akut Gastroenteritli Çocuk Hastalarda Rotavirüs Enfeksiyonu Sıklığı. Van Tıp Derg 2018; 25(4): 441-444.
- Alp Avci G, Akbaba M. Beş Yaşın Altındaki Akut Gastroenteritli Çocuklarda Rotavirüs, Enterik Adenovirüs ve Norovirüs İnsidansı. Türk Mikrobiyol Cem Derg 2018; 48(4): 264-72.
- Afrad MH, Hassan Z, Farjana S, Moni S, Barua S, Das SK, et al. Changing profile of rotavirus genotypes in Bangladesh, 2006-2012. BMC Infect Dis 2013; 13: 320.
- Tian Y, Chughtai AA, Gao Z, Yan H, Chen Y, Liu B, et al. Prevalence and genotypes of group A rotavirus among outpatient children under five years old with diarrhea in Beijing, China, 2011-2016. BMC Infect Dis 2018; 18(1): 497.
- WHO. Vaccine-Preventable Diseases, Surveillance Standards, Rotavirus, 2018.
- Bulut Y, Yenisehirli G, Durmaz R. Molecular Epidemiology of Rotavirus Strains in Under Five Children. Indian J Pediatr 2018; 85(5): 364-8.
- Bonkoungou IJ, Sanou I, Bon F, Benon B, Coulibaly SO, Haukka K, et al. Epidemiology of rotavirus infection among young children with acute diarrhoea in Burkina Faso. BMC Pediatr 2010; 10: 94.
- Güreser A, Karasartova D, Tasci L, İlkay BoyaciogLu Z, Taylan Ozkan A. Rotavirus and Adenovirus Frequency in Children with Acute Gastroenteritis. Flora 2017; 22(2): 58-6.
- Kırdar S, Kahyaoglu F, Yazıcı V, Aydın N. Investigation of The Agents of Viral Gastroenteritis by PCR İn Stool Specimens with Rota/Adenovirus Positive by Antigen Test. Journal of BSHR 2017; 1(3): 88-93.
- Borsa BA, Bahar Tokman H, Çağatay P. Mardin kadin doğum ve çocuk hastaliklari hastanesi’nde 0-5 yaş arasi akut gastroenteritli çocuklarda rotavirüs ve adenovirüs sıklığının belirlenmesi. Ankem Derg 2013; 27(2): 75-9.
- Dogan Y, Eksi F, Karslıgil T, Bayram A. Akut Gastroenteritli Hastalarda Rotavirüs ve Adenovirüs Varlığının Araştırılması. Türk Mikrobiyol Cem Derg 2014; 44(1): 18-22.
- Konca C, Tekin M, Akgun S, Bulbul M, Coban M, Kahramaner Z. Prevalence of Rotavirus in Children with Acute Gastroenteritis, Seasonal Distribution, and Laboratory Findings in the Southeast of Turkey. J Pediatr Inf 2014; 8: 7-11.
- Sugeçti S, Çelen U, Azaklı Taşkın P, Yenice S, Koçer F. Akut Gastroenteritli Çocuklarda İmmünokromatografik Olarak Enterik Adenovirus ve Rotavirus Antijen Varlığının Mevsimsel Prevelansı. Çocuk Enfeksiyon Dergisi 2015; 9(4): 161-5.
- Custodio H, Masnita-Iusan C, Wludyka P, Rathore MH. Change in rotavirus epidemiology in northeast Florida after the introduction of rotavirus vaccine. Pediatr Infect Dis J 2010; 29(8): 766-7.
- Tate JE, Panozzo CA, Payne DC et al. Decline and change in seasonality of US rotavirus activity after the introduction of rotavirus vaccine. Pediatrics 2009; 124(2): 465-71.
- Matthijnssens J, Heylen E, Zeller M, Rahman M, Lemey P, Van Ranst M. Phylodynamic analyses of rotavirus genotypes G9 and G12 underscore their potential for swift global spread. Mol Biol Evol 2010; 27(10): 2431-6.
- Crawford SE, Ramani S, Tate JE, Parashar UD, Svensson L, Hagbom M, et al. Rotavirus infection. Nat Rev Dis Primers 2017; 3: 17083.
- Azaran A, Makvandi M, Teimoori A, Ebrahimi S, Heydari F, Nikfar R. Distribution of Rotavirus Genotypes Circulating in Ahvaz, Iran in 2016. Iran Biomed J 2018; 22(2): 107-16.
- Meral M, Bozdayi G, Ozkan S, Dalgic B, Alp G, Ahmed K. [Rotavirus prevalence in children with acute gastroenteritis and the distribution of serotypes and electropherotypes]. Mikrobiyol Bul 2011; 45(1): 104-12.
- Rajendran P, Kang G. Molecular epidemiology of rotavirus in children and animals and characterization of an unusual G10P[15] strain associated with bovine diarrhea in south India. Vaccine 2014; 32 (Suppl 1): A89-94.
- Konstantopoulos A, Tragiannidis A, Fouzas S, Kavaliotis I, Tsiatsou O, Michailidou E, et al. Burden of rotavirus gastroenteritis in children <5 years of age in Greece: hospital-based prospective surveillance (2008-2010). BMJ Open 2013; 3(12): e003570.
- Cataloluk O, Iturriza M, Gray J. Molecular characterization of rotaviruses circulating in the population in Turkey. Epidemiol Infect 2005; 133(4): 673-8.
- Islamuddin M, Khan WH, Gupta S, Tiku VR, Khan N, Akdag AI, et al. Surveillance and genetic characterization of rotavirus strains circulating in four states of North Indian children. Infect Genet Evol 2018; 62: 253-61.
- Luchs A, Cilli A, Morillo SG, Gregorio Dde S, de Souza KA, Vieira HR, et al. Detection of the emerging rotavirus G12P[8] genotype at high frequency in brazil in 2014: Successive replacement of predominant strains after vaccine introduction. Acta Trop 2016; 156: 87-94.
- Azaran A, Makvandi M, Teimoori A, Ebrahimi S, Heydari F, Nikfar R. Distribution of Rotavirus Genotypes Circulating in Ahvaz, Iran in 2016. Iran Biomed J 2018; 22(2): 107-16.
- Moure UAE, Banga-Mingo V, Gody JC, Mwenda JM, Fandema J, Waku-Kouomou D, et al. Emergence of G12 and G9 rotavirus genotypes in the Central African Republic, January 2014 to February 2016. BMC Res Notes 2018; 11(1): 5.
- Aydin H, Aktas O. Rotavirus genotypes in children with gastroenteritis in Erzurum: first detection of G12P[6] and G12P[8] genotypes in Turkey. Prz Gastroenterol 2017; 12(2): 122-7.
- Tacharoenmuang R, Komoto S, Guntapong R, Ide T, Singchai P, Upachai S, et al. Characterization of a G10P[14] rotavirus strain from a diarrheic child in Thailand: Evidence for bovine-to-human zoonotic transmission. Infect Genet Evol 2018; 63: 43-57.
- Jain S, Vashistt J, Changotra H. Rotaviruses: is their surveillance needed? Vaccine 2014; 32(27): 3367-78.
- Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine. Rev Med Virol 2005; 15(1): 29-56.
İletişim (Correspondence):
Prof. Dr. Gülendam Bozdayı,
Gazi Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı,
Tıbbi Viroloji Bilim Dalı
Beşevler, Ankara, Türkiye.
E-posta (E-mail):gbozdayi@hotmail.com