Hastane Enfeksiyonu Etkeni Olan Metisiline Dirençli Staphylococcus
aureus Suşlarında
qacA/B Dezenfektan Direnç Genlerinin Varlığı ve Dezenfektanlara İn Vitro
Duyarlılıklarının Araştırılması*
Investigation
of the Presence of Disinfectant Resistance Genes qacA/B in Nosocomial
Methicillin-Resistant
Staphylococcus aureus Isolates and Evaluation of Their In
Vitro Disinfectant Susceptibilities
Şadiye
Berna AYKAN1, Kayhan ÇAĞLAR1, Evren Doruk ENGİN2,
Ayşe Bilge SİPAHİ1, Nedim SULTAN1,
Meltem YALINAY ÇIRAK1
1 Gazi Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Ankara.
1 Gazi University Faculty of Medicine, Department of Medical Microbiology, Ankara, Turkey.
2 Ankara Üniversitesi Biyoteknoloji Enstitüsü, Ankara.
2 Ankara University Biotechnology Institute, Ankara, Turkey.
* Bu çalışma, 6. Sterilizasyon ve Dezenfeksiyon Kongresi (1-5 Nisan 2009, Antalya)'nde poster olarak sunulmuştur.
ÖZET
Hastane enfeksiyonlarına neden olan mikroorganizmalarda görülen dezenfektan direnci, dezenfektanların hastanelerde yaygın olarak kullanımı ya da önerilen konsantrasyonların altında kullanılmaları gibi yapılan yanlış uygulamalar sonucu gelişebilmektedir. Önemli bir hastane enfeksiyonu etkeni olan metisiline dirençli Staphylococcus aureus (MRSA), antibiyotiklere olduğu gibi dezenfektanlara karşı da dirençli olabilmekte; kuarterner amonyum bileşikleri ve diğer katyonik dezenfektanlara direnç oluşumundan sorumlu, plazmidlerle taşınan qacA/B genlerini bulundurabilmektedir. Bu çalışmada, hastane enfeksiyonu etkeni olan MRSA suşlarında qacA/B direnç genlerinin varlığının araştırılması; bu suşların dezenfektanlara karşı in vitro duyarlılığının incelenmesi ve dezenfektan direnç geni bulunan suşlarda fenotipik direncin belirlenmesi amaçlanmıştır. Çalışmaya, klinik örneklerden izole edilen 69 nozokomiyal MRSA suşu dahil edilmiştir. Araştırmamızda, hastane enfeksiyonu etkeni olarak kabul edilen MRSA izolatlarının %11.6 (8/69)'sında polimeraz zincir reaksiyonu (PCR) ile qacA/B dezenfektan direnç genlerinin varlığı saptanmıştır. Bu genlerin varlığının, fenotipik olarak da dezenfektan direncine yol açıp açmadığı, klorhekzidin ve benzalkonyum klorür gibi dezenfektanlarla bakteriyostatik ve bakterisidal testler yapılarak araştırılmıştır. Bu amaçla, CLSI önerileri doğrultusunda mikrodilüsyon yöntemi ile dezenfektanların minimal inhibitör konsantrasyon (MİK) değerleri belirlenmiş ve ayrıca BS EN 13727:2003 Avrupa standardı doğrultusunda kantitatif süspansiyon testi ile dezenfektanların bakterisidal etkileri araştırılmıştır. İzolatlardaki benzalkonyum klorür ve klorhekzidin MİK değerleri 2-8 µg/ml arasında bulunmuştur. qacA/B geni pozitif bulunan izolatların beş tanesinde MİK değerlerinin daha yüksek olduğu (≥ 4 µg/ml) görülmekle beraber, qacA/B geni pozitif (n= 8) ve negatif (n= 61) saptanan gruplar arasında istatistiksel olarak anlamlı bir fark izlenmemiştir. Kantitatif süspansiyon testinde, klorhekzidin ve benzalkonyum klorürün her ikisinin de %1'lik klinik kullanım konsantrasyonu, qacA/B direnç geni bulunan ve bulunmayan tüm izolatlara bakterisidal etkili bulunmuştur. Sonuç olarak, qacA/B direnç geni taşıyan MRSA izolatlarında, dezenfektanların klinik kullanım konsantrasyonlarında direnç saptanmamış; yüksek MİK değerine sahip olan izolatlar için de bu dezenfektanlar bakterisidal etkili bulunmuştur. Dolayısıyla, direnç genlerinin varlığının ve dezenfektanlara karşı artmış MİK değerlerinin klinik anlamda direnç fenotipine yansımadıkları sonucuna varılmıştır.
Anahtar sözcükler: Metisiline dirençli Staphylococcus aureus; qacA/B geni; dezenfektan direnci; minimal inhibitör konsantrasyon; kantitatif süspansiyon testi.
ABSTRACT
Development of resistance to disinfectant substances in nosocomial microorganisms is an important problem encountered during disinfectant practices. Methicillin-resistant Staphylococcus aureus (MRSA) remains a significant cause of hospital-acquired infections. Besides being resistant to several antimicrobial agents, MRSA strains can also become resistant to some disinfectant substances. Resistance to disinfectant substances may develop due to the misuse of disinfectants. This may either be due to the frequent use of disinfectant substances or use in lower concentrations than recommended. MRSA strains may harbour the qacA/B disinfectant resistance genes that may cause resistance to quarternary ammonium compounds and some cationic disinfectants. These resistance genes are found in plasmids and are responsible for decreased susceptibility or resistance. In this study, a total of 69 nosocomial MRSA strains isolated from clinical specimens in our hospital were tested for disinfectant activity and the presence of qacA/B disinfectant resistance genes in these isolates was investigated by polymerase chain reaction. We determined whether the presence of these genes caused phenotypic resistance to chlorhexidine and benzalkonium chloride by the use of bactericidal and bacteriostatic tests. For this purpose, the minimum inhibitory concentration (MIC) values of these disinfectants against MRSA isolates were detected by microdilution method with the proposals of CLSI, and bactericidal effects of these disinfectants were also detected by using quantitative suspension test according to EN13727:2003 European Standard. It has been found that 11.6% (8/69) of the isolates harbored qacA/B resistance genes. MIC values for chlorhexidine and benzalkonium chloride were found in the range of 2-8 µg/ml. Although it was observed that MIC values were higher in five of the qacA/B gene positive isolates, statistically significant difference was not found between gene positive and gene negative groups. Both 1% chlorhexidine and 1% benzalkonium chloride were found bactericidal against the isolates including the ones carrying the qacA/B resistance genes. It was concluded that the presence of the qacA/B disinfectant resistance genes did not lead to resistance to the disinfectant substances at the concentrations used in clinical practices. Furthermore, tested disinfectants still exhibited bactericidal activity even with high MIC values.
Key words: Methicillin-resistant Staphylococcus aureus; qacA/B gene; disinfectant resistance; minimum inhibitory concentration; quantitative suspension test.
Geliş Tarihi (Received): 10.04.2012 • Kabul Ediliş Tarihi (Accepted): 30.10.2012
GİRİŞ
Hastane enfeksiyonlarının önlenmesinde ve kontrolünde uygun dezenfektanlardan yararlanılmaktadır. Hastane enfeksiyonu etkeni olan mikroorganizmalarda görülen dezenfektan direnci, dezenfeksiyon uygulamalarında karşılaşılan sorunlardan biridir. Bakterilerde 1950-1960'lı yıllarda gösterilmiş olan dezenfektan direncinin giderek arttığı bilinmektedir1. Dezenfektanlara karşı direnç, antibiyotik direncinde olduğu gibi doğal (kromozomal) ve kazanılmış (kromozomlardaki mutasyon, plazmid veya transpozon aracılı) direnç olarak karşımıza çıkmaktadır2,3.
Klinik örneklerden sıklıkla izole edilen ve birçok antibiyotiğe yüksek direnç oranları nedeniyle ciddi hastane enfeksiyonlarına yol açabilen Staphylococcus aureus suşlarında, kuarterner amonyum bileşiklerine direnç oluşumundan sorumlu genler tanımlanmış ve qac (quaternary ammonium compounds) olarak adlandırılmıştır. Bu genler plazmidler üzerinde taşınmaktadır ve çok sayıda biyoside karşı azalmış duyarlılık veya dirençten sorumludur4. Günümüzde qac genlerinin qacA, qacB, qacC, qacD, qacG, qacH ve qacJ olmak üzere farklı tipleri tanımlanmıştır. Bunlar düşük düzeyde katyonik biyosid ve ilişkili antibiyotik direncinden sorumludur1,5. Metisiline dirençli S.aureus (MRSA) suşlarında %5-72 arasında değişen oranlarda bulunan qacA/B geni, yüksek düzeyde dezenfektan ve antiseptik direnci ile ilişkilidir6,7. qacA/B direnç genleri plazmidler üzerinde taşındığı için, bu genlerin bulunması aynı zamanda antibiyotik direnci ile de ilişkili olabilmektedir. qacA/B genleri antiseptik direncine yol açmalarının dışında, aynı zamanda kimyasal olarak birbiriyle ilişkisiz birçok kimyasal maddeye de çapraz direnç oluşturabilir. Bu sebeple MRSA suşlarının direnç geni taşıyıp taşımadığının ve sahip olunan dezenfektan direnç genlerinin fenotipik yansımasının olup olmadığının belirlenmesi, MRSA kaynaklı hastane enfeksiyonlarının önlenmesi açısından önem taşımaktadır. Bu amaçla çalışmamızda, hastane enfeksiyonu etkeni olan MRSA suşlarında dezenfektan direnç genlerinin varlığı araştırılmış; bakterisidal ve bakteriyostatik testlerle MRSA suşlarının klorhekzidin ve benzalkonyum klorüre karşı in vitro duyarlılığı incelenmiş; qacA/B dezenfektan direnç geni bulunan suşlarda bu dezenfektanlara karşı fenotipik direncin olup olmadığı belirlenmiştir.
GEREÇ ve YÖNTEM
Bakteri İzolasyonu
Çalışmaya, Mayıs 2005-Haziran 2006 tarihleri arasında hastanemiz klinik mikrobiyoloji laboratuvarına gönderilen klinik örneklerden izole edilen ve hastane enfeksiyonu etkeni olduğu belirlenen 69 MRSA izolatı dahil edildi. Çalışmada her hastaya ait tek bir izolat kullanıldı. Çalışma öncesi tüm izolatların S.aureus oldukları konvansiyonel yöntemler ve otomatize tanımlama sistemi (API Staph; bioMerieux, Fransa) ile, MRSA olarak tanımlanmış izolatların metisilin direnci ise oksasilin disk difüzyon testi ile doğrulandı. Suşlar, saf kültürlerinden saklama şişelerine (Microbank, Pro-lab, Kanada) alındı ve moleküler, bakteriyostatik ve bakterisidal çalışmalara kadar -30°C'de saklandı.
qacA/B Dezenfektan Direnç Genlerinin Saptanması
Bakterilerden DNA izolasyonu yapılmadan önce, dondurularak saklanmış olan bakteri suşları Mueller Hinton besiyerine (Biolab, Macaristan) pasajlandı ve 37°C'de 24 saat inkübe edilerek canlandırıldı. 1 ml TE (1X TrisEDTA) içerisinde bakteri süspansiyonları hazırlandıktan sonra 6500 rpm'de 5 dakika santrifüj edildi ve üst sıvı atıldı. Bu işlem her bir bakteri için üç kez olmak üzere tekrarlandı. 200 µl TE içerisinde bakteri süspansiyonları hazırlandı ve 98°C'de 20 dakika inkübe edildi. İnkübasyon sonrasında 14.000 rpm'de 10 dakika santrifüj edilerek hücresel atıklar çöktürüldü. DNA'nın bulunduğu üst sıvı temiz tüplere aktarılarak bakterilerden DNA izolasyonu tamamlandı.
Elde edilen DNA'larda qacA/B genlerinin varlığı, qacAB-forward (5'-TGGCTTTACCGGAATTAGTAAGAG-3') ve qacAB-reverse (5'-GTCTTACGTCTAACATTGGAT CAG-3') primerleri kullanılarak polimeraz zincir reaksiyonu (PCR) ile araştırıldı. Primerlerin seçiminde National Centre for Biotechnology Information kor nükleotid veritabanında yer alan X56628 erişim numaralı qacA genini içeren kayıt ile AF053772 erişim numaralı qacB genini içeren kayıtlardan yararlanıldı. İki dizi ClustalW programı yardımıyla global olarak hizalandı. Dizilerin konsensus bölgeleri primer tasarımı için hedef bölge olarak seçildi. Bu bölge, PerlPrimer v1.1.21 programı ile analiz edildi ve 689 baz çifti (bç) uzunluğunda ürün çoğaltacak optimal primer çifti seçildi. PCR işlemi sırasında pozitif kontrol olarak Dr. N. Naguchi (Tokyo Üniversitesi, Japonya) ve Dr. N. Kobayashi (Sapporo Üniversitesi, Japonya) tarafından sağlanan toplam dört adet qacA/B geni pozitif MRSA izolatı, negatif kontrol olarak ise ön deneylerde qacA/B negatif bulunan MRSA suşları ve distile su kullanıldı.
Çalışmaya alınan suşlarda qacA ve qacB genlerinin taranması için 25 µl'lik tepkime hacminde 50 mM potasyum klorür, 10 mM Tris hidroklorür, %0.01 Tween-20, 3 mM magnezyum klorür, her bir deoksinükleotid trifosfattan 0.2 mM, ileri ve geri primerlerden 0.2 µM, yaklaşık 100 ng kalıp DNA eklendi. Termal döngü programı; 94°C'de 2 dakika denatürasyonun ardından 40 döngü boyunca 94°C'de 15 saniye denatürasyon, 56°C'de 1 dakika birleşme ve 72°C'de 1 dakika uzama olarak gerçekleştirildi. Son uzama için tüpler 72°C'de 5 dakika inkübe edildi. Elde edilen amplifikasyon ürünleri, %2'lik agaroz jel kullanılarak 5V/cm voltajda 60 dakika yürütüldü ve etidyum bromür ile boyandıktan sonra 254 nm dalga boyunda ışık kaynağına sahip transillüminatörde görüntülendi. Moleküler ağırlık standardı olarak, karışım haline getirilmiş 100-900, 1200 ve 1500 bç PCR ürünleri kullanıldı (SeeGene Forever Size Marker, ABD); 689 bç uzunlukta ürün çoğaltılan tüpler qacA ve/veya qacB pozitif olarak değerlendirildi.
Bakteriyostatik Etkinin Belirlenmesi
Klorhekzidin (Sigma, Almanya) ve benzalkonyum klorürün (Sigma, Almanya) MRSA izolatları için minimal inhibitör konsantrasyon (MİK) değerleri, CLSI önerileri doğrultusunda mikrodilüsyon yöntemiyle saptandı8. Buna göre mikroplaklarda dezenfektan konsantrasyonu 128 µg/ml ile 0.125 µg/ml arasında olacak şekilde sulandırımlar yapıldı ve test edilecek suşlar, her bir kuyucuğa 5 x 105 koloni oluşturan birim (kob) olacak şekilde inoküle edildi. Mikroplaklar 37°C'de 24-48 saat inkübe edildi ve değerlendirmede bulanıklığın olmadığı son kuyucuk her bakteri için MİK değeri olarak belirlendi. Mikrodilüsyon testleri her iki dezenfektan için tüm suşlarda iki kez tekrarlandı.
Kantitatif Süspansiyon Testi
Dezenfektanların MRSA izolatlarına bakterisidal etkisinin incelenmesinde kantitatif süspansiyon testi Avrupa standardı EN13727:2003 testi kullanıldı9. Bu amaçla, benzalkonyum klorür (Zefiran forte; 100 cc'de 10 g benzalkonyum klorür, İlsan, Türkiye) ve klorhekzidinin (Savlex; %15 setrimid, %1.5 klorheksidin glukonat, Drogsan, Türkiye) klinik kullanımda önerilen %1'lik konsantrasyonlarındaki bakterisidal etkisi tüm suşlar için belirlendi. Standart suşlar olarak Pseudomonas aeruginosa ATCC 15442, S.aureus ATCC 6538 ve Enterococcus hirae ATCC 10541 kullanıldı. Nötralizan olarak her iki dezenfektan için lesitin 30 g/L (Nattermann, Almanya), Tween 80 30 g/L (Merck, Almanya) ve Saponin 30 g/L (Fluka, İsviçre) kullanıldı. Kontrol deneylerinde, dezenfektan dışındaki test koşullarının letal etkisinin olmadığı, kullanılan nötralizanın toksik etkisinin bulunmadığı ve dezenfektanı nötralize ettiği gösterildi. Bu amaçla, kontrol bakterileri kullanılarak hazırlanan test süspansiyonu, 10-3 ile 10-5 oranında seyreltilerek validasyon süspansiyonu hazırlandı. İlk aşamada 1 ml kirletici madde + 1 ml validasyon süspansiyonu + 8 ml sert su kullanılarak sert su ve kirletici maddenin mikroorganizma sayısını azaltmadığı, yani letal etkisi olmadığı gösterildi. İkinci aşamada nötralizan, validasyon süspansiyonu ile bekletildi ve nötralizanın letal olmadığı gösterildi. Üçüncü aşamada ise 1 ml kirletici madde + 1 µl dilüent + 8 ml dezenfektan bir tüpte karıştırıldı. Buradan 1 ml alınarak 8 ml nötralizan ile muamele edildi; 5 dakika sonra üzerine 1 ml validasyon süspansiyonu eklendi ve bir süre sonra triptik soy agar (TSA) besiyerine ekim yapıldı. Böylece nötralizanın dezenfektanı nötralize ettiği gösterildi. Kantitafif süspansiyon testinde, bakterilerin test süspansiyonu 1.5 x 108 - 5 x 108 kob/ml olarak hazırlandı ve deneyler kirletici madde varlığında (3 g/L sığır albumini ve 3 ml/L yıkanmış eritrosit süspansiyonu) gerçekleştirildi. Bakteri solüsyonu ile dezenfektan bir tüp içinde 1 ve 5 dakika bekletildikten sonra, buradan bir miktar alınarak başka bir tüp içindeki nötralizan solüsyon içine aktarıldı ve ardından da TSA plaklarına ekimleri yapıldı. Dezenfektanların bakterisidal etkileri, 24 saat inkübasyon sonrasında TSA besiyerinde canlı kalan bakteri sayısı belirlenerek değerlendirildi. Başlangıçtaki koloni sayısıyla karşılaştırıldığında, inkübasyon sonundaki koloni sayısındaki 5 logaritmalık azalma bakterisidal etki olarak kabul edildi. Tüm deneyler ikişer kez tekrarlandı.
İstatistiksel Analiz
qacA/B direnç geni bulunan ve bulunmayan izolatların MİK değerleri arasındaki farkın önemi Mann-Whitney U testi ile belirlendi.
BULGULAR
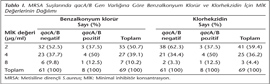
Çalışmamızda, hastane enfeksiyonu etkeni olan 69 MRSA suşunun 8 (%11.6)'inde qacA/B dezenfektan direnç geni saptanmıştır (Resim 1). Bu sekiz suşun üçünde benzalkonyum klorür ve klorhekzidin MİK değerleri, her iki dezenfektan için de benzer olarak 2 µg/ml, dördünde 4 µg/ml ve birinde 8 µg/ml olarak bulunmuştur (Tablo I). MRSA suşlarında qacA/B gen varlığına göre benzalkonyum klorür ve klorheksidin MİK değerlerinin dağılımı Tablo I'de gösterilmiştir. Sonuçlar incelendiğinde, qacA/B geni pozitif bulunan izolatların beşinde her iki dezenfektana ait MİK değerlerinin daha yüksek olduğu görülmekle beraber, qacA/B geni pozitif ve negatif gruplar arasında istatistiksel olarak anlamlı bir fark saptanmamıştır.
Bakterisidal etkinin incelendiği kantitatif süspansiyon testi sonuçlarına göre, her iki dezenfektanın klinik kullanımda önerilen %1'lik konsantrasyonları, qacA/B geni pozitifliği saptanan MRSA suşları da dahil olmak üzere çalışılan tüm izolatlarda bakterisidal etkili bulunmuştur. Buna göre, çalışmada kullanılan dezenfektanların, yüksek MİK değerlerine (≥ 4 µg/ml) sahip izolatlara da öldürücü etki gösterdiği izlenmiştir.
TARTIŞMA
Hastane enfeksiyonu etkeni MRSA'lar, farklı antibiyotiklere dirençli olduğu gibi dezenfektanlara da dirençli olabilmektedir. Dirençli stafilokokların ve diğer dirençli bakterilerin hastanelerde yaygın olarak bulunmasının bir sebebinin antibiyotik kullanımına ek olarak dezenfektan ve antiseptiklerin hastane ortamlarında sık kullanımına bağlı olduğu ileri sürülmektedir10. Hastanelerde dezenfektanların gereksiz, fazla veya önerilen konsantrasyonun altında kullanılması ya da bakterilerin dezenfektanın rezidüel konsantrasyonlarına maruz kalması bu maddelere direnç gelişmesine yol açabilmektedir11,12. Kuarterner amonyum bileşikleri gibi katyonik dezenfektanların yaygın kullanımının çoklu ilaç dışa atım pompasına sahip olan ve qacA/B genlerini bulunduran bakterilerin seçimine neden olduğu düşünülmektedir1. Plazmidlerle taşınan qacA/B genleri, bazı katyonik dezenfektanlara ve biguanidlere (klorhekzidin) karşı direnç gelişimi ile ilişkilidir13. Klorhekzidin gibi katyonik dezenfektanların hastanelerde yaygın olarak kullanımının, qacA/B direnç genlerini taşıyan bakterilerin seçilmesine ve artışına yol açtığı da ileri sürülmektedir5.
Çalışmamızda, hastane enfeksiyonu etkeni olarak izole edilen MRSA suşlarının %11.6'sında qacA/B genlerinin varlığı saptanmıştır. Bu genlerin prevalansı farklı ülkelerden yapılan çalışmalarda değişik oranlarda bildirilmiştir6,7,14,15,16,17. Mayer ve arkadaşları6, Avrupa'nın farklı şehirlerinden topladıkları 297 MRSA suşunun %63'ünde, 200 metisiline duyarlı S.aureus (MSSA) suşunun ise %12'sinde qacA/B varlığını bildirmişlerdir. Araştırıcılar, yüksek qacA/B gen prevalansının, enfeksiyon önleyici ajanların hastanelerde yaygın kullanımının zorunlu seçici etkisinden kaynaklandığını belirtmişler; qacA/B direnç genlerinin MRSA'larda daha yüksek oranda saptanmasını ise, bu genlerin çoklu ilaç direnci taşıyan plazmidlerde yaygın olarak bulunmasına bağlamışlardır6. Yapılan diğer çalışmalarda da qac genleri pozitifliği, Tunus'ta17 S.aureus suşlarında %12.8; Japonya'da14 MRSA suşlarında %10.2; Kanada'da18 MRSA suşlarında %2 ve Asya ülkelerinde7 MRSA suşlarında %41.6 (372/894) oranında bildirilmiştir. Asya ülkelerinde yapılan çalışmada, bu genlerin bulunma sıklığının %5 (Çin) ile %72 (Singapur) arasında olmak üzere oldukça değişkenlik gösterdiği izlenmiştir7. Ülkemizde ise bu konuda çok az veri bulunmakta olup, yapılan bir çalışmada, MRSA'larda qacA/B direnç genine rastlanmadığı, ancak MSSA izolatlarında %2.2 oranında bulunduğu bildirilmiştir19. Bu konuda geniş ölçekli çalışmaların yapılması, qacA/B genlerinin ülkemizin farklı bölgelerindeki prevalansı hakkında daha sağlıklı bilgi edinilmesini sağlayacaktır.
Literatürde, hem direnç genlerinin varlığının hem de dezenfektanın klinik kullanımına karşı bir direnç bulunup bulunmadığının birlikte araştırıldığı az sayıda çalışma mevcuttur. Yapılan çalışmalarda genellikle direnç genleri ile birlikte dezenfektanların MİK değerlerine bakılmış, dezenfektanın letal etkileri ise araştırılmamıştır16,20,21,22. Bu konudaki bilgiler sınırlı olup genellikle sadece dezenfektanların MİK değerlerine bakılarak yorumlar yapılmaktadır. Ancak dezenfektana karşı yüksek MİK değeri saptanmış olsa bile, bakteri o dezenfektanın kullanım konsantrasyonuna karşı direnç göstermeyebilir. Zira dezenfektanın önerilen kullanım konsantrasyonu, pratikte MİK değerlerinin çok üzerindedir ve dolayısıyla dezenfektana karşı gerçek bir direnç olmayabilir. Smith ve arkadaşları23 benzalkonyum klorür ve klorhekzidinin MRSA izolatlarındaki minimal bakterisidal konsantrasyonunu (MBC) mikrodilüsyon yöntemiyle araştırmışlar; qac geni taşıyan izolatlardaki MBC değerlerini taşımayanlara göre anlamlı düzeyde yüksek bulmuşlardır. Ancak bulunan MBC değerleri bu dezenfektanlar için önerilen klinik kullanım konsantrasyonunun çok altındadır23. Bir başka deyişle, eğer dezenfektanların kullanım konsantrasyonları doğru şekilde uygulanırsa bu bakterilerde bir direnç görülmeyecek ve izolatların hepsi ölecektir. Dolayısıyla, dezenfektanların klinik kullanım konsantrasyonlarında bakteriler üzerindeki öldürücü etkilerinin belirlenmesi önem taşımaktadır. Bu amaçla kullanılan yöntem ise kantitatif süspansiyon testidir24,25,26. Bu test bakterilerdeki dezenfektan direncini mikrodilüsyon testine göre çok daha doğru olarak belirler; zira kantitatif süspansiyon testinde dezenfektanlar klinik kullanımda olduğu gibi gerçek kullanım konsantrasyonlarında kullanılmaktadır. Bu yöntem ile, dezenfektanın bakteriye letal etki göstermediğinin saptanması, bakterilerde gerçek bir biyosid direncini ifade etmektedir. Bizim çalışmamızda da, qacA/B direnç genlerinin prevalansının belirlenmesinin yanında, klorhekzidin ve benzalkonyum klorürün MRSA izolatlarına karşı MİK değerleri ve ayrıca kantitatif süspansiyon testi ile öldürücü etkileri araştırılmıştır. Böylece bakterilerde direnç genlerinin genotipik olarak bulunmasının yanı sıra fenotipik olarak da dezenfektanlara karşı bir direnç olup olmadığı irdelenmiştir.
Çalışmamızda, qacA/B geni saptanan izolatların çoğunda (5/8) her iki dezenfektanın MİK değerleri (> 2 µg/ml), bu geni taşımayan izolatlara göre, istatistiksel olarak anlamlı fark bulunmasa da, daha yüksek saptanmıştır. Literatürdeki klorhekzidin ve benzalkonyum klorür MİK değerlerinin araştırıldığı çalışmalar incelendiğinde, 2 µg/ml'nin üzerindeki MİK değerlerinin genellikle yüksek olarak kabul edildiği, hatta bazı araştırıcıların 2 µg/ml'nin üzerindeki değerlere sahip izolatları dirençli olarak bildirdikleri görülmektedir2,17,27,28. Irizary ve arkadaşlarının27 çalışmasında klorhekzidin MİK değerleri MSSA'ların %83'ünde £ 2 µg/ml; MRSA'ların ise %83'ünde ≥ 2 µg/ml olarak bulunmuş; araştırıcılar, yüksek MİK değerlerini göz önüne alarak MRSA'ların klorhekzidine karşı duyarlılığının azaldığını belirtmişlerdir. Bir başka çalışmada, qacA geni taşıyan ve taşımayan S.aureus izolatlarında klorhekzidin MİK değerleri sırasıyla 2 ve 0.8 µg/ml; benzalkonyum klorür için sırasıyla 6 ve < 2 µg/ml olarak bildirilmiştir28. Noguchi ve arkadaşları14 qacA geni bulunan MRSA izolatlarında katyonik antiseptiklere karşı MİK değerlerini (> 2 µg/ml), bu geni bulundurmayan izolatlara (< 2 µg/ml) göre daha yüksek olarak saptamışlardır. Bizim çalışmamızda da, qacA/B direnç geni taşıyan ve taşımayan tüm MRSA izolatlarında MİK değerleri genel olarak yüksek (≥ 2 µg/ml) bulunmuş; bu durumun, hastanemizde klorhekzidin ve benzalkonyum klorürün yaygın olarak kullanımından kaynaklandığı düşünülmüştür. Bununla birlikte, yüksek MİK değerlerinin saptanması, dezenfektanın daha az inhibitör etki gösterdiği ya da dezenfektana karşı bakterilerin dirençli olduğu anlamına gelmemektedir; zira dezenfektan çalışmalarında antibiyotiklerde olduğu gibi duyarlılık ve dirençlilik sınırlarını gösteren kesin olarak belirlenmiş sınır değerleri yoktur. Bu nedenle, bakterilerin dezenfektanlara dirençli olarak bildirildiği birçok çalışmada, konunun bu yönü eksik kalmaktadır. Dolayısıyla, sadece yüksek MİK değerlerine bakılarak bakterilerin dirençli olduğunu ileri sürmek doğru bir yorum olmayabilir; çünkü bu çalışmalarda genellikle dezenfektanların klinik kullanım konsantrasyonlarında bakterilere karşı öldürücü etkilerine bakılmamış ve sadece yüksek MİK değerlerine göre yorum yapılmıştır. Ancak, yalnızca yüksek MİK değerleri dikkate alınarak, bakterilerde gerçek bir dezenfektan direncinin olduğunun ileri sürülmesi doğru değildir. Nitekim Cookson ve arkadaşları29, direnç geni bulunmasının klorhekzidinin öldürücü etkisinde bir değişiklik yapmadığını bildirmektedir. Bizim çalışmamızın sonuçları da bu yoruma paralellik göstermiş ve kantitatif süspansiyon testi ile yüksek MİK değerlerine sahip olan izolatların da diğer izolatlarda olduğu gibi, dezenfektanların klinik kullanım konsantrasyonuna (%1) karşı duyarlı olduğu saptanmıştır. Artmış MİK değerlerinin dezenfektanların klinik uygulamasında anlamının olmamasının sebepleri arasında, dezenfektanın bakteri hücresi üzerinde çok sayıda hedef bölgesinin bulunması ve dezenfektanın klinik kullanım konsantrasyonlarının MİK düzeylerinin kat kat üzerinde olması sayılabilir. Bunun sonucunda bakterinin artmış MİK değerlerine sahip olmasına veya direnç geni taşımasına rağmen, dezenfektan bakterisidal etki gösterebilmektedir.
Sonuç olarak çalışmamızda, hastane enfeksiyonu etkeni olan MRSA suşlarında PCR yöntemi ile %11.6 (8/69) oranında qacA/B geni pozitifliği saptanmış; klorhekzidin ve benzalkonyum klorür solüsyonunun %1'lik konsantrasyonları gerek qacA/B geni taşıyan gerekse yüksek MİK (≥ 2 µg/ml) değerlerine sahip MRSA suşlarının hepsi için bakterisidal etkili bulunmuş; buna göre direnç genlerinin varlığının ve artmış MİK değerlerinin direnç fenotipine yansımadığı sonucuna varılmıştır.
KAYNAKLAR
- Russell AD. Introduction of biocides into clinical practice and the impact on antibiotic-resistant bacteria. J Appl Microbiol 2002; 92(Suppl): 121S-35S. [Özet] [Tam Metin] [PDF]
- McDonnell G, Russell AD. Antiseptics and disinfectants: activity, action, and resistance. Clin Microbiol Rev 1999; 12(1): 147-79. [Özet] [Tam Metin] [PDF]
-
Poole K. Mechanisms of bacterial biocide and antibiotic resistance. J Appl Microbiol
2002; 92(Suppl): 55S-64S.
[Özet] [Tam Metin] [PDF] -
Fraise AP. Susceptibility of antibiotic-resistant cocci to biocides. J Appl Microbiol
2002; 92(Suppl): 158S-62S.
[Özet] [Tam Metin] [PDF] - Paulsen IT, Brown MH, Skurray RA. Characterization of the earliest known Staphylococcus aureus plasmid encoding a multidrug efflux system. J Bacteriol 1998; 180(13): 3477-9. [Özet] [Tam Metin] [PDF]
- Mayer S, Boos M, Beyer A, Fluit AC, Schmitz FJ. Distribution of the antiseptic resistance genes qacA, qacB, and qacC in 497 methicillin-resistance and susceptible European isolates of Staphylococcus aureus. J Antimicrob Chemother 2001; 47(6): 896-7. [Tam Metin] [PDF]
- Noguchi N, Suwa J, Narui K, et al. Susceptibilities to antiseptic agents and distribution of antiseptic-resistance genes qacA/B and smr of methicillin-resistant Staphylococcus aureus isolated in Asia during 1998-1999. J Med Microbiol 2005; 54(6): 557-65. [Özet] [Tam Metin] [PDF]
- Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved Standard, 7th edition, 2006, CLSI Document M7-A7. CLSI, Wayne, PA.
- British Standards Institution. Chemical disinfectants and antiseptics. Quantitative suspension test for the evaluation of bactericidal activity of chemical disinfectants for instruments used in the medical area. Test method and requirements (Phase 2/Step 1). BS EN 13727: 2003. British-Adopted European Standard, UK.
- Russell AD. Biocide use and antibiotic resistance: the relevance of laboratory findings to clinical and environmental situations. Lancet Infect Dis 2003; 3(12): 794-803. [Özet]
- Thomas L, Maillard JY, Lambert RJ, Russell AD. Development of resistance to chlorhexidine diacetate in Pseudomonas aeruginosa and the effect of a residual concentration. J Hosp Infect 2000; 46(4): 297-303. [Özet]
- Block C, Furman M. Association between intensity of chlorhexidine use and micro-organisms of reduced susceptibility in a hospital environment. J Hosp Infect 2005; 51(3): 201-6. [Özet]
- Putnam M, van Ween HW, Konings WN. Molecular properties of bacterial multidrug transporters. Microbiol Mol Biol Rev 2000; 64(4): 672-93. [Özet] [Tam Metin] [PDF]
- Noguchi N, Hase M, Kitta M, Sasatsu M, Deguchi K, Kono M. Antiseptic susceptibility and distribution of antiseptic-resistance genes in methicillin-resistant Staphylococcus aureus. FEMS Microbiol Lett 1999; 172(2): 247-53. [Özet]
- Alam MM, Kobayashi N, Uehara N, Watanabe N. Analysis on distribution and genomic diversity of high-level antiseptic resistance genes qacA and qacB in human clinical isolates of Staphylococcus aureus. Microb Drug Resist 2003; 9(2): 109-21. [Özet]
- Noguchi N, Nakaminami H, Nishijima S, Kurokawa I, So H, Sasatsu M. Antimicrobial agent of susceptibilities and antiseptic resistance gene distribution among methicillin-resistant Staphylococcus aureus isolates from patients with impetigo and staphylococcal scalded skin syndrome. J Clin Microbiol 2006; 44(6): 2119-25. [Özet] [Tam Metin] [PDF]
-
Zmantar T, Kouidhi B, Miladi H, Bakhrouf A. Detection of macrolide and disinfectant
resistance genes in clinical Staphylococcus aureus and
coagulase-negative staphylococci. BMC Res Notes 2011; 4: 453.
[Özet] [Tam Metin] [PDF] - Longtin J, Seah C, Siebert K, et al. Distribution of antiseptic resistance genes qacA, qacB, and smr in methicillin-resistant Staphylococcus aureus isolated in Toronto, Canada, from 2005 to 2009. Antimicrob Agent Chemother 2011; 55(6): 2999-3001. [Özet] [Tam Metin] [PDF]
- Nakipoğlu Y, Ignak S, Gurler N, Gurler B. The prevalence of antiseptic resistance genes (qacA/B and smr) and antibiotic resistance in clinical Staphylococcus aureus strains. Mikrobiyol Bul 2012; 46(2): 180-9. [Özet] [Tam Metin] [PDF]
- Sheng WH, Wang JT, Lauderlale TL. Epidemiology and susceptibilities of methicillin-resistant Staphylococcus aureus in Taiwan: emphasis on chlorhexidine susceptibility. Diagn Microb Infect Dis 2009; 69 (3): 309-13. [Özet]
- Zhang M, O'Donoghue MM, Ito T, Hiramatsu K, Boost MV. Prevalence of antiseptic-resistance genes in Staphylococcus aureus and coagulase-negative staphylococci colonising nurses and the general population in Hong Kong. J Hosp Infect 2011; 78(2): 113-7. [Özet]
- Shamsudin MN, Alreshidi MA, Hamat RA, et al. High prevalence of qacA/B carriage among clinical isolates of methicillin-resistant Staphylococcus aureus in Malaysia. J Hosp Infect 2012; 81(3): 206-8. [Özet]
-
Smith K, Gemmel CG, Hunter IS. The association between biocide tolerance and the
presence or absence of qac genes among hospital-acquired and
community-acquired MRSA isolates. J Antimicrob Chemother 2008; 61(1): 78-84.
[Özet] [Tam Metin] [PDF] - Espirages E, Bueno A, Fernandez-Crehuet M, Espirages M. Efficacy of some neutralizers in suspension tests determining the activity of disinfectants. J Hosp Infect 2003; 55(2): 137-40. [Özet]
- Wisplinghoff A, Schmitt R, Wöhrmann A, Stefanik D, Seifert H. Resistance to disinfectants in epidemiologically defined clinical isolates of Acinetobacter baumannii. J Hosp Infect 2007; 66(2): 174-81. [Özet]
- Garcia-de-Lomas J, Lerma M, Cebrian L, et al. Evaluation of the in-vitro cidal activity and toxicity of a novel peroxygen biocide: 2-butanone peroxide. J Hosp Infect 2008; 68(3): 248-54. [Özet]
- Irizarry L, Merlin T, Rupp J, Griffith J. Reduced susceptibility of methicillin-resistant Staphylococcus aureus to cetylpyridinium chloride and chlorhexidine. Chemotherapy 1996; 42(4): 248-52. [Özet]
- Littlejohn TG, Paulsen IT, Gillespie MT, et al. Substrate specificity and energetics of antiseptic and disinfectant resistance in Staphylococcus aureus. FEMS Microbiol Lett 1992; 74(2-3): 259-65. [Özet]
- Cookson BD, Bolton MC, Platt JH. Chlorhexidine resistance in methicillin-resistant Staphylococcus aureus or just an elevated MIC? An in-vitro and in-vivo assessment. Antimicrob Agents Chemother 1991; 35(10): 1997-2002. [Özet] [PDF]
İletişim (Correspondence):
Prof. Dr. Kayhan Çağlar,
Gazi Üniversitesi Tıp Fakültesi
Tıbbi Mikrobiyoloji Anabilim Dalı,
Beşevler, Ankara, Türkiye.
Tel (Phone): +90 312 202 6979,
E-posta (E-mail): kayhancaglar@gmail.com