Semptomatik Hastaların Genital Sürüntü Örneklerinde Hücre
Kültürü,
DFA ve PCR Yöntemleriyle Chlamydia trachomatis'in Araştırılması
Investigation
of Chlamydia trachomatis with Cell Culture, DFA and PCR Methods in the
Genital Swab Samples of Symptomatic Patients
Osman ÖZÜBERK1, Selma GÖKAHMETOĞLU1, Bülent ÖZÇELİK2, Oğuz EKMEKÇİOĞLU3
1 Erciyes Üniversitesi Tıp Fakültesi, Tıbbi Mikrobiyoloji Anabilim Dalı, Kayseri.
1 Erciyes University Faculty of Medicine, Department of Medical Microbiology, Kayseri, Turkey.
2 Erciyes Üniversitesi Tıp Fakültesi, Kadın Hastalıkları ve Doğum Anabilim Dalı, Kayseri.
2 Erciyes University Faculty of Medicine, Department of Obstetrics and Gynecology, Kayseri, Turkey.
3 Erciyes Üniversitesi Tıp Fakültesi, Üroloji Anabilim Dalı, Kayseri.
3 Erciyes University Faculty of Medicine, Department of Urology, Kayseri, Turkey.
ÖZET
Tüm dünyada cinsel yolla bulaşan bakteriyel hastalıklardan en yaygın olanı Chlamydia trachomatis enfeksiyonlarıdır. C.trachomatis, trahom ve yenidoğan inklüzyon konjunktiviti gibi göz enfeksiyonlarına, yenidoğanlarda pnömonilere, genitoüriner sistem enfeksiyonlarına ve süpüratif inguinal adenitle karakterize lenfogranüloma veneruma yol açabilmektedir. Bu çalışmada, genital enfeksiyon ön tanısıyla mikrobiyoloji laboratuvarına gönderilen klinik örneklerde C.trachomatis varlığının, hücre kültürü, direkt floresan antikor (DFA) ve polimeraz zincir reaksiyonu (PCR) yöntemleriyle araştırılması amaçlanmıştır. Çalışmaya, Şubat-Mart 2010 tarihinde genital akıntı yakınmasıyla hastanemize başvuran 50 (49 kadın, 1 erkek) erişkin hastadan alınan sürüntü örnekleri dahil edilmiştir. Örneklerde C.trachomatis antijeni ticari bir DFA (PathoDx, Remel, ABD) yöntemiyle araştırılmış; etkenin izolasyonunda ise mikroplaklarda hazırlanan McCoy hücre kültürleri kullanılmıştır. Hücre kültürlerinde C.trachomatis üremesi DFA ve iyot boyama yöntemleri ile doğrulanmıştır. Örneklerde C.trachomatis DNA varlığının araştırılması için ticari bir PCR yöntemi (Chlamydia trachomatis 330/740 IC; Sacace, İtalya) kullanılmıştır. Çalışmamızda, 50 sürüntü örneğinin 4 (%8)'ünde DFA ile, 1 (%2)'inde hücre kültürü ile ve 1 (%2)'inde de PCR ile pozitiflik saptanmıştır. Her üç yöntemle de pozitif bulunan tek örneğin, çalışmadaki erkek hastaya ait üretral sürüntü örneği olduğu izlenmiştir. Sadece DFA ile pozitifliğin saptandığı üç servikal sürüntü örneği ise yalancı pozitif olarak değerlendirilmiştir. Hücre kültürü referans olarak alındığında DFA yönteminin duyarlığı %100, özgüllüğü %94; PCR yönteminin duyarlılığı ve özgüllüğü %100 olarak belirlenmiştir. Sonuç olarak, hücre kültürü altın standart olarak yerini korumakla birlikte, zaman alıcı olması ve uygulama güçlüğü nedeniyle daha hızlı ve güvenilir olan PCR yönteminin, koşullar ve olanaklar dahilinde, C.trachomatis enfeksiyonlarının tanısında kullanılabileceği düşünülmüştür. Rutin klinik laboratuvarlarda pratik ve ucuz olması nedeniyle tercih edilen DFA yönteminde ise, yalancı negatif ve yalancı pozitif sonuçların önlenebilmesi açısından, örneğin kaliteli olmasına, değerlendirmenin deneyimli personel tarafından yapılmasına ve her çalışmada kalite kontrollerinin kullanılmasına özen gösterilmesi gerektiği akılda tutulmalıdır.
Anahtar sözcükler: Chlamydia trachomatis; genital enfeksiyon; tanı; immünofloresans; PCR; hücre kültürü.
ABSTRACT
Chlamydia trachomatis infection is considered the most prevalent bacterial sexually transmitted disease worldwide. C.trachomatis causes eye infections such as trachoma and newborn inclusion conjunctivitis, newborn pneumonia, genitourinary system infections and suppurative inguinal lymphadenitis namely lymphogranuloma venerum. The aim of this study was to investigate C.trachomatis by direct fluorescent antibody (DFA), polymerase chain reaction (PCR) and cell culture methods in the clinical samples sent to the microbiology laboratory with the prediagnosis of genital infections. A total of 50 swab samples obtained from adult patients (49 female, 1 male) who were admitted to Erciyes University Hospital, Kayseri, Turkey between February-March 2010, were included in the study. C.trachomatis antigens were investigated by a commercial DFA (PathoDx, Remel, USA) method. McCoy cell cultures prepared in microplate wells were used for the isolation of C.trachomatis. The growth of C.trachomatis in cell cultures was confirmed by DFA and iodine staining methods. C.trachomatis DNA was investigated by commercially available PCR (Chlamydia trachomatis 330/740 IC; Sacace, Italy) method. In our study, 4 (8%) of the 50 swab samples were found positive with DFA, 1 (2%) was positive with cell culture, and 1 (2%) was positive with PCR. The only sample that gave positive results with all of the three methods was an urethral swab. Three cervical swab samples that were found positive only with DFA method was evaluated as false positivity. When cell culture was considered as the reference method, the sensitivity and specificity of DFA method were estimated as 100% and 94%, respectively, while those rates for PCR were 100% and 100%, respectively. In conclusion, although cell culture is still the gold standard in the diagnosis of C.trachomatis. infections, since it is time consuming and difficult to apply, more rapid and reliable PCR methods may be applied in diagnosis. DFA method which is practical and cheap, is preferred largely in routine laboratory practice. However, false negative and false positive DFA results should be prevented by the maintainence of good quality clinical specimens, evaluation of the test by experienced personnel and use of quality control samples in each run.
Key words: Chlamydia trachomatis; genital infection; diagnosis; immunofluorescence; PCR; cell culture.
Geliş Tarihi (Received): 04.06.2012 • Kabul Ediliş Tarihi (Accepted): 17.09.2012
GİRİŞ
Zorunlu hücre içi paraziti olan Chlamydia trachomatis, tüm dünyada en yaygın seksüel geçişli bakteriyel enfeksiyon ajanı olarak bilinir1. Geniş bir klinik spektrumda hastalık oluşturabilen C.trachomatis, kronik keratokonjunktivit (trahom) ve yenidoğan inklüzyon konjunktiviti gibi göz enfeksiyonlarına; yenidoğanlarda pnömonilere; genitoüriner sistem enfeksiyonlarına ve süpüratif inguinal adenitle karakterize lenfogranüloma veneruma yol açabilmektedir1. Kadınlarda genital C.trachomatis enfeksiyonlarının çoğu asemptomatik olarak seyretmekte ancak pelvik inflamatuvar hastalık ve tübal infertiliteye kadar ilerleyebilmektedir2.
C.trachomatis enfeksiyonlarının laboratuvar tanısı; kültür ve izolasyon, serolojik testlerle antijen ve antikor tespiti, sitolojik inceleme ile inklüzyon cisimciklerinin araştırılması ve moleküler yöntemlerle yapılmaktadır2,3. Bu çalışmada, genital enfeksiyon ön tanısıyla mikrobiyoloji laboratuvarına gönderilen klinik örneklerde C.trachomatis varlığının, hücre kültürü, direkt floresan antikor (DFA) ve polimeraz zincir reaksiyonu (PCR) yöntemleriyle araştırılması amaçlanmıştır.
GEREÇ ve YÖNTEM
Erciyes Üniversitesi Tıp Fakültesi Mikrobiyoloji ve Klinik Mikrobiyoloji Anabilim Dalı Viroloji Laboratuvarında yapılan bu çalışma, Erciyes Üniversitesi Tıp Fakültesi İlaç Araştırmaları Yerel Etik Kurulu onayı (4.11.2008 tarih ve 2008/548 no) ile gerçekleştirildi. Şubat-Mart 2010 tarihleri arasında Erciyes Üniversitesi Tıp Fakültesi Gevher Nesibe Araştırma ve Uygulama Hastanesi Kadın Hastalıkları ve Doğum Poliklinikleri ile Üroloji Polikliniklerine genital akıntı ön tanısıyla başvuran ve genital enfeksiyon düşünülen 50 hastadan (49 kadın, 1 erkek) alınan sürüntü örneği çalışmaya dahil edildi. Genital akıntı ön tanılı hastaların herbirinden ikişer adet steril plastik saplı dakron eküvyon ile üretral veya servikal sürüntü örnekleri alındı. Sürüntü örneklerinden birisi PCR ve DFA için, diğeri ise hücre kültüründe kullanılmak üzere C.trachomatis için özel taşıma besiyerine (Vircell, İspanya) koyularak -70°C'de saklandı.
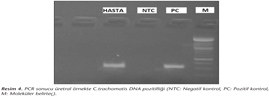
Örneklerden nükleik asit izolasyonu QIAamp DNA Mini Kiti (Qiagen, Almanya) kullanılarak, kit prosedürüne uygun olarak çalışıldı. C.trachomatis DNA amplifikasyonu için "Chlamydia trachomatis 330/740 IC" (Sacace, İtalya) kiti ile termal döngü cihazında (GeneAmp PCR System 2700, Applied Biosystems) PCR uygulandı. PCR ürünleri jel elektroforezi ile değerlendirildi. Jel transilüminatörde UV ışık altında incelendi. Örnekler 330 baz çifti (bç) uzunluğunda olan pozitif kontrol ile aynı bölgede bant verdiğinde pozitif kabul edildi.
Sürüntü örneklerinde C.trachomatis antijeni, DFA (PathoDx, Remel, ABD) yöntemiyle kit prosedürüne uygun olarak araştırıldı. Teflon kaplı lam üzerindeki kuyucukta hücre dışında floresan veren en az 10 adet elementer cisim (EC) görüldüğünde test pozitif olarak değerlendirildi.
Klinik örneklerden C.trachomatis izolasyonu, McCoy hücre kültürleri (Vircell, İspanya) kullanılarak konvansiyonel yöntem ile yapıldı4. Kısaca; hücre kültürü şişelerinde tek tabaka olarak üretilen hücreler, 1 ml tripsin ile muamele edildi ve 5-10 dakika 37°C'de CO2'li ortamda bekletilerek şişe yüzeyinden ve birbirlerinden ayrılmaları sağlandı. Daha sonra 10 ml hücre üretim besiyeri (MEM Eagle besiyeri 500 ml, 200 mM L-glutamin 6 ml, fetal sığır serumu 55 ml) şişeye ilave edildi ve pipetaj yapılarak homojen hücre süspansiyonu elde edildi. Hücre süspansiyonunun üzerine 20 ml hücre üretim besiyeri eklendi ve pipetaj yapılarak karıştırıldı. Bu süspansiyondan 24 kuyucuklu hücre kültürü plaklarının her kuyucuğuna 1'er ml dağıtıldı ve 37°C'de %5 CO2li ortamda inkübe edildi. Hücrelerin plak tabanını kaplayıp kaplamadığı invert mikroskobuyla kontrol edildi. Plak tabanı hücre ile kaplandıktan sonra, üreme besiyeri hücrelere zarar vermeden pipetle alındı ve 1'er ml eşit oranlarda her kuyucuğa izolasyon besiyeri eklendi. Muayene maddesi içeren taşıma besiyerleri iki dakika vorteklendi ve taşıma besiyerinden 500 µl alınarak hücre içeren kuyucuklara ekim yapıldı. Plaklar 37°C'de %5 CO2li ortamda üç gün inkübe edildi. Her gün invert mikroskobuyla hücreler incelendi ve günlük olarak izolasyon besiyeri değiştirildi. Hücre kuyucuklarının içindeki izolasyon besiyeri 72 saat sonra pipet yardımıyla boşaltıldı. Her kuyucuğa 500 µl PBS solüsyonundan eşit oranlarda eklendi ve plak tabanındaki hücreler ucu künt plastik pastör pipetleri ile kazınarak pipetaj yapıldı. Hazırlanan bu hücre süspansiyonunda DFA ve iyot boyama yöntemleriyle C.trachomatis antijenleri/inklüzyonları araştırıldı5.
Süspansiyon haline getirilen hücrelerde DFA yöntemi (PathoDx Chlamydia Culture Confirmation Kit, Remel, ABD) kit prosedürüne göre uygulandı. Preparatlar floresan mikrokobunda 10x ve 40x objektifle incelenerek C.trachomatis'e özgü floresan veren inklüzyon antijenleri araştırıldı. Her alanda bir adet floresan veren hücre görüldüğünde test pozitif olarak değerlendirildi.
İyot boyama yönteminde; hücre süspansiyonundan hazırlanan yayma oda ısısında kurutulduktan sonra metanol ile fikse edildi ve üzerine iyot çözeltisi damlatılarak bir dakika bekletildi. Preparat su ile yıkanarak boya fazlası uzaklaştırıldı ve immersiyon yağı ile ışık mikroskobunda 100x objektifle incelendi. Değerlendirmede, sarı renkle boyanmış McCoy hücreleri içinde koyu kahverengi inklüzyonların görülmesi pozitif olarak kabul edildi.
BULGULAR
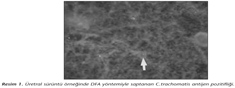
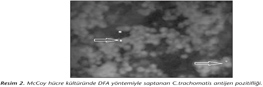
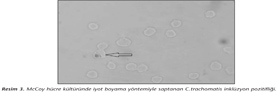
Çalışmamızda, 49 servikal sürüntü örneğinin üçünde ve bir üretral sürüntü örneğinde olmak üzere toplam 50 örneğin 4 (%8)'ünde DFA ile C.trachomatis antijeni pozitif bulunmuştur (Resim 1). Hücre kültürüne ekimi yapılan genital sürüntü örneklerinin %2 (1/50)'sinde DFA ve iyot boyama yöntemiyle C.trachomatis antijen/inklüzyonları saptanmış; PCR ile çalışılan örneklerin de %2 (1/50)'sinde C.trachomatis DNA'sı pozitif bulunmuştur (Resim 2,3,4). Her üç yöntemle de pozitif bulunan örneğin üretral sürüntü örneği olduğu izlenmiştir. DFA yöntemi ile C.trachomatis antijeni pozitif bulunan üç servikal sürüntü örneğinde, hem PCR hem de hücre kültürü yöntemleri ile negatif sonuç alınmıştır (Tablo I).
Hücre kültürü altın standart olarak kabul edildiğinde, DFA yönteminin duyarlılığı %100, özgüllüğü %94; PCR yönteminin duyarlılığı ve özgüllüğü ise %100 olarak bulunmuştur.
TARTIŞMA
Günümüzde cinsel yolla bulaşan bakteriyel hastalıklardan en yaygın olanı C.trachomatis enfeksiyonlarıdır. Dünya Sağlık Örgütü raporuna göre, dünyada her yıl 50 milyondan fazla yeni C.trachomatis olgusunun ortaya çıktığını tahmin edilmekte, ancak kadınların çoğunda (> %50) alt genital sistem enfeksiyonlarının asemptomatik olması nedeniyle tanı konulamamaktadır2. Ülkemizde İzmir bölgesinde DFA yöntemiyle yapılan çeşitli çalışmalarda, C.trachomatis enfeksiyon insidansının asemptomatik kadınlarda %23-27.3, semptomatik kadınlarda %32.4-42, infertil kadınlarda %8.5-11.5, hayat kadınlarında %25.4, konjunktivit olgularında ise %26.5 olduğu bildirilmektedir5,6,7,8,9. Ankara'da Özdağ ve arkadaşlarının10 çalışmasında, kadın hastalıkları kliniğine başvuran semptomatik ve asemptomatik kadınlarda C.trachomatis antijen pozitifliği DFA yöntemiyle %24.5 (49/200) olarak saptanmıştır. Ağaçfidan'ın11 İstanbul'da yaptığı çalışmada ise, risk grubundaki 560 olguya ait klinik örneklerde hücre kültürü yöntemi ile C.trachomatis varlığı araştırılmış; servikal örneklerde %19.2 (45/234), üretral örneklerde %15.2 (43/282) ve rektal örneklerde %18.2 (8/44) oranında pozitiflik saptamıştır. Çiçek ve arkadaşlarının12 Ege Bölgesinde semptomatik olgularda C.trachomatis prevalansını araştırmak için yaptıkları çalışmada, McCoy hücre dizisi ile shell-vial yöntemi kullanılmış ve erkek hastaların %20 (10/50)'sinden, kadın hastaların %20 (15/75)'sinden ve çocuk hastaların %30.8 (4/13)'inin konjunktival, %6.1 (12/195)'inin ise nazofarengeal örneklerinden C.trachomatis izole etmiştir. Bizim çalışmamızda, McCoy hücre kültürü yöntemiyle 50 genital sürüntü örneğinin 1 (%2)'inden C.trachomatis izole edilmiştir.
C.trachomatis enfeksiyonlarının tanısında DFA yöntemi, hızlı, pratik ve ekonomik olmakla birlikte, örneğin uygunluğu, kalitesi (epitel hücre içeriği) ve değerlendirmeyi yapan kişinin deneyimine bağlı olarak özgüllük ve duyarlılığı değişebilmektedir13,14. Schwebke ve arkadaşları15, majör dış membran proteinine (MOMP) özgül antikorların kullanıldığı bir DFA kitinin, hücre kültürüyle karşılaştırıldığında %99 duyarlılık ve %99.8 özgüllüğe sahip olduğunu bildirmişlerdir. Ertem ve arkadaşları6 ise, semptomatik ve asemptomatik 93 kadından alınan endoservikal sürüntü örneğinde DFA yöntemiyle C.trachomatis pozitifliğini %34.4 olarak saptamışlar; yöntemin duyarlılık ve özgüllüğünü sırayla %50-96 ve %94-96 olarak rapor etmişlerdir. Dereli ve arkadaşları7, endoservikal örneklerde C.trachomatis tespitinde DFA yönteminin duyarlılığını semptomatik ve asemptomatik kadınlarda sırasıyla %84 ve %75, özgüllüğünü ise sırasıyla %89 ve %95 olarak bildirmişlerdir. Bizim çalışmamızda, MOMP'a özgül antikorların kullanıldığı DFA yönteminin duyarlılığı %100 ve özgüllüğü %94 olarak bulunmuş; olgu sayısının az olmasına rağmen verilerimizin diğer çalışmaların sonuçları ile uyumlu olduğu görülmüştür.
Son yıllarda moleküler yöntemler, mikrobiyolojinin tüm alanlarında olduğu gibi C.trachomatis enfeksiyonlarının tanısında da hızlı ve duyarlı bir tanı aracı olarak kullanılmaktadır3,16. Cheng ve arkadaşları17 asemptomatik 1138 erkeğin üretral sürüntü örneklerinde C.trachomatis'in araştırılmasında moleküler yöntemleri hücre kültürüyle karşılaştırmışlar ve PCR yönteminin hücre kültürüne kıyasla daha duyarlı, ancak özgüllüğün birbirine benzer olduğunu ifade etmişlerdir. Olafsson ve arkadaşları18, yüksek risk grubunda yer alan 203 kadının servikal sürüntü örneğinde McCoy hücre kültürü ve PCR yöntemleriyle, aynı hastaların idrar örneklerinde PCR yöntemiyle C.trachomatis varlığını araştırmışlar; servikal sürüntü örneklerinde hücre kültürü ve PCR yöntemlerinin duyarlılığını sırasıyla %87 ve %92, idrar örneklerinde PCR yönteminin duyarlılığını ise %95 olarak bildirmişlerdir. Goessens ve arkadaşları19, ilk akım idrar örneklerinde C.trachomatis varlığını farklı moleküler yöntemler (PCR, LCR, TMA) ile araştırmışlar; C.trachomatis prevalansını %7.7 olarak tespit etmişler ve tüm yöntemlerle özgüllüğün %99'dan fazla olduğunu belirtmişlerdir. Bizim çalışmamızda, kriptik plazmid gen bölgesinin hedef alındığı PCR yönteminde duyarlılık ve özgüllük %100 olarak bulunmuştur.
Bu çalışmada, incelenen bir üretral sürüntü örneğinde hücre kültürü, PCR ve DFA yöntemleriyle C.trachomatis pozitif olarak bulunmuş; 49 servikal sürüntü örneğinin ise üçünde DFA yöntemiyle pozitiflik saptanmıştır. Bu örneklerde hücre kültürü ve PCR yöntemleri negatif sonuç verdiğinden, elde edilen DFA sonucu yalancı pozitiflik olarak yorumlanmıştır. Çalışmamızda, C.trachomatis'in hücre kültüründen izolasyonu üç gün sonra sonuçlanırken, DFA ve PCR yöntemleri çalışma başladığı gün birkaç saat içerisinde tamamlanmıştır. Sonuç olarak, hücre kültürü altın standart olarak yerini korumakla birlikte, uygun koşulların her zaman sağlanamaması ve uygulama güçlüğü nedeniyle daha hızlı, kolay ve güvenilir bir yöntem olan PCR'nin C.trachomatis enfeksiyonlarının laboratuvar tanısında -koşullar ve olanaklar dahilinde- kullanılabileceği düşünülmüştür. Rutin klinik laboratuvarlarda pratik ve ucuz olması nedeniyle tercih edilen DFA yönteminde ise, yalancı negatif ve yalancı pozitif sonuçların önlenebilmesi açısından, örneğin kaliteli olmasına, değerlendirmenin deneyimli personel tarafından yapılmasına ve her çalışmada kalite kontrollerinin kullanılmasına özen gösterilmesi gerektiği akılda tutulmalıdır.
KAYNAKLAR
-
Bébéar C, de Barbeyrac B. Genital Chlamydia trachomatis infections. Clin
Microbiol Infect 2009; 15(1): 4-10.
[Özet] [Tam Metin] [PDF] - Land JA, Van Bergen JE, Morré SA, Postma MJ. Epidemiology of Chlamydia trachomatis infection in women and the cost-effectiveness of screening. Hum Reprod Update 2010; 16(2): 189-204. [Özet] [Tam Metin] [PDF]
- Low N, McCarthy A, Macleod J, et al; Chlamydia Screening Studies Project Group. Epidemiological, social, diagnostic and economic evaluation of population screening for genital chlamydial infection. Health Technol Assess 2007; 11(8): iii-iv, ix-xii, 1-165. [Özet]
- Özüberk O. Klinik örneklerde çeşitli yöntemlerle Chlamydia trachomatis araştırılması. Yüksek Lisans Tezi, 2011. Erciyes Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı, Kayseri.
- Ertem E, Dereli D, Serter D, Tavmergen E, Çapanoğlu R. İnfertil kadınlarda Chlamydia trachomatis insidansı. Türk Mikrobiyol Cem Derg 1991; 21: 47.
- Ertem E, Dereli D, Serter D, Yüce K. Screening for Chlamydia trachomatis in a Turkish population. Genitourin Med 1991; 67(4): 354-5. [PDF]
- Dereli D, Ertem E, Serter D, Yüce K. Evaluation of a direct fluorescent antibody test for detection of Chlamydia trachomatis in endocervical specimens. Brief report. APMIS 1991; 99(10): 961-4. [Özet]
- Ertem E, Dereli D, Serter D, Engin Ö. İzmir genelevinde çalışan kadınlarda Chlamydia trachomatis araştırılması. Mikrobiyol Bul 1993; 27(4): 335-7. [Özet] [PDF]
- Dereli D, Ertem E, Serter D, Köse S, Haznedaroğlu G. Konjunktival örneklerde Chlamydia trachomatis araştırılması. Mikrobiyol Bul 1993; 27(2): 127-30. [Özet] [PDF]
-
Ozdağ D, Us D, Demirezen S, Beksaç S. Investigation of Chlamydia trachomatis
positivity in women with and without gynecologic complaints by cytologic and
direct immunofluorescence methods. Mikrobiyol Bul 2007; 41(1): 51-61.
[Özet] [PDF] - Ağaçfidan A. Chlamydia trachomatis'in McCoy hücre kültürleri yöntemi kullanarak izolasyonu. Türk Mikrobiol Cem Derg 2000; 30(3-4): 114-20. [Özet] [PDF]
- Çiçek C, Bilgiç A, Yaygın E ve ark. Semptomlu hastalarda Chlamydia trachomatis enfeksiyonun prevalansı. İnfeksiyon Derg 2006; 20(1): 27-30. [Özet] [PDF]
- Chan EL. Laboratory testing for Chlamydia trachomatis urogenital infections. J Fam Plann Reprod Health Care 2002; 28(3): 153-4. [PDF]
- Swain GR, McDonald RA, Pfister JR, Gradus MS, Sedmak GV, Singh A. Decision analysis: point-of-care Chlamydia testing vs. laboratory-based methods. Clin Med Res 2004; 2(1): 29-35. [Özet] [Tam Metin] [PDF]
- Schwebke JR, Stamm WE, Handsfield HH. Use of sequential enzyme immunoassay and direct fluorescent antibody tests for detection of Chlamydia trachomatis infections in women. J Clin Microbiol 1990; 28(11): 2473-6. [Özet] [PDF]
- Harkins AL, Munson E. Molecular diagnosis of sexually transmitted Chlamydia trachomatis in the United States. ISRN Obstet Gynecol 2011; 2011: 279149. [Özet] [Tam Metin] [PDF]
- Cheng H, Macaluso M, Vermund SH, Hook EW 3rd. Relative accuracy of nucleic acid amplification test and culture in detecting Chlamydia in asymptomatic men. J Clin Mic 2001; 39(11): 3927-37. [Özet] [Tam Metin] [PDF]
- Olafsson JH, Davidsson S, Karlsson SM, Palsdottir R, Steingrimssn O. Diagnosis of Chlamydia trachomatis infection in high-risk females with PCR on first void urine. Acta Derm Venereol 1996; 76(3): 226-7. [Özet]
- Goessens WH, Mouton JW, van der Meijden WI, et al. Comparison of three commercially available amplification assays, AMP CT, LCx and COBAS AMPLICOR, for detection of Chlamydia trachomatis in first void urine. J Clin Microbiol 1997; 35(10): 2628-33. [Özet] [PDF]
İletişim (Correspondence):
Prof. Dr. Selma Gökahmetoğlu,
Erciyes Üniversitesi Tıp Fakültesi,
Tıbbi Mikrobiyoloji Anabilim Dalı,
38039 Talas, Kayseri, Türkiye.
Tel (Phone): +90 352 437 4937,
E-posta (E-mail): selmagk@gmail.com